8.4 常见的盐 导学案(学生版+教师版)
文档属性
| 名称 | 8.4 常见的盐 导学案(学生版+教师版) |  | |
| 格式 | doc | ||
| 文件大小 | 206.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-17 17:25:58 | ||
图片预览




文档简介
设计: 审核:
8.4常见的盐
【课前复习】
一、单选题(本大题共6小题,共12.0分)
向含有酚酞的NaOH溶液中滴加盐酸,溶液红色褪去,变为无色,此时溶液pH可能是( )
A. 5 B. 9 C. 12 D. 13
中和反应在生产、生活中应用广泛。下列应用的主要原理不涉及中和反应的是( )
A. 生石灰用于加热即热食品 B. 氢氧化铝用于治疗胃酸过多
C. 熟石灰用于改良酸性土壤 D. 硼酸用于处理皮肤上沾有的碱
推理是学习化学的一种重要方法。下列的推理正确的是( )
A. 某溶液不能使酚酞溶液变色,说明该溶液一定显酸性
B. 中和反应生成盐和水,所以生成盐和水的反应一定是中和反应
C. 酸和碱的溶液能与指示剂反应,则所有的酸和碱都能使指示剂变色
D. 稀盐酸、稀硫酸都能使石蕊试液变红,则稀硝酸也能使石蕊溶液变红
对于化学反应A+B=C+D的下列说法中正确的是( )
A. 若生成物C和D分别为盐和水,则该反应一定是中和反应
B. 若A和C是单质,B和D是化合物,则该反应一定是置换反应
C. 若A、B各取10g混合,使其充分反应,则C、D质量的总和一定等于20g
D. 若A、B、C、D都是化合物,则该反应一定是复分解反应
下列各组离子在水溶液中能大量共存的是()
A. H+、、OH- B. Na+、Ca2+、
C. OH-、、Cu2+ D. Ba2+、、K+
某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如图所示。下列说法错误的是( )
A. 图中b点所示溶液中,溶质是NaCl
B. 向图中c点所示溶液中滴加无色酚酞,溶液不变色
C. 该实验是将氢氧化钠溶液逐滴滴入到盛有稀盐酸的烧杯中
D. 由a点到b点的pH变化过程证明酸和碱发生了中和反应
二、填空题(本大题共1小题,共8.0分)
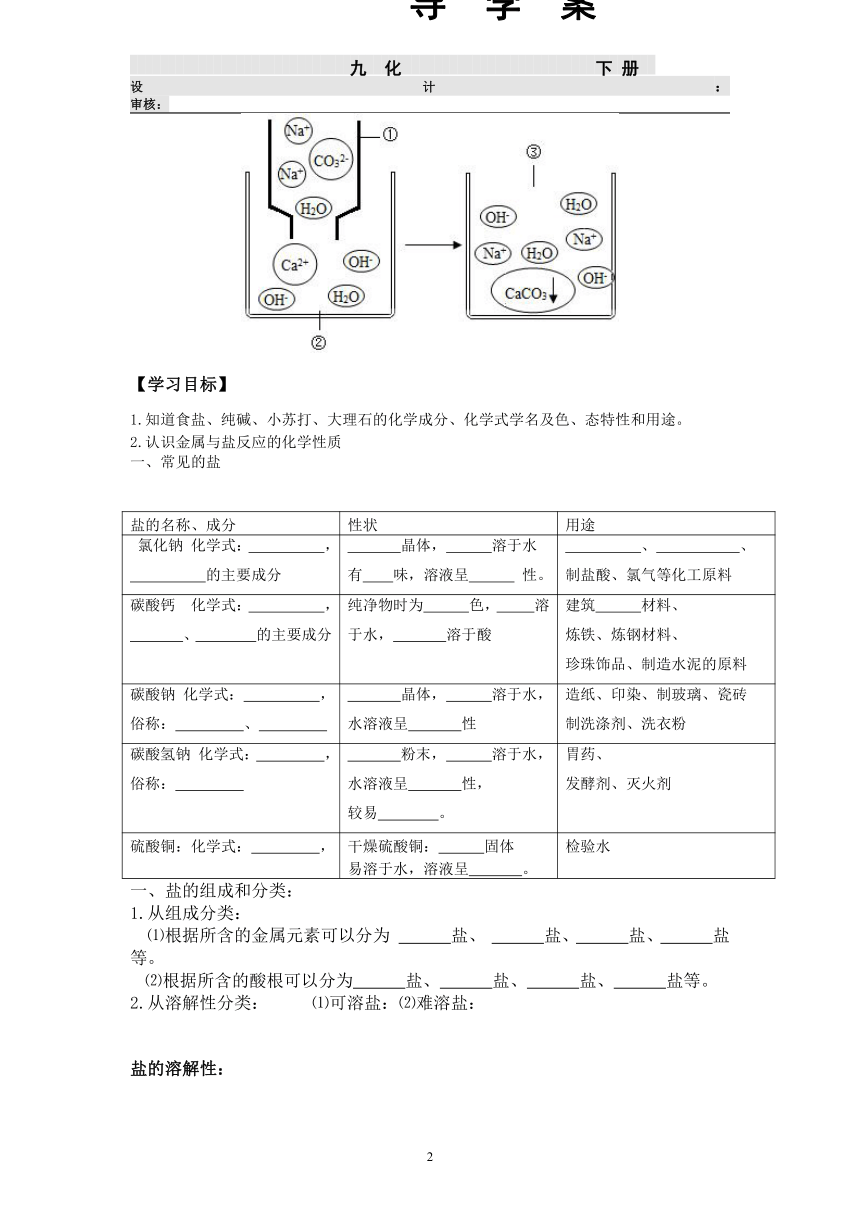
如图所示是溶液①和②之间发生复分解反应时有关粒子的变化情况,请回答下列问题:
(1)①溶液中的溶质属于 ______ (填“酸”“碱”“盐”或“氧化物”),写出该溶质的化学式: ______ 。
(2)由图示可知,①和②两溶液反应的实质是 ______ 和 ______ (填微粒符号)之间的结合,反应的化学方程式为 ______ 。
【学习目标】
1.知道食盐、纯碱、小苏打、大理石的化学成分、化学式学名及色、态特性和用途。
2.认识金属与盐反应的化学性质
常见的盐
盐的名称、成分 性状 用途
氯化钠 化学式: , 的主要成分 晶体, 溶于水有 味,溶液呈 性。 、 、制盐酸、氯气等化工原料
碳酸钙 化学式: , 、 的主要成分 纯净物时为 色, 溶于水, 溶于酸 建筑 材料、炼铁、炼钢材料、珍珠饰品、制造水泥的原料
碳酸钠 化学式: ,俗称: 、 晶体, 溶于水,水溶液呈 性 造纸、印染、制玻璃、瓷砖制洗涤剂、洗衣粉
碳酸氢钠 化学式: ,俗称: 粉末, 溶于水,水溶液呈 性,较易 。 胃药、发酵剂、灭火剂
硫酸铜:化学式: , 干燥硫酸铜: 固体易溶于水,溶液呈 。 检验水
一、盐的组成和分类:
1.从组成分类:
⑴根据所含的金属元素可以分为 盐、 盐、 盐、 盐等。
⑵根据所含的酸根可以分为 盐、 盐、 盐、 盐等。
2.从溶解性分类: ⑴可溶盐:⑵难溶盐:
盐的溶解性:
二、盐的化学性质
1、盐与金属的置换反应: 盐 + 金属 → +
CuSO4 + Fe = +
现象; (1) (2)
反应物条件:(1)参加反应的盐必须 水; (2)参加反应的金属在金属活动顺序中位于被置换的金属 。
2、盐与酸的反应: 盐 + 酸 → +
AgNO3+ HCl = + 现象;
BaCl2 + H2SO4 = + 现象;
3、盐与碱的反应: 盐 + 碱 → +
Na2CO3 + Ca(OH)2 = + 现象;
CuSO4 + NaOH = + 现象;
反应物条件:参加反应的盐和碱都必须 水;
4、盐与盐的反应: 盐1 + 盐2→ +
Na2SO4 + BaCl2 = + 现象;
Na2CO3 + BaCl2 = + 现象;
反应物条件:参加反应的盐都必须 水;
初中化学最常见的沉淀:白色___________、____________、____________、__________、__________
蓝色______________、红褐色_________________
主题二:复分解反应发生的条件
1.复分解反应发生的条件是
2.根据复分解反应发生的条件,判断下列反应能否发生,如能发生,请写化学方程式
Cu(OH)2 + HCl—— NaCl + KNO3——
CaCO3 + HCl—— AgNO3 + HCl——
CuSO4 + Ba(OH)2—— Na2CO3 + HC l——
Na2CO3 + KOH—— H2SO4 + Ba(NO3)2——
FeCl3 + NaOH—— NaOH + HCl——
【课堂练习】
一、单选题(本大题共7小题,共14.0分)
下列物质俗称干冰的是
A. 固态的水 B. 固态的氧气
C. 固态的二氧化碳 D. 固态的氮气
下列叙述正确的是( )
A. 用小苏打治疗胃酸过多 B. 用氢氧化钠改良酸性土壤
C. 用铁桶长时间存放硫酸铜溶液 D. 用食盐水除去热水瓶中的水垢
已知某溶液X是下列四种溶液中的一种,取三份等量的该溶液,分别向其中滴加NaOH溶液、稀盐酸、AgNO3溶液中的各一种,产生的现象如表所述。则该溶液X是下列各项中的( )
加入的物质 NaOH溶液 稀盐酸 AgNO3溶液
实验现象 蓝色沉淀 无明显现象 白色沉淀
A. Na2CO3溶液 B. 稀硝酸 C. NaCl溶液 D. CuCl2溶液
下列物质不能由金属与酸反应直接制得的是( )
A. FeSO4 B. ZnSO4 C. AgCl D. AlCl3
下列物质的性质与用途,不相匹配的是( )
A. 碳酸钙能与胃酸反应--可做补钙剂
B. 熟石灰显碱性--中和酸性土壤
C. 白醋含有醋酸,显酸性--家庭中可用作除水垢
D. 碳酸钡不溶于水--医疗上可用于“钡餐”造影
观察是学习化学的重要方法。下列有关实验现象描述正确的是( )
A. 加热“铜绿”时,绿色固体会变为黑色固体,管壁出现小水珠
B. 镁条在空气中燃烧,发出耀眼的白色火焰,放热,产生大量白烟
C. 硫粉在氧气中燃烧,发出明亮的蓝紫色火焰,产生二氧化硫气体
D. 木炭在空气中燃烧,发白光,放热,产生气体能使石灰水变浑浊
一包白色粉末,可能含有CuSO4、CaCO3、BaCl2、Na2SO4、NaOH中的一种或几种。为探究其组成进行如下实验:
①取少量白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液;
②取实验①滤出的白色沉淀,向其中加入足量的盐酸,沉淀全部溶解,并产生无色气体;
③取实验①得到的滤液,向其中通入CO2,产生白色沉淀;
根据以上实验现象,判断白色粉末。下列结论不正确的是( )
A. 白色粉末中一定不含CuSO4、Na2SO4
B. 白色粉末中一定含有CaCO3、BaCl2
C. 白色粉末中一定含有CaCO3、BaCl2、NaOH
D. 白色粉末中可能含有NaOH
二、填空题(本大题共2小题,共16.0分)
选择下列适当的物质填空(选填序号):
A.氧气 B.金刚石 C.钢铁 D.氯化钠 E.氮气 F.活性炭 G.赤铁矿 H.石灰石
(1)自然界硬度最大的是 ______;
(2)可用作医疗急救的是 ______;
(3)炼铁造渣所用矿石是 ______;
(4)生活中作调味品的是 ______;
(5)用于食品保护气的是 ______;
(6)常用来作净水剂的是 ______。
“酸、碱和盐的溶解性表(室温)”是学习化学的重要工具,智慧小组同学利用该工具进行探究学习。
离子 OH- Cl- SO42- CO32-
K+ 乙 丁 戊
Ba2+ 甲 丙
如表,表中标注了甲、乙、丙、丁和戊五种物质,物质的溶解性均未标明。请回答如下问题:
(1)认识符号:NO3-名称是 ______;
(2)物质分类:五种物质中,属于碱的是 ______(用化学式表示);
(3)溶解能力:五种物质中,只有一种不溶于水,它是 ______(用化学式表示);
(4)相互反应:五种物质中,在溶液中能相互发生的反应是 ______(用化学方程式表示)。
三、推断题(本大题共1小题,共10.0分)
有一包固体粉末M,可能由FeCl3、Ba(NO3)2、Na2SO4、NaOH、NaCl中的几种组成。为了确定其成分,现进行如图所示实验(各步骤均充分反应)。
(1)操作a的名称是 ______ 。
(2)溶液A中的溶质是 ______ ,白色沉淀B为 ______ 。
(3)写出步骤④发生反应的化学方程式 ______ ,该反应属于 ______ (填基本反应类型)。
(4)由以上实验推断,粉末M中一定含有的物质是 ______ 。
四、简答题(本大题共1小题,共8.0分)
(1)现有下列四种物质,请选择适当物质的序号填空:
a.食醋 b.生石灰 c.熟石灰 d.碳酸氢钠
①可用来除去水垢的是 ______。
②常用作食品干燥剂的是 ______。
③制作松软可口的馒头时,常加入的物质是 ______。
④常用作改良酸性土壤的是 ______。
(2)能源和环境问题是人们日益关注的问题。在农村推广家用沼气池建设是改善农村能源结构和环境卫生的重要举措,沼气的主要成分是 ______(填名称)。
(3)日常生活中最常用的消毒药水之一是84消毒液,它的有效成分是NaClO,该物质中氯元素的化合价为 ______价。使用84消毒液时不能和洁厕灵混用,原因是两者的有效成分会发生下列方程式:NaClO+2HCl=NaCl+X↑+H2O,其中X的化学式为 ______。
五、计算题(本大题共1小题,共10.0分)
酸、碱、盐在生产和生活中有广泛的应用。(1)下列关于常见盐的用途,错误的是______(填字母)。
A.食盐用作调味品 B.纯碱用于除水垢
C.碳酸钙用作补钙剂 D.碳酸氢钠用于焙制糕点
(2)下图是利用数字化传感器得到的氢氧化钠溶与硫酸反应时溶液pH变化图像。
①根据图中曲线,判断进行的操作是______(填字母)。
A.将硫酸溶液逐滴滴加到氢氧化钠溶液中
B.将氢氧化钠溶液逐滴滴加到硫酸溶液中
②b点对应的溶液中的溶质为______________(写化学式)。
③若80g 5%的氢氧化钠溶液能恰好中和50g硫酸溶液,试计算该硫酸溶液的溶质质量分数。
(3)为除去粗盐水中的可溶性杂质MgSO4、CaCl2,某化学小组设计了如图方案:
①过滤用到的玻璃仪器有烧杯、玻璃棒和____________。
②加入过量的Ba(OH)2溶液目的是__________________________________。
③溶液X中有氯化钠、__________________。
8.4常见的盐答案
【课前复习】
一、单选题(本大题共6小题,共12.0分)
向含有酚酞的NaOH溶液中滴加盐酸,溶液红色褪去,变为无色,此时溶液pH可能是( )
A. 5 B. 9 C. 12 D. 13
中和反应在生产、生活中应用广泛。下列应用的主要原理不涉及中和反应的是( )
A. 生石灰用于加热即热食品 B. 氢氧化铝用于治疗胃酸过多
C. 熟石灰用于改良酸性土壤 D. 硼酸用于处理皮肤上沾有的碱
推理是学习化学的一种重要方法。下列的推理正确的是( )
A. 某溶液不能使酚酞溶液变色,说明该溶液一定显酸性
B. 中和反应生成盐和水,所以生成盐和水的反应一定是中和反应
C. 酸和碱的溶液能与指示剂反应,则所有的酸和碱都能使指示剂变色
D. 稀盐酸、稀硫酸都能使石蕊试液变红,则稀硝酸也能使石蕊溶液变红
对于化学反应A+B=C+D的下列说法中正确的是( )
A. 若生成物C和D分别为盐和水,则该反应一定是中和反应
B. 若A和C是单质,B和D是化合物,则该反应一定是置换反应
C. 若A、B各取10g混合,使其充分反应,则C、D质量的总和一定等于20g
D. 若A、B、C、D都是化合物,则该反应一定是复分解反应
下列各组离子在水溶液中能大量共存的是()
A. H+、、OH- B. Na+、Ca2+、
C. OH-、、Cu2+ D. Ba2+、、K+
某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如图所示。下列说法错误的是( )
A. 图中b点所示溶液中,溶质是NaCl
B. 向图中c点所示溶液中滴加无色酚酞,溶液不变色
C. 该实验是将氢氧化钠溶液逐滴滴入到盛有稀盐酸的烧杯中
D. 由a点到b点的pH变化过程证明酸和碱发生了中和反应
二、填空题(本大题共1小题,共8.0分)
如图所示是溶液①和②之间发生复分解反应时有关粒子的变化情况,请回答下列问题:
(1)①溶液中的溶质属于 ______ (填“酸”“碱”“盐”或“氧化物”),写出该溶质的化学式: ______ 。
(2)由图示可知,①和②两溶液反应的实质是 ______ 和 ______ (填微粒符号)之间的结合,反应的化学方程式为 ______ 。
1.【答案】A
2.【答案】A
3.【答案】D
4.【答案】B
5.【答案】D
6.【答案】B
7.【答案】盐 Na2CO3 Ca2+ CO32- Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
【学习目标】
1.知道食盐、纯碱、小苏打、大理石的化学成分、化学式学名及色、态特性和用途。
2.认识金属与盐反应的化学性质
常见的盐
盐的名称、成分 性状 用途
氯化钠 化学式: NaCl , 食盐 的主要成分 无色 晶体, 易 溶于水有 咸 味,溶液呈中 性。 调味剂 、 配制生理盐水 、制盐酸、氯气等化工原料
碳酸钙 化学式: CaCO3 , 石灰石 、 大理石 的主要成分 纯净物时为 白 色, 不溶于水, 易容 溶于酸 建筑 材料、炼铁、炼钢材料、珍珠饰品、制造水泥的原料
碳酸钠 化学式:Na2CO3 ,俗称: 苏打 、 纯碱 白色 晶体, 易 溶于水,水溶液呈 碱 性 造纸、印染、制玻璃、瓷砖制洗涤剂、洗衣粉
碳酸氢钠 化学式: NaHCO3 ,俗称: 小苏打 粉末, 溶于水,水溶液呈 性,较易 。 胃药、发酵剂、灭火剂
硫酸铜:化学式: , 干燥硫酸铜: 固体易溶于水,溶液呈 。 检验水
一、盐的组成和分类:
1.从组成分类:
⑴根据所含的金属元素可以分为 盐、 盐、 盐、 盐等。
⑵根据所含的酸根可以分为 盐、 盐、 盐、 盐等。
2.从溶解性分类: ⑴可溶盐:⑵难溶盐:
盐的溶解性;钾钠铵盐硝酸盐均可溶,盐酸盐不容银,硫酸盐不容钡,碳酸盐只溶钾钠铵盐。
二、盐的化学性质
1、盐与金属的置换反应: 盐 + 金属 → +
CuSO4 + Fe = +
现象; (1) (2)
反应物条件:(1)参加反应的盐必须 水; (2)参加反应的金属在金属活动顺序中位于被置换的金属 。
2、盐与酸的反应: 盐 + 酸 → +
AgNO3+ HCl = + 现象;
BaCl2 + H2SO4 = + 现象;
3、盐与碱的反应: 盐 + 碱 → +
Na2CO3 + Ca(OH)2 = + 现象;
CuSO4 + NaOH = + 现象;
反应物条件:参加反应的盐和碱都必须 水;
4、盐与盐的反应: 盐1 + 盐2→ +
Na2SO4 + BaCl2 = + 现象;
Na2CO3 + BaCl2 = + 现象;
反应物条件:参加反应的盐都必须 水;
初中化学最常见的沉淀:白色___________、____________、____________、__________、__________
蓝色______________、红褐色_________________
主题二:复分解反应发生的条件
1.复分解反应发生的条件是
2.根据复分解反应发生的条件,判断下列反应能否发生,如能发生,请写化学方程式
Cu(OH)2 + HCl—— NaCl + KNO3——
CaCO3 + HCl—— AgNO3 + HCl——
CuSO4 + Ba(OH)2—— Na2CO3 + HC l——
Na2CO3 + KOH—— H2SO4 + Ba(NO3)2——
FeCl3 + NaOH—— NaOH + HCl——
【课堂练习】
一、单选题(本大题共7小题,共14.0分)
下列物质俗称干冰的是
A. 固态的水 B. 固态的氧气
C. 固态的二氧化碳 D. 固态的氮气
下列叙述正确的是( )
A. 用小苏打治疗胃酸过多 B. 用氢氧化钠改良酸性土壤
C. 用铁桶长时间存放硫酸铜溶液 D. 用食盐水除去热水瓶中的水垢
已知某溶液X是下列四种溶液中的一种,取三份等量的该溶液,分别向其中滴加NaOH溶液、稀盐酸、AgNO3溶液中的各一种,产生的现象如表所述。则该溶液X是下列各项中的( )
加入的物质 NaOH溶液 稀盐酸 AgNO3溶液
实验现象 蓝色沉淀 无明显现象 白色沉淀
A. Na2CO3溶液 B. 稀硝酸 C. NaCl溶液 D. CuCl2溶液
下列物质不能由金属与酸反应直接制得的是( )
A. FeSO4 B. ZnSO4 C. AgCl D. AlCl3
下列物质的性质与用途,不相匹配的是( )
A. 碳酸钙能与胃酸反应--可做补钙剂
B. 熟石灰显碱性--中和酸性土壤
C. 白醋含有醋酸,显酸性--家庭中可用作除水垢
D. 碳酸钡不溶于水--医疗上可用于“钡餐”造影
观察是学习化学的重要方法。下列有关实验现象描述正确的是( )
A. 加热“铜绿”时,绿色固体会变为黑色固体,管壁出现小水珠
B. 镁条在空气中燃烧,发出耀眼的白色火焰,放热,产生大量白烟
C. 硫粉在氧气中燃烧,发出明亮的蓝紫色火焰,产生二氧化硫气体
D. 木炭在空气中燃烧,发白光,放热,产生气体能使石灰水变浑浊
一包白色粉末,可能含有CuSO4、CaCO3、BaCl2、Na2SO4、NaOH中的一种或几种。为探究其组成进行如下实验:
①取少量白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液;
②取实验①滤出的白色沉淀,向其中加入足量的盐酸,沉淀全部溶解,并产生无色气体;
③取实验①得到的滤液,向其中通入CO2,产生白色沉淀;
根据以上实验现象,判断白色粉末。下列结论不正确的是( )
A. 白色粉末中一定不含CuSO4、Na2SO4
B. 白色粉末中一定含有CaCO3、BaCl2
C. 白色粉末中一定含有CaCO3、BaCl2、NaOH
D. 白色粉末中可能含有NaOH
二、填空题(本大题共2小题,共16.0分)
选择下列适当的物质填空(选填序号):
A.氧气 B.金刚石 C.钢铁 D.氯化钠 E.氮气 F.活性炭 G.赤铁矿 H.石灰石
(1)自然界硬度最大的是 ______;
(2)可用作医疗急救的是 ______;
(3)炼铁造渣所用矿石是 ______;
(4)生活中作调味品的是 ______;
(5)用于食品保护气的是 ______;
(6)常用来作净水剂的是 ______。
“酸、碱和盐的溶解性表(室温)”是学习化学的重要工具,智慧小组同学利用该工具进行探究学习。
离子 OH- Cl- SO42- CO32-
K+ 乙 丁 戊
Ba2+ 甲 丙
如表,表中标注了甲、乙、丙、丁和戊五种物质,物质的溶解性均未标明。请回答如下问题:
(1)认识符号:NO3-名称是 ______;
(2)物质分类:五种物质中,属于碱的是 ______(用化学式表示);
(3)溶解能力:五种物质中,只有一种不溶于水,它是 ______(用化学式表示);
(4)相互反应:五种物质中,在溶液中能相互发生的反应是 ______(用化学方程式表示)。
三、推断题(本大题共1小题,共10.0分)
有一包固体粉末M,可能由FeCl3、Ba(NO3)2、Na2SO4、NaOH、NaCl中的几种组成。为了确定其成分,现进行如图所示实验(各步骤均充分反应)。
(1)操作a的名称是 ______ 。
(2)溶液A中的溶质是 ______ ,白色沉淀B为 ______ 。
(3)写出步骤④发生反应的化学方程式 ______ ,该反应属于 ______ (填基本反应类型)。
(4)由以上实验推断,粉末M中一定含有的物质是 ______ 。
四、简答题(本大题共1小题,共8.0分)
(1)现有下列四种物质,请选择适当物质的序号填空:
a.食醋 b.生石灰 c.熟石灰 d.碳酸氢钠
①可用来除去水垢的是 ______。
②常用作食品干燥剂的是 ______。
③制作松软可口的馒头时,常加入的物质是 ______。
④常用作改良酸性土壤的是 ______。
(2)能源和环境问题是人们日益关注的问题。在农村推广家用沼气池建设是改善农村能源结构和环境卫生的重要举措,沼气的主要成分是 ______(填名称)。
(3)日常生活中最常用的消毒药水之一是84消毒液,它的有效成分是NaClO,该物质中氯元素的化合价为 ______价。使用84消毒液时不能和洁厕灵混用,原因是两者的有效成分会发生下列方程式:NaClO+2HCl=NaCl+X↑+H2O,其中X的化学式为 ______。
五、计算题(本大题共1小题,共10.0分)
酸、碱、盐在生产和生活中有广泛的应用。(1)下列关于常见盐的用途,错误的是______(填字母)。
A.食盐用作调味品 B.纯碱用于除水垢
C.碳酸钙用作补钙剂 D.碳酸氢钠用于焙制糕点
(2)下图是利用数字化传感器得到的氢氧化钠溶与硫酸反应时溶液pH变化图像。
①根据图中曲线,判断进行的操作是______(填字母)。
A.将硫酸溶液逐滴滴加到氢氧化钠溶液中
B.将氢氧化钠溶液逐滴滴加到硫酸溶液中
②b点对应的溶液中的溶质为______________(写化学式)。
③若80g 5%的氢氧化钠溶液能恰好中和50g硫酸溶液,试计算该硫酸溶液的溶质质量分数。
(3)为除去粗盐水中的可溶性杂质MgSO4、CaCl2,某化学小组设计了如图方案:
①过滤用到的玻璃仪器有烧杯、玻璃棒和____________。
②加入过量的Ba(OH)2溶液目的是__________________________________。
③溶液X中有氯化钠、__________________。
1.【答案】C
2.【答案】A
3.【答案】D
4.【答案】C
5.【答案】D
6.【答案】A
7.【答案】C
8.【答案】B A H D E F
9.【答案】硝酸根离子 Ba(OH)2 BaSO4 K2CO3+Ba(OH)2=BaCO3↓+2KOH
10.【答案】过滤 Na2SO4和NaCl BaSO4 AgNO3+NaCl=AgCl↓+NaNO3 复分解反应 FeCl3、NaOH、Na2SO4
11.【答案】a b d c 甲烷 +1 CI2
12.【答案】(1)B;
(2)①B;②NaOH和Na2SO4;
③设硫酸溶液中溶质的质量为x,则:
2NaOH+H2SO4=Na2SO4+2H2O
80 98
x
x=4.9g,该硫酸溶液的溶质质量分数是:×100%=9.8%。
(3)①漏斗;②使MgSO4完全反应;③Na2CO3、NaOH。
8.4常见的盐
【课前复习】
一、单选题(本大题共6小题,共12.0分)
向含有酚酞的NaOH溶液中滴加盐酸,溶液红色褪去,变为无色,此时溶液pH可能是( )
A. 5 B. 9 C. 12 D. 13
中和反应在生产、生活中应用广泛。下列应用的主要原理不涉及中和反应的是( )
A. 生石灰用于加热即热食品 B. 氢氧化铝用于治疗胃酸过多
C. 熟石灰用于改良酸性土壤 D. 硼酸用于处理皮肤上沾有的碱
推理是学习化学的一种重要方法。下列的推理正确的是( )
A. 某溶液不能使酚酞溶液变色,说明该溶液一定显酸性
B. 中和反应生成盐和水,所以生成盐和水的反应一定是中和反应
C. 酸和碱的溶液能与指示剂反应,则所有的酸和碱都能使指示剂变色
D. 稀盐酸、稀硫酸都能使石蕊试液变红,则稀硝酸也能使石蕊溶液变红
对于化学反应A+B=C+D的下列说法中正确的是( )
A. 若生成物C和D分别为盐和水,则该反应一定是中和反应
B. 若A和C是单质,B和D是化合物,则该反应一定是置换反应
C. 若A、B各取10g混合,使其充分反应,则C、D质量的总和一定等于20g
D. 若A、B、C、D都是化合物,则该反应一定是复分解反应
下列各组离子在水溶液中能大量共存的是()
A. H+、、OH- B. Na+、Ca2+、
C. OH-、、Cu2+ D. Ba2+、、K+
某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如图所示。下列说法错误的是( )
A. 图中b点所示溶液中,溶质是NaCl
B. 向图中c点所示溶液中滴加无色酚酞,溶液不变色
C. 该实验是将氢氧化钠溶液逐滴滴入到盛有稀盐酸的烧杯中
D. 由a点到b点的pH变化过程证明酸和碱发生了中和反应
二、填空题(本大题共1小题,共8.0分)
如图所示是溶液①和②之间发生复分解反应时有关粒子的变化情况,请回答下列问题:
(1)①溶液中的溶质属于 ______ (填“酸”“碱”“盐”或“氧化物”),写出该溶质的化学式: ______ 。
(2)由图示可知,①和②两溶液反应的实质是 ______ 和 ______ (填微粒符号)之间的结合,反应的化学方程式为 ______ 。
【学习目标】
1.知道食盐、纯碱、小苏打、大理石的化学成分、化学式学名及色、态特性和用途。
2.认识金属与盐反应的化学性质
常见的盐
盐的名称、成分 性状 用途
氯化钠 化学式: , 的主要成分 晶体, 溶于水有 味,溶液呈 性。 、 、制盐酸、氯气等化工原料
碳酸钙 化学式: , 、 的主要成分 纯净物时为 色, 溶于水, 溶于酸 建筑 材料、炼铁、炼钢材料、珍珠饰品、制造水泥的原料
碳酸钠 化学式: ,俗称: 、 晶体, 溶于水,水溶液呈 性 造纸、印染、制玻璃、瓷砖制洗涤剂、洗衣粉
碳酸氢钠 化学式: ,俗称: 粉末, 溶于水,水溶液呈 性,较易 。 胃药、发酵剂、灭火剂
硫酸铜:化学式: , 干燥硫酸铜: 固体易溶于水,溶液呈 。 检验水
一、盐的组成和分类:
1.从组成分类:
⑴根据所含的金属元素可以分为 盐、 盐、 盐、 盐等。
⑵根据所含的酸根可以分为 盐、 盐、 盐、 盐等。
2.从溶解性分类: ⑴可溶盐:⑵难溶盐:
盐的溶解性:
二、盐的化学性质
1、盐与金属的置换反应: 盐 + 金属 → +
CuSO4 + Fe = +
现象; (1) (2)
反应物条件:(1)参加反应的盐必须 水; (2)参加反应的金属在金属活动顺序中位于被置换的金属 。
2、盐与酸的反应: 盐 + 酸 → +
AgNO3+ HCl = + 现象;
BaCl2 + H2SO4 = + 现象;
3、盐与碱的反应: 盐 + 碱 → +
Na2CO3 + Ca(OH)2 = + 现象;
CuSO4 + NaOH = + 现象;
反应物条件:参加反应的盐和碱都必须 水;
4、盐与盐的反应: 盐1 + 盐2→ +
Na2SO4 + BaCl2 = + 现象;
Na2CO3 + BaCl2 = + 现象;
反应物条件:参加反应的盐都必须 水;
初中化学最常见的沉淀:白色___________、____________、____________、__________、__________
蓝色______________、红褐色_________________
主题二:复分解反应发生的条件
1.复分解反应发生的条件是
2.根据复分解反应发生的条件,判断下列反应能否发生,如能发生,请写化学方程式
Cu(OH)2 + HCl—— NaCl + KNO3——
CaCO3 + HCl—— AgNO3 + HCl——
CuSO4 + Ba(OH)2—— Na2CO3 + HC l——
Na2CO3 + KOH—— H2SO4 + Ba(NO3)2——
FeCl3 + NaOH—— NaOH + HCl——
【课堂练习】
一、单选题(本大题共7小题,共14.0分)
下列物质俗称干冰的是
A. 固态的水 B. 固态的氧气
C. 固态的二氧化碳 D. 固态的氮气
下列叙述正确的是( )
A. 用小苏打治疗胃酸过多 B. 用氢氧化钠改良酸性土壤
C. 用铁桶长时间存放硫酸铜溶液 D. 用食盐水除去热水瓶中的水垢
已知某溶液X是下列四种溶液中的一种,取三份等量的该溶液,分别向其中滴加NaOH溶液、稀盐酸、AgNO3溶液中的各一种,产生的现象如表所述。则该溶液X是下列各项中的( )
加入的物质 NaOH溶液 稀盐酸 AgNO3溶液
实验现象 蓝色沉淀 无明显现象 白色沉淀
A. Na2CO3溶液 B. 稀硝酸 C. NaCl溶液 D. CuCl2溶液
下列物质不能由金属与酸反应直接制得的是( )
A. FeSO4 B. ZnSO4 C. AgCl D. AlCl3
下列物质的性质与用途,不相匹配的是( )
A. 碳酸钙能与胃酸反应--可做补钙剂
B. 熟石灰显碱性--中和酸性土壤
C. 白醋含有醋酸,显酸性--家庭中可用作除水垢
D. 碳酸钡不溶于水--医疗上可用于“钡餐”造影
观察是学习化学的重要方法。下列有关实验现象描述正确的是( )
A. 加热“铜绿”时,绿色固体会变为黑色固体,管壁出现小水珠
B. 镁条在空气中燃烧,发出耀眼的白色火焰,放热,产生大量白烟
C. 硫粉在氧气中燃烧,发出明亮的蓝紫色火焰,产生二氧化硫气体
D. 木炭在空气中燃烧,发白光,放热,产生气体能使石灰水变浑浊
一包白色粉末,可能含有CuSO4、CaCO3、BaCl2、Na2SO4、NaOH中的一种或几种。为探究其组成进行如下实验:
①取少量白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液;
②取实验①滤出的白色沉淀,向其中加入足量的盐酸,沉淀全部溶解,并产生无色气体;
③取实验①得到的滤液,向其中通入CO2,产生白色沉淀;
根据以上实验现象,判断白色粉末。下列结论不正确的是( )
A. 白色粉末中一定不含CuSO4、Na2SO4
B. 白色粉末中一定含有CaCO3、BaCl2
C. 白色粉末中一定含有CaCO3、BaCl2、NaOH
D. 白色粉末中可能含有NaOH
二、填空题(本大题共2小题,共16.0分)
选择下列适当的物质填空(选填序号):
A.氧气 B.金刚石 C.钢铁 D.氯化钠 E.氮气 F.活性炭 G.赤铁矿 H.石灰石
(1)自然界硬度最大的是 ______;
(2)可用作医疗急救的是 ______;
(3)炼铁造渣所用矿石是 ______;
(4)生活中作调味品的是 ______;
(5)用于食品保护气的是 ______;
(6)常用来作净水剂的是 ______。
“酸、碱和盐的溶解性表(室温)”是学习化学的重要工具,智慧小组同学利用该工具进行探究学习。
离子 OH- Cl- SO42- CO32-
K+ 乙 丁 戊
Ba2+ 甲 丙
如表,表中标注了甲、乙、丙、丁和戊五种物质,物质的溶解性均未标明。请回答如下问题:
(1)认识符号:NO3-名称是 ______;
(2)物质分类:五种物质中,属于碱的是 ______(用化学式表示);
(3)溶解能力:五种物质中,只有一种不溶于水,它是 ______(用化学式表示);
(4)相互反应:五种物质中,在溶液中能相互发生的反应是 ______(用化学方程式表示)。
三、推断题(本大题共1小题,共10.0分)
有一包固体粉末M,可能由FeCl3、Ba(NO3)2、Na2SO4、NaOH、NaCl中的几种组成。为了确定其成分,现进行如图所示实验(各步骤均充分反应)。
(1)操作a的名称是 ______ 。
(2)溶液A中的溶质是 ______ ,白色沉淀B为 ______ 。
(3)写出步骤④发生反应的化学方程式 ______ ,该反应属于 ______ (填基本反应类型)。
(4)由以上实验推断,粉末M中一定含有的物质是 ______ 。
四、简答题(本大题共1小题,共8.0分)
(1)现有下列四种物质,请选择适当物质的序号填空:
a.食醋 b.生石灰 c.熟石灰 d.碳酸氢钠
①可用来除去水垢的是 ______。
②常用作食品干燥剂的是 ______。
③制作松软可口的馒头时,常加入的物质是 ______。
④常用作改良酸性土壤的是 ______。
(2)能源和环境问题是人们日益关注的问题。在农村推广家用沼气池建设是改善农村能源结构和环境卫生的重要举措,沼气的主要成分是 ______(填名称)。
(3)日常生活中最常用的消毒药水之一是84消毒液,它的有效成分是NaClO,该物质中氯元素的化合价为 ______价。使用84消毒液时不能和洁厕灵混用,原因是两者的有效成分会发生下列方程式:NaClO+2HCl=NaCl+X↑+H2O,其中X的化学式为 ______。
五、计算题(本大题共1小题,共10.0分)
酸、碱、盐在生产和生活中有广泛的应用。(1)下列关于常见盐的用途,错误的是______(填字母)。
A.食盐用作调味品 B.纯碱用于除水垢
C.碳酸钙用作补钙剂 D.碳酸氢钠用于焙制糕点
(2)下图是利用数字化传感器得到的氢氧化钠溶与硫酸反应时溶液pH变化图像。
①根据图中曲线,判断进行的操作是______(填字母)。
A.将硫酸溶液逐滴滴加到氢氧化钠溶液中
B.将氢氧化钠溶液逐滴滴加到硫酸溶液中
②b点对应的溶液中的溶质为______________(写化学式)。
③若80g 5%的氢氧化钠溶液能恰好中和50g硫酸溶液,试计算该硫酸溶液的溶质质量分数。
(3)为除去粗盐水中的可溶性杂质MgSO4、CaCl2,某化学小组设计了如图方案:
①过滤用到的玻璃仪器有烧杯、玻璃棒和____________。
②加入过量的Ba(OH)2溶液目的是__________________________________。
③溶液X中有氯化钠、__________________。
8.4常见的盐答案
【课前复习】
一、单选题(本大题共6小题,共12.0分)
向含有酚酞的NaOH溶液中滴加盐酸,溶液红色褪去,变为无色,此时溶液pH可能是( )
A. 5 B. 9 C. 12 D. 13
中和反应在生产、生活中应用广泛。下列应用的主要原理不涉及中和反应的是( )
A. 生石灰用于加热即热食品 B. 氢氧化铝用于治疗胃酸过多
C. 熟石灰用于改良酸性土壤 D. 硼酸用于处理皮肤上沾有的碱
推理是学习化学的一种重要方法。下列的推理正确的是( )
A. 某溶液不能使酚酞溶液变色,说明该溶液一定显酸性
B. 中和反应生成盐和水,所以生成盐和水的反应一定是中和反应
C. 酸和碱的溶液能与指示剂反应,则所有的酸和碱都能使指示剂变色
D. 稀盐酸、稀硫酸都能使石蕊试液变红,则稀硝酸也能使石蕊溶液变红
对于化学反应A+B=C+D的下列说法中正确的是( )
A. 若生成物C和D分别为盐和水,则该反应一定是中和反应
B. 若A和C是单质,B和D是化合物,则该反应一定是置换反应
C. 若A、B各取10g混合,使其充分反应,则C、D质量的总和一定等于20g
D. 若A、B、C、D都是化合物,则该反应一定是复分解反应
下列各组离子在水溶液中能大量共存的是()
A. H+、、OH- B. Na+、Ca2+、
C. OH-、、Cu2+ D. Ba2+、、K+
某校化学兴趣小组利用数字化传感器探究稀盐酸和氢氧化钠溶液的反应过程,测得烧杯中溶液的pH随滴加液体体积变化的曲线如图所示。下列说法错误的是( )
A. 图中b点所示溶液中,溶质是NaCl
B. 向图中c点所示溶液中滴加无色酚酞,溶液不变色
C. 该实验是将氢氧化钠溶液逐滴滴入到盛有稀盐酸的烧杯中
D. 由a点到b点的pH变化过程证明酸和碱发生了中和反应
二、填空题(本大题共1小题,共8.0分)
如图所示是溶液①和②之间发生复分解反应时有关粒子的变化情况,请回答下列问题:
(1)①溶液中的溶质属于 ______ (填“酸”“碱”“盐”或“氧化物”),写出该溶质的化学式: ______ 。
(2)由图示可知,①和②两溶液反应的实质是 ______ 和 ______ (填微粒符号)之间的结合,反应的化学方程式为 ______ 。
1.【答案】A
2.【答案】A
3.【答案】D
4.【答案】B
5.【答案】D
6.【答案】B
7.【答案】盐 Na2CO3 Ca2+ CO32- Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
【学习目标】
1.知道食盐、纯碱、小苏打、大理石的化学成分、化学式学名及色、态特性和用途。
2.认识金属与盐反应的化学性质
常见的盐
盐的名称、成分 性状 用途
氯化钠 化学式: NaCl , 食盐 的主要成分 无色 晶体, 易 溶于水有 咸 味,溶液呈中 性。 调味剂 、 配制生理盐水 、制盐酸、氯气等化工原料
碳酸钙 化学式: CaCO3 , 石灰石 、 大理石 的主要成分 纯净物时为 白 色, 不溶于水, 易容 溶于酸 建筑 材料、炼铁、炼钢材料、珍珠饰品、制造水泥的原料
碳酸钠 化学式:Na2CO3 ,俗称: 苏打 、 纯碱 白色 晶体, 易 溶于水,水溶液呈 碱 性 造纸、印染、制玻璃、瓷砖制洗涤剂、洗衣粉
碳酸氢钠 化学式: NaHCO3 ,俗称: 小苏打 粉末, 溶于水,水溶液呈 性,较易 。 胃药、发酵剂、灭火剂
硫酸铜:化学式: , 干燥硫酸铜: 固体易溶于水,溶液呈 。 检验水
一、盐的组成和分类:
1.从组成分类:
⑴根据所含的金属元素可以分为 盐、 盐、 盐、 盐等。
⑵根据所含的酸根可以分为 盐、 盐、 盐、 盐等。
2.从溶解性分类: ⑴可溶盐:⑵难溶盐:
盐的溶解性;钾钠铵盐硝酸盐均可溶,盐酸盐不容银,硫酸盐不容钡,碳酸盐只溶钾钠铵盐。
二、盐的化学性质
1、盐与金属的置换反应: 盐 + 金属 → +
CuSO4 + Fe = +
现象; (1) (2)
反应物条件:(1)参加反应的盐必须 水; (2)参加反应的金属在金属活动顺序中位于被置换的金属 。
2、盐与酸的反应: 盐 + 酸 → +
AgNO3+ HCl = + 现象;
BaCl2 + H2SO4 = + 现象;
3、盐与碱的反应: 盐 + 碱 → +
Na2CO3 + Ca(OH)2 = + 现象;
CuSO4 + NaOH = + 现象;
反应物条件:参加反应的盐和碱都必须 水;
4、盐与盐的反应: 盐1 + 盐2→ +
Na2SO4 + BaCl2 = + 现象;
Na2CO3 + BaCl2 = + 现象;
反应物条件:参加反应的盐都必须 水;
初中化学最常见的沉淀:白色___________、____________、____________、__________、__________
蓝色______________、红褐色_________________
主题二:复分解反应发生的条件
1.复分解反应发生的条件是
2.根据复分解反应发生的条件,判断下列反应能否发生,如能发生,请写化学方程式
Cu(OH)2 + HCl—— NaCl + KNO3——
CaCO3 + HCl—— AgNO3 + HCl——
CuSO4 + Ba(OH)2—— Na2CO3 + HC l——
Na2CO3 + KOH—— H2SO4 + Ba(NO3)2——
FeCl3 + NaOH—— NaOH + HCl——
【课堂练习】
一、单选题(本大题共7小题,共14.0分)
下列物质俗称干冰的是
A. 固态的水 B. 固态的氧气
C. 固态的二氧化碳 D. 固态的氮气
下列叙述正确的是( )
A. 用小苏打治疗胃酸过多 B. 用氢氧化钠改良酸性土壤
C. 用铁桶长时间存放硫酸铜溶液 D. 用食盐水除去热水瓶中的水垢
已知某溶液X是下列四种溶液中的一种,取三份等量的该溶液,分别向其中滴加NaOH溶液、稀盐酸、AgNO3溶液中的各一种,产生的现象如表所述。则该溶液X是下列各项中的( )
加入的物质 NaOH溶液 稀盐酸 AgNO3溶液
实验现象 蓝色沉淀 无明显现象 白色沉淀
A. Na2CO3溶液 B. 稀硝酸 C. NaCl溶液 D. CuCl2溶液
下列物质不能由金属与酸反应直接制得的是( )
A. FeSO4 B. ZnSO4 C. AgCl D. AlCl3
下列物质的性质与用途,不相匹配的是( )
A. 碳酸钙能与胃酸反应--可做补钙剂
B. 熟石灰显碱性--中和酸性土壤
C. 白醋含有醋酸,显酸性--家庭中可用作除水垢
D. 碳酸钡不溶于水--医疗上可用于“钡餐”造影
观察是学习化学的重要方法。下列有关实验现象描述正确的是( )
A. 加热“铜绿”时,绿色固体会变为黑色固体,管壁出现小水珠
B. 镁条在空气中燃烧,发出耀眼的白色火焰,放热,产生大量白烟
C. 硫粉在氧气中燃烧,发出明亮的蓝紫色火焰,产生二氧化硫气体
D. 木炭在空气中燃烧,发白光,放热,产生气体能使石灰水变浑浊
一包白色粉末,可能含有CuSO4、CaCO3、BaCl2、Na2SO4、NaOH中的一种或几种。为探究其组成进行如下实验:
①取少量白色粉末,向其中加入足量的水,充分搅拌后过滤,得到白色沉淀和无色滤液;
②取实验①滤出的白色沉淀,向其中加入足量的盐酸,沉淀全部溶解,并产生无色气体;
③取实验①得到的滤液,向其中通入CO2,产生白色沉淀;
根据以上实验现象,判断白色粉末。下列结论不正确的是( )
A. 白色粉末中一定不含CuSO4、Na2SO4
B. 白色粉末中一定含有CaCO3、BaCl2
C. 白色粉末中一定含有CaCO3、BaCl2、NaOH
D. 白色粉末中可能含有NaOH
二、填空题(本大题共2小题,共16.0分)
选择下列适当的物质填空(选填序号):
A.氧气 B.金刚石 C.钢铁 D.氯化钠 E.氮气 F.活性炭 G.赤铁矿 H.石灰石
(1)自然界硬度最大的是 ______;
(2)可用作医疗急救的是 ______;
(3)炼铁造渣所用矿石是 ______;
(4)生活中作调味品的是 ______;
(5)用于食品保护气的是 ______;
(6)常用来作净水剂的是 ______。
“酸、碱和盐的溶解性表(室温)”是学习化学的重要工具,智慧小组同学利用该工具进行探究学习。
离子 OH- Cl- SO42- CO32-
K+ 乙 丁 戊
Ba2+ 甲 丙
如表,表中标注了甲、乙、丙、丁和戊五种物质,物质的溶解性均未标明。请回答如下问题:
(1)认识符号:NO3-名称是 ______;
(2)物质分类:五种物质中,属于碱的是 ______(用化学式表示);
(3)溶解能力:五种物质中,只有一种不溶于水,它是 ______(用化学式表示);
(4)相互反应:五种物质中,在溶液中能相互发生的反应是 ______(用化学方程式表示)。
三、推断题(本大题共1小题,共10.0分)
有一包固体粉末M,可能由FeCl3、Ba(NO3)2、Na2SO4、NaOH、NaCl中的几种组成。为了确定其成分,现进行如图所示实验(各步骤均充分反应)。
(1)操作a的名称是 ______ 。
(2)溶液A中的溶质是 ______ ,白色沉淀B为 ______ 。
(3)写出步骤④发生反应的化学方程式 ______ ,该反应属于 ______ (填基本反应类型)。
(4)由以上实验推断,粉末M中一定含有的物质是 ______ 。
四、简答题(本大题共1小题,共8.0分)
(1)现有下列四种物质,请选择适当物质的序号填空:
a.食醋 b.生石灰 c.熟石灰 d.碳酸氢钠
①可用来除去水垢的是 ______。
②常用作食品干燥剂的是 ______。
③制作松软可口的馒头时,常加入的物质是 ______。
④常用作改良酸性土壤的是 ______。
(2)能源和环境问题是人们日益关注的问题。在农村推广家用沼气池建设是改善农村能源结构和环境卫生的重要举措,沼气的主要成分是 ______(填名称)。
(3)日常生活中最常用的消毒药水之一是84消毒液,它的有效成分是NaClO,该物质中氯元素的化合价为 ______价。使用84消毒液时不能和洁厕灵混用,原因是两者的有效成分会发生下列方程式:NaClO+2HCl=NaCl+X↑+H2O,其中X的化学式为 ______。
五、计算题(本大题共1小题,共10.0分)
酸、碱、盐在生产和生活中有广泛的应用。(1)下列关于常见盐的用途,错误的是______(填字母)。
A.食盐用作调味品 B.纯碱用于除水垢
C.碳酸钙用作补钙剂 D.碳酸氢钠用于焙制糕点
(2)下图是利用数字化传感器得到的氢氧化钠溶与硫酸反应时溶液pH变化图像。
①根据图中曲线,判断进行的操作是______(填字母)。
A.将硫酸溶液逐滴滴加到氢氧化钠溶液中
B.将氢氧化钠溶液逐滴滴加到硫酸溶液中
②b点对应的溶液中的溶质为______________(写化学式)。
③若80g 5%的氢氧化钠溶液能恰好中和50g硫酸溶液,试计算该硫酸溶液的溶质质量分数。
(3)为除去粗盐水中的可溶性杂质MgSO4、CaCl2,某化学小组设计了如图方案:
①过滤用到的玻璃仪器有烧杯、玻璃棒和____________。
②加入过量的Ba(OH)2溶液目的是__________________________________。
③溶液X中有氯化钠、__________________。
1.【答案】C
2.【答案】A
3.【答案】D
4.【答案】C
5.【答案】D
6.【答案】A
7.【答案】C
8.【答案】B A H D E F
9.【答案】硝酸根离子 Ba(OH)2 BaSO4 K2CO3+Ba(OH)2=BaCO3↓+2KOH
10.【答案】过滤 Na2SO4和NaCl BaSO4 AgNO3+NaCl=AgCl↓+NaNO3 复分解反应 FeCl3、NaOH、Na2SO4
11.【答案】a b d c 甲烷 +1 CI2
12.【答案】(1)B;
(2)①B;②NaOH和Na2SO4;
③设硫酸溶液中溶质的质量为x,则:
2NaOH+H2SO4=Na2SO4+2H2O
80 98
x
x=4.9g,该硫酸溶液的溶质质量分数是:×100%=9.8%。
(3)①漏斗;②使MgSO4完全反应;③Na2CO3、NaOH。
