【高效攻略、逐个击破】人教版选修4高二化学章节验收《第四章 章末综合检测》(共18页、word版、含答案点拨)
文档属性
| 名称 | 【高效攻略、逐个击破】人教版选修4高二化学章节验收《第四章 章末综合检测》(共18页、word版、含答案点拨) |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-04-10 09:24:06 | ||
图片预览




文档简介
章末综合检测
(90分钟,100分)
一、选择题(本题包括17个小题,每小题3分,共51分)
1.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-===Cl2↑
B.氢氧燃料电池的负极反应式为:O2+2H2O+4e-===4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-===Cu2+
D.钢铁发生电化学腐蚀的正极反应式为:Fe-2e-===Fe2+
答案:A
点拨:A项中,惰性电极电解食盐水阳极上Cl-放电正确;B中,负极上是H2放电;C中粗铜应接电源的正极;钢铁发生电化学腐蚀的本质是负极:Fe-2e-===Fe2+,故答案为A。
2.下列叙述中,正确的是( )
①电解池是将化学能转变成电能的装置
②原电池是将电能转变成化学能的装置
③金属和石墨导电均为物理变化,电解质溶液导电是化学变化
④不能自发进行的氧化还原反应,通过电解的原理有可能实现
⑤电镀过程相当于金属的“迁移”,可视为物理变化
A.①②③④ B.③④
C.③④⑤ D.④
答案:B
点拨:①、②正好相反了,③、④正确,⑤中电镀是特殊形式的电解,仍然是化学变化。
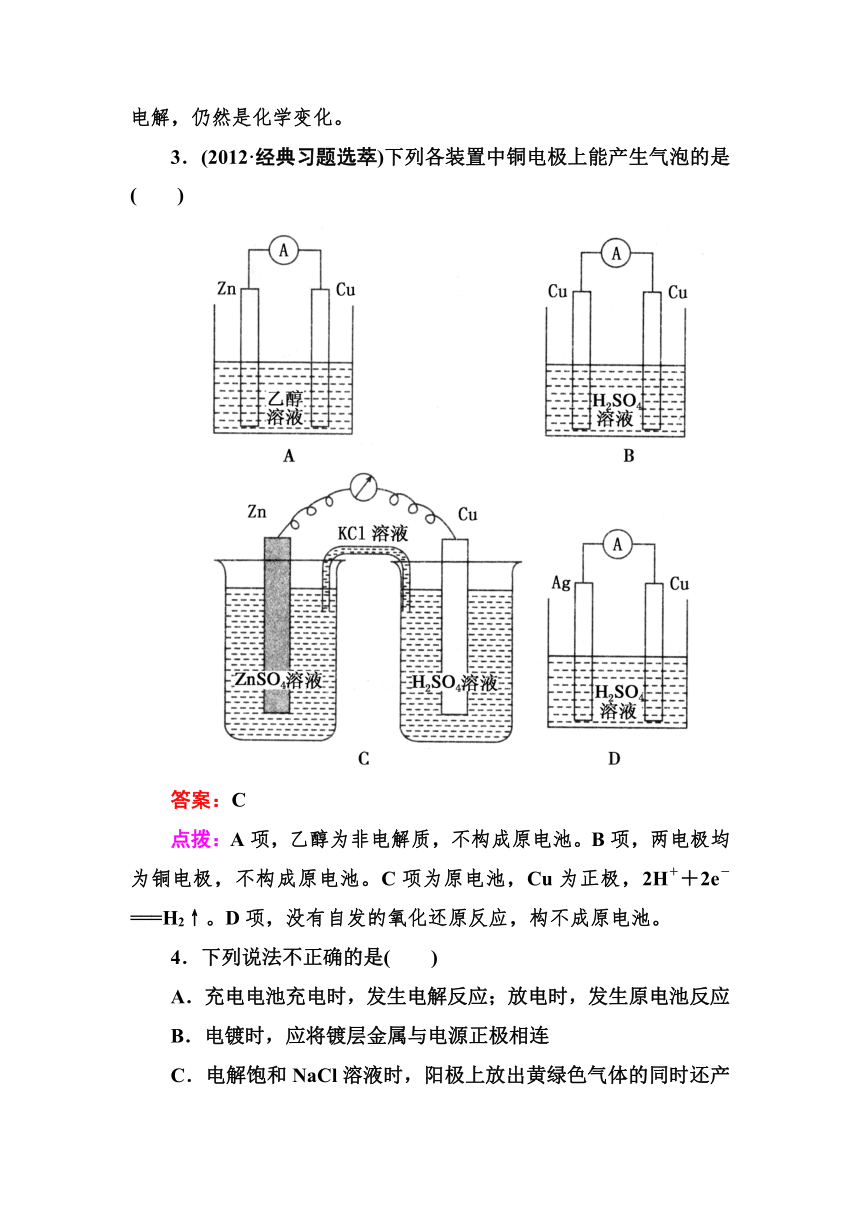
3.(2012·经典习题选萃)下列各装置中铜电极上能产生气泡的是( )
答案:C
点拨:A项,乙醇为非电解质,不构成原电池。B项,两电极均为铜电极,不构成原电池。C项为原电池,Cu为正极,2H++2e-===H2↑。D项,没有自发的氧化还原反应,构不成原电池。
4.下列说法不正确的是( )
A.充电电池充电时,发生电解反应;放电时,发生原电池反应
B.电镀时,应将镀层金属与电源正极相连
C.电解饱和NaCl溶液时,阳极上放出黄绿色气体的同时还产生大量的氢氧化钠
D.利用电化学原理保护金属主要有两种方法,分别是牺牲阳极的阴极保护法和外加电流的阴极保护法
答案:C
点拨:二次电池放电时是原电池,充电时是电解池,所以A正确;电镀时镀层金属就应该和电源的正极相连构成阳极;C项中NaOH在阴极区生成,所以C错;D正确。
5.如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流表中有电流通过,则下列说法正确的是( )
A.锌片是负极
B.两个铜片上都发生氧化反应
C.石墨是阴极
D.两个番茄都形成原电池
答案:A
点拨:由于番茄汁显酸性,Zn和Cu的活泼性不同,且Zn能与H+反应,因此左侧为原电池,右侧为电解池。在左侧,Zn作负极,Cu作正极,在右侧C作阳极,Cu作阴极,故A正确。
6.在理论上不能用于设计成原电池的化学反应是( )
A. 4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s) ΔH<0
B.CH3CH2OH(l)+3O2(g)===2CO2 (g)+3H2O(l) ΔH<0
C.Al(OH)3(s)+NaOH(aq)===NaAlO2(aq)+2H2O(l) ΔH<0
D.H2(g)+Cl2(g)===2HCl(g) ΔH<0
答案:C
点拨:能设计成原电池的反应,应是自发的氧化还原反应。C项不是氧化还原反应,所以不能设计成原电池。
7.下列事实与电化学腐蚀无关的是( )
A.钢铁制品生锈后用盐酸处理
B.黄铜(Cu、Zn合金)制的铜锣不易产生铜绿
C.铜、铝电线一般不连接起来作导线
D.生铁比熟铁(几乎是纯铁)容易生锈
答案:A
点拨:B项中黄铜是铜锌合金,可以构成原电池,但铜没有锌活泼,被腐蚀的是锌而不是铜,所以不易产生铜绿,选项C中铝的活泼性比铜强,两者构成原电池;选项D中生铁是铁碳合金,可以构成原电池而使铁腐蚀生锈。
8.下列过程需要通电才能进行的是( )
①电离 ②电解 ③电镀 ④电泳 ⑤电化学腐蚀
A.①②③ B.②④⑤
C.②③④ D.全部
答案:B
9.对外加电流的金属保护中,下列叙述正确的是( )
A,被保护的金属与电源的正极相连
B.被保护的金属与电源的负极相连
C.在被保护的金属表面上发生氧化反应
D.被保护的金属为阴极,其表面上不发生氧化反应,而发生还原反应
答案:BD
点拨:外加电流的金属保护法依据的是电解池的原理,被保护的金属与电源的负极相连,作阴极,发生还原反应。
10.我国某大城市今年夏季多次降下酸雨。据环保部门测定,该城市整个夏季酸雨的pH平均为3.2。在这种环境中的铁制品极易被腐蚀。对此条件下铁的腐蚀的叙述不正确的是( )
A.此腐蚀过程有化学腐蚀也有电化学腐蚀
B.发生电化学腐蚀时的正极反应为2H2O+O2+4e-===4OH-
C.在化学腐蚀过程中有氢气产生
D.发生电化学腐蚀时的负极反应为Fe-2e-===Fe2+
答案:B
点拨:酸性条件下发生析氢腐蚀,正极反应为2H++2e-===H2↑,负极反应为Fe-2e-===Fe2+。
11.根据下列事实:
(1)X+Y2+===X2++Y;
(2)Z+2H2O===Z(OH)2+H2↑;
(3)Z2+氧化性比X2+弱;
(4)由Y、W电极组成的原电池,电极反应为:W2++2e-===W,Y-2e-===Y2+。可知X、Y、Z、W的还原性由强到弱的顺序是( )
A.X>Z>Y>W B.Z>W>X>Y
C.Z>X>Y>W D.Z>Y>X>W
答案:C
点拨:依据氧化还原反应规律,还原性:还原剂>还原产物。还原性:由题中(1)可知X>Y,由(3)可知Z>X,由(4)可知Y>W,故C项正确。
12.(2012·试题调研)用惰性电极电解下列溶液,一段时间后,停止电解,向溶液中加入一定质量的另一种物质(括号内),能使溶液完全复原的是( )
A. CuCl2 (CuO) B.NaOH (NaOH)
C.CuSO4 (CuCO3) D.NaCl (NaOH)
答案:C
点拨:
选项
产物物质的量比
复原加入物质
A
Cu:Cl2 =1:1
CuCl2固体
B
H2:O2=2:1
H2O
C
Cu:O2 =2:1
CuO或CuCO3
D
Cl2:H2 =1:1
HCl气体
13.如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味的气体放出,符合这一情况的是( )
a极板
b极板
X电极
Z
A
锌
石墨
负极
CuSO4
B
石墨
石墨
负极
NaOH
C
银
铁
正极
AgNO3
D
铜
石墨
负极
CuCl2
答案:A
点拨:该装置为电解装置,a极板质量增加,说明a为阴极,X为负极,Y为正极,b为阳极。A项,a极板2Cu2++4e-===2Cu,阳极:4OH--4e-===2H2O+O2↑,符合题意。B项,a极板生成H2,质量不增加,不合题意。C项,X为正极,不合题意。D项,b极:2Cl--2e-===Cl2↑,Cl2为黄绿色气体,不合题意。
14.下图有关电化学的示意图正确的是( )
答案:D
点拨:A项,Zn作负极、Cu作正极,错误;B项,Zn、Cu两极应互换;C项,粗铜应作阳极,精铜作阴极。
15.(2012·试题调研)在铁制品上镀上一定厚度的铜层,以下电镀方案中正确的是( )
A.铜作阳极,铁制品作阴极,溶液中含Fe2+
B.铜作阴极,铁制品作阳极,溶液中含Cu2+
C.铜作阴极,铁制品作阳极,溶液中含Fe3+
D.铜作阳极,铁制品作阴极,溶液中含Cu2+
答案:D
点拨:在铁上镀铜,则要求铜在阳极,铁在阴极,电解质溶液含Cu2+,D项符合题意。
16.如下图所示,装置中都盛有0.1mol/L的NaCl溶液,放置一段时间后,装置中的四块相同的锌片腐蚀速率由快到慢的正确顺序是( )
A.①②③④ B.①②④③
C.③①④② D.②①④③
答案:D
点拨:腐蚀速率:作电解池阳极引起的腐蚀>作原电池负极引起的腐蚀>化学腐蚀>有防护措施的腐蚀,可知答案为D。
17.(2012·试题调研)用阳极X和阴极Y电解Z的水溶液,电解一段时间后,再加入W,能使溶液恢复到电解前的状态,下表中符合题意的一组是( )
X
Y
Z
W
A
C
Fe
NaCl
H2O
B
Pt
Cu
CuSO4
CuSO4溶液
C
C
C
H2SO4
H2O
D
Ag
Fe
AgNO3
AgNO3晶体
答案:C
点拨:A项,电解NaCl溶液生成H2和Cl2,显然加H2O不能恢复到电解前的状态,应通入适量HCl气体;B项,电解CuSO4溶液时n(SO)不变,加CuSO4溶液也不能复原;C项,电解H2SO4实质是电解水,再加适量水,可使H2SO4溶液复原;D项,Ag作阳极、Fe作阴极电解AgNO3溶液,实质是Fe上镀Ag,AgNO3溶液浓度不变,不需加AgNO3晶体。
二、非选择题(本题包括6小题,共49分)
18.(8分)(2012·试题调研)下图为以惰性电极进行电解的装置:
(1)写出A、B、C、D各电极上的电极反应式和反应方程式:
A:_________________________________________________,
B:_________________________________________________,
总反应方程式:______________________________________;
C:_________________________________________________,
D:________________________________________________,
总反应方程式:______________________________________;
(2)在A、B、C、D各电极上析出生成物的物质的量之比为_______________________________________________________。
答案:(1)Cu2++2e-===Cu 2Cl--2e-===Cl2↑
CuCl2Cu+Cl2↑ 2Ag++2e-===2Ag
4OH--4e-===2H2O+O2↑
4AgNO3+2H2O4Ag+4HNO3+O2↑
(2)2:2:4:1
点拨:该题装置在串联的条件下进行电解。A、B、C、D分别发生如下反应:Cu2++2e-===Cu;2Cl--2e-===Cl2↑;2Ag++2e-===2Ag;4OH--4e-===2H2O+O2↑;由电子守恒可知在四个电极依次析出物质的物质的量之比为n(Cu):n(Cl)2:n(Ag):n(O2)=2:2:4:1。
19.(8分)(2012·试题调研)在由铜片、锌片和200mL一定浓度的稀硫酸组成的原电池中,若锌片只发生电化学腐蚀,当在铜片上放出3. 36 L(标准状况)的H2时,硫酸恰好用完,请填空:
①正极的电极反应式为_______________________________;
负极的电极反应式为_________________________________;
②通过导线的电子的物质的量为_______________________;
③原稀硫酸的物质的量浓度为_________________________。
答案:①2H++2e-===H2↑ Zn-2e-===Zn2+
②0.3mol ③0.75mol/L
点拨:由铜片、锌片和稀硫酸组成的原电池中,锌作负极,电极反应式为Zn-2e-===Zn2+,铜为正极,电极反应式为2H++2e-===H2↑,由正极电极反应式可知,生成3. 36L氢气,通过导线的电子的物质的量为0.3mol,消耗氢离子的物质的量为0.3mol,硫酸的物质的量为0.15mol,则稀硫酸的物质的量浓度为0.75mol/L。
20.(8分)请按要求回答下列问题。
(1)根据下图回答①②:
①打开K2,合并K1。
A电极可观察到的现象是______________________________;
B极的电极反应式为__________________________________。
②打开K1,合并K2。
A电极可观察到的现象是_____________________________;
B极的电极反应为____________________________________。
(2)根据右图回答③④:
③将较纯净的CuSO4溶液放入如图2所示的装置中进行电解,石墨电极上的电极反应式为____________________________________
_________________________________________________________,
电解反应的离子方程式为________________________________
________________________________________________________________________________________________________________;
④实验完成后,铜电极增重ag,石墨电极产生标准状况下的气体体积________L。
答案:(1)①锌不断溶解 Cu2++2e-===Cu
②电极表面有红色固体附着 Cu-2e-===Cu2+
(2)③4OH--4e-===2H2O+O2↑
2Cu2++2H2O2Cu+O2↑+4H+
④
点拨:(1)①此时为原电池,锌为负极,不断溶解,B极为正极,反应为Cu2++2e-===Cu。②此时为电解池,A极为阴极,反应为Cu2++2e-===Cu,故A极上镀上一层红色的铜,B极为阳极,反应为Cu-2e-===Cu2+。
(2)此时为惰性电极电解CuSO4溶液,石墨极上反应为4OH--4e-===2H2O+O2↑,总反应的离子方程式为2Cu2++2H2O2Cu+O2↑+4H+,V(O2)=××22.4 L= L。
21.(8分)(2012·试题调研)如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色。试完成以下问题:
(1)电源A极的名称是________。
(2)甲装置中电解反应的总化学方程式是___________________
____________________________________________________________________________________________________________________。
(3)如果收集乙装置中产生的气体,两种气体的体积比是________。
(4)欲用丙装置给铜镀银,G应该是________(填“铜”或“银”),电镀液的主要成分是________(填化学式)。
答案:(1)正极
(2)2CuSO4+2H2O2Cu+O2↑+2H2SO4
(3)1:1
(4)银 AgNO3
点拨:向乙中滴入酚酞溶液,在F极附近显红色,说明F为阴极,E为阳极,所以B为电源的负极,A为电源的正极。甲是电解CuSO4溶液,总方程式:2CuSO4+2H2O2Cu+O2↑+2H2SO4。乙装置中生成的两种气体体积比为V(Cl2):V(H2) =1:1。丙是电镀池,所以给铜镀银阳极G应为Ag,阴极H为Cu,电镀液为AgNO3溶液。
22.(8分)(2012·经典习题选萃)请从图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25mL),并检验氯气的氧化性。
(1)A极发生的电极反应式是_____________________________;
B极发生的电极反应式是_______________________________;
电解饱和食盐水的化学方程式是__________________________
_________________________________________________________________________________________________________________。
(2)电源的M端应连接的电极为________(A或B)极。
(3)设计上述气体实验装置时,各接口的正确连接顺序为:
________接________、________接A,B接________、________接________。
(4)实验中,在盛有KI淀粉溶液的容器中发生反应的离子方程式为_______________________________________________________。
(5)已知饱和食盐水50mL,某时刻测得H2体积为56mL(标准状况)。此时溶液pH约为________。
答案:(1)2H++2e-===H2↑
2Cl--2e-===Cl2↑
2NaCl+2H2O2NaOH+H2↑+Cl2↑
(2)B (3)H F G D E C
(4)Cl2+2I-===2Cl-+I2 (5)13
点拨:(1)因Fe为活泼电极,电解饱和食盐水时,要作阴极发生还原反应,B为惰性电极作阳极,发生氧化反应。
(2)电源负极接电解池的铁棒,碳棒作阳极接电源正极。
(3)电解池左边A导管口产生H2,右边B导管口产生Cl2,以电解池为中心,则有:H←F、G←A、B→D、E→C相应装置的作用:
(4)Cl2氧化I-,即Cl2+2I-===2Cl-+I2。
(5) 2NaOH ~ H2
2mol 22.4 L
5×10-3mol 56×10-3 L
c(OH-)==0.1mol·L-1
pOH=-lg0.1=1
pH=14-pOH=14-1=13。
23.(9分)(2012·辽宁五校协作体期末联考)某课外活动小组同学用如右图装置进行实验,试回答下列问题:
(1)若开始时开关K与a连接,则B极的电极反应式为_________
___________________________________________________。
(2)若开始时开关K与b连接,则B极的电极反应式为__________
___________________________________________________。
总反应的离子方程式为__________________________。
有关上述实验,下列说法正确的是(填序号)____。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生22.4 L气体,则溶液中转移0.2mol电子
(3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为_____________________________
___________________________________________________________________________________________________________________。
此时通过阴离子交换膜的离子数________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数②通电开始后,阴极附近溶液pH会增大,请简述原因:______________________________。
③若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则电池负极的电极反应式为___________________________________
________________________________________________________________________________________________________。
答案:(1)Fe-2e-===Fe2+ (2)2H++2e-===H2↑
2Cl-+2H2O2OH-+H2↑+Cl2↑ ②
(3)①4OH--4e-===2H2O+O2↑ 小于
②H+放电促进水的电离,使OH-浓度增大
③O2+2H2O+4e-===4OH-
点拨:(1)为原电池,铁被氧化腐蚀,即电极反应式为Fe-2e-===Fe2+。(2)为电解池,阳极A发生2Cl--2e-===Cl2↑、阴极B发生2H++2e-===H2↑;阳离子向阴极移动,①错误;③应该通入HCl,不能加盐酸,因为盐酸是HCl的水溶液,错误;④电子不能在溶液中移动,错误。(3)依据电荷守恒通过阳离子交换膜的K+是通过阴离子交换膜的SO的2倍。
(90分钟,100分)
一、选择题(本题包括17个小题,每小题3分,共51分)
1.化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A.惰性电极电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-===Cl2↑
B.氢氧燃料电池的负极反应式为:O2+2H2O+4e-===4OH-
C.粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-===Cu2+
D.钢铁发生电化学腐蚀的正极反应式为:Fe-2e-===Fe2+
答案:A
点拨:A项中,惰性电极电解食盐水阳极上Cl-放电正确;B中,负极上是H2放电;C中粗铜应接电源的正极;钢铁发生电化学腐蚀的本质是负极:Fe-2e-===Fe2+,故答案为A。
2.下列叙述中,正确的是( )
①电解池是将化学能转变成电能的装置
②原电池是将电能转变成化学能的装置
③金属和石墨导电均为物理变化,电解质溶液导电是化学变化
④不能自发进行的氧化还原反应,通过电解的原理有可能实现
⑤电镀过程相当于金属的“迁移”,可视为物理变化
A.①②③④ B.③④
C.③④⑤ D.④
答案:B
点拨:①、②正好相反了,③、④正确,⑤中电镀是特殊形式的电解,仍然是化学变化。
3.(2012·经典习题选萃)下列各装置中铜电极上能产生气泡的是( )
答案:C
点拨:A项,乙醇为非电解质,不构成原电池。B项,两电极均为铜电极,不构成原电池。C项为原电池,Cu为正极,2H++2e-===H2↑。D项,没有自发的氧化还原反应,构不成原电池。
4.下列说法不正确的是( )
A.充电电池充电时,发生电解反应;放电时,发生原电池反应
B.电镀时,应将镀层金属与电源正极相连
C.电解饱和NaCl溶液时,阳极上放出黄绿色气体的同时还产生大量的氢氧化钠
D.利用电化学原理保护金属主要有两种方法,分别是牺牲阳极的阴极保护法和外加电流的阴极保护法
答案:C
点拨:二次电池放电时是原电池,充电时是电解池,所以A正确;电镀时镀层金属就应该和电源的正极相连构成阳极;C项中NaOH在阴极区生成,所以C错;D正确。
5.如图所示,铜片、锌片和石墨棒用导线连接后插入番茄里,电流表中有电流通过,则下列说法正确的是( )
A.锌片是负极
B.两个铜片上都发生氧化反应
C.石墨是阴极
D.两个番茄都形成原电池
答案:A
点拨:由于番茄汁显酸性,Zn和Cu的活泼性不同,且Zn能与H+反应,因此左侧为原电池,右侧为电解池。在左侧,Zn作负极,Cu作正极,在右侧C作阳极,Cu作阴极,故A正确。
6.在理论上不能用于设计成原电池的化学反应是( )
A. 4Fe(OH)2(s)+2H2O(l)+O2(g)===4Fe(OH)3(s) ΔH<0
B.CH3CH2OH(l)+3O2(g)===2CO2 (g)+3H2O(l) ΔH<0
C.Al(OH)3(s)+NaOH(aq)===NaAlO2(aq)+2H2O(l) ΔH<0
D.H2(g)+Cl2(g)===2HCl(g) ΔH<0
答案:C
点拨:能设计成原电池的反应,应是自发的氧化还原反应。C项不是氧化还原反应,所以不能设计成原电池。
7.下列事实与电化学腐蚀无关的是( )
A.钢铁制品生锈后用盐酸处理
B.黄铜(Cu、Zn合金)制的铜锣不易产生铜绿
C.铜、铝电线一般不连接起来作导线
D.生铁比熟铁(几乎是纯铁)容易生锈
答案:A
点拨:B项中黄铜是铜锌合金,可以构成原电池,但铜没有锌活泼,被腐蚀的是锌而不是铜,所以不易产生铜绿,选项C中铝的活泼性比铜强,两者构成原电池;选项D中生铁是铁碳合金,可以构成原电池而使铁腐蚀生锈。
8.下列过程需要通电才能进行的是( )
①电离 ②电解 ③电镀 ④电泳 ⑤电化学腐蚀
A.①②③ B.②④⑤
C.②③④ D.全部
答案:B
9.对外加电流的金属保护中,下列叙述正确的是( )
A,被保护的金属与电源的正极相连
B.被保护的金属与电源的负极相连
C.在被保护的金属表面上发生氧化反应
D.被保护的金属为阴极,其表面上不发生氧化反应,而发生还原反应
答案:BD
点拨:外加电流的金属保护法依据的是电解池的原理,被保护的金属与电源的负极相连,作阴极,发生还原反应。
10.我国某大城市今年夏季多次降下酸雨。据环保部门测定,该城市整个夏季酸雨的pH平均为3.2。在这种环境中的铁制品极易被腐蚀。对此条件下铁的腐蚀的叙述不正确的是( )
A.此腐蚀过程有化学腐蚀也有电化学腐蚀
B.发生电化学腐蚀时的正极反应为2H2O+O2+4e-===4OH-
C.在化学腐蚀过程中有氢气产生
D.发生电化学腐蚀时的负极反应为Fe-2e-===Fe2+
答案:B
点拨:酸性条件下发生析氢腐蚀,正极反应为2H++2e-===H2↑,负极反应为Fe-2e-===Fe2+。
11.根据下列事实:
(1)X+Y2+===X2++Y;
(2)Z+2H2O===Z(OH)2+H2↑;
(3)Z2+氧化性比X2+弱;
(4)由Y、W电极组成的原电池,电极反应为:W2++2e-===W,Y-2e-===Y2+。可知X、Y、Z、W的还原性由强到弱的顺序是( )
A.X>Z>Y>W B.Z>W>X>Y
C.Z>X>Y>W D.Z>Y>X>W
答案:C
点拨:依据氧化还原反应规律,还原性:还原剂>还原产物。还原性:由题中(1)可知X>Y,由(3)可知Z>X,由(4)可知Y>W,故C项正确。
12.(2012·试题调研)用惰性电极电解下列溶液,一段时间后,停止电解,向溶液中加入一定质量的另一种物质(括号内),能使溶液完全复原的是( )
A. CuCl2 (CuO) B.NaOH (NaOH)
C.CuSO4 (CuCO3) D.NaCl (NaOH)
答案:C
点拨:
选项
产物物质的量比
复原加入物质
A
Cu:Cl2 =1:1
CuCl2固体
B
H2:O2=2:1
H2O
C
Cu:O2 =2:1
CuO或CuCO3
D
Cl2:H2 =1:1
HCl气体
13.如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色无味的气体放出,符合这一情况的是( )
a极板
b极板
X电极
Z
A
锌
石墨
负极
CuSO4
B
石墨
石墨
负极
NaOH
C
银
铁
正极
AgNO3
D
铜
石墨
负极
CuCl2
答案:A
点拨:该装置为电解装置,a极板质量增加,说明a为阴极,X为负极,Y为正极,b为阳极。A项,a极板2Cu2++4e-===2Cu,阳极:4OH--4e-===2H2O+O2↑,符合题意。B项,a极板生成H2,质量不增加,不合题意。C项,X为正极,不合题意。D项,b极:2Cl--2e-===Cl2↑,Cl2为黄绿色气体,不合题意。
14.下图有关电化学的示意图正确的是( )
答案:D
点拨:A项,Zn作负极、Cu作正极,错误;B项,Zn、Cu两极应互换;C项,粗铜应作阳极,精铜作阴极。
15.(2012·试题调研)在铁制品上镀上一定厚度的铜层,以下电镀方案中正确的是( )
A.铜作阳极,铁制品作阴极,溶液中含Fe2+
B.铜作阴极,铁制品作阳极,溶液中含Cu2+
C.铜作阴极,铁制品作阳极,溶液中含Fe3+
D.铜作阳极,铁制品作阴极,溶液中含Cu2+
答案:D
点拨:在铁上镀铜,则要求铜在阳极,铁在阴极,电解质溶液含Cu2+,D项符合题意。
16.如下图所示,装置中都盛有0.1mol/L的NaCl溶液,放置一段时间后,装置中的四块相同的锌片腐蚀速率由快到慢的正确顺序是( )
A.①②③④ B.①②④③
C.③①④② D.②①④③
答案:D
点拨:腐蚀速率:作电解池阳极引起的腐蚀>作原电池负极引起的腐蚀>化学腐蚀>有防护措施的腐蚀,可知答案为D。
17.(2012·试题调研)用阳极X和阴极Y电解Z的水溶液,电解一段时间后,再加入W,能使溶液恢复到电解前的状态,下表中符合题意的一组是( )
X
Y
Z
W
A
C
Fe
NaCl
H2O
B
Pt
Cu
CuSO4
CuSO4溶液
C
C
C
H2SO4
H2O
D
Ag
Fe
AgNO3
AgNO3晶体
答案:C
点拨:A项,电解NaCl溶液生成H2和Cl2,显然加H2O不能恢复到电解前的状态,应通入适量HCl气体;B项,电解CuSO4溶液时n(SO)不变,加CuSO4溶液也不能复原;C项,电解H2SO4实质是电解水,再加适量水,可使H2SO4溶液复原;D项,Ag作阳极、Fe作阴极电解AgNO3溶液,实质是Fe上镀Ag,AgNO3溶液浓度不变,不需加AgNO3晶体。
二、非选择题(本题包括6小题,共49分)
18.(8分)(2012·试题调研)下图为以惰性电极进行电解的装置:
(1)写出A、B、C、D各电极上的电极反应式和反应方程式:
A:_________________________________________________,
B:_________________________________________________,
总反应方程式:______________________________________;
C:_________________________________________________,
D:________________________________________________,
总反应方程式:______________________________________;
(2)在A、B、C、D各电极上析出生成物的物质的量之比为_______________________________________________________。
答案:(1)Cu2++2e-===Cu 2Cl--2e-===Cl2↑
CuCl2Cu+Cl2↑ 2Ag++2e-===2Ag
4OH--4e-===2H2O+O2↑
4AgNO3+2H2O4Ag+4HNO3+O2↑
(2)2:2:4:1
点拨:该题装置在串联的条件下进行电解。A、B、C、D分别发生如下反应:Cu2++2e-===Cu;2Cl--2e-===Cl2↑;2Ag++2e-===2Ag;4OH--4e-===2H2O+O2↑;由电子守恒可知在四个电极依次析出物质的物质的量之比为n(Cu):n(Cl)2:n(Ag):n(O2)=2:2:4:1。
19.(8分)(2012·试题调研)在由铜片、锌片和200mL一定浓度的稀硫酸组成的原电池中,若锌片只发生电化学腐蚀,当在铜片上放出3. 36 L(标准状况)的H2时,硫酸恰好用完,请填空:
①正极的电极反应式为_______________________________;
负极的电极反应式为_________________________________;
②通过导线的电子的物质的量为_______________________;
③原稀硫酸的物质的量浓度为_________________________。
答案:①2H++2e-===H2↑ Zn-2e-===Zn2+
②0.3mol ③0.75mol/L
点拨:由铜片、锌片和稀硫酸组成的原电池中,锌作负极,电极反应式为Zn-2e-===Zn2+,铜为正极,电极反应式为2H++2e-===H2↑,由正极电极反应式可知,生成3. 36L氢气,通过导线的电子的物质的量为0.3mol,消耗氢离子的物质的量为0.3mol,硫酸的物质的量为0.15mol,则稀硫酸的物质的量浓度为0.75mol/L。
20.(8分)请按要求回答下列问题。
(1)根据下图回答①②:
①打开K2,合并K1。
A电极可观察到的现象是______________________________;
B极的电极反应式为__________________________________。
②打开K1,合并K2。
A电极可观察到的现象是_____________________________;
B极的电极反应为____________________________________。
(2)根据右图回答③④:
③将较纯净的CuSO4溶液放入如图2所示的装置中进行电解,石墨电极上的电极反应式为____________________________________
_________________________________________________________,
电解反应的离子方程式为________________________________
________________________________________________________________________________________________________________;
④实验完成后,铜电极增重ag,石墨电极产生标准状况下的气体体积________L。
答案:(1)①锌不断溶解 Cu2++2e-===Cu
②电极表面有红色固体附着 Cu-2e-===Cu2+
(2)③4OH--4e-===2H2O+O2↑
2Cu2++2H2O2Cu+O2↑+4H+
④
点拨:(1)①此时为原电池,锌为负极,不断溶解,B极为正极,反应为Cu2++2e-===Cu。②此时为电解池,A极为阴极,反应为Cu2++2e-===Cu,故A极上镀上一层红色的铜,B极为阳极,反应为Cu-2e-===Cu2+。
(2)此时为惰性电极电解CuSO4溶液,石墨极上反应为4OH--4e-===2H2O+O2↑,总反应的离子方程式为2Cu2++2H2O2Cu+O2↑+4H+,V(O2)=××22.4 L= L。
21.(8分)(2012·试题调研)如下图所示的装置,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞溶液,在F极附近显红色。试完成以下问题:
(1)电源A极的名称是________。
(2)甲装置中电解反应的总化学方程式是___________________
____________________________________________________________________________________________________________________。
(3)如果收集乙装置中产生的气体,两种气体的体积比是________。
(4)欲用丙装置给铜镀银,G应该是________(填“铜”或“银”),电镀液的主要成分是________(填化学式)。
答案:(1)正极
(2)2CuSO4+2H2O2Cu+O2↑+2H2SO4
(3)1:1
(4)银 AgNO3
点拨:向乙中滴入酚酞溶液,在F极附近显红色,说明F为阴极,E为阳极,所以B为电源的负极,A为电源的正极。甲是电解CuSO4溶液,总方程式:2CuSO4+2H2O2Cu+O2↑+2H2SO4。乙装置中生成的两种气体体积比为V(Cl2):V(H2) =1:1。丙是电镀池,所以给铜镀银阳极G应为Ag,阴极H为Cu,电镀液为AgNO3溶液。
22.(8分)(2012·经典习题选萃)请从图中选用必要的装置进行电解饱和食盐水的实验,要求测定产生的氢气的体积(大于25mL),并检验氯气的氧化性。
(1)A极发生的电极反应式是_____________________________;
B极发生的电极反应式是_______________________________;
电解饱和食盐水的化学方程式是__________________________
_________________________________________________________________________________________________________________。
(2)电源的M端应连接的电极为________(A或B)极。
(3)设计上述气体实验装置时,各接口的正确连接顺序为:
________接________、________接A,B接________、________接________。
(4)实验中,在盛有KI淀粉溶液的容器中发生反应的离子方程式为_______________________________________________________。
(5)已知饱和食盐水50mL,某时刻测得H2体积为56mL(标准状况)。此时溶液pH约为________。
答案:(1)2H++2e-===H2↑
2Cl--2e-===Cl2↑
2NaCl+2H2O2NaOH+H2↑+Cl2↑
(2)B (3)H F G D E C
(4)Cl2+2I-===2Cl-+I2 (5)13
点拨:(1)因Fe为活泼电极,电解饱和食盐水时,要作阴极发生还原反应,B为惰性电极作阳极,发生氧化反应。
(2)电源负极接电解池的铁棒,碳棒作阳极接电源正极。
(3)电解池左边A导管口产生H2,右边B导管口产生Cl2,以电解池为中心,则有:H←F、G←A、B→D、E→C相应装置的作用:
(4)Cl2氧化I-,即Cl2+2I-===2Cl-+I2。
(5) 2NaOH ~ H2
2mol 22.4 L
5×10-3mol 56×10-3 L
c(OH-)==0.1mol·L-1
pOH=-lg0.1=1
pH=14-pOH=14-1=13。
23.(9分)(2012·辽宁五校协作体期末联考)某课外活动小组同学用如右图装置进行实验,试回答下列问题:
(1)若开始时开关K与a连接,则B极的电极反应式为_________
___________________________________________________。
(2)若开始时开关K与b连接,则B极的电极反应式为__________
___________________________________________________。
总反应的离子方程式为__________________________。
有关上述实验,下列说法正确的是(填序号)____。
①溶液中Na+向A极移动
②从A极处逸出的气体能使湿润KI淀粉试纸变蓝
③反应一段时间后加适量盐酸可恢复到电解前电解质的浓度
④若标准状况下B极产生22.4 L气体,则溶液中转移0.2mol电子
(3)该小组同学模拟工业上用离子交换膜法制烧碱的方法,那么可以设想用如图装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为_____________________________
___________________________________________________________________________________________________________________。
此时通过阴离子交换膜的离子数________(填“大于”、“小于”或“等于”)通过阳离子交换膜的离子数②通电开始后,阴极附近溶液pH会增大,请简述原因:______________________________。
③若将制得的氢气、氧气和氢氧化钠溶液组合为氢氧燃料电池,则电池负极的电极反应式为___________________________________
________________________________________________________________________________________________________。
答案:(1)Fe-2e-===Fe2+ (2)2H++2e-===H2↑
2Cl-+2H2O2OH-+H2↑+Cl2↑ ②
(3)①4OH--4e-===2H2O+O2↑ 小于
②H+放电促进水的电离,使OH-浓度增大
③O2+2H2O+4e-===4OH-
点拨:(1)为原电池,铁被氧化腐蚀,即电极反应式为Fe-2e-===Fe2+。(2)为电解池,阳极A发生2Cl--2e-===Cl2↑、阴极B发生2H++2e-===H2↑;阳离子向阴极移动,①错误;③应该通入HCl,不能加盐酸,因为盐酸是HCl的水溶液,错误;④电子不能在溶液中移动,错误。(3)依据电荷守恒通过阳离子交换膜的K+是通过阴离子交换膜的SO的2倍。
