第3章第5节有机合成课件2021-2022学年高二化学人教版(2019)选择性必修3(61张ppt)
文档属性
| 名称 | 第3章第5节有机合成课件2021-2022学年高二化学人教版(2019)选择性必修3(61张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 11.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-18 16:23:13 | ||
图片预览










文档简介
(共61张PPT)
第五节 有机合成
第三章
烃的衍生物
第五节 有机合成
学习任务
有机合成的主要任务
有机合成路线的设计与实施
1. 结合碳骨架的构建及官能团衍变过程中的反应规律,掌握有机化合物分子骨架的构建,官能团引入、转化或消除的方法。能利用反应规律进行有机物的推断与合成。
2.落实有机物分子结构分析的思路和方法,建立对有机反应多角度认识模型、并利用模型进一步掌握有机合成的思路和方法。
3.体会有机合成在发展经济、提高生活质量方面的贡献及对健康、环境造成的影响,能用“绿色化学”的理念指导合成路线的选择。
2021年10月16日,航天员翟志刚、王亚平、叶光富在酒泉卫星发射中心搭乘神舟十三号载人飞船进入天和核心舱,成为入住中国空间站的第二批航天员。180余天的太空飞行中,3名航天员圆满完成了各项任务。1个小时前,航天员乘组安全返回地面。
2021据有关资料报道,宇航员的服装能使太空的人处于加压状态,供给宇航没问生命所需的氧气,控制温度和湿度,防止辐射,还要经得起微流星的冲击。
宇航服中已经应用了一百三十多种新型材料,其中多数是有机合成材料。
密闭头盔由透明聚碳酸酯组成,密闭服由耐高温的防火聚酰胺纤维织物等特殊材料组成。宇航服面罩是由碳材料制成的金刚石膜。
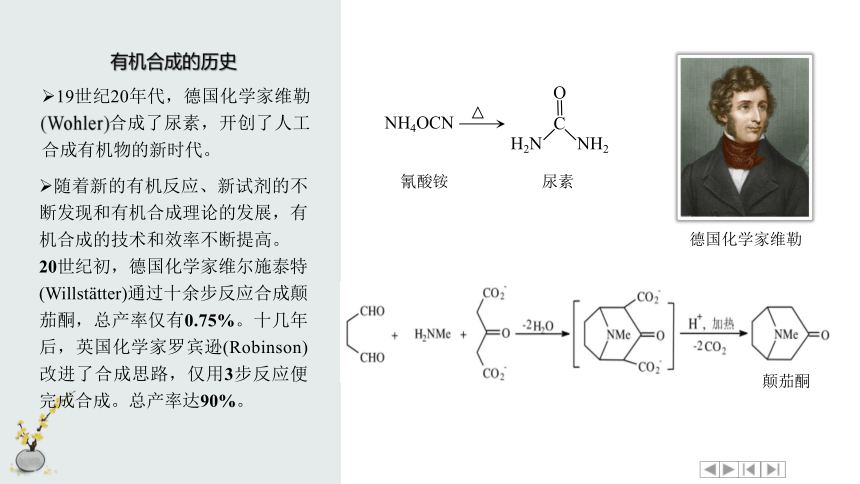
有机合成的历史
19世纪20年代,德国化学家维勒(Wohler)合成了尿素,开创了人工合成有机物的新时代。
NH4OCN
H2N
NH2
C
O
氰酸铵
尿素
德国化学家维勒
随着新的有机反应、新试剂的不断发现和有机合成理论的发展,有机合成的技术和效率不断提高。
20世纪初,德国化学家维尔施泰特
(Willst tter)通过十余步反应合成颠茄酮,总产率仅有0.75%。十几年后,英国化学家罗宾逊(Robinson)改进了合成思路,仅用3步反应便完成合成。总产率达90%。
颠茄酮
有机合成的历史
20世纪中后期,伍德沃德与多位化学家合作,成功合成了奎宁、胆固醇、叶绿素、红霉素、维生素B12等一系列结构复杂的天然产物,促进了有机合成技术和有机反应理论的发展。
1967年,科里提出了系统化的逆合成概念,开始利用计算机辅助设计合成路线,让合成路线的设计逐步成为有严密思维逻辑的科学过程。科里的逆合成分析是现代有机合成化学的重要基石,使有机合成进入了新的发展阶段。
维生素B12
美国化学家伍德沃德
有机合成的贡献
有机合成的发展,使人们不仅能通过人工手段合成原本只能从生物体内分离、提取的天然产物,还可以根据实际需要设计合成具有特定结构和性能的新物质,为化学、生物、医药、材料等领域的研究和相关工业生产提供了坚实的物质基础,有力地促进了人类健康水平提高和社会发展进步。
一座年产万吨的合成纤维厂相当于30万亩棉田或250万头绵羊的棉毛产量。
合成纤维
一座年产8万吨的合成橡胶厂相当于145万亩橡胶园的年产量。
合成橡胶
1965年中国科学家首次用人工方法合成了结晶牛胰岛素
一、有机合成的主要任务
1. 构建碳骨架
有机合成的主要任务:使用相对简单易得的原料,通过有机化学反应来构建碳骨架和引入官能团,由此合成出具有特定结构和性质的目标分子。
碳骨架是有机化合物分子的结构基础,进行有机合成时需要考虑碳骨架的形成,包括碳链的增长和缩短、成环等过程。
1. 构建碳骨架
当原料分子中的碳原子数少于目标分子中的碳原子数时,可以通过引入含碳原子的官能团等方式使碳链增长。
炔烃和醛中的不饱和键与HCN发生加成反应生成含有氰基(—CN)的物质,再经水解生成羧酸,或经催化加氢还原生成胺。如:
(1)碳链的增长
乙炔与HCN加成后再水解:
CH≡CH
丙烯腈
丙烯酸
CH2==CHCN
CH2==CHCOOH
1. 构建碳骨架
(1)碳链的增长
这样,在将羧基、氨基等引入碳链的同时,产物较原料分子增加了一个碳原子。
醛与HCN反应,再还原:
酮与氢氰酸的加成反应:
2-甲基-2-羟基丙腈
2-甲基-2-羟基丙酸
1. 构建碳骨架
(1)碳链的增长
卤代烃与NaCN取代反应
CH3CH2Br + NaCN CH3CH2CN + NaBr
水
羟醛缩合反应: 醛分子中在醛基邻位碳原子上的氢原子(α-H)受羰基吸电子作用的影响,具有一定的活泼性。分子内含有α-H的醛在一定条件下可发生加成反应,生成β-羟基醛,该产物易失水,得到α,β-不饱和醛。这类反应被称为羟醛缩合反应,是一种常用的增长碳链的方法。
CH3—C—H
O
+ CH3CHO
催化剂
CH3—C—CH2CHO
OH
H
催化剂
CH3—CH==CHCHO+H2O
β
α
α
α
β
1. 构建碳骨架
(2)碳链的缩短
氧化反应
+ HOOC—R
烯烃:
芳香烃:
炔烃:
RCOOH
RC≡CH
烷烃的裂化(裂解)反应
1. 构建碳骨架
(3)碳链的成环
共轭二烯烃(含有两个碳碳双键,且两个双键被一个单键隔开的烯烃,如1,3 丁二烯)与含碳碳双键的化合物在一定条件下发生第尔斯 阿尔德反应(Diels Alder reaction),得到环加成产物,构建了环状碳骨架。
+
形成环醚
HOCH2CH2OH +H2O
O
1. 构建碳骨架
(3)碳链的成环
形成环酯
2. 引入官能团
有选择地通过取代、加成、消去、氧化、还原等有机化学反应,可以实现有机化合物类别的转化,并引入目标官能团。
醇的消去反应: CH3CH2OH CH2==CH2↑+H2O
2. 引入官能团
卤代烃的消去反应: CH3—CH2—Br+NaOH CH2==CH2↑+NaBr+H2O
(1)碳碳双键的引入方法
炔烃与H2、HX、X2的不完全加成(限制物质的量)可得碳碳双键。
CH≡CH+HCl CH2==CHCl
催化剂
2. 引入官能团
烃与卤素单质的取代反应
(2)碳卤键的引入方法
2. 引入官能团
不饱和烃与卤素单质、卤化氢等的加成反应
醇与氢卤酸的取代反应
(2)碳卤键的引入方法
2. 引入官能团
(3)羟基的引入方法
醇羟基
2. 引入官能团
(3)羟基的引入方法
酚羟基
2. 引入官能团
(4)醛基和酮羰基的引入方法
醇的催化氧化
催化剂
△
2RCH2OH+O2 2RCHO+2H2O
2RCHR′+O2 2R—C—R′+2H2O
OH
O
催化剂
△
炔烃与水加成反应
CH≡CH+H2O CH3CHO
催化剂
△
乙烯催化氧化反应
2CH2==CH2+O2 2CH3CHO
催化剂
△
2. 引入官能团
(5)羧基的引入方法
醛的氧化
酯在酸性条件下水解
2. 引入官能团
(5)羧基的引入方法
含侧链的芳香烃被强氧化剂氧化
某些烯烃被强氧化剂氧化
R—CH==CH2 RCOOH+CO2↑
(6)酯基的引入方法
CH3COOH+HOCH2CH3 CH3COOCH2CH3+H2O
3. 官能团的保护
含多个官能团的有机化合物在进行反应时,非目标官能团也可能受到影响,此时先将其转化为不受该反应影响的其他官能团,反应后再转化复原。
【思考】下列两个有机合成设计流程有何特点?
其设计的目的是什么?
流程1
流程2
保护羰基不被反应
保护酚羟基不被氧化
3. 官能团的保护
(1)醇羟基的保护方法: 可先将羟基转化为醚键,使醇转化为在一般反应条件下比较
稳定的醚。待相关合成反应结束后,再在一定条件下脱除起保护作用的基团(保
护基),恢复羟基。
合成反应影响羟基,无法直接转化
(2)酚羟基的保护方法: 酚羟基易被氧化,在氧化其他基团前可以先使其与NaOH反
应,把–OH转变为–ONa保护起来,待氧化其他基团后再酸化将其转变为 OH。
3. 官能团的保护
(3)碳碳双键的保护方法: 碳碳双键也容易被氧化,在氧化其他基团前可以利用其
与卤素单质、卤化氢等的加成反应将其保护起来,待氧化其他基团后再利用消
去反应将其转变为碳碳双键
(4)胺基的保护方法: 胺基易被O2、O3、H2O2等氧化
二、有机合成路线的设计与实施
有机合成路线设计的原则
有机合成路线的确定,需要在掌握碳骨架构建和官能团转化基本方法的基础上,综合多方面因素进行设计与选择,合理规划方案,以较低的成本和较高的产率,通过简便而对环境友好的操作得到目标产物。
①原料、溶剂和催化剂尽可能价廉易得、低毒;
②合成步骤较少,副反应少,反应产率高;
③反应条件温和,操作简便,产物易于分离提纯;
④要贯彻“绿色化学”理念,选择最佳合成路线,污染排放少,以较低的经济成本和环境代价得到目标产物。
有机合成路线分析方法
方法 内容
正合成 分析法 采用正向思维方法,从已知原料入手,找出合成所需要的直接或间接的中间体,逐步推向待合成有机化合物,其思维程序:
原料→中间体→产品
逆合成 分析法 采用逆向思维方法,从产品的组成、结构、性质入手,找出合成所需要的直接或间接的中间体,逐步推向已知原料,其思维程序:
产品 中间体 原料
综合 比较法 采用综合思维的方法,将正向或逆向推导出的几种合成途径进行比较,从而得到最佳合成路线
表示合成步骤时,用箭头“→”表示每一步反应;而表示逆合成时,用“ ”表示逆推过程。
1. 正合成分析法
从简单、易得的原料出发,比较原料分子和产物分子在碳骨架和官能团等方面的异同,再有目的地选择每一步的转化反应。基础原料通过有机反应形成一段碳链或连上一个官能团,合成第一个中间体;在此基础上,利用中间体的官能团,加上辅助原料,进行第二步反应,合成出第二个中间体……经过多步反应,最后得到具有特定结构和功能的目标化合物。
1. 正合成分析法
(1)人们最初是通过发酵法由粮食制备乙酸,现在食醋仍主要以这种方式生产,工业上大量使用的乙酸是通过石油化学工业人工合成的。请以乙烯为原料,设计合理的路线合成乙酸,分析该合成过程中官能团的变化。
(2)目前已经出现了将乙烯直接氧化生成乙酸的工艺。假定该工艺涉及的反应和(1)中合成路线的每一步反应的产率均为70%,请计算并比较这两种合成路线的总产率。
思考与讨论:
70%
70%
70%
H2O
催化剂/△
CH2=CH2
CH3CH2OH
O2/Cu
△
CH3CHO
CH3COOH
O2
催化剂/△
× × =34.3%
低于直接氧化成乙酸的产率(70%),因此,合成步骤应尽可能少,以提高产率。
2. 逆合成分析法
设计复杂化合物合成路线时常用逆合成分析法。基本思路是:从目标化合物出发,在目标化合物的适当位置断开相应的化学键,目的是使得到的较小片段所对应的中间体经过反应可以得到目标化合物;接下来继续断开中间体适当位置的化学键,使其可以从更上一步的中间体反应得来;依次倒推,最后确定最适宜的基础原料和合成路线。
2. 逆合成分析法
实例:医药和染料工业原料乙二酸二乙酯的合成路线设计。
逆合成分析:
合成路线设计:
H2O
催化剂,△,加压
NaOH/水
△
Cl2
催化剂
△
催化剂
△
2. 逆合成分析法
【思考与讨论】
在实际工业生产中,乙二醇还可以通过环氧乙烷与水直接化合的方法合成,而环氧乙烷则可由乙烯直接氧化得到。请比较该方法与以上合成乙二酸二乙酯中合成乙二醇的两步反应,分析生产中选择该路线的可能原因。
①从原料成本的角度考虑,使用O2和H2O,比使用C12和NaOH成本更低;
②从原子利用率的角度考虑,环氧乙烷法没有副产物,原子利用率高;
③从环境保护的角度考虑,C12有毒,NaOH有腐蚀性,对环境不够友好。
资料卡片
实验室中进行有机合成的常用装置如图3-31所示,它能够在加热时进行搅拌、温度监测、加料和冷凝回流等实验操作。
规模化的工业生产中多使用体积较大的反应釜(如图3-32)。工业生产须在实验室研究的基础上进行小试、中试等规模放大研究,完善实验室研究所
确定的反应条件,
更多考虑工业化
生产的设备选择、
操作方法、成本
控制和环境保护
等因素,为正式
生产提供依据。
重、难点分析与训练
一、有机合成中官能团的引入、转化和消除
1.常见官能团的引入
官能团 引入方法
碳碳双键 卤代烃的消去;醇的消去;炔烃的不完全加成。
碳卤键 醇、酚的取代;烯烃、炔烃的加成;烷烃、苯及苯的同系物的取代。
羟基 烯烃与水的加成;卤代烃的水解;醛的还原;酯的水解。
醛基 醇的催化氧化;烯烃的氧化。
羧基 醇的氧化;醛的氧化;酯的水解。
酯基 酯化反应。
一、有机合成中官能团的引入、转化和消除
2.官能团的转化
(1)官能团种类变化
利用官能团的衍生关系进行衍变,如:
一、有机合成中官能团的引入、转化和消除
2.官能团的转化
(2)官能团数目变化
通过不同的反应途径增加官能团的个数
一、有机合成中官能团的引入、转化和消除
2.官能团的转化
(3)官能团位置变化
通过不同的反应,改变官能团的位置
一、有机合成中官能团的引入、转化和消除
3.官能团的消除
(1)经加成反应消除不饱和键。
(2)经取代、消去、酯化、氧化等反应消除—OH。
(3)经加成或氧化反应消除—CHO。
(4)经水解反应消除酯基。
(5)通过消去或水解反应可消除碳卤键。
典例 1
一、有机合成中官能团的引入、转化和消除
在有机合成中,常需要将官能团消除或增加,下列变化过程中的反应类型及相关产物不合理的是
A.①② B.②③ C.③④ D.①④
√
二、有机合成路线的设计
利用逆合成分析法设计有机合成路线的分析思路
观察目标
分子结构
目标分子的碳骨架特征,以及官能团的种类和位置
逆推中间产物
设计合成路线
目标分子碳骨架的构建,以及官能团的引入或转化
优选合成路线
以绿色合成思想为指导
二、有机合成路线的设计
中学常见的合成路线
(1)脂肪烃为基础原料到酯的合成路线
二、有机合成路线的设计
中学常见的合成路线
(2)芳香族化合物合成路线
典例 2
二、有机合成路线的设计
以氯乙烷为原料制取乙二酸(HOOC—COOH)的过程中,要依次经过下列步骤中的
①与NaOH的水溶液共热 ②与NaOH的醇溶液共热 ③与浓硫酸共热到170 ℃ ④在催化剂存在的情况下与氯气反应 ⑤在Cu或Ag存在的情况下与氧气共热
⑥与新制的Cu(OH)2共热
A.①③④②⑥ B.①③④②⑤
C.②④①⑤⑥ D.②④①⑥⑤
√
知识网络
学习评价
1.下列反应可以使碳链增长的是
A.CH3CH2CH2CH2Br和NaCN共热
B.CH3CH2CH2CH2Br和NaOH的乙醇溶液共热
C.CH3CH2CH2CH2Br和NaOH的水溶液共热
D.CH3CH2CH2CH2Br(g)和Br2(g)光照
√
学习评价
2.已知卤代烃在一定条件下既可发生水解反应,又可发生消去反应,现以2-溴丙烷为主要原料制取1,2-丙二醇时,需要经过的反应是
A.消去—加成—取代 B.加成—消去—取代
C.取代—消去—加成 D.取代—加成—消去
√
学习评价
3.由石油裂解产物乙烯制取HOCH2COOH,需要经历的反应类型有
A.氧化——氧化——取代——水解
B.加成——水解——氧化——氧化
C.氧化——取代——氧化——水解
D.水解——氧化——氧化——取代
√
学习评价
4.官能团的引入和转化是有机合成中的关键和主要内容。下面是某同学设计的引入羧基的几种方案,请判断其中无法实现的是
A.卤代烃的水解
B.腈(RCN)在酸性条件下水解
C.醛的氧化
D.烯烃的氧化
√
学习评价
A. B.CH≡CH
C. D.
5.下列物质发生反应不能一步引入醛基的是(已知:当两个羟基连接同一个碳原子时,易脱去一分子水)
√
学习评价
下列说法错误的是
A.③发生氧化反应,⑥发生消去反应
B.M的结构简式为CH3CH2X
C.P的分子式为C4H10O
D.2-丁烯与Br2以1∶1加成可得三种不同产物
6.已知: +R—MgX―→
由乙醇合成CH3CH==CHCH3(2-丁烯)的流程如下:
√
学习评价
A.化合物A中一定含有的官能团是醛基、羧基和碳碳双键
B.由A生成E发生还原反应
C.F的结构简式可表示为
D.由B生成D发生加成反应
7.某物质的转化关系如图所示,下列有关说法不正确的是
√
学习评价
下列说法不正确的是
A.A是苯酚的一种同系物,且溶解度小于苯酚
B.经反应A→B和C→D的目的是保护官能团酚羟基不被氧化
C.与B属于同类有机物的同分异构体有3种(不包含B)
D.1 mol D可以消耗1 mol NaHCO3
8.E是一种食品添加剂中的防腐剂,可经下列反应路线得到(部分反应条件略)。
√
―→
A
B
C
D
E
学习评价
9.对氨基苯甲酸可用甲苯为原料合成。已知:①苯环上的硝基可被还原为氨基:
+3Fe+6HCl―→ +3FeCl2+2H2O,产物苯胺还原性强,易被氧化;②—CH3为邻、对位取代定位基,而—COOH为间位取代定位基。则由甲苯合成对氨基苯甲酸的步骤合理的是
√
学习评价
10.卤代烃与金属镁在无水乙醚中反应,可得格林试剂R—MgX,它可与醛、酮等羰基化合物加成:
+R—MgX―→
所得产物经水解可以得到醇,这是某些复杂醇的合成方法之一。现欲合成
(CH3)3C—OH,下列所选用的卤代烃和羰基化合物的组合正确的是
A.乙醛和氯乙烷 B.甲醛和1-溴丙烷
C.甲醛和2-溴丙烷 D.丙酮和一氯甲烷
√
学习评价
11.烯烃复分解反应的示意图如下:
+
+
下列化合物中,经过烯烃复分解反应可以生成 的是
√
学习评价
A. B.
C. D.
12.分析下列合成路线,可推知B应为下列物质中的
A―→B―→C―→
CH2==CH—CH==CH2
√
感谢聆听
第五节 有机合成
第三章
烃的衍生物
第五节 有机合成
学习任务
有机合成的主要任务
有机合成路线的设计与实施
1. 结合碳骨架的构建及官能团衍变过程中的反应规律,掌握有机化合物分子骨架的构建,官能团引入、转化或消除的方法。能利用反应规律进行有机物的推断与合成。
2.落实有机物分子结构分析的思路和方法,建立对有机反应多角度认识模型、并利用模型进一步掌握有机合成的思路和方法。
3.体会有机合成在发展经济、提高生活质量方面的贡献及对健康、环境造成的影响,能用“绿色化学”的理念指导合成路线的选择。
2021年10月16日,航天员翟志刚、王亚平、叶光富在酒泉卫星发射中心搭乘神舟十三号载人飞船进入天和核心舱,成为入住中国空间站的第二批航天员。180余天的太空飞行中,3名航天员圆满完成了各项任务。1个小时前,航天员乘组安全返回地面。
2021据有关资料报道,宇航员的服装能使太空的人处于加压状态,供给宇航没问生命所需的氧气,控制温度和湿度,防止辐射,还要经得起微流星的冲击。
宇航服中已经应用了一百三十多种新型材料,其中多数是有机合成材料。
密闭头盔由透明聚碳酸酯组成,密闭服由耐高温的防火聚酰胺纤维织物等特殊材料组成。宇航服面罩是由碳材料制成的金刚石膜。
有机合成的历史
19世纪20年代,德国化学家维勒(Wohler)合成了尿素,开创了人工合成有机物的新时代。
NH4OCN
H2N
NH2
C
O
氰酸铵
尿素
德国化学家维勒
随着新的有机反应、新试剂的不断发现和有机合成理论的发展,有机合成的技术和效率不断提高。
20世纪初,德国化学家维尔施泰特
(Willst tter)通过十余步反应合成颠茄酮,总产率仅有0.75%。十几年后,英国化学家罗宾逊(Robinson)改进了合成思路,仅用3步反应便完成合成。总产率达90%。
颠茄酮
有机合成的历史
20世纪中后期,伍德沃德与多位化学家合作,成功合成了奎宁、胆固醇、叶绿素、红霉素、维生素B12等一系列结构复杂的天然产物,促进了有机合成技术和有机反应理论的发展。
1967年,科里提出了系统化的逆合成概念,开始利用计算机辅助设计合成路线,让合成路线的设计逐步成为有严密思维逻辑的科学过程。科里的逆合成分析是现代有机合成化学的重要基石,使有机合成进入了新的发展阶段。
维生素B12
美国化学家伍德沃德
有机合成的贡献
有机合成的发展,使人们不仅能通过人工手段合成原本只能从生物体内分离、提取的天然产物,还可以根据实际需要设计合成具有特定结构和性能的新物质,为化学、生物、医药、材料等领域的研究和相关工业生产提供了坚实的物质基础,有力地促进了人类健康水平提高和社会发展进步。
一座年产万吨的合成纤维厂相当于30万亩棉田或250万头绵羊的棉毛产量。
合成纤维
一座年产8万吨的合成橡胶厂相当于145万亩橡胶园的年产量。
合成橡胶
1965年中国科学家首次用人工方法合成了结晶牛胰岛素
一、有机合成的主要任务
1. 构建碳骨架
有机合成的主要任务:使用相对简单易得的原料,通过有机化学反应来构建碳骨架和引入官能团,由此合成出具有特定结构和性质的目标分子。
碳骨架是有机化合物分子的结构基础,进行有机合成时需要考虑碳骨架的形成,包括碳链的增长和缩短、成环等过程。
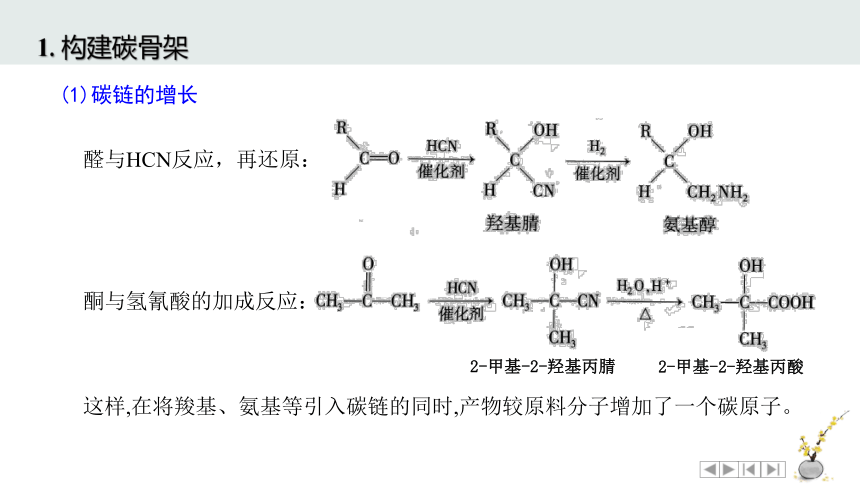
1. 构建碳骨架
当原料分子中的碳原子数少于目标分子中的碳原子数时,可以通过引入含碳原子的官能团等方式使碳链增长。
炔烃和醛中的不饱和键与HCN发生加成反应生成含有氰基(—CN)的物质,再经水解生成羧酸,或经催化加氢还原生成胺。如:
(1)碳链的增长
乙炔与HCN加成后再水解:
CH≡CH
丙烯腈
丙烯酸
CH2==CHCN
CH2==CHCOOH
1. 构建碳骨架
(1)碳链的增长
这样,在将羧基、氨基等引入碳链的同时,产物较原料分子增加了一个碳原子。
醛与HCN反应,再还原:
酮与氢氰酸的加成反应:
2-甲基-2-羟基丙腈
2-甲基-2-羟基丙酸
1. 构建碳骨架
(1)碳链的增长
卤代烃与NaCN取代反应
CH3CH2Br + NaCN CH3CH2CN + NaBr
水
羟醛缩合反应: 醛分子中在醛基邻位碳原子上的氢原子(α-H)受羰基吸电子作用的影响,具有一定的活泼性。分子内含有α-H的醛在一定条件下可发生加成反应,生成β-羟基醛,该产物易失水,得到α,β-不饱和醛。这类反应被称为羟醛缩合反应,是一种常用的增长碳链的方法。
CH3—C—H
O
+ CH3CHO
催化剂
CH3—C—CH2CHO
OH
H
催化剂
CH3—CH==CHCHO+H2O
β
α
α
α
β
1. 构建碳骨架
(2)碳链的缩短
氧化反应
+ HOOC—R
烯烃:
芳香烃:
炔烃:
RCOOH
RC≡CH
烷烃的裂化(裂解)反应
1. 构建碳骨架
(3)碳链的成环
共轭二烯烃(含有两个碳碳双键,且两个双键被一个单键隔开的烯烃,如1,3 丁二烯)与含碳碳双键的化合物在一定条件下发生第尔斯 阿尔德反应(Diels Alder reaction),得到环加成产物,构建了环状碳骨架。
+
形成环醚
HOCH2CH2OH +H2O
O
1. 构建碳骨架
(3)碳链的成环
形成环酯
2. 引入官能团
有选择地通过取代、加成、消去、氧化、还原等有机化学反应,可以实现有机化合物类别的转化,并引入目标官能团。
醇的消去反应: CH3CH2OH CH2==CH2↑+H2O
2. 引入官能团
卤代烃的消去反应: CH3—CH2—Br+NaOH CH2==CH2↑+NaBr+H2O
(1)碳碳双键的引入方法
炔烃与H2、HX、X2的不完全加成(限制物质的量)可得碳碳双键。
CH≡CH+HCl CH2==CHCl
催化剂
2. 引入官能团
烃与卤素单质的取代反应
(2)碳卤键的引入方法
2. 引入官能团
不饱和烃与卤素单质、卤化氢等的加成反应
醇与氢卤酸的取代反应
(2)碳卤键的引入方法
2. 引入官能团
(3)羟基的引入方法
醇羟基
2. 引入官能团
(3)羟基的引入方法
酚羟基
2. 引入官能团
(4)醛基和酮羰基的引入方法
醇的催化氧化
催化剂
△
2RCH2OH+O2 2RCHO+2H2O
2RCHR′+O2 2R—C—R′+2H2O
OH
O
催化剂
△
炔烃与水加成反应
CH≡CH+H2O CH3CHO
催化剂
△
乙烯催化氧化反应
2CH2==CH2+O2 2CH3CHO
催化剂
△
2. 引入官能团
(5)羧基的引入方法
醛的氧化
酯在酸性条件下水解
2. 引入官能团
(5)羧基的引入方法
含侧链的芳香烃被强氧化剂氧化
某些烯烃被强氧化剂氧化
R—CH==CH2 RCOOH+CO2↑
(6)酯基的引入方法
CH3COOH+HOCH2CH3 CH3COOCH2CH3+H2O
3. 官能团的保护
含多个官能团的有机化合物在进行反应时,非目标官能团也可能受到影响,此时先将其转化为不受该反应影响的其他官能团,反应后再转化复原。
【思考】下列两个有机合成设计流程有何特点?
其设计的目的是什么?
流程1
流程2
保护羰基不被反应
保护酚羟基不被氧化
3. 官能团的保护
(1)醇羟基的保护方法: 可先将羟基转化为醚键,使醇转化为在一般反应条件下比较
稳定的醚。待相关合成反应结束后,再在一定条件下脱除起保护作用的基团(保
护基),恢复羟基。
合成反应影响羟基,无法直接转化
(2)酚羟基的保护方法: 酚羟基易被氧化,在氧化其他基团前可以先使其与NaOH反
应,把–OH转变为–ONa保护起来,待氧化其他基团后再酸化将其转变为 OH。
3. 官能团的保护
(3)碳碳双键的保护方法: 碳碳双键也容易被氧化,在氧化其他基团前可以利用其
与卤素单质、卤化氢等的加成反应将其保护起来,待氧化其他基团后再利用消
去反应将其转变为碳碳双键
(4)胺基的保护方法: 胺基易被O2、O3、H2O2等氧化
二、有机合成路线的设计与实施
有机合成路线设计的原则
有机合成路线的确定,需要在掌握碳骨架构建和官能团转化基本方法的基础上,综合多方面因素进行设计与选择,合理规划方案,以较低的成本和较高的产率,通过简便而对环境友好的操作得到目标产物。
①原料、溶剂和催化剂尽可能价廉易得、低毒;
②合成步骤较少,副反应少,反应产率高;
③反应条件温和,操作简便,产物易于分离提纯;
④要贯彻“绿色化学”理念,选择最佳合成路线,污染排放少,以较低的经济成本和环境代价得到目标产物。
有机合成路线分析方法
方法 内容
正合成 分析法 采用正向思维方法,从已知原料入手,找出合成所需要的直接或间接的中间体,逐步推向待合成有机化合物,其思维程序:
原料→中间体→产品
逆合成 分析法 采用逆向思维方法,从产品的组成、结构、性质入手,找出合成所需要的直接或间接的中间体,逐步推向已知原料,其思维程序:
产品 中间体 原料
综合 比较法 采用综合思维的方法,将正向或逆向推导出的几种合成途径进行比较,从而得到最佳合成路线
表示合成步骤时,用箭头“→”表示每一步反应;而表示逆合成时,用“ ”表示逆推过程。
1. 正合成分析法
从简单、易得的原料出发,比较原料分子和产物分子在碳骨架和官能团等方面的异同,再有目的地选择每一步的转化反应。基础原料通过有机反应形成一段碳链或连上一个官能团,合成第一个中间体;在此基础上,利用中间体的官能团,加上辅助原料,进行第二步反应,合成出第二个中间体……经过多步反应,最后得到具有特定结构和功能的目标化合物。
1. 正合成分析法
(1)人们最初是通过发酵法由粮食制备乙酸,现在食醋仍主要以这种方式生产,工业上大量使用的乙酸是通过石油化学工业人工合成的。请以乙烯为原料,设计合理的路线合成乙酸,分析该合成过程中官能团的变化。
(2)目前已经出现了将乙烯直接氧化生成乙酸的工艺。假定该工艺涉及的反应和(1)中合成路线的每一步反应的产率均为70%,请计算并比较这两种合成路线的总产率。
思考与讨论:
70%
70%
70%
H2O
催化剂/△
CH2=CH2
CH3CH2OH
O2/Cu
△
CH3CHO
CH3COOH
O2
催化剂/△
× × =34.3%
低于直接氧化成乙酸的产率(70%),因此,合成步骤应尽可能少,以提高产率。
2. 逆合成分析法
设计复杂化合物合成路线时常用逆合成分析法。基本思路是:从目标化合物出发,在目标化合物的适当位置断开相应的化学键,目的是使得到的较小片段所对应的中间体经过反应可以得到目标化合物;接下来继续断开中间体适当位置的化学键,使其可以从更上一步的中间体反应得来;依次倒推,最后确定最适宜的基础原料和合成路线。
2. 逆合成分析法
实例:医药和染料工业原料乙二酸二乙酯的合成路线设计。
逆合成分析:
合成路线设计:
H2O
催化剂,△,加压
NaOH/水
△
Cl2
催化剂
△
催化剂
△
2. 逆合成分析法
【思考与讨论】
在实际工业生产中,乙二醇还可以通过环氧乙烷与水直接化合的方法合成,而环氧乙烷则可由乙烯直接氧化得到。请比较该方法与以上合成乙二酸二乙酯中合成乙二醇的两步反应,分析生产中选择该路线的可能原因。
①从原料成本的角度考虑,使用O2和H2O,比使用C12和NaOH成本更低;
②从原子利用率的角度考虑,环氧乙烷法没有副产物,原子利用率高;
③从环境保护的角度考虑,C12有毒,NaOH有腐蚀性,对环境不够友好。
资料卡片
实验室中进行有机合成的常用装置如图3-31所示,它能够在加热时进行搅拌、温度监测、加料和冷凝回流等实验操作。
规模化的工业生产中多使用体积较大的反应釜(如图3-32)。工业生产须在实验室研究的基础上进行小试、中试等规模放大研究,完善实验室研究所
确定的反应条件,
更多考虑工业化
生产的设备选择、
操作方法、成本
控制和环境保护
等因素,为正式
生产提供依据。
重、难点分析与训练
一、有机合成中官能团的引入、转化和消除
1.常见官能团的引入
官能团 引入方法
碳碳双键 卤代烃的消去;醇的消去;炔烃的不完全加成。
碳卤键 醇、酚的取代;烯烃、炔烃的加成;烷烃、苯及苯的同系物的取代。
羟基 烯烃与水的加成;卤代烃的水解;醛的还原;酯的水解。
醛基 醇的催化氧化;烯烃的氧化。
羧基 醇的氧化;醛的氧化;酯的水解。
酯基 酯化反应。
一、有机合成中官能团的引入、转化和消除
2.官能团的转化
(1)官能团种类变化
利用官能团的衍生关系进行衍变,如:
一、有机合成中官能团的引入、转化和消除
2.官能团的转化
(2)官能团数目变化
通过不同的反应途径增加官能团的个数
一、有机合成中官能团的引入、转化和消除
2.官能团的转化
(3)官能团位置变化
通过不同的反应,改变官能团的位置
一、有机合成中官能团的引入、转化和消除
3.官能团的消除
(1)经加成反应消除不饱和键。
(2)经取代、消去、酯化、氧化等反应消除—OH。
(3)经加成或氧化反应消除—CHO。
(4)经水解反应消除酯基。
(5)通过消去或水解反应可消除碳卤键。
典例 1
一、有机合成中官能团的引入、转化和消除
在有机合成中,常需要将官能团消除或增加,下列变化过程中的反应类型及相关产物不合理的是
A.①② B.②③ C.③④ D.①④
√
二、有机合成路线的设计
利用逆合成分析法设计有机合成路线的分析思路
观察目标
分子结构
目标分子的碳骨架特征,以及官能团的种类和位置
逆推中间产物
设计合成路线
目标分子碳骨架的构建,以及官能团的引入或转化
优选合成路线
以绿色合成思想为指导
二、有机合成路线的设计
中学常见的合成路线
(1)脂肪烃为基础原料到酯的合成路线
二、有机合成路线的设计
中学常见的合成路线
(2)芳香族化合物合成路线
典例 2
二、有机合成路线的设计
以氯乙烷为原料制取乙二酸(HOOC—COOH)的过程中,要依次经过下列步骤中的
①与NaOH的水溶液共热 ②与NaOH的醇溶液共热 ③与浓硫酸共热到170 ℃ ④在催化剂存在的情况下与氯气反应 ⑤在Cu或Ag存在的情况下与氧气共热
⑥与新制的Cu(OH)2共热
A.①③④②⑥ B.①③④②⑤
C.②④①⑤⑥ D.②④①⑥⑤
√
知识网络
学习评价
1.下列反应可以使碳链增长的是
A.CH3CH2CH2CH2Br和NaCN共热
B.CH3CH2CH2CH2Br和NaOH的乙醇溶液共热
C.CH3CH2CH2CH2Br和NaOH的水溶液共热
D.CH3CH2CH2CH2Br(g)和Br2(g)光照
√
学习评价
2.已知卤代烃在一定条件下既可发生水解反应,又可发生消去反应,现以2-溴丙烷为主要原料制取1,2-丙二醇时,需要经过的反应是
A.消去—加成—取代 B.加成—消去—取代
C.取代—消去—加成 D.取代—加成—消去
√
学习评价
3.由石油裂解产物乙烯制取HOCH2COOH,需要经历的反应类型有
A.氧化——氧化——取代——水解
B.加成——水解——氧化——氧化
C.氧化——取代——氧化——水解
D.水解——氧化——氧化——取代
√
学习评价
4.官能团的引入和转化是有机合成中的关键和主要内容。下面是某同学设计的引入羧基的几种方案,请判断其中无法实现的是
A.卤代烃的水解
B.腈(RCN)在酸性条件下水解
C.醛的氧化
D.烯烃的氧化
√
学习评价
A. B.CH≡CH
C. D.
5.下列物质发生反应不能一步引入醛基的是(已知:当两个羟基连接同一个碳原子时,易脱去一分子水)
√
学习评价
下列说法错误的是
A.③发生氧化反应,⑥发生消去反应
B.M的结构简式为CH3CH2X
C.P的分子式为C4H10O
D.2-丁烯与Br2以1∶1加成可得三种不同产物
6.已知: +R—MgX―→
由乙醇合成CH3CH==CHCH3(2-丁烯)的流程如下:
√
学习评价
A.化合物A中一定含有的官能团是醛基、羧基和碳碳双键
B.由A生成E发生还原反应
C.F的结构简式可表示为
D.由B生成D发生加成反应
7.某物质的转化关系如图所示,下列有关说法不正确的是
√
学习评价
下列说法不正确的是
A.A是苯酚的一种同系物,且溶解度小于苯酚
B.经反应A→B和C→D的目的是保护官能团酚羟基不被氧化
C.与B属于同类有机物的同分异构体有3种(不包含B)
D.1 mol D可以消耗1 mol NaHCO3
8.E是一种食品添加剂中的防腐剂,可经下列反应路线得到(部分反应条件略)。
√
―→
A
B
C
D
E
学习评价
9.对氨基苯甲酸可用甲苯为原料合成。已知:①苯环上的硝基可被还原为氨基:
+3Fe+6HCl―→ +3FeCl2+2H2O,产物苯胺还原性强,易被氧化;②—CH3为邻、对位取代定位基,而—COOH为间位取代定位基。则由甲苯合成对氨基苯甲酸的步骤合理的是
√
学习评价
10.卤代烃与金属镁在无水乙醚中反应,可得格林试剂R—MgX,它可与醛、酮等羰基化合物加成:
+R—MgX―→
所得产物经水解可以得到醇,这是某些复杂醇的合成方法之一。现欲合成
(CH3)3C—OH,下列所选用的卤代烃和羰基化合物的组合正确的是
A.乙醛和氯乙烷 B.甲醛和1-溴丙烷
C.甲醛和2-溴丙烷 D.丙酮和一氯甲烷
√
学习评价
11.烯烃复分解反应的示意图如下:
+
+
下列化合物中,经过烯烃复分解反应可以生成 的是
√
学习评价
A. B.
C. D.
12.分析下列合成路线,可推知B应为下列物质中的
A―→B―→C―→
CH2==CH—CH==CH2
√
感谢聆听
