湖南省衡山县岳云高级中学2021-2022学年高三下学期期中考试化学试卷(Word版含答案)
文档属性
| 名称 | 湖南省衡山县岳云高级中学2021-2022学年高三下学期期中考试化学试卷(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 791.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-20 07:59:39 | ||
图片预览

文档简介
岳云高级中学2021-2022学年高三下学期期中考试
化学试题
(时间:75分钟 满分:100分)
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 K 39 Ni 59
第I卷(共50分)
一、单项选择题:本题共10小题,每小题3分,共30分。在每小题给出的四个选项中,只有一项符合题目要求。
1.下列有关化学及人类社会发展历程的说法中,正确的是
A.“所在山洋,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”过程包括了溶解、蒸发、结晶等操作
B.“千淘万漉虽辛苦,吹尽黄沙始到金”中,淘金原理与化学上的萃取一致
C.门捷列夫将元素按原子序数由小到大的顺序依次排列,制出了第一张元素周期表
D.《茶疏》中对泡茶过程有如下记载:“治壶、投茶、出浴、淋壶、烫杯、酾茶、品茶”文中涉及过滤和蒸馏等化学实验操作方法
2.木犀草素有镇咳化痰的作用,其结构简式如右图。下列说法不正确的是
A.分子中有3种含氧官能团
B.分子中碳原子均为sp2杂化
C.能与NaHCO3溶液反应,产生气泡
D.能与Br2发生取代反应和加成反应
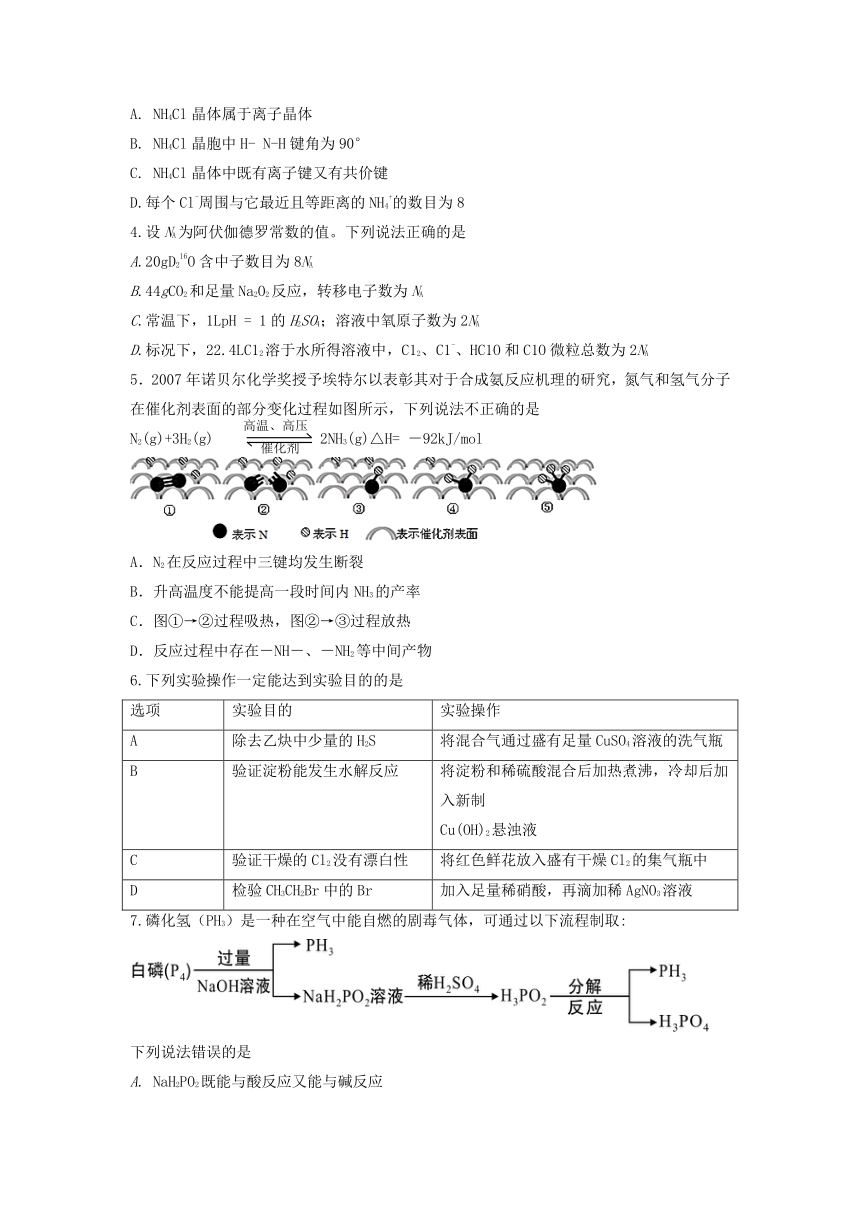
3. NH4Cl的晶胞为立方体,其结构如下。下列说法不正确的是
A. NH4Cl晶体属于离子晶体
B. NH4Cl晶胞中H- N-H键角为90°
C. NH4Cl晶体中既有离子键又有共价键
D.每个Cl-周围与它最近且等距离的NH4+的数目为8
4.设NA为阿伏伽德罗常数的值。下列说法正确的是
A.20gD216O含中子数目为8NA
B.44gCO2和足量Na2O2反应,转移电子数为NA
C.常温下,1LpH = 1的H2SO4;溶液中氧原子数为2NA
D.标况下,22.4LC12溶于水所得溶液中,C12、C1-、HC1O和C1O微粒总数为2NA
(
催化剂
高温、高压
)5.2007年诺贝尔化学奖授予埃特尔以表彰其对于合成氨反应机理的研究,氮气和氢气分子在催化剂表面的部分变化过程如图所示,下列说法不正确的是
N2(g)+3H2(g) 2NH3(g)△H= -92kJ/mol
A.N2在反应过程中三键均发生断裂
B.升高温度不能提高一段时间内NH3的产率
C.图①→②过程吸热,图②→③过程放热
D.反应过程中存在-NH-、-NH2等中间产物
6.下列实验操作一定能达到实验目的的是
选项 实验目的 实验操作
A 除去乙炔中少量的H2S 将混合气通过盛有足量CuSO4溶液的洗气瓶
B 验证淀粉能发生水解反应 将淀粉和稀硫酸混合后加热煮沸,冷却后加入新制 Cu(OH)2悬浊液
C 验证干燥的Cl2没有漂白性 将红色鲜花放入盛有干燥Cl2的集气瓶中
D 检验CH3CH2Br中的Br 加入足量稀硝酸,再滴加稀AgNO3溶液
7.磷化氢(PH3)是一种在空气中能自燃的剧毒气体,可通过以下流程制取:
下列说法错误的是
A. NaH2PO2既能与酸反应又能与碱反应
B.流程中有两处涉及氧化还原反应
C.该过程需要在无氧条件下进行
D.分解反应生成H3PO4和PH3的物质的量之比为1:1
8.某种锂盐的结构如图所示,其阴离子由W、X、Y、Z四种同周期主族元素构成,X原子的最外层电子数是W原子的次外层电子数的3倍,化合物中除Li+外其它原子均满足8电子稳定结构。下列说法正确的是
A.W位于第2周期第IVA族
B.元素电负性:Y > Z > X
C.原子半径:Z > X > Y
D.最高化合价:Y > Z > W
9.实验是化学研究的基础,下列关于各实验装置图(部分夹持装置省略)的叙述错误的是
A.利用装置①可除去粗溴苯(溴苯沸点为156.2℃)中混有的苯(沸点为80.1℃)
B.利用装置②及相关实验现象可推知酸性:
C.利用装置③,由b口进气可收集H2、NH3
D.利用装置④可制备二氧化硫气体
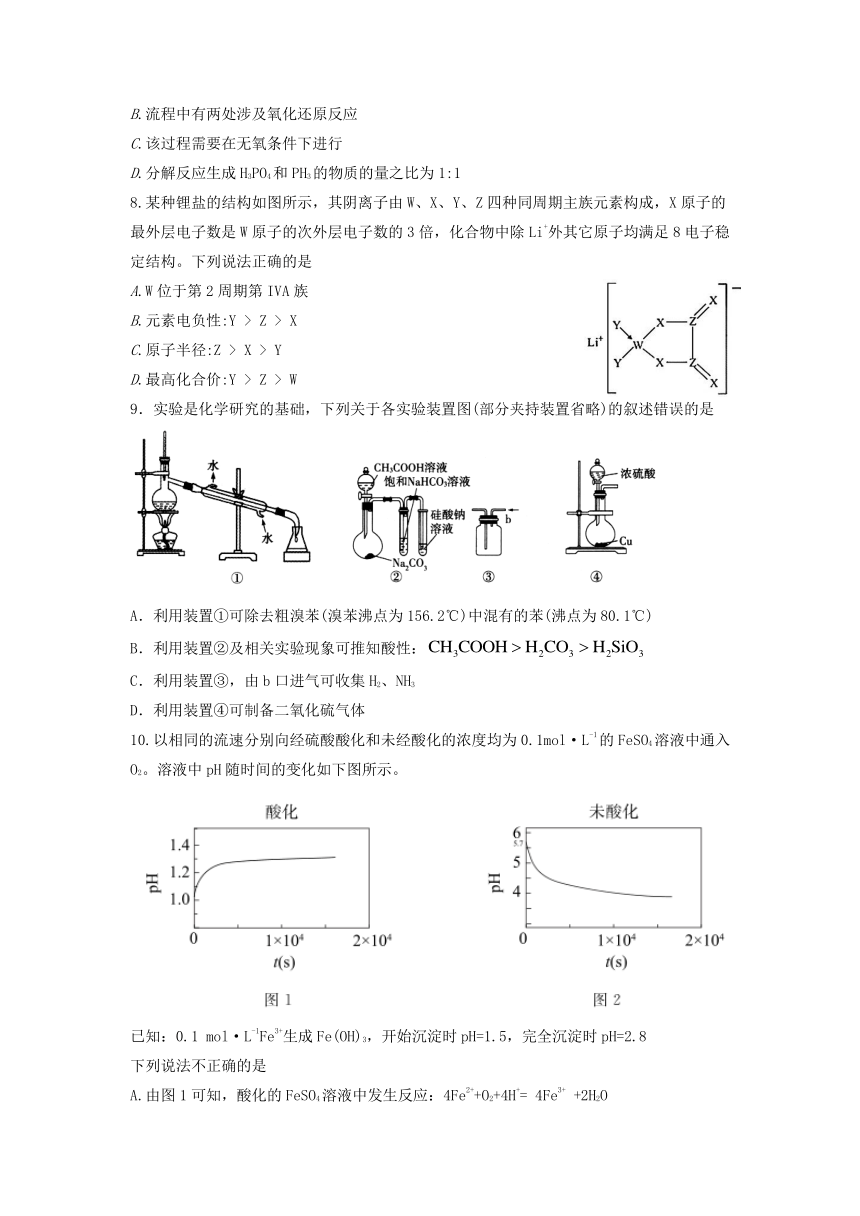
10.以相同的流速分别向经硫酸酸化和未经酸化的浓度均为0.1mol·L-1的FeSO4溶液中通入O2。溶液中pH随时间的变化如下图所示。
已知:0.1 mol·L-1Fe3+生成Fe(OH)3,开始沉淀时pH=1.5,完全沉淀时pH=2.8
下列说法不正确的是
A.由图1可知,酸化的FeSO4溶液中发生反应:4Fe2++O2+4H+= 4Fe3+ +2H2O
B.图2中,t=0时刻,FeSO4溶液pH=5.7是由于Fe2+发生了水解反应
C.由图2可知,未酸化的FeSO4溶液中发生反应生成Fe(OH)3的同时还生成了H+
D.若向FeSO4溶液中先加入过量NaOH溶液再通入O2,pH先增大后明显减小
二、不定项选择题:本题共5小题,每小题4分,共20分。在每小题给出的四个选项中,有一个或两个选项符合题目要求。全部选对的得4分,选对但不全的得2分,有选错的得0分。
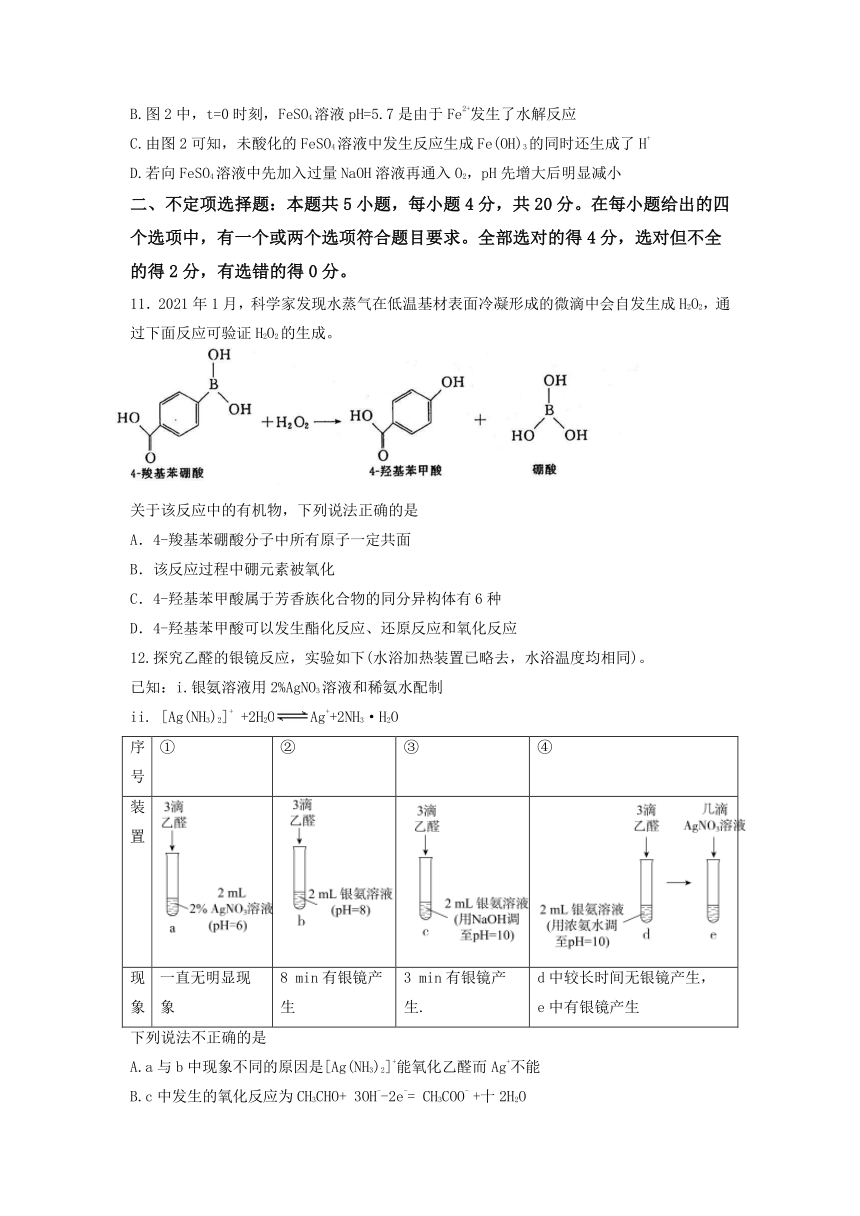
11.2021年1月,科学家发现水蒸气在低温基材表面冷凝形成的微滴中会自发生成H2O2,通过下面反应可验证H2O2的生成。
关于该反应中的有机物,下列说法正确的是
A.4-羧基苯硼酸分子中所有原子一定共面
B.该反应过程中硼元素被氧化
C.4-羟基苯甲酸属于芳香族化合物的同分异构体有6种
D.4-羟基苯甲酸可以发生酯化反应、还原反应和氧化反应
12.探究乙醛的银镜反应,实验如下(水浴加热装置已略去,水浴温度均相同)。
已知:i.银氨溶液用2%AgNO3溶液和稀氨水配制
ii. [Ag(NH3)2]+ +2H2OAg++2NH3·H2O
序号 ① ② ③ ④
装置
现象 一直无明显现象 8 min有银镜产生 3 min有银镜产生. d中较长时间无银镜产生, e中有银镜产生
下列说法不正确的是
A.a与b中现象不同的原因是[Ag(NH3)2]+能氧化乙醛而Ag+不能
B.c中发生的氧化反应为CH3CHO+ 3OH--2e-= CH3COO- +十2H2O
C.其他条件不变时,增大pH能增强乙醛的氧化性
D.由③和④可知,c与d现象不同的原因是c(Ag+)不同
13. CO2资源化利用是实现碳中和的一种有效途径。下图是CO2在电催化下产生合成气(CO和H2)的一种方法。下列说法不正确的是
A.a电极连接电源的负极
B.SO42-从a极区向b极区移动
C. b极区中c(CH3COO- )逐渐增大
D.a极区中c(CO32- )逐渐减小
14.W、X、Y、Z 为原子序数依次增大的四种短周期元素,M、N、R、Q为上述元素组成的化合物。已知有机物M的相对分子质量为28,Z是短周期原子半径最大的元素,N分子中含有10个电子。它们之间的转化关系如下图所示。
下列相关说法错误的是
A.X、Y的氢化物沸点:X一定低于Y
B.Y和Z形成的化合物可能只含有离子键
C.Z与N反应比Z与R反应更剧烈
D.1mol Z2Y2和足量N反应,转移1mol电子
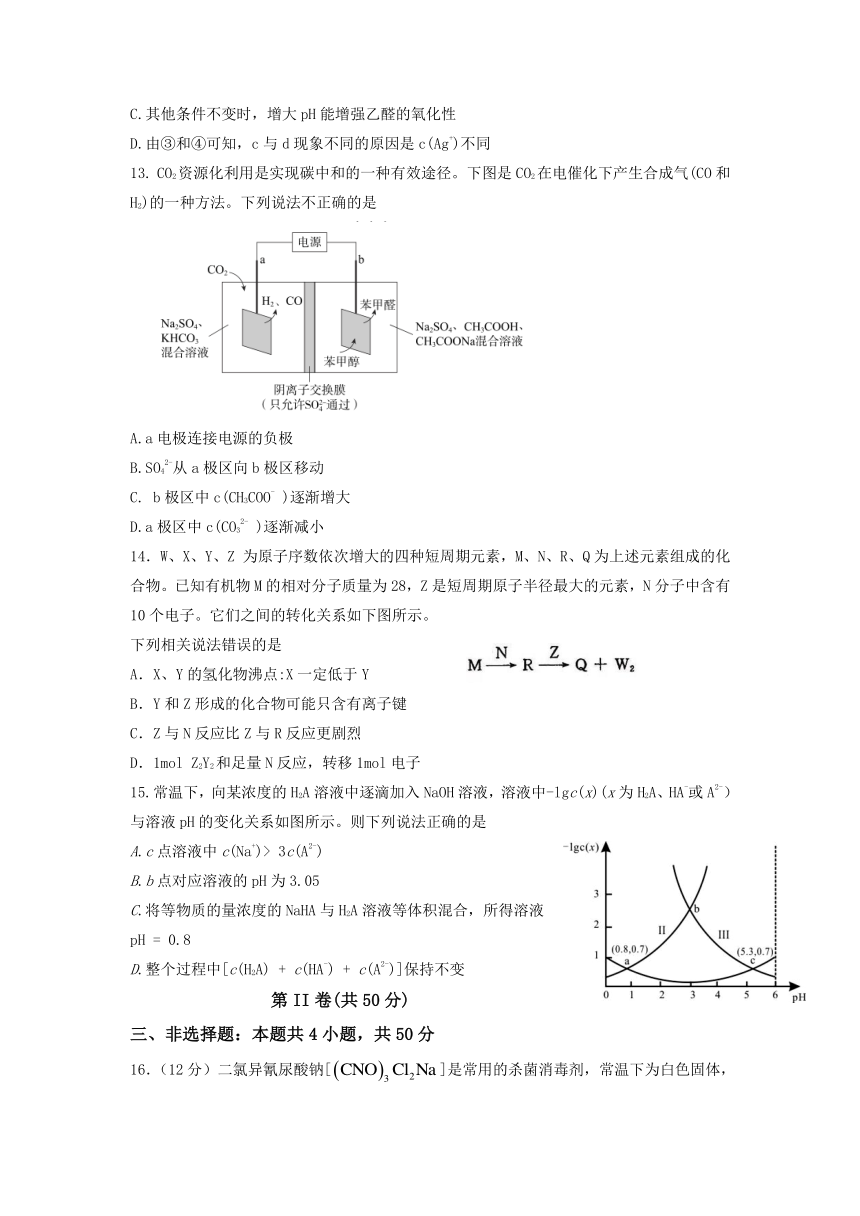
15.常温下,向某浓度的H2A溶液中逐滴加入NaOH溶液,溶液中-lgc(x)(x为H2A、HA-或A2-)与溶液pH的变化关系如图所示。则下列说法正确的是
A.c点溶液中c(Na+)> 3c(A2-)
B.b点对应溶液的pH为3.05
C.将等物质的量浓度的NaHA与H2A溶液等体积混合,所得溶液pH = 0.8
D.整个过程中[c(H2A) + c(HA-) + c(A2-)]保持不变
第II卷(共50分)
三、非选择题:本题共4小题,共50分
16.(12分)二氯异氰尿酸钠[]是常用的杀菌消毒剂,常温下为白色固体,难溶于冷水。利用高浓度的NaClO溶液和异氰尿酸[]固体制备二氯异氰尿酸钠,实验装置如下图所示(部分夹持装置略)。
已知:
①
②
回答下列问题:
(1)装置A中发生反应的离子方程式为。
(2)装置B中盛放的试剂为,若撤去该装置,对C中制备实验产生的影响是。
(3)三颈烧瓶液面上出现黄绿色气体时,由上口加入固体,反应过程中仍需不断通入,原因是。
(4)装置C中冰水浴的目的是。
(5)通过下列实验可测定二氯异氰尿酸钠样品中有效氯的含量(样品中不含NaClO):
反应原理:
实验步骤:准确称取W样品配成100mL溶液,取25.00mL于碘量瓶中,加入适量稀硫酸和过量KI溶液,暗处静置充分反应后,用0.1000标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗溶液V mL。
①滴定终点的现象是。
②该样品中有效氯含量为(用含w、V的代数式表示)。
()。
③若滴定前滴定管尖嘴有气泡,滴定后气泡消失,则有效氯的测定值将(填“偏高”、“偏低”或“无影响”)。
17. (12分)半导体芯片行业是金属靶材的主要应用领域之一、利用镍铂靶材废料(主要成分为Ni、Pt以及微量Fe、Al的单质)采用选择性溶解法回收铂并制备硫酸镍晶体的一种工艺流程如下:
已知:①溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 Ni2+
开始沉淀时(c=0.01mol/L)的pH 7.2 3.7 2.2 7.5
沉淀完全时 ()的pH 8.7 4.7 3.2 9.0
②王水是按浓盐酸和浓硝酸的体积比为3∶1配制而成;
③氧化性
④室温:;
(1)“酸浸”时镍发生反应的化学方程式为_______。
(2)铂在王水中生成二元强酸,其中Pt元素的化合价为_______,该反应的离子方程式为_______。
(3)设“调pH”应控制的pH范围是_______。
(4)当液固比为4∶1时,"酸浸"过程中镍的浸出率与温度和时间的关系如图所示,“酸浸”的最佳温度和时间是_______。
(5)沉铂过程中,的沉淀率随温度的升高而增大,结合平衡移动原理解释沉淀率随温度变化的主要原因_______。
(6)在“沉铂”过程中,若向的溶液里加入等体积的溶液,使沉淀完全,则加入溶液的浓度最小值为_______mol/L(结果保留两位小数,忽略溶液混合后体积的变化)。
(7)“操作1”中包括沉淀的洗涤,应选用下列哪种试剂最佳_______。
A. 蒸馏水 B. 浓盐酸 C. 氯化铵溶液 D. 王水
18.(12分) 作为一种轻质热电材料被广泛应用,为提高该材料的宏观性能(如韧性、弹性等)研究人员尝试在中掺杂稀土元素,其简要流程如下:
(1)基态Si原子核外未成对电子数有_______个,稀土元素镧(La)位于周期表_______区。
(2)流程中三种晶体、、熔点从高到低顺序为_______,其中四种元素电负性从大到小顺序为_______。
(3)上述流程中分子构型或者结构单元为正四面体构型的有_______(填化学式,至少填两种)。
(4)分析工业冶炼单质镁采用电解熔融而不是MgO的原因_______。
(5)晶胞如图,该晶胞棱长为、阿伏加德罗常数为NA,该晶体的密度为_______(列出计算式)
(6)科研人员通过实验数据计算出La掺杂后的多种存在形式的生成焓数据如下表(生成焓是某温度下,标准状态的各种元素的最稳定单质生成标准状态1mol某纯物质的热效应)。结合生成焓数据判断掺杂后的目标物最稳定的是_______(填化学式),目标物中La原子最有可能填充的位置为_______。
目标物 生成焓(kJ/mol)
-19.31
-8.06
-10.56
+3.56
19.(14分)我国科学家发现化合物 J 对消除由蜈蚣叮咬产生的严重临床症状有良好效果。J 的两条合成路线如下图所示。
已知:
回答下列问题:
(1)A 中官能团有:硝基和________。
D→E 的化学方程式是________。F 的结构简式是________。
反应中 的作用________。
B 有多种同分异构体,写出任意一种同时满足下列条件的 M 的结构简式是______。
含有-NO2 的芳香族化合物
能发生水解反应且水解产物之一含有醛基
苯环上一氯代物有两种
G→H 的反应类型是 _________。
I→J 的反应还可能有副产物,请写出其中一种的结构简式________。
苯胺( )和乙二酸(HOOC-COOH)为起始原料,可以制备
。选用必要的试剂完成合成路线_______。
岳云高级中学2021-2022学年高三下学期期中考试
化学参考答案
一、单项选择题:本题共10小题,每小题3分,共30分。在每小题给出的四个选项中,只有一项符合题目要求。
题号 1 2 3 4 5 6 7 8 9 10
答案 A C B B B A A C D D
二、不定项选择题:本题共5小题,每小题4分,共20分。在每小题给出的四个选项中,有一个或两个选项符合题目要求。全部选对的得4分,选对但不全的得2分,有选错的得0分。
题号 11 12 13 14 15
答案 D AC CD A B
三、非选择题:本题共4小题,共50分
16.(12分)(1)
(2)饱和食盐水挥发的氯化氢会和装置C中的NaOH反应,降低产率
(3)使反应生成的NaOH再次生成次氯酸钠,提高原料的利用率
(4)防止温度过高生成
(5)滴入最后半滴溶液时,溶液的浅蓝色褪去且半分钟内颜色不恢复偏高
17.(12分)(1)
(2) ①. +4 ②.
(3)4.7pH<7.2
(4)70℃、120min
(5)存在可逆反应,升高温度有利于HCl挥发,促使平衡正向移动,使沉淀率升高;
(6) (7)C
18.(12分)(1) ①. 2 ②. f
(2) ①. >> ②. O>Cl>Si>Mg
(3)、、Si
(4)MgO的熔点高于
(5)
(6) ①. ②. 体心
19.(14分)(1) 氨基 (2)
(3)保护氨基,防止在消化过程中被氧化
(5)取代反应
(6)合理即可
化学试题
(时间:75分钟 满分:100分)
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂黑。如需改动,用橡皮擦擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上。
3.考试结束后,将本试卷和答题卡一并交回。
可能用到的相对原子质量:H 1 C 12 O 16 Na 23 S 32 K 39 Ni 59
第I卷(共50分)
一、单项选择题:本题共10小题,每小题3分,共30分。在每小题给出的四个选项中,只有一项符合题目要求。
1.下列有关化学及人类社会发展历程的说法中,正确的是
A.“所在山洋,冬月地上有霜,扫取以水淋汁后,乃煎炼而成”过程包括了溶解、蒸发、结晶等操作
B.“千淘万漉虽辛苦,吹尽黄沙始到金”中,淘金原理与化学上的萃取一致
C.门捷列夫将元素按原子序数由小到大的顺序依次排列,制出了第一张元素周期表
D.《茶疏》中对泡茶过程有如下记载:“治壶、投茶、出浴、淋壶、烫杯、酾茶、品茶”文中涉及过滤和蒸馏等化学实验操作方法
2.木犀草素有镇咳化痰的作用,其结构简式如右图。下列说法不正确的是
A.分子中有3种含氧官能团
B.分子中碳原子均为sp2杂化
C.能与NaHCO3溶液反应,产生气泡
D.能与Br2发生取代反应和加成反应
3. NH4Cl的晶胞为立方体,其结构如下。下列说法不正确的是
A. NH4Cl晶体属于离子晶体
B. NH4Cl晶胞中H- N-H键角为90°
C. NH4Cl晶体中既有离子键又有共价键
D.每个Cl-周围与它最近且等距离的NH4+的数目为8
4.设NA为阿伏伽德罗常数的值。下列说法正确的是
A.20gD216O含中子数目为8NA
B.44gCO2和足量Na2O2反应,转移电子数为NA
C.常温下,1LpH = 1的H2SO4;溶液中氧原子数为2NA
D.标况下,22.4LC12溶于水所得溶液中,C12、C1-、HC1O和C1O微粒总数为2NA
(
催化剂
高温、高压
)5.2007年诺贝尔化学奖授予埃特尔以表彰其对于合成氨反应机理的研究,氮气和氢气分子在催化剂表面的部分变化过程如图所示,下列说法不正确的是
N2(g)+3H2(g) 2NH3(g)△H= -92kJ/mol
A.N2在反应过程中三键均发生断裂
B.升高温度不能提高一段时间内NH3的产率
C.图①→②过程吸热,图②→③过程放热
D.反应过程中存在-NH-、-NH2等中间产物
6.下列实验操作一定能达到实验目的的是
选项 实验目的 实验操作
A 除去乙炔中少量的H2S 将混合气通过盛有足量CuSO4溶液的洗气瓶
B 验证淀粉能发生水解反应 将淀粉和稀硫酸混合后加热煮沸,冷却后加入新制 Cu(OH)2悬浊液
C 验证干燥的Cl2没有漂白性 将红色鲜花放入盛有干燥Cl2的集气瓶中
D 检验CH3CH2Br中的Br 加入足量稀硝酸,再滴加稀AgNO3溶液
7.磷化氢(PH3)是一种在空气中能自燃的剧毒气体,可通过以下流程制取:
下列说法错误的是
A. NaH2PO2既能与酸反应又能与碱反应
B.流程中有两处涉及氧化还原反应
C.该过程需要在无氧条件下进行
D.分解反应生成H3PO4和PH3的物质的量之比为1:1
8.某种锂盐的结构如图所示,其阴离子由W、X、Y、Z四种同周期主族元素构成,X原子的最外层电子数是W原子的次外层电子数的3倍,化合物中除Li+外其它原子均满足8电子稳定结构。下列说法正确的是
A.W位于第2周期第IVA族
B.元素电负性:Y > Z > X
C.原子半径:Z > X > Y
D.最高化合价:Y > Z > W
9.实验是化学研究的基础,下列关于各实验装置图(部分夹持装置省略)的叙述错误的是
A.利用装置①可除去粗溴苯(溴苯沸点为156.2℃)中混有的苯(沸点为80.1℃)
B.利用装置②及相关实验现象可推知酸性:
C.利用装置③,由b口进气可收集H2、NH3
D.利用装置④可制备二氧化硫气体
10.以相同的流速分别向经硫酸酸化和未经酸化的浓度均为0.1mol·L-1的FeSO4溶液中通入O2。溶液中pH随时间的变化如下图所示。
已知:0.1 mol·L-1Fe3+生成Fe(OH)3,开始沉淀时pH=1.5,完全沉淀时pH=2.8
下列说法不正确的是
A.由图1可知,酸化的FeSO4溶液中发生反应:4Fe2++O2+4H+= 4Fe3+ +2H2O
B.图2中,t=0时刻,FeSO4溶液pH=5.7是由于Fe2+发生了水解反应
C.由图2可知,未酸化的FeSO4溶液中发生反应生成Fe(OH)3的同时还生成了H+
D.若向FeSO4溶液中先加入过量NaOH溶液再通入O2,pH先增大后明显减小
二、不定项选择题:本题共5小题,每小题4分,共20分。在每小题给出的四个选项中,有一个或两个选项符合题目要求。全部选对的得4分,选对但不全的得2分,有选错的得0分。
11.2021年1月,科学家发现水蒸气在低温基材表面冷凝形成的微滴中会自发生成H2O2,通过下面反应可验证H2O2的生成。
关于该反应中的有机物,下列说法正确的是
A.4-羧基苯硼酸分子中所有原子一定共面
B.该反应过程中硼元素被氧化
C.4-羟基苯甲酸属于芳香族化合物的同分异构体有6种
D.4-羟基苯甲酸可以发生酯化反应、还原反应和氧化反应
12.探究乙醛的银镜反应,实验如下(水浴加热装置已略去,水浴温度均相同)。
已知:i.银氨溶液用2%AgNO3溶液和稀氨水配制
ii. [Ag(NH3)2]+ +2H2OAg++2NH3·H2O
序号 ① ② ③ ④
装置
现象 一直无明显现象 8 min有银镜产生 3 min有银镜产生. d中较长时间无银镜产生, e中有银镜产生
下列说法不正确的是
A.a与b中现象不同的原因是[Ag(NH3)2]+能氧化乙醛而Ag+不能
B.c中发生的氧化反应为CH3CHO+ 3OH--2e-= CH3COO- +十2H2O
C.其他条件不变时,增大pH能增强乙醛的氧化性
D.由③和④可知,c与d现象不同的原因是c(Ag+)不同
13. CO2资源化利用是实现碳中和的一种有效途径。下图是CO2在电催化下产生合成气(CO和H2)的一种方法。下列说法不正确的是
A.a电极连接电源的负极
B.SO42-从a极区向b极区移动
C. b极区中c(CH3COO- )逐渐增大
D.a极区中c(CO32- )逐渐减小
14.W、X、Y、Z 为原子序数依次增大的四种短周期元素,M、N、R、Q为上述元素组成的化合物。已知有机物M的相对分子质量为28,Z是短周期原子半径最大的元素,N分子中含有10个电子。它们之间的转化关系如下图所示。
下列相关说法错误的是
A.X、Y的氢化物沸点:X一定低于Y
B.Y和Z形成的化合物可能只含有离子键
C.Z与N反应比Z与R反应更剧烈
D.1mol Z2Y2和足量N反应,转移1mol电子
15.常温下,向某浓度的H2A溶液中逐滴加入NaOH溶液,溶液中-lgc(x)(x为H2A、HA-或A2-)与溶液pH的变化关系如图所示。则下列说法正确的是
A.c点溶液中c(Na+)> 3c(A2-)
B.b点对应溶液的pH为3.05
C.将等物质的量浓度的NaHA与H2A溶液等体积混合,所得溶液pH = 0.8
D.整个过程中[c(H2A) + c(HA-) + c(A2-)]保持不变
第II卷(共50分)
三、非选择题:本题共4小题,共50分
16.(12分)二氯异氰尿酸钠[]是常用的杀菌消毒剂,常温下为白色固体,难溶于冷水。利用高浓度的NaClO溶液和异氰尿酸[]固体制备二氯异氰尿酸钠,实验装置如下图所示(部分夹持装置略)。
已知:
①
②
回答下列问题:
(1)装置A中发生反应的离子方程式为。
(2)装置B中盛放的试剂为,若撤去该装置,对C中制备实验产生的影响是。
(3)三颈烧瓶液面上出现黄绿色气体时,由上口加入固体,反应过程中仍需不断通入,原因是。
(4)装置C中冰水浴的目的是。
(5)通过下列实验可测定二氯异氰尿酸钠样品中有效氯的含量(样品中不含NaClO):
反应原理:
实验步骤:准确称取W样品配成100mL溶液,取25.00mL于碘量瓶中,加入适量稀硫酸和过量KI溶液,暗处静置充分反应后,用0.1000标准溶液滴定至溶液呈微黄色,加入淀粉指示剂继续滴定至终点,消耗溶液V mL。
①滴定终点的现象是。
②该样品中有效氯含量为(用含w、V的代数式表示)。
()。
③若滴定前滴定管尖嘴有气泡,滴定后气泡消失,则有效氯的测定值将(填“偏高”、“偏低”或“无影响”)。
17. (12分)半导体芯片行业是金属靶材的主要应用领域之一、利用镍铂靶材废料(主要成分为Ni、Pt以及微量Fe、Al的单质)采用选择性溶解法回收铂并制备硫酸镍晶体的一种工艺流程如下:
已知:①溶液中金属离子开始沉淀和完全沉淀的pH如下表所示:
金属离子 Ni2+
开始沉淀时(c=0.01mol/L)的pH 7.2 3.7 2.2 7.5
沉淀完全时 ()的pH 8.7 4.7 3.2 9.0
②王水是按浓盐酸和浓硝酸的体积比为3∶1配制而成;
③氧化性
④室温:;
(1)“酸浸”时镍发生反应的化学方程式为_______。
(2)铂在王水中生成二元强酸,其中Pt元素的化合价为_______,该反应的离子方程式为_______。
(3)设“调pH”应控制的pH范围是_______。
(4)当液固比为4∶1时,"酸浸"过程中镍的浸出率与温度和时间的关系如图所示,“酸浸”的最佳温度和时间是_______。
(5)沉铂过程中,的沉淀率随温度的升高而增大,结合平衡移动原理解释沉淀率随温度变化的主要原因_______。
(6)在“沉铂”过程中,若向的溶液里加入等体积的溶液,使沉淀完全,则加入溶液的浓度最小值为_______mol/L(结果保留两位小数,忽略溶液混合后体积的变化)。
(7)“操作1”中包括沉淀的洗涤,应选用下列哪种试剂最佳_______。
A. 蒸馏水 B. 浓盐酸 C. 氯化铵溶液 D. 王水
18.(12分) 作为一种轻质热电材料被广泛应用,为提高该材料的宏观性能(如韧性、弹性等)研究人员尝试在中掺杂稀土元素,其简要流程如下:
(1)基态Si原子核外未成对电子数有_______个,稀土元素镧(La)位于周期表_______区。
(2)流程中三种晶体、、熔点从高到低顺序为_______,其中四种元素电负性从大到小顺序为_______。
(3)上述流程中分子构型或者结构单元为正四面体构型的有_______(填化学式,至少填两种)。
(4)分析工业冶炼单质镁采用电解熔融而不是MgO的原因_______。
(5)晶胞如图,该晶胞棱长为、阿伏加德罗常数为NA,该晶体的密度为_______(列出计算式)
(6)科研人员通过实验数据计算出La掺杂后的多种存在形式的生成焓数据如下表(生成焓是某温度下,标准状态的各种元素的最稳定单质生成标准状态1mol某纯物质的热效应)。结合生成焓数据判断掺杂后的目标物最稳定的是_______(填化学式),目标物中La原子最有可能填充的位置为_______。
目标物 生成焓(kJ/mol)
-19.31
-8.06
-10.56
+3.56
19.(14分)我国科学家发现化合物 J 对消除由蜈蚣叮咬产生的严重临床症状有良好效果。J 的两条合成路线如下图所示。
已知:
回答下列问题:
(1)A 中官能团有:硝基和________。
D→E 的化学方程式是________。F 的结构简式是________。
反应中 的作用________。
B 有多种同分异构体,写出任意一种同时满足下列条件的 M 的结构简式是______。
含有-NO2 的芳香族化合物
能发生水解反应且水解产物之一含有醛基
苯环上一氯代物有两种
G→H 的反应类型是 _________。
I→J 的反应还可能有副产物,请写出其中一种的结构简式________。
苯胺( )和乙二酸(HOOC-COOH)为起始原料,可以制备
。选用必要的试剂完成合成路线_______。
岳云高级中学2021-2022学年高三下学期期中考试
化学参考答案
一、单项选择题:本题共10小题,每小题3分,共30分。在每小题给出的四个选项中,只有一项符合题目要求。
题号 1 2 3 4 5 6 7 8 9 10
答案 A C B B B A A C D D
二、不定项选择题:本题共5小题,每小题4分,共20分。在每小题给出的四个选项中,有一个或两个选项符合题目要求。全部选对的得4分,选对但不全的得2分,有选错的得0分。
题号 11 12 13 14 15
答案 D AC CD A B
三、非选择题:本题共4小题,共50分
16.(12分)(1)
(2)饱和食盐水挥发的氯化氢会和装置C中的NaOH反应,降低产率
(3)使反应生成的NaOH再次生成次氯酸钠,提高原料的利用率
(4)防止温度过高生成
(5)滴入最后半滴溶液时,溶液的浅蓝色褪去且半分钟内颜色不恢复偏高
17.(12分)(1)
(2) ①. +4 ②.
(3)4.7pH<7.2
(4)70℃、120min
(5)存在可逆反应,升高温度有利于HCl挥发,促使平衡正向移动,使沉淀率升高;
(6) (7)C
18.(12分)(1) ①. 2 ②. f
(2) ①. >> ②. O>Cl>Si>Mg
(3)、、Si
(4)MgO的熔点高于
(5)
(6) ①. ②. 体心
19.(14分)(1) 氨基 (2)
(3)保护氨基,防止在消化过程中被氧化
(5)取代反应
(6)合理即可
同课章节目录
