湖南省株洲市南方高级中学2021-2022学年高三下学期期中考试化学试题(Word版含答案)
文档属性
| 名称 | 湖南省株洲市南方高级中学2021-2022学年高三下学期期中考试化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-20 08:05:15 | ||
图片预览



文档简介
南方高级中学2021-2022学年高三下学期期中考试
化学试题
(时间:75分钟 满分:100分)
班级 姓名 准考证号
注意事项:
1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的姓名、考生号和座号,并将条形码粘贴在指定位置上。
2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米黑色签字笔书写,字体工整、笔迹清楚。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。保持卡面清洁,不折叠、不破损。
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Si-28 S-32 Fe-56
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1. 化学与生产、生活、科技等密切相关,下列说法错误的是
A. 手机芯片的主要成分是高纯硅,硅石的主要成分为硅酸盐
B. 高铁车厢的大部分材料是铝合金,铝合金材料具有强度大、质量轻、耐腐蚀等优点
C. 利用二氧化碳合成聚碳酸酯可降解塑料符合低碳经济理念
D. 开发太阳能、风能、地热能、潮汐能等新能源可以减少霾的产生
2. 下列文字叙述与反应原理不对应的是
A. 向溴化亚铁溶液中通入少量氯气:
B. 溶液与稀硫酸的反应:
C. 乙醇的催化氧化:
D. 向NaClO溶液中通入过量气体:
3. 有机物M的结构简式如图。下列说法错误的是
A. M的分子式为
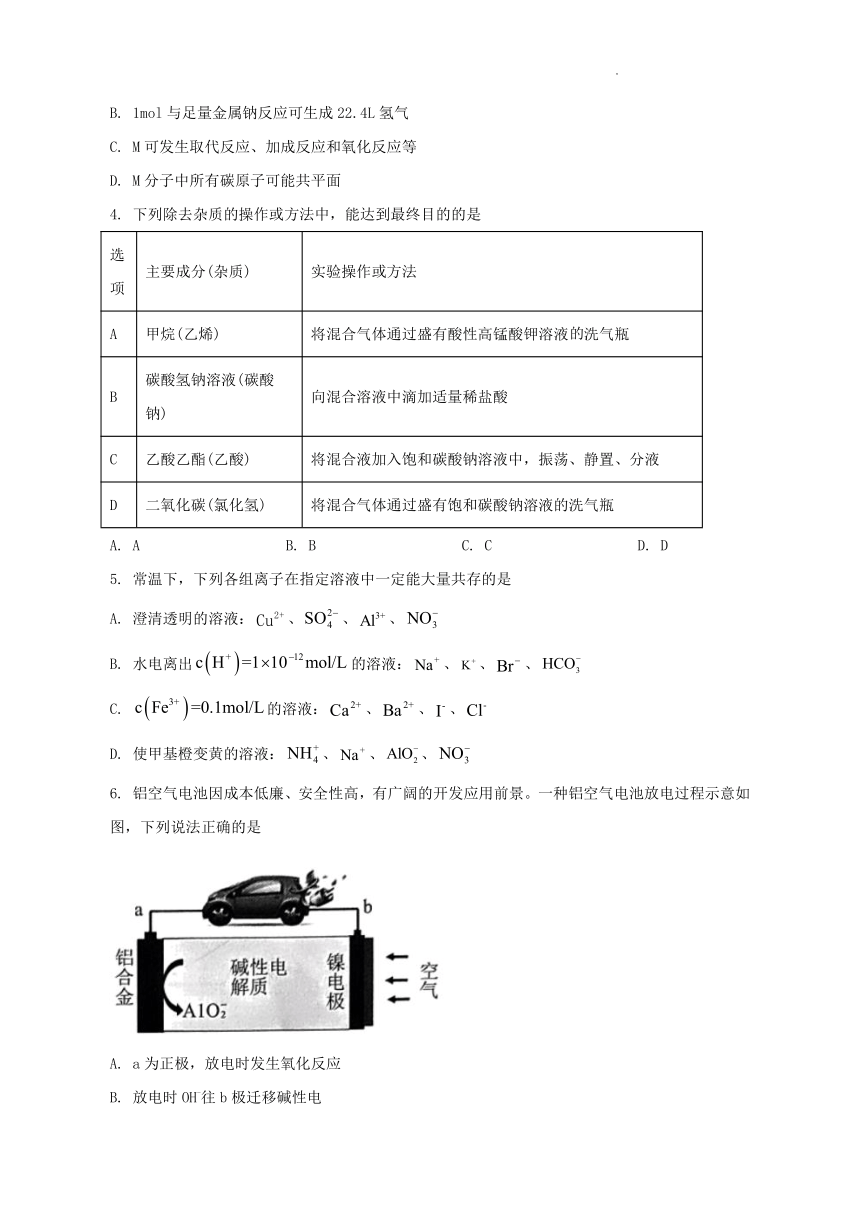
B. 1mol与足量金属钠反应可生成22.4L氢气
C. M可发生取代反应、加成反应和氧化反应等
D. M分子中所有碳原子可能共平面
4. 下列除去杂质的操作或方法中,能达到最终目的的是
选项 主要成分(杂质) 实验操作或方法
A 甲烷(乙烯) 将混合气体通过盛有酸性高锰酸钾溶液洗气瓶
B 碳酸氢钠溶液(碳酸钠) 向混合溶液中滴加适量稀盐酸
C 乙酸乙酯(乙酸) 将混合液加入饱和碳酸钠溶液中,振荡、静置、分液
D 二氧化碳(氯化氢) 将混合气体通过盛有饱和碳酸钠溶液的洗气瓶
A. A B. B C. C D. D
5. 常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 澄清透明的溶液:、、、
B. 水电离出的溶液:、、、
C. 的溶液:、、、
D. 使甲基橙变黄的溶液:、、、
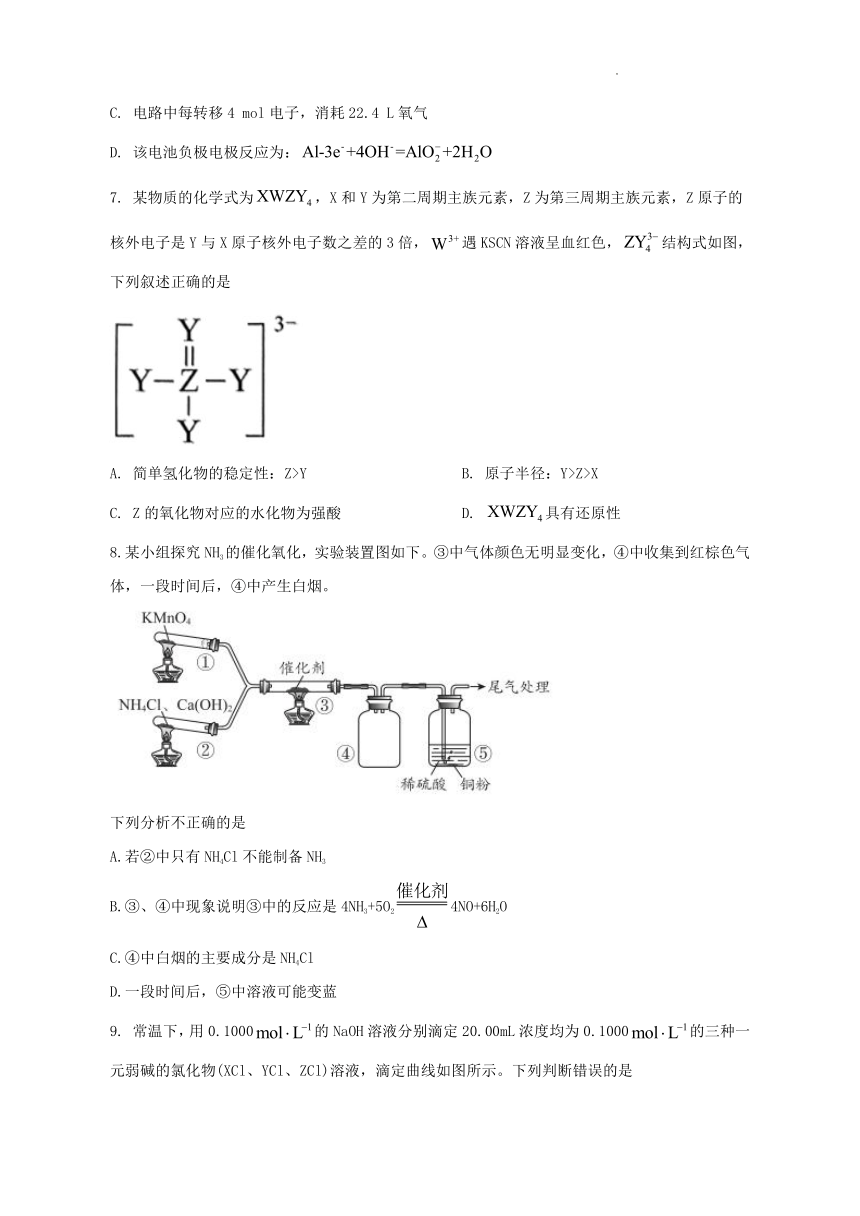
6. 铝空气电池因成本低廉、安全性高,有广阔的开发应用前景。一种铝空气电池放电过程示意如图,下列说法正确的是
A. a为正极,放电时发生氧化反应
B. 放电时OH-往b极迁移碱性电
C. 电路中每转移4 mol电子,消耗22.4 L氧气
D. 该电池负极电极反应为:
7. 某物质的化学式为,X和Y为第二周期主族元素,Z为第三周期主族元素,Z原子的核外电子是Y与X原子核外电子数之差的3倍,遇KSCN溶液呈血红色,结构式如图,下列叙述正确的是
A. 简单氢化物的稳定性:Z>Y B. 原子半径:Y>Z>X
C. Z的氧化物对应的水化物为强酸 D. 具有还原性
8.某小组探究NH3的催化氧化,实验装置图如下。③中气体颜色无明显变化,④中收集到红棕色气体,一段时间后,④中产生白烟。
下列分析不正确的是
A.若②中只有NH4Cl不能制备NH3
B.③、④中现象说明③中的反应是4NH3+5O24NO+6H2O
C.④中白烟的主要成分是NH4Cl
D.一段时间后,⑤中溶液可能变蓝
9. 常温下,用0.1000的NaOH溶液分别滴定20.00mL浓度均为0.1000的三种一元弱碱的氯化物(XCl、YCl、ZCl)溶液,滴定曲线如图所示。下列判断错误的是
A. 该XCl溶液中:
B. 三种弱碱的电离常数:
C 当时,三种溶液中:
D. 分别滴加20.00mLNaOH溶液后,再将三种溶液混合:
10. 异丁醇催化脱水制备异丁烯主要涉及以下2个反应。研究一定压强下不同含水量的异丁醇在恒压反应器中的脱水反应,得到了异丁烯的平衡产率随温度的变化结果如下图。
①+H2O(g) ΔH1= + 28 kJ/molK1(190°C)= 104
②△H2= -72 kJ/molK2(190 ° C)=0.1
下列说法不正确的是
A.其他条件不变时,在催化剂的活性温度内,升高温度有利于异丁烯的制备
B.若只有异丁烯、水和二聚异丁烯生成,则初始物质浓度c0与流出物质浓度c之间存在: c0(异丁醇) =c(异丁烯)+2c(二聚异丁烯)
C. 190° C时,增大n(H2O): n(异丁醇),不利于反应②的进行
D.高于190 ° C时,温度对异丁烯的平衡产率影响不大的原因是K1>104、K2<0.1
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11. 我国科学家采用单原子Ni和纳米Cu作串联催化剂,通过电解法将CO2转化为乙烯。装置示意图如下。
已知:电解效率n(B)=
下列说法不正确的是
A.电极a连接电源的负极
B.电极a上有O2产生
C.纳米Cu催化剂上发生反应:2CO+ 6H2O+ 8e-= C2H4 + 8OH-
D.若乙烯的电解效率为60%,电路中通过1 mol电子时,产生0.075 mol乙烯
12.高铁酸钾()是种环保、高效、多功能饮用水处理剂,制备流程如图所示:
下列叙述错误的是
A.若通过电解法以铁为原料制高铁酸钾,铁棒应做阳极分物
B.“尾气”可用碱溶液吸收也可用等具有还原性的物质溶液吸收硫及
C.反应Ⅱ中生成2mol 时转移的电子数为3
D.最后一步能制取的原因是相同温度下的溶解度大于
13.下列实验操作、现象与结论正确的是
选项 操作 现象 结论
A 将溶液与溶液混合 产生白色絮状沉淀 结合质子能力:
B 将硫酸酸化的溶液滴入溶液中 溶液变黄色 氧化性:
C 与浓硫酸170℃共热,制得的气体通入酸性溶液 酸性溶液褪色 制得气体为乙烯
D 向1mL 0.1KCl溶液中加入过量溶液,再加入1mL0.1KI溶液 先出现白色沉淀,后出现黄色沉淀
14.GeorgeA.Olah教授和其合作者使用Ru-PNPpincer络合物作催化剂,用五乙烯六胺(PEHA)多聚物来捕获二氧化碳,可以直接将空气中二氧化碳转化为甲醇,反应可能的过程如图所示。下列叙述不正确的是
A.反应过程中只有极性键的断裂和形成
B.甲醇可作为车用燃料
C.循环过程中催化剂参与中间反应
D.总反应方程式CO2 3H2CH3OH H2O
15. 常温下,向的溶液中滴加的溶液,溶液中随的变化关系如图所示。下列说法错误的是
A. 常温下,的电离平衡常数为
B. 时,消耗溶液的体积小于
C. 溶液中水的电离程度大小:
D. c点溶液中
三、非选择题:本题共4小题,共50分。
16. (14分)新冠疫情期间使用了大量的消毒剂,其中二氧化氯(ClO2)与亚氯酸钠(NaClO2)都具有强氧化性。两者作漂白剂时,不伤害织物;作饮用水消毒剂时,不残留异味。某研究性学习小组利用如下装置由二氧化氯制备NaClO2·3H2O,并探究其性质。
I.查阅资料;
①ClO2易与碱溶液反应生成等物质的量的两种盐,其中一种为氯酸盐。
②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
II.制备与分离:
(1)实验加药品前应进行的实验操作是___________。
(2)盛放NaClO3和Na2SO3固体的仪器名称是___________,
(3)装置A中参加反应的氧化剂与还原剂的物质的量之比为___________。
(4)若要从装置C反应后的溶液获得无水NaClO2晶体的操作步骤如下,请完成下列操作步骤②的内容。
①减压,55℃ 蒸发结晶;
②___________;
③用38℃~60℃热水洗涤;
④在38℃~60℃间进行干燥,得到成品。
(5)装置D是处理尾气,反应的化学方程式___________。
III.测量与计算:
(6)利用题中原理制备出NaClO2·3H2O晶体的样品,可以用“间接碘量法”测定样品(杂质与I不发生反应)的纯度,过程如下:取样品1.4450g 配制成250mL溶液,从中取出25.00mL,加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液,(已知:ClO+4I-+4H+ =2H2O+ 2I2+Cl- ),然后用cmol·L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL (已知I2+2S2O=S4O+2I-)。
①滴定终点的现象是___________。
②下列滴定操作会导致测量结果偏低的是___________(填字母)。
a锥形瓶洗涤后没有干燥
b滴定时锥形瓶中有液体溅出
c滴定终点时俯视读数
d滴定管滴定前有气泡,滴定后气泡消失
③样品中NaClO2·3H2O的纯度为___________% (用含c、v的代数式表示)。
17. (12分)海水中蕴藏着大量的财富,已发现含有80多种化学元素。海水晒得的粗盐中除少量泥沙外,还有少量的、、等可溶性杂质离子。下图表示的是粗盐精制和利用苦卤水提取液溴的过程。
(1)在操作a与b中都用到的一种玻璃仪器是___________,其作用分别是___________、___________。
(2)实验室中保存液溴的方法是___________。
(3)“过量Y”若为过量的NaOH溶液,则Z为___________(填试剂名称)。
(4)提取液溴的过程中两次通,这样做的目的是___________。
(5)若要检验加入过量除杂试剂X、Y、Z后已将除净,需取用少量待测液进行实验,请问取何处的少量待测液更好?___________(填“滤液”或“精盐水”),理由是___________。
18.(12分) 铁、镧、锑的合金能实现热电效应。所谓的热电效应,是当受热物体中的电子(空穴),因随着温度梯度由高温区往低温区移动时,所产生电流或电荷堆积的一种现象。若选用具有明显的热电效应的稀有矿物石为原料,加入到墙体材料中,在与空气接触中,随温度变化可发生极化,并向外放电, 起到净化室内空气的作用。
(1)镧与Sc同族位于第六周期。镧的价电子排布式为_______,锑的核外有_______种运动状态不同的电子。
(2)多数配离子显示的颜色与d轨道的分裂能有关。分裂能是指配离子的中心原子(离子)的一个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量(用 表示),它与中心离子的电子构型、电荷、配体有关。试判断分裂能 [Fe(H2O)6]3+(黄色)_______ [Fe(H2O)6]2+(浅绿色) 填“大于”,“小于”或“等于”),原因是_______。
(3)一种镧,锑形成的配合物结构如图所示
①该结构中,中心离子La3+配位数为_______,碳的杂化方式为_______。
②该配合物中长周期元素的第一电离能由大到小的顺序为_______。
(4)某铁、镧、锑的合金晶胞如下图1,铁原子位于锑原子构成的正八面体的体心,晶胞的六个表面结构都如下图2。
①若上图中A 点锑原子的坐标为,则B点铁原子的坐标为_______。
②若该晶体的密度为ρg/cm3,阿伏加德罗常数为NA,则Sb原子与Sb原子的最近距离为_______cm。
19.(12分) 化合物Ⅸ是合成一种新型多靶向抗肿瘤药物的中间体,其合成路线流程图如下:
回答下列问题:
(1)写出化合物Ⅰ的名称_______,化合物Ⅰ→Ⅱ的反应类型_______。
(2)化合物Ⅲ由C、H、O三种原子组成,结构简式为_______。
(3)化合物Ⅳ分子结构中的含氧官能团有_______(填名称)。
(4)化合物Ⅴ在酸性下水解,有一种产物能在一定条件下自身聚合形成高聚物。形成该高聚物的反应方程式为_______。
(5)化合物X是V的同系物,其相对分子质量比V小28,化合物X同时满足如下条件的同分异构体有_______种。
①苯环上有两种取代基,且能与溶液发生显色反应;
②能与溶液反应生成气体。
这些同分异构体中满足核磁共振氢谱峰面积比为6∶2∶2∶1∶1的结构简式_______。
(6)根据上述信息,写出以苯乙烯( )与化合物Ⅶ为主要原料合成有机物 的路线流程为_______。
化学试题参考答案
一、选择题:本题共10小题,每小题3分,共30分。每小题只有一个选项符合题意。
1.A 2.D 3.B 4.C 5.A 6.D 7.D 8.C 9.C 10.B
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.BD 12.CD 13.A 14.A 15.D
三、非选择题:本题共4小题,共50分。
16.(14分)(1)检查装置气密性
(2)三颈烧瓶 (3)2:1
(4)趁热过滤 (5)2ClO2+2NaOH=NaClO3+NaClO2+H2O
(6) ①. 滴入最后一滴Na2S2O3标准溶液时,溶液由蓝色变为无色,且半分钟内不变色。 ②. bc ③. 25cV
17.(12分)(1)①. 玻璃棒 ②. 引流 ③. 搅拌使受热均匀,防止液体飞溅
(2)水封法 (3)碳酸钠溶液
(4)富集溴元素,氧化溴离子为溴单质
(5) ①. 精盐水 ②. 滤液中还含有氢氧化钠、碳酸钠,需加入大量盐酸酸化,而精盐水不用再加入盐酸,直接加入氯化钡溶液即可,方便可行
18.(12分)(1)①. 5d16s2 ②. 51
(2) ①. > ②. Fe3+的正电荷数比Fe2+的多,吸引电子能力更强;Fe3+的3d达到半充满稳定结构,Fe2+的3d未达到半充满稳定结构;
(3)①. 5 ②. sp2、sp3 ③. Sb> La
(4)①. ②. cm
19.(12分)(1)①. 4-溴苯甲酸(对溴苯甲酸) ②. 取代反应
(2)CH≡CCH2CH2OH
(3)羟基、酯基
(4)n+(n-1)H2O
(5) ①. 15 ②.
(6)
化学试题
(时间:75分钟 满分:100分)
班级 姓名 准考证号
注意事项:
1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的姓名、考生号和座号,并将条形码粘贴在指定位置上。
2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米黑色签字笔书写,字体工整、笔迹清楚。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效。保持卡面清洁,不折叠、不破损。
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 Si-28 S-32 Fe-56
一、选择题:本题共10小题,每小题2分,共20分。每小题只有一个选项符合题意。
1. 化学与生产、生活、科技等密切相关,下列说法错误的是
A. 手机芯片的主要成分是高纯硅,硅石的主要成分为硅酸盐
B. 高铁车厢的大部分材料是铝合金,铝合金材料具有强度大、质量轻、耐腐蚀等优点
C. 利用二氧化碳合成聚碳酸酯可降解塑料符合低碳经济理念
D. 开发太阳能、风能、地热能、潮汐能等新能源可以减少霾的产生
2. 下列文字叙述与反应原理不对应的是
A. 向溴化亚铁溶液中通入少量氯气:
B. 溶液与稀硫酸的反应:
C. 乙醇的催化氧化:
D. 向NaClO溶液中通入过量气体:
3. 有机物M的结构简式如图。下列说法错误的是
A. M的分子式为
B. 1mol与足量金属钠反应可生成22.4L氢气
C. M可发生取代反应、加成反应和氧化反应等
D. M分子中所有碳原子可能共平面
4. 下列除去杂质的操作或方法中,能达到最终目的的是
选项 主要成分(杂质) 实验操作或方法
A 甲烷(乙烯) 将混合气体通过盛有酸性高锰酸钾溶液洗气瓶
B 碳酸氢钠溶液(碳酸钠) 向混合溶液中滴加适量稀盐酸
C 乙酸乙酯(乙酸) 将混合液加入饱和碳酸钠溶液中,振荡、静置、分液
D 二氧化碳(氯化氢) 将混合气体通过盛有饱和碳酸钠溶液的洗气瓶
A. A B. B C. C D. D
5. 常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 澄清透明的溶液:、、、
B. 水电离出的溶液:、、、
C. 的溶液:、、、
D. 使甲基橙变黄的溶液:、、、
6. 铝空气电池因成本低廉、安全性高,有广阔的开发应用前景。一种铝空气电池放电过程示意如图,下列说法正确的是
A. a为正极,放电时发生氧化反应
B. 放电时OH-往b极迁移碱性电
C. 电路中每转移4 mol电子,消耗22.4 L氧气
D. 该电池负极电极反应为:
7. 某物质的化学式为,X和Y为第二周期主族元素,Z为第三周期主族元素,Z原子的核外电子是Y与X原子核外电子数之差的3倍,遇KSCN溶液呈血红色,结构式如图,下列叙述正确的是
A. 简单氢化物的稳定性:Z>Y B. 原子半径:Y>Z>X
C. Z的氧化物对应的水化物为强酸 D. 具有还原性
8.某小组探究NH3的催化氧化,实验装置图如下。③中气体颜色无明显变化,④中收集到红棕色气体,一段时间后,④中产生白烟。
下列分析不正确的是
A.若②中只有NH4Cl不能制备NH3
B.③、④中现象说明③中的反应是4NH3+5O24NO+6H2O
C.④中白烟的主要成分是NH4Cl
D.一段时间后,⑤中溶液可能变蓝
9. 常温下,用0.1000的NaOH溶液分别滴定20.00mL浓度均为0.1000的三种一元弱碱的氯化物(XCl、YCl、ZCl)溶液,滴定曲线如图所示。下列判断错误的是
A. 该XCl溶液中:
B. 三种弱碱的电离常数:
C 当时,三种溶液中:
D. 分别滴加20.00mLNaOH溶液后,再将三种溶液混合:
10. 异丁醇催化脱水制备异丁烯主要涉及以下2个反应。研究一定压强下不同含水量的异丁醇在恒压反应器中的脱水反应,得到了异丁烯的平衡产率随温度的变化结果如下图。
①+H2O(g) ΔH1= + 28 kJ/molK1(190°C)= 104
②△H2= -72 kJ/molK2(190 ° C)=0.1
下列说法不正确的是
A.其他条件不变时,在催化剂的活性温度内,升高温度有利于异丁烯的制备
B.若只有异丁烯、水和二聚异丁烯生成,则初始物质浓度c0与流出物质浓度c之间存在: c0(异丁醇) =c(异丁烯)+2c(二聚异丁烯)
C. 190° C时,增大n(H2O): n(异丁醇),不利于反应②的进行
D.高于190 ° C时,温度对异丁烯的平衡产率影响不大的原因是K1>104、K2<0.1
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11. 我国科学家采用单原子Ni和纳米Cu作串联催化剂,通过电解法将CO2转化为乙烯。装置示意图如下。
已知:电解效率n(B)=
下列说法不正确的是
A.电极a连接电源的负极
B.电极a上有O2产生
C.纳米Cu催化剂上发生反应:2CO+ 6H2O+ 8e-= C2H4 + 8OH-
D.若乙烯的电解效率为60%,电路中通过1 mol电子时,产生0.075 mol乙烯
12.高铁酸钾()是种环保、高效、多功能饮用水处理剂,制备流程如图所示:
下列叙述错误的是
A.若通过电解法以铁为原料制高铁酸钾,铁棒应做阳极分物
B.“尾气”可用碱溶液吸收也可用等具有还原性的物质溶液吸收硫及
C.反应Ⅱ中生成2mol 时转移的电子数为3
D.最后一步能制取的原因是相同温度下的溶解度大于
13.下列实验操作、现象与结论正确的是
选项 操作 现象 结论
A 将溶液与溶液混合 产生白色絮状沉淀 结合质子能力:
B 将硫酸酸化的溶液滴入溶液中 溶液变黄色 氧化性:
C 与浓硫酸170℃共热,制得的气体通入酸性溶液 酸性溶液褪色 制得气体为乙烯
D 向1mL 0.1KCl溶液中加入过量溶液,再加入1mL0.1KI溶液 先出现白色沉淀,后出现黄色沉淀
14.GeorgeA.Olah教授和其合作者使用Ru-PNPpincer络合物作催化剂,用五乙烯六胺(PEHA)多聚物来捕获二氧化碳,可以直接将空气中二氧化碳转化为甲醇,反应可能的过程如图所示。下列叙述不正确的是
A.反应过程中只有极性键的断裂和形成
B.甲醇可作为车用燃料
C.循环过程中催化剂参与中间反应
D.总反应方程式CO2 3H2CH3OH H2O
15. 常温下,向的溶液中滴加的溶液,溶液中随的变化关系如图所示。下列说法错误的是
A. 常温下,的电离平衡常数为
B. 时,消耗溶液的体积小于
C. 溶液中水的电离程度大小:
D. c点溶液中
三、非选择题:本题共4小题,共50分。
16. (14分)新冠疫情期间使用了大量的消毒剂,其中二氧化氯(ClO2)与亚氯酸钠(NaClO2)都具有强氧化性。两者作漂白剂时,不伤害织物;作饮用水消毒剂时,不残留异味。某研究性学习小组利用如下装置由二氧化氯制备NaClO2·3H2O,并探究其性质。
I.查阅资料;
①ClO2易与碱溶液反应生成等物质的量的两种盐,其中一种为氯酸盐。
②NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO2·3H2O,高于38 ℃时析出的晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。
II.制备与分离:
(1)实验加药品前应进行的实验操作是___________。
(2)盛放NaClO3和Na2SO3固体的仪器名称是___________,
(3)装置A中参加反应的氧化剂与还原剂的物质的量之比为___________。
(4)若要从装置C反应后的溶液获得无水NaClO2晶体的操作步骤如下,请完成下列操作步骤②的内容。
①减压,55℃ 蒸发结晶;
②___________;
③用38℃~60℃热水洗涤;
④在38℃~60℃间进行干燥,得到成品。
(5)装置D是处理尾气,反应的化学方程式___________。
III.测量与计算:
(6)利用题中原理制备出NaClO2·3H2O晶体的样品,可以用“间接碘量法”测定样品(杂质与I不发生反应)的纯度,过程如下:取样品1.4450g 配制成250mL溶液,从中取出25.00mL,加入足量KI固体和适量稀H2SO4,再滴加几滴淀粉溶液,(已知:ClO+4I-+4H+ =2H2O+ 2I2+Cl- ),然后用cmol·L-1Na2S2O3标准溶液滴定至终点,重复2次,测得消耗标准溶液的体积平均值为vmL (已知I2+2S2O=S4O+2I-)。
①滴定终点的现象是___________。
②下列滴定操作会导致测量结果偏低的是___________(填字母)。
a锥形瓶洗涤后没有干燥
b滴定时锥形瓶中有液体溅出
c滴定终点时俯视读数
d滴定管滴定前有气泡,滴定后气泡消失
③样品中NaClO2·3H2O的纯度为___________% (用含c、v的代数式表示)。
17. (12分)海水中蕴藏着大量的财富,已发现含有80多种化学元素。海水晒得的粗盐中除少量泥沙外,还有少量的、、等可溶性杂质离子。下图表示的是粗盐精制和利用苦卤水提取液溴的过程。
(1)在操作a与b中都用到的一种玻璃仪器是___________,其作用分别是___________、___________。
(2)实验室中保存液溴的方法是___________。
(3)“过量Y”若为过量的NaOH溶液,则Z为___________(填试剂名称)。
(4)提取液溴的过程中两次通,这样做的目的是___________。
(5)若要检验加入过量除杂试剂X、Y、Z后已将除净,需取用少量待测液进行实验,请问取何处的少量待测液更好?___________(填“滤液”或“精盐水”),理由是___________。
18.(12分) 铁、镧、锑的合金能实现热电效应。所谓的热电效应,是当受热物体中的电子(空穴),因随着温度梯度由高温区往低温区移动时,所产生电流或电荷堆积的一种现象。若选用具有明显的热电效应的稀有矿物石为原料,加入到墙体材料中,在与空气接触中,随温度变化可发生极化,并向外放电, 起到净化室内空气的作用。
(1)镧与Sc同族位于第六周期。镧的价电子排布式为_______,锑的核外有_______种运动状态不同的电子。
(2)多数配离子显示的颜色与d轨道的分裂能有关。分裂能是指配离子的中心原子(离子)的一个电子从较低能量的d轨道跃迁到较高能量的d轨道所需的能量(用 表示),它与中心离子的电子构型、电荷、配体有关。试判断分裂能 [Fe(H2O)6]3+(黄色)_______ [Fe(H2O)6]2+(浅绿色) 填“大于”,“小于”或“等于”),原因是_______。
(3)一种镧,锑形成的配合物结构如图所示
①该结构中,中心离子La3+配位数为_______,碳的杂化方式为_______。
②该配合物中长周期元素的第一电离能由大到小的顺序为_______。
(4)某铁、镧、锑的合金晶胞如下图1,铁原子位于锑原子构成的正八面体的体心,晶胞的六个表面结构都如下图2。
①若上图中A 点锑原子的坐标为,则B点铁原子的坐标为_______。
②若该晶体的密度为ρg/cm3,阿伏加德罗常数为NA,则Sb原子与Sb原子的最近距离为_______cm。
19.(12分) 化合物Ⅸ是合成一种新型多靶向抗肿瘤药物的中间体,其合成路线流程图如下:
回答下列问题:
(1)写出化合物Ⅰ的名称_______,化合物Ⅰ→Ⅱ的反应类型_______。
(2)化合物Ⅲ由C、H、O三种原子组成,结构简式为_______。
(3)化合物Ⅳ分子结构中的含氧官能团有_______(填名称)。
(4)化合物Ⅴ在酸性下水解,有一种产物能在一定条件下自身聚合形成高聚物。形成该高聚物的反应方程式为_______。
(5)化合物X是V的同系物,其相对分子质量比V小28,化合物X同时满足如下条件的同分异构体有_______种。
①苯环上有两种取代基,且能与溶液发生显色反应;
②能与溶液反应生成气体。
这些同分异构体中满足核磁共振氢谱峰面积比为6∶2∶2∶1∶1的结构简式_______。
(6)根据上述信息,写出以苯乙烯( )与化合物Ⅶ为主要原料合成有机物 的路线流程为_______。
化学试题参考答案
一、选择题:本题共10小题,每小题3分,共30分。每小题只有一个选项符合题意。
1.A 2.D 3.B 4.C 5.A 6.D 7.D 8.C 9.C 10.B
二、选择题:本题共5小题,每小题4分,共20分。每小题有一个或两个选项符合题意,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.BD 12.CD 13.A 14.A 15.D
三、非选择题:本题共4小题,共50分。
16.(14分)(1)检查装置气密性
(2)三颈烧瓶 (3)2:1
(4)趁热过滤 (5)2ClO2+2NaOH=NaClO3+NaClO2+H2O
(6) ①. 滴入最后一滴Na2S2O3标准溶液时,溶液由蓝色变为无色,且半分钟内不变色。 ②. bc ③. 25cV
17.(12分)(1)①. 玻璃棒 ②. 引流 ③. 搅拌使受热均匀,防止液体飞溅
(2)水封法 (3)碳酸钠溶液
(4)富集溴元素,氧化溴离子为溴单质
(5) ①. 精盐水 ②. 滤液中还含有氢氧化钠、碳酸钠,需加入大量盐酸酸化,而精盐水不用再加入盐酸,直接加入氯化钡溶液即可,方便可行
18.(12分)(1)①. 5d16s2 ②. 51
(2) ①. > ②. Fe3+的正电荷数比Fe2+的多,吸引电子能力更强;Fe3+的3d达到半充满稳定结构,Fe2+的3d未达到半充满稳定结构;
(3)①. 5 ②. sp2、sp3 ③. Sb> La
(4)①. ②. cm
19.(12分)(1)①. 4-溴苯甲酸(对溴苯甲酸) ②. 取代反应
(2)CH≡CCH2CH2OH
(3)羟基、酯基
(4)n+(n-1)H2O
(5) ①. 15 ②.
(6)
同课章节目录
