2.2.2 影响化学平衡的因素-2022-2023学年高二化学高效备课设计PPT(人教版2019选择性必修1)(26张ppt)
文档属性
| 名称 | 2.2.2 影响化学平衡的因素-2022-2023学年高二化学高效备课设计PPT(人教版2019选择性必修1)(26张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-20 08:18:24 | ||
图片预览




文档简介
(共26张PPT)
第二章 第二节(第2课时)
影响化学平衡的因素
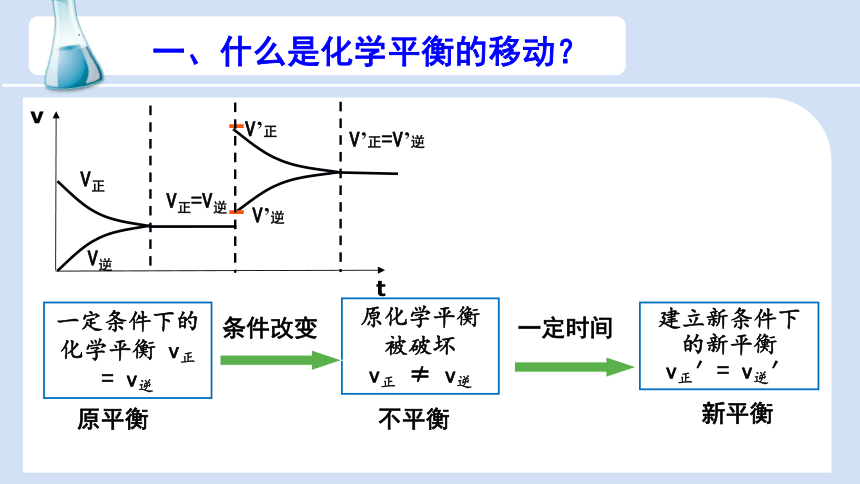
v
t
V’正
V’逆
V’正=V’逆
V正=V逆
t1
t2
V正
V逆
t3
一定条件下的化学平衡 v正 = v逆
原化学平衡被破坏
v正 ≠ v逆
建立新条件下的新平衡
v正′= v逆′
条件改变
新平衡
一定时间
原平衡
不平衡
一、什么是化学平衡的移动?
化学平衡移动定义:
由原有的平衡状态达到新的平衡状态的过程
反应速率 的变化 V(正)>V(逆) V(正)<V(逆) V(正)=V(逆)
移动方向
正向移动
逆向移动
不移动
一、什么是化学平衡的移动?
【讨论】哪些因素能通过改变化学反应速率以使化学平衡发生移动?
浓度、压强、温度、催化剂
二、影响化学平衡的因素
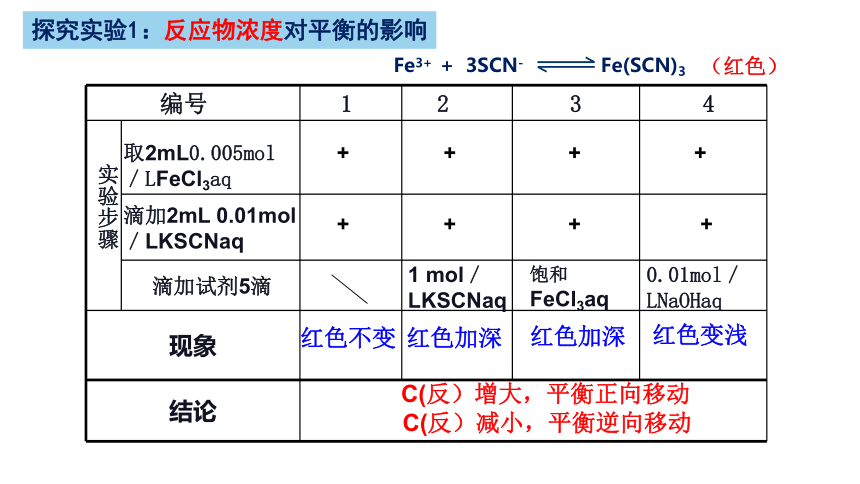
探究实验1:反应物浓度对平衡的影响
原理:
Fe3+ + 3SCN- Fe(SCN)3
(红色)
药品:0.005mol/L FeCl3溶液 0.01mol/L KSCN溶液
1mol/L KSCN溶液 饱和FeCl3 溶液
0.01mol/L NaOH溶液
现象
结论
0.01mol/LNaOHaq
C(反)增大,平衡正向移动
取2mL0.005mol/LFeCl3aq
滴加2mL 0.01mol/LKSCNaq
编号 1 2 3 4
滴加试剂5滴
1 mol/LKSCNaq
饱和FeCl3aq
红色加深
红色变浅
Fe3+ + 3SCN- Fe(SCN)3
(红色)
红色加深
红色不变
+
+
+
+
+
+
+
+
C(反)减小,平衡逆向移动
实验步骤
探究实验1:反应物浓度对平衡的影响
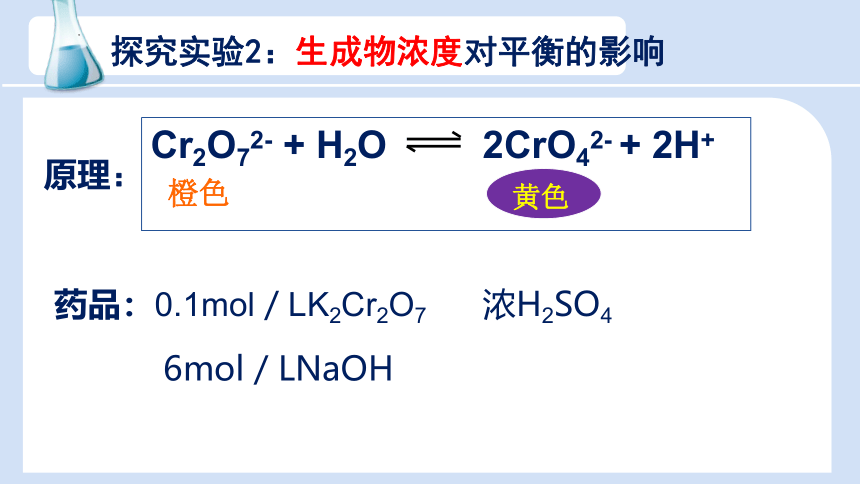
探究实验2:生成物浓度对平衡的影响
Cr2O72- + H2O 2CrO42- + 2H+
橙色
黄色
原理:
药品:0.1mol/LK2Cr2O7 浓H2SO4
6mol/LNaOH
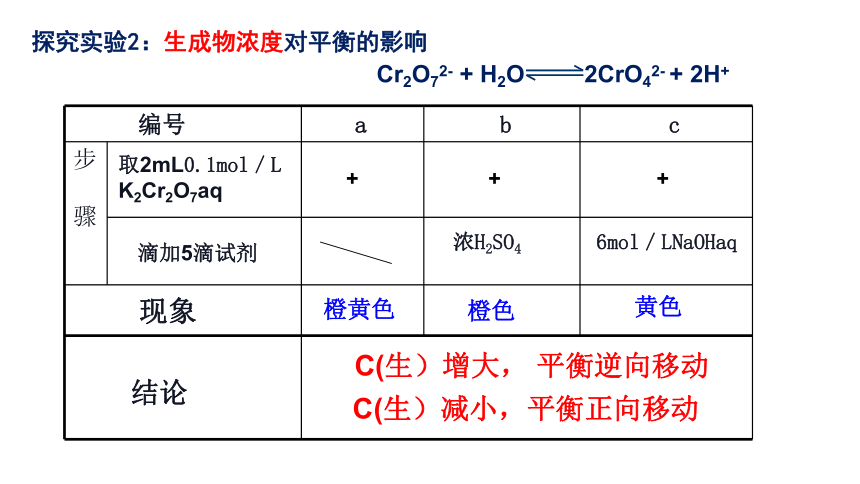
步 骤
浓H2SO4
6mol/LNaOHaq
橙黄色
黄色
C(生)增大, 平衡逆向移动
取2mL0.1mol/L
K2Cr2O7aq
滴加5滴试剂
结论
现象
编号 a b c
Cr2O72- + H2O 2CrO42- + 2H+
+
+
+
橙色
C(生)减小,平衡正向移动
探究实验2:生成物浓度对平衡的影响
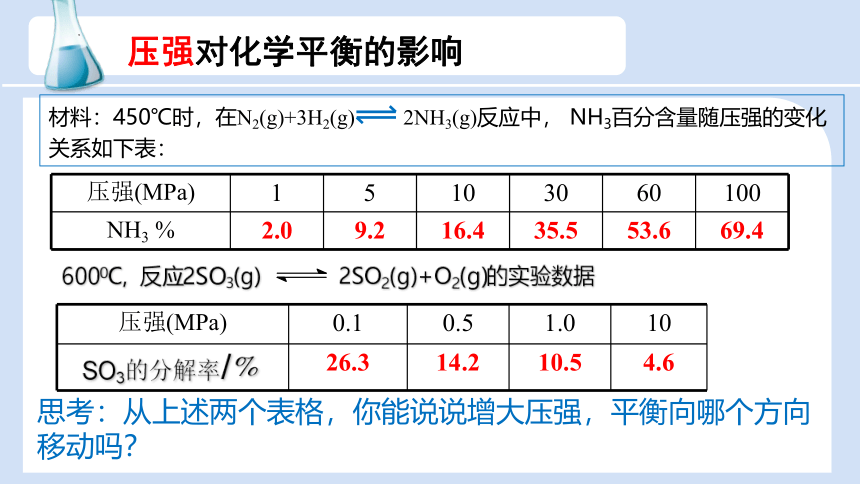
压强对化学平衡的影响
压强(MPa) 1 5 10 30 60 100
NH3 % 2.0 9.2 16.4 35.5 53.6 69.4
材料:450℃时,在N2(g)+3H2(g) 2NH3(g)反应中, NH3百分含量随压强的变化关系如下表:
6000C, 反应2SO3(g) 2SO2(g)+O2(g)的实验数据
压强(MPa) 0.1 0.5 1.0 10
SO3的分解率/﹪ 26.3 14.2 10.5 4.6
思考:从上述两个表格,你能说说增大压强,平衡向哪个方向移动吗?
4A(g)+5B(g)==4C(g)+6D(s)
增大压强,平衡正向移动,结合上两个表,总结压强对平衡的影响?
其他条件不变时,
增大压强,化学平衡向气体体积减小的方向移动;
减小压强,化学平衡向气体体积增大的方向移动。
压强对化学平衡的影响
加压过程演示
刚加压时
加压前
加压一段时间后
2NO2(g) N2O4(g)
红棕色 无色
压强对化学平衡的影响
2NO2(g) N2O4(g)
NO2浓度增大
平衡向正反应方向移动
平衡移动只能削弱外界条件的改变
当加压气体体积缩小时,混和气体颜色先变
深是由于___________________
[思考] A:
后又逐渐变浅是由于___________________
但比原平衡时颜色深原因是
_____________________________
压强对化学平衡的影响
[思考] B:当减压气体体积增大时,混和气体颜色先
变浅是由于_________________________
后又逐渐变深是由于___________________
但比原平衡时颜色浅原因是
_________________________________.
NO2浓度减小
平衡向逆反应方向移动
平衡移动只能削弱外界条件的改变
2NO2(g) N2O4(g)
压强对化学平衡的影响
(1)在定容条件下充入He,平衡__________
(2)在定压条件下充入He,平衡__________
不移动
向逆向移动
[思考] C:
压强对化学平衡的影响
V正= V逆
V正
V逆
t1
t(s)
V(mol·L-1·S-1)
0
t2
V’正 = V’逆
V’逆
V’正
增大压强
aA(g)+bB(g) cC(g)+dD(g) a+b > c+d
压强对化学平衡的影响
思考:对于等体积的气体反应,压强改变将怎样影响化学平衡?
结论:由于压强变化同时、同步、等倍数影响正、逆反应速率,v’正= v’逆,化学平衡不移动,但反应速率改变。
在反应I2(g)+H2 (g) 2HI (g)中增大压强
v
t
v’正= v’逆
v正= v逆
O
压强对化学平衡的影响
(1)原理:2NO2(g) N2O4(g) △H=-56.9kJ/mol
设计实验:探究温度对化学平衡的影响
(红棕色)
(无色)
(3)预设实验现象:
(4)推测结论:
温度对化学平衡的影响
2NO2(g) N2O4(g) △H=- 56.9KJ/mol
红棕色 无色
在其它条件不变的情况下,
升高温度,平衡向吸热反应方向移动。
降低温度,平衡向放热反应方向移动。
压强对化学平衡的影响
温度改变引起平衡移动V-t图像分析
aA(g)+bB(g) cC(g)+dD(g) △H > 0
V正= V逆
V正
V逆
t1
t(s)
V(mol·L-1·S-1)
O
t2
V’正 = V’逆
V’逆
V’正
升高温度
加入正催化剂
加入负催化剂
V’正=V’逆
结论:催化剂对化学平衡无影响
v
t
V正
V逆
V正=V逆
V’正=V’逆
v
t
V正
V逆
催化剂对化学平衡的影响
V正=V逆
改 变 反 应 条 件 平 衡 移 动 方 向
增 大
减 小
V(g) ↑方
升 高
吸热方
放热方
降 低
正向
正向
逆向
逆向
V(g) ↓方
能同等程度的改变化学反应速率,对平衡无影响
浓度
温度
压强
催化剂
反应物
生成物
增大
增大
减小
减小
化学平衡移动原理——勒夏特列原理
如果改变影响平衡的一个条件(浓度、温度、压强),
化学平衡就向减弱这种改变的方向移动。
适用范围:只适用于已达平衡的体系。
移动方向:与条件改变方向相反。
移动结果:只能是减弱外界条件的影响, 但不能消除。
勒夏特列
(1850-1936)
适用条件:一个能影响化学平衡的外界条
件的改变。
应用
在工业生产中适当增大廉价的反应物的浓度,使化学平衡向正反应方向移动,可以提高价格较高原料的转化率,以降低生产成本
2SO2(g) + O2(g) SO3(g)的平衡体系中,为了提高SO2的利用率,可采用什么措施?
催化剂
不断的鼓入空气,以增大氧气的浓度来提高SO2的转化率
V正= V逆
t1
V正
V逆
t(s)
V(mol·L-1·S-1)
O
催化剂
N2+3H2 2NH3
高温、高压
工业上如何提高氨气的产量?
应用
定量分析化学平衡移动方向
相对大小 平衡移动方向
Q > K
Q = K
Q < K
逆向移动
不移动
正向移动
(1)写出该反应的平衡常数表达式;
(2)达平衡后,加入蒸馏水稀释,使体积变为原来的两倍,平衡将向哪个方向移动?
沙场练兵
可逆反应Fe3++3SCN- Fe(SCN)3
第二章 第二节(第2课时)
影响化学平衡的因素
v
t
V’正
V’逆
V’正=V’逆
V正=V逆
t1
t2
V正
V逆
t3
一定条件下的化学平衡 v正 = v逆
原化学平衡被破坏
v正 ≠ v逆
建立新条件下的新平衡
v正′= v逆′
条件改变
新平衡
一定时间
原平衡
不平衡
一、什么是化学平衡的移动?
化学平衡移动定义:
由原有的平衡状态达到新的平衡状态的过程
反应速率 的变化 V(正)>V(逆) V(正)<V(逆) V(正)=V(逆)
移动方向
正向移动
逆向移动
不移动
一、什么是化学平衡的移动?
【讨论】哪些因素能通过改变化学反应速率以使化学平衡发生移动?
浓度、压强、温度、催化剂
二、影响化学平衡的因素
探究实验1:反应物浓度对平衡的影响
原理:
Fe3+ + 3SCN- Fe(SCN)3
(红色)
药品:0.005mol/L FeCl3溶液 0.01mol/L KSCN溶液
1mol/L KSCN溶液 饱和FeCl3 溶液
0.01mol/L NaOH溶液
现象
结论
0.01mol/LNaOHaq
C(反)增大,平衡正向移动
取2mL0.005mol/LFeCl3aq
滴加2mL 0.01mol/LKSCNaq
编号 1 2 3 4
滴加试剂5滴
1 mol/LKSCNaq
饱和FeCl3aq
红色加深
红色变浅
Fe3+ + 3SCN- Fe(SCN)3
(红色)
红色加深
红色不变
+
+
+
+
+
+
+
+
C(反)减小,平衡逆向移动
实验步骤
探究实验1:反应物浓度对平衡的影响
探究实验2:生成物浓度对平衡的影响
Cr2O72- + H2O 2CrO42- + 2H+
橙色
黄色
原理:
药品:0.1mol/LK2Cr2O7 浓H2SO4
6mol/LNaOH
步 骤
浓H2SO4
6mol/LNaOHaq
橙黄色
黄色
C(生)增大, 平衡逆向移动
取2mL0.1mol/L
K2Cr2O7aq
滴加5滴试剂
结论
现象
编号 a b c
Cr2O72- + H2O 2CrO42- + 2H+
+
+
+
橙色
C(生)减小,平衡正向移动
探究实验2:生成物浓度对平衡的影响
压强对化学平衡的影响
压强(MPa) 1 5 10 30 60 100
NH3 % 2.0 9.2 16.4 35.5 53.6 69.4
材料:450℃时,在N2(g)+3H2(g) 2NH3(g)反应中, NH3百分含量随压强的变化关系如下表:
6000C, 反应2SO3(g) 2SO2(g)+O2(g)的实验数据
压强(MPa) 0.1 0.5 1.0 10
SO3的分解率/﹪ 26.3 14.2 10.5 4.6
思考:从上述两个表格,你能说说增大压强,平衡向哪个方向移动吗?
4A(g)+5B(g)==4C(g)+6D(s)
增大压强,平衡正向移动,结合上两个表,总结压强对平衡的影响?
其他条件不变时,
增大压强,化学平衡向气体体积减小的方向移动;
减小压强,化学平衡向气体体积增大的方向移动。
压强对化学平衡的影响
加压过程演示
刚加压时
加压前
加压一段时间后
2NO2(g) N2O4(g)
红棕色 无色
压强对化学平衡的影响
2NO2(g) N2O4(g)
NO2浓度增大
平衡向正反应方向移动
平衡移动只能削弱外界条件的改变
当加压气体体积缩小时,混和气体颜色先变
深是由于___________________
[思考] A:
后又逐渐变浅是由于___________________
但比原平衡时颜色深原因是
_____________________________
压强对化学平衡的影响
[思考] B:当减压气体体积增大时,混和气体颜色先
变浅是由于_________________________
后又逐渐变深是由于___________________
但比原平衡时颜色浅原因是
_________________________________.
NO2浓度减小
平衡向逆反应方向移动
平衡移动只能削弱外界条件的改变
2NO2(g) N2O4(g)
压强对化学平衡的影响
(1)在定容条件下充入He,平衡__________
(2)在定压条件下充入He,平衡__________
不移动
向逆向移动
[思考] C:
压强对化学平衡的影响
V正= V逆
V正
V逆
t1
t(s)
V(mol·L-1·S-1)
0
t2
V’正 = V’逆
V’逆
V’正
增大压强
aA(g)+bB(g) cC(g)+dD(g) a+b > c+d
压强对化学平衡的影响
思考:对于等体积的气体反应,压强改变将怎样影响化学平衡?
结论:由于压强变化同时、同步、等倍数影响正、逆反应速率,v’正= v’逆,化学平衡不移动,但反应速率改变。
在反应I2(g)+H2 (g) 2HI (g)中增大压强
v
t
v’正= v’逆
v正= v逆
O
压强对化学平衡的影响
(1)原理:2NO2(g) N2O4(g) △H=-56.9kJ/mol
设计实验:探究温度对化学平衡的影响
(红棕色)
(无色)
(3)预设实验现象:
(4)推测结论:
温度对化学平衡的影响
2NO2(g) N2O4(g) △H=- 56.9KJ/mol
红棕色 无色
在其它条件不变的情况下,
升高温度,平衡向吸热反应方向移动。
降低温度,平衡向放热反应方向移动。
压强对化学平衡的影响
温度改变引起平衡移动V-t图像分析
aA(g)+bB(g) cC(g)+dD(g) △H > 0
V正= V逆
V正
V逆
t1
t(s)
V(mol·L-1·S-1)
O
t2
V’正 = V’逆
V’逆
V’正
升高温度
加入正催化剂
加入负催化剂
V’正=V’逆
结论:催化剂对化学平衡无影响
v
t
V正
V逆
V正=V逆
V’正=V’逆
v
t
V正
V逆
催化剂对化学平衡的影响
V正=V逆
改 变 反 应 条 件 平 衡 移 动 方 向
增 大
减 小
V(g) ↑方
升 高
吸热方
放热方
降 低
正向
正向
逆向
逆向
V(g) ↓方
能同等程度的改变化学反应速率,对平衡无影响
浓度
温度
压强
催化剂
反应物
生成物
增大
增大
减小
减小
化学平衡移动原理——勒夏特列原理
如果改变影响平衡的一个条件(浓度、温度、压强),
化学平衡就向减弱这种改变的方向移动。
适用范围:只适用于已达平衡的体系。
移动方向:与条件改变方向相反。
移动结果:只能是减弱外界条件的影响, 但不能消除。
勒夏特列
(1850-1936)
适用条件:一个能影响化学平衡的外界条
件的改变。
应用
在工业生产中适当增大廉价的反应物的浓度,使化学平衡向正反应方向移动,可以提高价格较高原料的转化率,以降低生产成本
2SO2(g) + O2(g) SO3(g)的平衡体系中,为了提高SO2的利用率,可采用什么措施?
催化剂
不断的鼓入空气,以增大氧气的浓度来提高SO2的转化率
V正= V逆
t1
V正
V逆
t(s)
V(mol·L-1·S-1)
O
催化剂
N2+3H2 2NH3
高温、高压
工业上如何提高氨气的产量?
应用
定量分析化学平衡移动方向
相对大小 平衡移动方向
Q > K
Q = K
Q < K
逆向移动
不移动
正向移动
(1)写出该反应的平衡常数表达式;
(2)达平衡后,加入蒸馏水稀释,使体积变为原来的两倍,平衡将向哪个方向移动?
沙场练兵
可逆反应Fe3++3SCN- Fe(SCN)3
