2.2氯及其化合物第一课时 2021-2022学年高一上学期化学人教版(2019)必修第一册(51张ppt)
文档属性
| 名称 | 2.2氯及其化合物第一课时 2021-2022学年高一上学期化学人教版(2019)必修第一册(51张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-20 08:20:05 | ||
图片预览







文档简介
(共51张PPT)
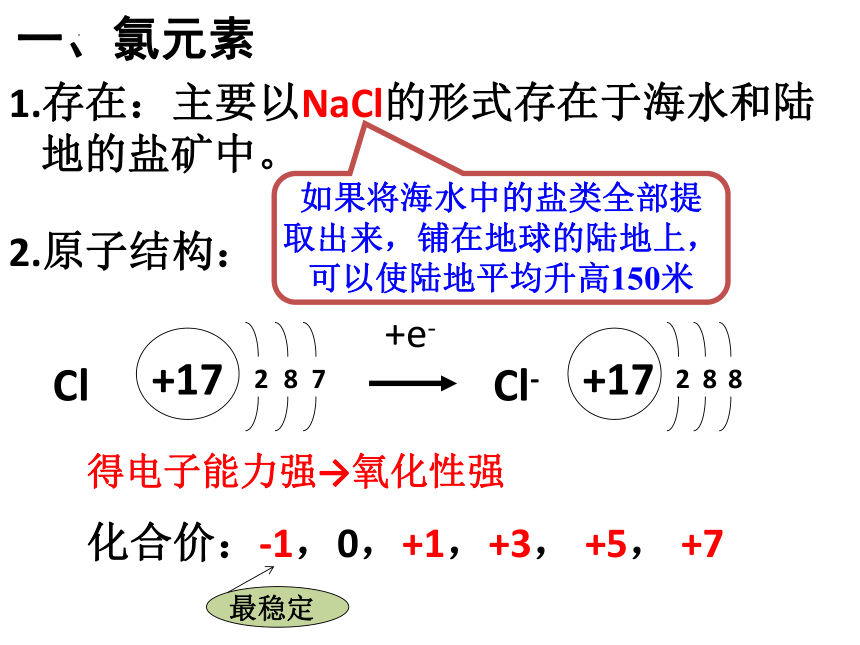
富集在海水中的元素—氯
1.存在:主要以NaCl的形式存在于海水和陆地的盐矿中。
+17
2
8
7
Cl
2.原子结构:
如果将海水中的盐类全部提取出来,铺在地球的陆地上,可以使陆地平均升高150米
一、氯元素
+e-
+17
2
8
8
Cl-
得电子能力强→氧化性强
化合价:-1,0,+1,+3, +5, +7
最稳定
二、活泼的黄绿色气体—氯气(Cl2)
(一) Cl2的物理性质
(1)氯气是黄绿色
(2)有刺激性气味,有毒的气体
(3)易液化
(4)能溶于水(1体积水可溶解2体积氯气)
(5)密度比空气大
(二)化学性质
1、与金属反应
(1)与钠反应
现象:
剧烈燃烧,黄色火焰,生成白烟。
反应方程式:
2Na + Cl2 = 2NaCl
点燃
失2× e-
得2× e-
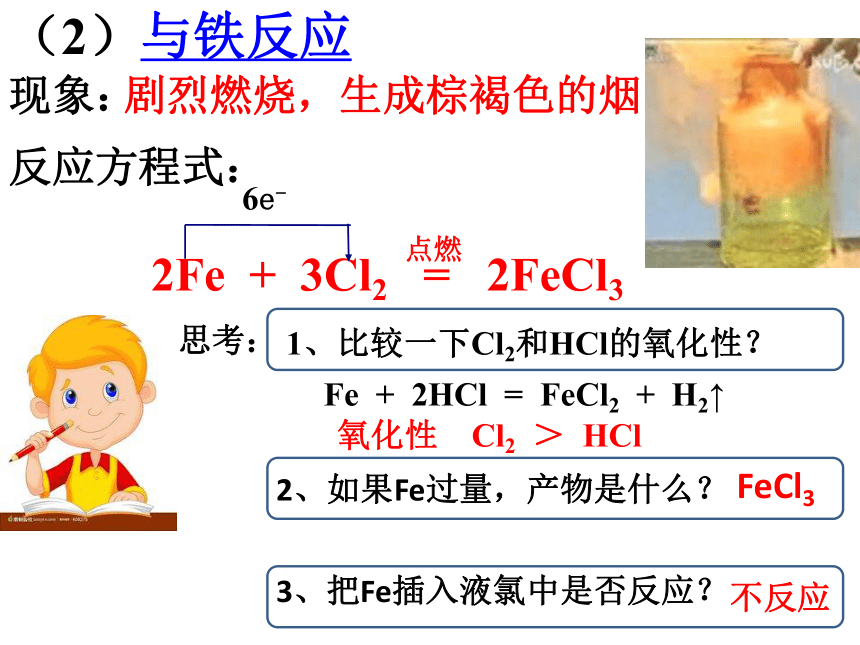
(2)与铁反应
现象:
剧烈燃烧,生成棕褐色的烟。
2Fe + 3Cl2 = 2FeCl3
点燃
1、比较一下Cl2和HCl的氧化性?
氧化性 Cl2 > HCl
反应方程式:
2、如果Fe过量,产物是什么?
3、把Fe插入液氯中是否反应?
Fe + 2HCl = FeCl2 + H2↑
思考:
FeCl3
不反应
6e-
(3)与铜的反应
现象:
剧烈燃烧,生成棕黄色的烟。
Cu + Cl2 = CuCl2
点燃
小结:大多数金属都能在一定条件下与氯气化合(Pt,Au除外),氯气是强氧化剂,变价金属与它反应一般得到高价的金属氯化物。
反应方程式:
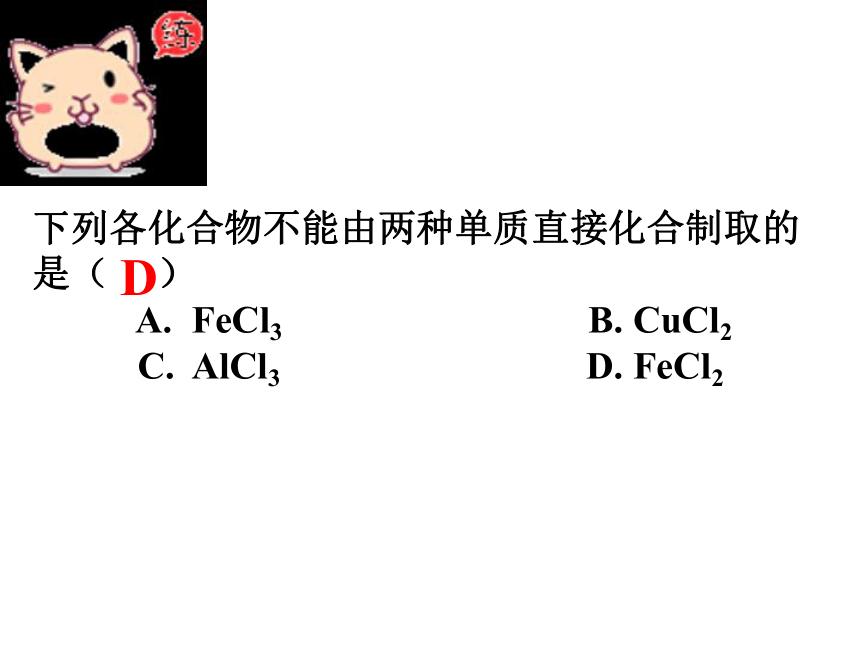
下列各化合物不能由两种单质直接化合制取的
是( )
A. FeCl3 B. CuCl2
C. AlCl3 D. FeCl2
D
H2+Cl2 2HCl
点燃或光照
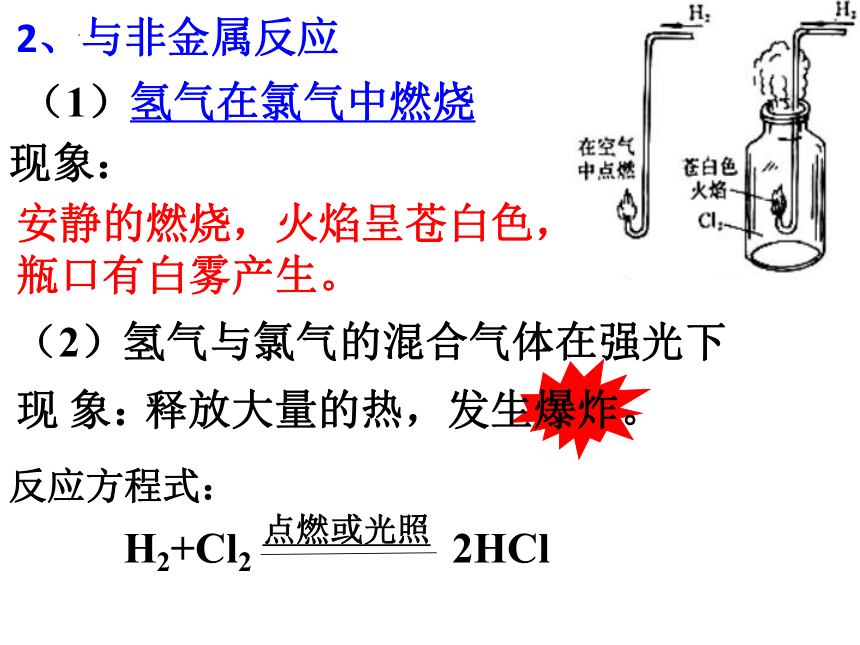
2、与非金属反应
安静的燃烧,火焰呈苍白色, 瓶口有白雾产生。
(1)氢气在氯气中燃烧
现象:
(2)氢气与氯气的混合气体在强光下
现 象:
释放大量的热,发生爆炸。
反应方程式:
通过以上实验,你对燃烧条件和本质有什么新的认识?
①燃烧不一定有氧气参加,物质并不是只有在氧气中才可以燃烧。
②燃烧的本质是氧化还原反应,所以
发光发热的剧烈的氧化还原反应都称为燃烧。
氯气可溶于水,请思考氯气仅是溶于水,还是会和水反应呢?
如何设计实验证明猜想?
想一想:
氯离子的检验:
氢离子的检验:
(1)pH试纸
(2)紫色石蕊试液
(3)活泼金属
(4)NaCO3溶液,澄清石灰水
加入硝酸酸化的AgNO3溶液
将红色纸条放入盛有新制氯水的试管中,震荡,观察现象。
探究氯气和氯水的漂白作用:
氯水中有的漂白性物质到底是什么呢?
如何设计实验证明猜想?
实验探究:
氯水具漂白性
将干燥的红色纸条和用蒸馏水湿润的红色纸条分别放入盛有氯气的的广口瓶中,塞紧瓶塞,观察现象。
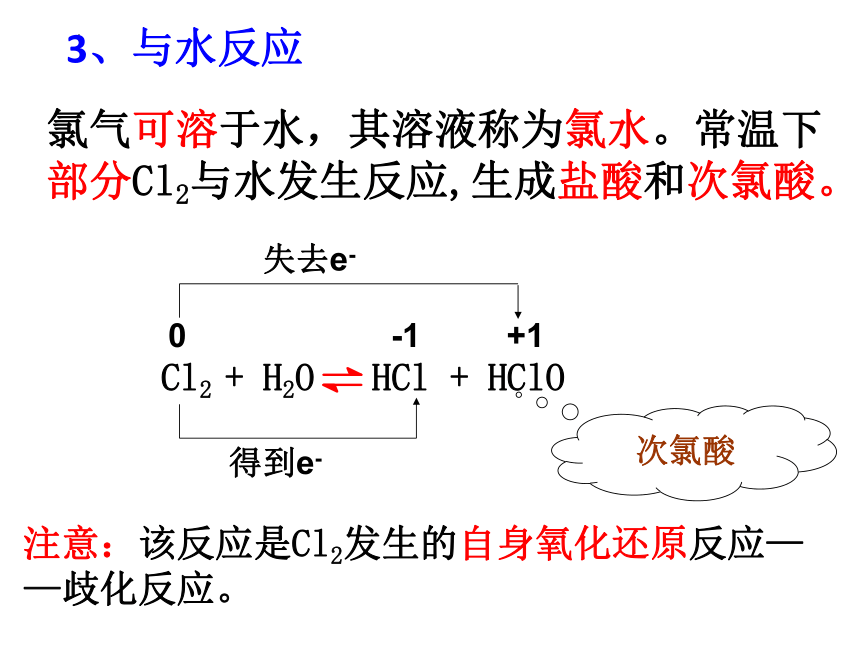
3、与水反应
氯气可溶于水,其溶液称为氯水。常温下部分Cl2与水发生反应,生成盐酸和次氯酸。
Cl2 + H2O HCl + HClO
次氯酸
得到e-
0
-1
+1
失去e-
注意:该反应是Cl2发生的自身氧化还原反应——歧化反应。
HClO的性质和用途:
(1)弱酸性:酸性比碳酸还弱
光照
(3)强氧化性:用于漂白、杀菌消毒
(2)不稳定性:
2HClO = 2HCl + O2↑
小结:干燥的氯气没有漂白作用。氯水或湿润的氯气中,因为生成次氯酸才具有漂白性。
拓展:
1.氯水的性质
新制氯水呈浅黄绿色、有刺激性气味,属混合物,其所含的多种微粒使氯水的化学性质表现出多重性。
2.氯水的成分
Cl2溶于水:Cl2+H2O??H++Cl-+HClO
(三分四离)
思考:
液氯、新制氯水、久制氯水的区别?
①液氯是纯净物,只含Cl2分子;
②新制氯水是混合物,含有三分子、四离子:H2O、Cl2、HClO、H+ 、 Cl-、ClO-、OH-
③久制氯水是混合物,含一分子、三离子:
H2O 、H+ 、 Cl- 、OH- (就是盐酸)
总结:氯水中的各种粒子如何检验
微粒 检验方法 现 象
H2O
H+
Cl-
HClO
Cl2
无水CuSO4粉末
粉末变蓝
加CaCO3粉末
有气泡生成
加AgNO3溶液
有色纸条
纸条褪色
观察颜色
浅黄绿色
有白色的沉淀生成
1、下列说法正确的是: ( )
A、氯气以液态形式存在时可称作氯水或液氯
B、Cl2有毒,Cl-也有毒
C 、Cl2和Cl-都是黄绿色
D 、红热的铜丝在氯气中燃烧,生成棕黄色的 固体CuCl2
D
2、下列现象不属于H2在Cl2中燃烧现象的是( )
A.苍白色火焰 B.瓶口有白雾
C.集气瓶内气体颜色变浅 D.爆炸
D
3.下列有关液氯和氯水两种液体的实验描述正确的是( )
A.两种液体都可以使干燥的红布条褪色
B.两种液体都可以使干燥的蓝色石蕊试纸变红 C.用这两种液体都可以给自来水消毒
D.分别向这两种液体中投入几颗金属锌粒均有气泡产生
C
氯水性质具有多样性,试指出下列各现象主要是何种微粒所表现出来的性质:
①氯水呈浅黄绿色______
②滴加AgNO3溶液后生成白色沉淀___
③往含有Fe2+溶液中滴加KSCN溶液无明显现象,再滴加氯水后呈红色___。
④ 使湿润的紫色石蕊试纸先变红后褪色_____
Cl2
Cl2
Cl-
H+ HClO
设计实验验证起漂白作用的是HClO
氯水的酸性和漂白性
往含有酚酞的NaOH溶液中滴加氯水,溶液红色褪去,有两种可能:
通过向褪色后的溶液中再加入NaOH溶液或者酚酞,看溶液是否重新变成红色来验证溶液褪色的原因。
向新制氯水中滴入石蕊试液,溶液先变红色(酸性),后来颜色又褪去,是由于HClO的强氧化性将色素氧化使之颜色褪去(漂白性)。
①氯水中含有强氧化性的HClO,它的漂白作用能使红色褪去,②氯水中含有H+,能中和OH-,使酚酞褪色。
如何验证是哪种原因呢?
4、与碱反应
Cl2 + 2NaOH = NaCl + NaClO + H2O
2Cl2 + 2 Ca(OH)2 = CaCl2+ Ca(ClO)2 + 2H2O
拓展: 发洪水的地方,经常发放漂白粉和消毒液对被污染的水进行杀菌消毒。你知道它们的有效成分是什么吗?
漂白液: NaClO 漂白粉: Ca(ClO)2
漂白粉的漂白原理:
Ca(ClO)2+ CO2 (少) + H2O =CaCO3↓+2HClO
②怎样保存漂白粉?
密封,保存于干燥处。
①漂白粉露天放置失效原因?
Ca(ClO)2+ CO2 (少) + H2O =CaCO3↓+2HClO
2HClO = 2HCl + O2↑
光照
思考:
③用次氯酸盐杀菌的好处是什么?
次氯酸盐比次氯酸稳定,容易储运且杀菌效果持久。
氯水滴加 溶液 反应离子方程式
NaBr溶液 (或HBr溶液) 2Br -+Cl2=2Cl -+Br2
FeCl2溶液 2Fe2++Cl2=2Fe3++2Cl-
KI溶液 (或HI溶液) 2I-+Cl2=2Cl-+I2
K2S溶液 (或H2S溶液) S2-+Cl2=2Cl-+S↓
Na2SO3溶液 (或SO2) SO32-+Cl2+H2O=SO42-+2H++Cl-
SO2+ Cl2+2H2O=SO42-+2Cl-+4H+
5、与还原性物质反应
学习指导
请同学们用3分钟时间认真阅读课本82-83页的[科学史话]。注意以下问题:
完成[思考与交流],
(试写出Cl2的实验室制法的化学方程式)
MnO2 + 4HCl (浓)== MnCl2 +2H2O +Cl2 ↑
(三)氯气的实验室制法:
1. 是氧化剂, 是还原剂
2.浓盐酸表现出 性和 性
3.氧化剂与还原剂的物质的量之比为
MnO2
HCl
酸
还原
1:2
一套完整的气体实验装置应该包括哪些装置?
尾气处理装置
气体净化装置
气体发生装置
气体收集
或性质实验装置
1、发生装置
液固(液)加热型
固液不加热型
固固加热型
HCl气体
水蒸气
饱和食盐水
浓硫酸
浓 H2SO4
饱和食盐水
2、净化装置
a. 向上排空气法
b. 排饱和食盐水法
3、收集装置
4、尾气吸收
Cl2 + 2NaOH = NaCl + NaClO + H2O
尾气有毒或污染空气,常用点燃或用试剂吸收
氯气的实验室制法
MnO2+4HCl(浓) = MnCl2 +Cl2↑+2H2O
加热
拓展:哪种物质能用如图装置制备氯气(简易制法)
KMnO4+ HCl(浓)=
Ca(ClO)2+ HCl (浓) =
K2Cr2O7+14HCl(浓)= 2KCl +2CrCl3+3Cl2↑+7H2O
?
2KCl+2MnCl2+8H2O+5Cl2 ↑
CaCl2+2Cl2↑+2H2O
2
16
4
1、能使湿润的淀粉碘化钾试纸变蓝的化学试剂是( )
① 溴水 ② 氯水 ③ 碘酒 ④ 氯化钾
⑤ 酸性高锰酸钾
A ①②③ B ①②④
C ③④⑤ D ①②③⑤
D
2:某强酸性溶液中可能存在NO3- 、I-、Cl-、Fe3+中的一种或几种。向该溶液中加入溴水后,溴被还原,由此推断该溶液中( )
A.不含NO3- ,含Fe3+
B.含有NO3- 、I-、Cl-
C.含I-,但不能确定是否含Cl-
D.含有Fe3+
C
① ② ③ ④
A 黄绿色 橙色 蓝色 白色
B 无色 橙色 紫色 白色
C 黄绿色 橙色 蓝色 无色
D 黄绿色 无色 紫色 白色
3.已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是
A
4.下列说法正确的是( )
一种物质有阳离子就一定有阴离子
B.能使酚酞变红的溶液一定是碱溶液
C.金属在合金中是0价
D.把少量的Cl2气通入到FeBr2溶液中,发生的反应方程式为:Cl2+2Br-=Br2+2Cl-
C
5.二氧化锰与浓盐酸作用制氯气的反应中,作为还原剂的HCl和参加反应的HCl物质的量之比是 ( )
A.1∶1 B.2∶1
C.1∶2 D.任意比
C
6、用1mol MnO2和含HCl为4mol浓盐酸共热充分反应,在不考虑HCl挥发的情况下,得到的氯气物质的量是( )
A 等于2 mol B 等于1 mol
C 小于1 mol D 大于1 mol
C
若将“含HCl为4mol浓盐酸”改为“足量的浓盐酸”结果又怎样?
7、实验室制氯气时有如下操作,操作顺序正确的是 ( )
①连接好装置,检查气密性
②缓缓加热,加快反应,使气体均匀逸出
③在烧瓶中加入二氧化锰粉末
④往分液漏斗中加入浓盐酸,再缓缓滴入烧瓶中
⑤用向上排空气法收集氯气,尾气导入氢氧化钠溶液中
A ①②③④⑤ B ④③①②⑤
C ①③④②⑤ D ①④③②⑤
C
(四)氯离子的检验
1.实验4-6
2.原理:Ag+ + Cl- = AgCl↓
3.方法:
待检液 白色沉淀
稀硝酸酸化
硝酸银溶液
取少量溶液于试管中,加入过量Ba(NO3)2溶液,静置,向上层清液中滴加几滴AgNO3溶液,若生成白色沉淀,证明原溶液存在Cl-。
能力提升:若溶液中存在大量SO42-,检验Cl-时如何排除干扰?
成盐元素 卤素
在元素周期表中,与氯元素处于同一纵行---第ⅦA族的元素还有氟(F)、溴(Br)、碘(Ⅰ)、砹(At,人工合成元素)。
科学视野
氟原子
氯原子
溴原子
碘原子
①最外层电子都有7个电子,易得到一个电子;
③都能与Na、K、Ca、Mg等金属化合生成盐,所以统称为卤素(成盐元素之意)。
②都是典型的非金属元素;
卤素单质氧化性的比较:
随元素原子核电荷数的增大,原子半径增大,得电子能力减弱,故氧化性减弱
氧化性: F2 Cl2 Br2 I2
F
Cl
Br
I
还原性: F-(五) 卤素单质及其化合物的用途
1.碘单质被用于制作碘酊(碘酒)
用于一般皮肤消毒和手术前手术局部皮肤的消毒 。
2.溴化银(AgBr)被用于制作感光胶卷和变色玻璃
碘化银(AgⅠ)被用于人工降雨
1.已知反应:Cl﹣+ClO﹣+2H+=Cl2↑+H2O,下列说法正确的是( )
A.符合该离子方程式的化学方程式可以是: HClO+HCl = Cl2↑+H2O
B.在无色碱性溶液中:ClO-、Cl﹣、Fe2+、Na+能大量共存
C.洁厕灵(主要成分是盐酸)和84消毒液(主要成分是次氯酸钠)混合使用效果更好
D.Cl﹣、ClO﹣在酸性溶液中不能大量共存
D
2、将一个盛满Cl2的试管倒立在水槽中,当日光照射一段时间后,试管中最后剩余的气体约占试管容积的( )
A. 2/3
B. 1/2
C. 1/3
D. 1/4
B
3.某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3- 的浓度之比为1∶1,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为( )
A.4∶1 B.11∶3
C.3∶1 D.21∶5
C
4、(1)配平:
--KMnO4+ ----HCl(浓)=----KCl+--MnCl2+---Cl2 ↑+—
(2)在以上反应中,还原剂是 ,被还原的元素是 ,还原产物是 。
(3)若生成2mol的Cl2气体,总共转移的电子数是 mol。
(4)用单(双)线桥法标明电子转移方向和数目
2
16
2
2
5
8H2O
HCl
Mn
MnCl2
4mol
富集在海水中的元素—氯
1.存在:主要以NaCl的形式存在于海水和陆地的盐矿中。
+17
2
8
7
Cl
2.原子结构:
如果将海水中的盐类全部提取出来,铺在地球的陆地上,可以使陆地平均升高150米
一、氯元素
+e-
+17
2
8
8
Cl-
得电子能力强→氧化性强
化合价:-1,0,+1,+3, +5, +7
最稳定
二、活泼的黄绿色气体—氯气(Cl2)
(一) Cl2的物理性质
(1)氯气是黄绿色
(2)有刺激性气味,有毒的气体
(3)易液化
(4)能溶于水(1体积水可溶解2体积氯气)
(5)密度比空气大
(二)化学性质
1、与金属反应
(1)与钠反应
现象:
剧烈燃烧,黄色火焰,生成白烟。
反应方程式:
2Na + Cl2 = 2NaCl
点燃
失2× e-
得2× e-
(2)与铁反应
现象:
剧烈燃烧,生成棕褐色的烟。
2Fe + 3Cl2 = 2FeCl3
点燃
1、比较一下Cl2和HCl的氧化性?
氧化性 Cl2 > HCl
反应方程式:
2、如果Fe过量,产物是什么?
3、把Fe插入液氯中是否反应?
Fe + 2HCl = FeCl2 + H2↑
思考:
FeCl3
不反应
6e-
(3)与铜的反应
现象:
剧烈燃烧,生成棕黄色的烟。
Cu + Cl2 = CuCl2
点燃
小结:大多数金属都能在一定条件下与氯气化合(Pt,Au除外),氯气是强氧化剂,变价金属与它反应一般得到高价的金属氯化物。
反应方程式:
下列各化合物不能由两种单质直接化合制取的
是( )
A. FeCl3 B. CuCl2
C. AlCl3 D. FeCl2
D
H2+Cl2 2HCl
点燃或光照
2、与非金属反应
安静的燃烧,火焰呈苍白色, 瓶口有白雾产生。
(1)氢气在氯气中燃烧
现象:
(2)氢气与氯气的混合气体在强光下
现 象:
释放大量的热,发生爆炸。
反应方程式:
通过以上实验,你对燃烧条件和本质有什么新的认识?
①燃烧不一定有氧气参加,物质并不是只有在氧气中才可以燃烧。
②燃烧的本质是氧化还原反应,所以
发光发热的剧烈的氧化还原反应都称为燃烧。
氯气可溶于水,请思考氯气仅是溶于水,还是会和水反应呢?
如何设计实验证明猜想?
想一想:
氯离子的检验:
氢离子的检验:
(1)pH试纸
(2)紫色石蕊试液
(3)活泼金属
(4)NaCO3溶液,澄清石灰水
加入硝酸酸化的AgNO3溶液
将红色纸条放入盛有新制氯水的试管中,震荡,观察现象。
探究氯气和氯水的漂白作用:
氯水中有的漂白性物质到底是什么呢?
如何设计实验证明猜想?
实验探究:
氯水具漂白性
将干燥的红色纸条和用蒸馏水湿润的红色纸条分别放入盛有氯气的的广口瓶中,塞紧瓶塞,观察现象。
3、与水反应
氯气可溶于水,其溶液称为氯水。常温下部分Cl2与水发生反应,生成盐酸和次氯酸。
Cl2 + H2O HCl + HClO
次氯酸
得到e-
0
-1
+1
失去e-
注意:该反应是Cl2发生的自身氧化还原反应——歧化反应。
HClO的性质和用途:
(1)弱酸性:酸性比碳酸还弱
光照
(3)强氧化性:用于漂白、杀菌消毒
(2)不稳定性:
2HClO = 2HCl + O2↑
小结:干燥的氯气没有漂白作用。氯水或湿润的氯气中,因为生成次氯酸才具有漂白性。
拓展:
1.氯水的性质
新制氯水呈浅黄绿色、有刺激性气味,属混合物,其所含的多种微粒使氯水的化学性质表现出多重性。
2.氯水的成分
Cl2溶于水:Cl2+H2O??H++Cl-+HClO
(三分四离)
思考:
液氯、新制氯水、久制氯水的区别?
①液氯是纯净物,只含Cl2分子;
②新制氯水是混合物,含有三分子、四离子:H2O、Cl2、HClO、H+ 、 Cl-、ClO-、OH-
③久制氯水是混合物,含一分子、三离子:
H2O 、H+ 、 Cl- 、OH- (就是盐酸)
总结:氯水中的各种粒子如何检验
微粒 检验方法 现 象
H2O
H+
Cl-
HClO
Cl2
无水CuSO4粉末
粉末变蓝
加CaCO3粉末
有气泡生成
加AgNO3溶液
有色纸条
纸条褪色
观察颜色
浅黄绿色
有白色的沉淀生成
1、下列说法正确的是: ( )
A、氯气以液态形式存在时可称作氯水或液氯
B、Cl2有毒,Cl-也有毒
C 、Cl2和Cl-都是黄绿色
D 、红热的铜丝在氯气中燃烧,生成棕黄色的 固体CuCl2
D
2、下列现象不属于H2在Cl2中燃烧现象的是( )
A.苍白色火焰 B.瓶口有白雾
C.集气瓶内气体颜色变浅 D.爆炸
D
3.下列有关液氯和氯水两种液体的实验描述正确的是( )
A.两种液体都可以使干燥的红布条褪色
B.两种液体都可以使干燥的蓝色石蕊试纸变红 C.用这两种液体都可以给自来水消毒
D.分别向这两种液体中投入几颗金属锌粒均有气泡产生
C
氯水性质具有多样性,试指出下列各现象主要是何种微粒所表现出来的性质:
①氯水呈浅黄绿色______
②滴加AgNO3溶液后生成白色沉淀___
③往含有Fe2+溶液中滴加KSCN溶液无明显现象,再滴加氯水后呈红色___。
④ 使湿润的紫色石蕊试纸先变红后褪色_____
Cl2
Cl2
Cl-
H+ HClO
设计实验验证起漂白作用的是HClO
氯水的酸性和漂白性
往含有酚酞的NaOH溶液中滴加氯水,溶液红色褪去,有两种可能:
通过向褪色后的溶液中再加入NaOH溶液或者酚酞,看溶液是否重新变成红色来验证溶液褪色的原因。
向新制氯水中滴入石蕊试液,溶液先变红色(酸性),后来颜色又褪去,是由于HClO的强氧化性将色素氧化使之颜色褪去(漂白性)。
①氯水中含有强氧化性的HClO,它的漂白作用能使红色褪去,②氯水中含有H+,能中和OH-,使酚酞褪色。
如何验证是哪种原因呢?
4、与碱反应
Cl2 + 2NaOH = NaCl + NaClO + H2O
2Cl2 + 2 Ca(OH)2 = CaCl2+ Ca(ClO)2 + 2H2O
拓展: 发洪水的地方,经常发放漂白粉和消毒液对被污染的水进行杀菌消毒。你知道它们的有效成分是什么吗?
漂白液: NaClO 漂白粉: Ca(ClO)2
漂白粉的漂白原理:
Ca(ClO)2+ CO2 (少) + H2O =CaCO3↓+2HClO
②怎样保存漂白粉?
密封,保存于干燥处。
①漂白粉露天放置失效原因?
Ca(ClO)2+ CO2 (少) + H2O =CaCO3↓+2HClO
2HClO = 2HCl + O2↑
光照
思考:
③用次氯酸盐杀菌的好处是什么?
次氯酸盐比次氯酸稳定,容易储运且杀菌效果持久。
氯水滴加 溶液 反应离子方程式
NaBr溶液 (或HBr溶液) 2Br -+Cl2=2Cl -+Br2
FeCl2溶液 2Fe2++Cl2=2Fe3++2Cl-
KI溶液 (或HI溶液) 2I-+Cl2=2Cl-+I2
K2S溶液 (或H2S溶液) S2-+Cl2=2Cl-+S↓
Na2SO3溶液 (或SO2) SO32-+Cl2+H2O=SO42-+2H++Cl-
SO2+ Cl2+2H2O=SO42-+2Cl-+4H+
5、与还原性物质反应
学习指导
请同学们用3分钟时间认真阅读课本82-83页的[科学史话]。注意以下问题:
完成[思考与交流],
(试写出Cl2的实验室制法的化学方程式)
MnO2 + 4HCl (浓)== MnCl2 +2H2O +Cl2 ↑
(三)氯气的实验室制法:
1. 是氧化剂, 是还原剂
2.浓盐酸表现出 性和 性
3.氧化剂与还原剂的物质的量之比为
MnO2
HCl
酸
还原
1:2
一套完整的气体实验装置应该包括哪些装置?
尾气处理装置
气体净化装置
气体发生装置
气体收集
或性质实验装置
1、发生装置
液固(液)加热型
固液不加热型
固固加热型
HCl气体
水蒸气
饱和食盐水
浓硫酸
浓 H2SO4
饱和食盐水
2、净化装置
a. 向上排空气法
b. 排饱和食盐水法
3、收集装置
4、尾气吸收
Cl2 + 2NaOH = NaCl + NaClO + H2O
尾气有毒或污染空气,常用点燃或用试剂吸收
氯气的实验室制法
MnO2+4HCl(浓) = MnCl2 +Cl2↑+2H2O
加热
拓展:哪种物质能用如图装置制备氯气(简易制法)
KMnO4+ HCl(浓)=
Ca(ClO)2+ HCl (浓) =
K2Cr2O7+14HCl(浓)= 2KCl +2CrCl3+3Cl2↑+7H2O
?
2KCl+2MnCl2+8H2O+5Cl2 ↑
CaCl2+2Cl2↑+2H2O
2
16
4
1、能使湿润的淀粉碘化钾试纸变蓝的化学试剂是( )
① 溴水 ② 氯水 ③ 碘酒 ④ 氯化钾
⑤ 酸性高锰酸钾
A ①②③ B ①②④
C ③④⑤ D ①②③⑤
D
2:某强酸性溶液中可能存在NO3- 、I-、Cl-、Fe3+中的一种或几种。向该溶液中加入溴水后,溴被还原,由此推断该溶液中( )
A.不含NO3- ,含Fe3+
B.含有NO3- 、I-、Cl-
C.含I-,但不能确定是否含Cl-
D.含有Fe3+
C
① ② ③ ④
A 黄绿色 橙色 蓝色 白色
B 无色 橙色 紫色 白色
C 黄绿色 橙色 蓝色 无色
D 黄绿色 无色 紫色 白色
3.已知常温下氯酸钾与浓盐酸反应放出氯气,现按下图进行卤素的性质实验。玻璃管内装有分别滴有不同溶液的白色棉球,反应一段时间后,对图中指定部位颜色描述正确的是
A
4.下列说法正确的是( )
一种物质有阳离子就一定有阴离子
B.能使酚酞变红的溶液一定是碱溶液
C.金属在合金中是0价
D.把少量的Cl2气通入到FeBr2溶液中,发生的反应方程式为:Cl2+2Br-=Br2+2Cl-
C
5.二氧化锰与浓盐酸作用制氯气的反应中,作为还原剂的HCl和参加反应的HCl物质的量之比是 ( )
A.1∶1 B.2∶1
C.1∶2 D.任意比
C
6、用1mol MnO2和含HCl为4mol浓盐酸共热充分反应,在不考虑HCl挥发的情况下,得到的氯气物质的量是( )
A 等于2 mol B 等于1 mol
C 小于1 mol D 大于1 mol
C
若将“含HCl为4mol浓盐酸”改为“足量的浓盐酸”结果又怎样?
7、实验室制氯气时有如下操作,操作顺序正确的是 ( )
①连接好装置,检查气密性
②缓缓加热,加快反应,使气体均匀逸出
③在烧瓶中加入二氧化锰粉末
④往分液漏斗中加入浓盐酸,再缓缓滴入烧瓶中
⑤用向上排空气法收集氯气,尾气导入氢氧化钠溶液中
A ①②③④⑤ B ④③①②⑤
C ①③④②⑤ D ①④③②⑤
C
(四)氯离子的检验
1.实验4-6
2.原理:Ag+ + Cl- = AgCl↓
3.方法:
待检液 白色沉淀
稀硝酸酸化
硝酸银溶液
取少量溶液于试管中,加入过量Ba(NO3)2溶液,静置,向上层清液中滴加几滴AgNO3溶液,若生成白色沉淀,证明原溶液存在Cl-。
能力提升:若溶液中存在大量SO42-,检验Cl-时如何排除干扰?
成盐元素 卤素
在元素周期表中,与氯元素处于同一纵行---第ⅦA族的元素还有氟(F)、溴(Br)、碘(Ⅰ)、砹(At,人工合成元素)。
科学视野
氟原子
氯原子
溴原子
碘原子
①最外层电子都有7个电子,易得到一个电子;
③都能与Na、K、Ca、Mg等金属化合生成盐,所以统称为卤素(成盐元素之意)。
②都是典型的非金属元素;
卤素单质氧化性的比较:
随元素原子核电荷数的增大,原子半径增大,得电子能力减弱,故氧化性减弱
氧化性: F2 Cl2 Br2 I2
F
Cl
Br
I
还原性: F-
1.碘单质被用于制作碘酊(碘酒)
用于一般皮肤消毒和手术前手术局部皮肤的消毒 。
2.溴化银(AgBr)被用于制作感光胶卷和变色玻璃
碘化银(AgⅠ)被用于人工降雨
1.已知反应:Cl﹣+ClO﹣+2H+=Cl2↑+H2O,下列说法正确的是( )
A.符合该离子方程式的化学方程式可以是: HClO+HCl = Cl2↑+H2O
B.在无色碱性溶液中:ClO-、Cl﹣、Fe2+、Na+能大量共存
C.洁厕灵(主要成分是盐酸)和84消毒液(主要成分是次氯酸钠)混合使用效果更好
D.Cl﹣、ClO﹣在酸性溶液中不能大量共存
D
2、将一个盛满Cl2的试管倒立在水槽中,当日光照射一段时间后,试管中最后剩余的气体约占试管容积的( )
A. 2/3
B. 1/2
C. 1/3
D. 1/4
B
3.某温度下,将Cl2通入NaOH溶液中,反应得到NaCl、NaClO、NaClO3的混合液,经测定ClO-与ClO3- 的浓度之比为1∶1,则Cl2与NaOH溶液反应时被还原的氯元素与被氧化的氯元素的物质的量之比为( )
A.4∶1 B.11∶3
C.3∶1 D.21∶5
C
4、(1)配平:
--KMnO4+ ----HCl(浓)=----KCl+--MnCl2+---Cl2 ↑+—
(2)在以上反应中,还原剂是 ,被还原的元素是 ,还原产物是 。
(3)若生成2mol的Cl2气体,总共转移的电子数是 mol。
(4)用单(双)线桥法标明电子转移方向和数目
2
16
2
2
5
8H2O
HCl
Mn
MnCl2
4mol
