1.1反应热课件2021-2022学年高二上学期化学人教版(2019)选择性必修1(35张ppt)
文档属性
| 名称 | 1.1反应热课件2021-2022学年高二上学期化学人教版(2019)选择性必修1(35张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-20 08:27:30 | ||
图片预览











文档简介
(共35张PPT)
第一节 反应热
回顾旧知
化学反应都伴随着能量的变化,化学上把释放热量的化学反应称为放热反应,吸收热量的化学反应称为吸热反应。
常见的放热反应和吸热反应
放热反应
燃料的燃烧
酸碱中和反应
金属与酸或水的反应
物质的缓慢氧化
大多数的化合反应
吸热反应
Ba(OH)2·8H2O与NH4Cl的反应
C+CO2==== 2CO
C+H2O ==== CO + H2
以C、CO为还原剂的氧化还原反应
大多数的分解反应
高温
高温
断裂化学键吸收的总能量<形成化学键放出的总能量
放热反应
断裂化学键吸收的总能量>形成化学键放出的总能量
吸热反应
反应物的总能量>生成物的总能量
放热反应
反应物的总能量<生成物的总能量
吸热反应
一、反应热 焓变
1.反应热:在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
化学反应为什么会产生反应热?这是因为化学反应前后体系的内能(符号为U)发生了变化。为了描述等压条件下的反应热,科学上引入了一个与内能有关的物理量——焓(符号为H)。
研究表明,在等压条件下进行的化学反应(严格来说,对反应体系做功还有限定,中学阶段一般不考虑),其反应热等于反应的焓变,用符号 H表示。常用单位:kJ/mol
2.焓变
H = H生成物-H反应物
反应物
生成物
焓(H)
H = H生成物-H反应物 < 0
放热反应
反应物
生成物
焓(H)
H = H生成物-H反应物 > 0
吸热反应
例如:在25℃和101kPa下,1mol H2与1mol Cl2反应生成2mol HCl 时放出184.6 kJ的热量,则该反应的反应热为:
H = -184.6 kJ/mol
在25℃和101kPa下,1mol C(如无特别说明,C均指石墨)与1mol H2O(g)反应,生成1mol CO和1mol H2,需要吸收131.5 kJ的热量,则该反应的反应热为:
H = +131.5 kJ/mol(一般“+”号不能省略)
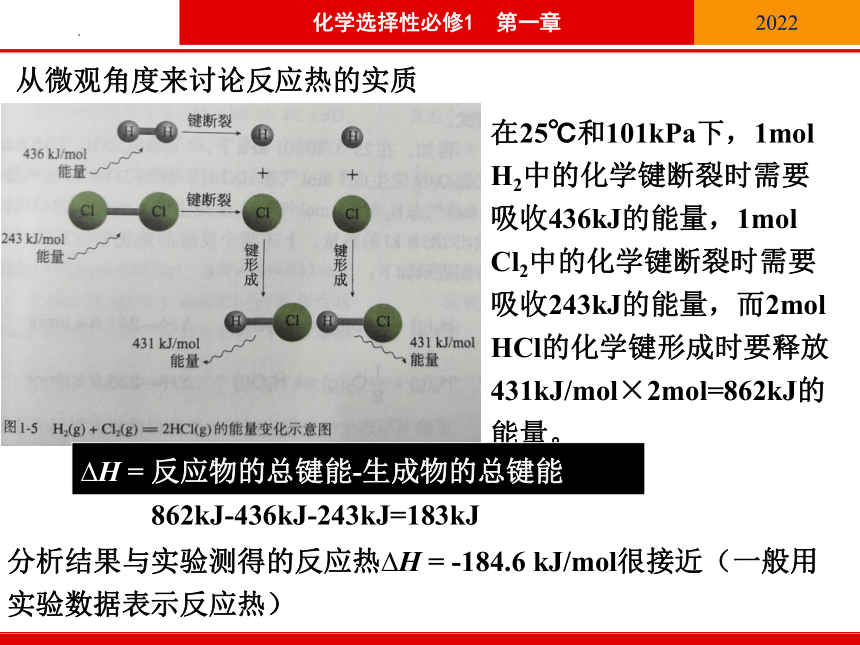
从微观角度来讨论反应热的实质
在25℃和101kPa下,1mol H2中的化学键断裂时需要吸收436kJ的能量,1mol Cl2中的化学键断裂时需要吸收243kJ的能量,而2mol HCl的化学键形成时要释放431kJ/mol×2mol=862kJ的能量。
1mol H2与1mol Cl2反应生成2mol HCl时放出
862kJ-436kJ-243kJ=183kJ
分析结果与实验测得的反应热 H = -184.6 kJ/mol很接近(一般用实验数据表示反应热)
H = 反应物的总键能-生成物的总键能
二、热化学方程式
1.概念:表明反应所释放或吸收的热量的化学方程式,叫做热化学方程式
例如:在25℃和101kPa下,1mol 气态H2与1mol气态Cl2反应生成2mol气态HCl 时放出184.6 kJ的热量,则该反应的热化学方程式为:
H2(g) + Cl2(g) = 2HCl(g) ΔH= -184.6 kJ/mol
2.书写热化学方程式时注意:
(1)需注明反应时的温度和压强。温度和压强不同,其ΔH也不同。常用的ΔH的数据一般反应都是在25℃和101kPa时的数据,因此可不特别注明。
(2)需注明反应物和生成物的聚焦状态。
固体:s 液体:l 气体:g 溶液:aq
(3)热化学方程式中各物质前的化学计量数可以是整数,也可以是分数。化学计量数不同,ΔH也不同。
H2(g) + Cl2(g) = 2HCl(g) ΔH= -184.6 kJ/mol
练习1:依据事实,写出下列反应的热化学方程式
(1)1mol CO(g)与适量O2(g)反应生成CO2,放出283kJ 的热量。
(2)H2与O2反应生成1mol水蒸气,放出241.8kJ的热量。
(3)6g C(s)与适量水蒸气反应生成CO和H2,吸收65.75kJ的热量
(1) CO(g) + 1/2O2(g) = CO2(g) ΔH=-283kJ/mol
或2CO(g) + O2(g) = 2CO2(g) ΔH=-566kJ/mol
(2)H2(g) + 1/2O2(g) = H2O(g) ΔH=-241.8kJ/mol
或2H2(g) + O2(g) = 2H2O(g) ΔH=-483.6kJ/mol
(3) C(s) + H2O(g) = CO(g) + H2(g) ΔH=+131.5kJ/mol
练习2:在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量称为键能。已知下列化学键的键能:
化学键 H—H O=O H—O
键能kJ/mol a b c
三、燃烧热
1.概念:在101kPa时,1mol纯物质完全燃烧生成指定产物时所放出的热量,叫做该物质的燃烧热。
(2)生成指定产物:碳元素变为CO2(g),氢元素变为H2O(l),硫元素变为SO2(g),氮元素变为N2(g)等。
例如,实验测得在25℃和101kPa时,1mol H2完全燃烧生成液态水,放出285.8kJ的热量,这就是H2的燃烧热。
则表示H2的燃烧热热化学方程式为:
2.注意:
(1)表示燃烧热时,燃烧的物质为纯物质且为1mol,即热化学方程式中燃料的系数为1 。
H2(g) + 1/2O2(g) = H2O(l) ΔH=-285.8kJ/mol
BE
1.概念:在稀溶液中,强酸与强碱中和生成1mol H2O时所放出的热量,叫做中和热。
四、中和热
练习:下列可表示中和热的热化学方程式有( )
A.1/2H2SO4(aq) + 1/2Ba(OH)2(aq) = 1/2BaSO4(s) + H2O(l) ΔH1
B.HNO3(aq) + NaOH(aq) = NaNO3(aq) + H2O(l) ΔH2
C.CH3COOH(aq) + KOH(aq) = CH3COONa(aq) + H2O(l) ΔH3
D.H2SO4(aq) + Ca(OH)2(aq) = CaSO4(aq) + 2H2O(l) ΔH4
B
1.概念:在稀溶液中,强酸与强碱中和生成1mol H2O时所放出的热量,叫做中和热。
四、中和热
(2)生成的水必须是1mol,即热化学方程式中水的系数为1。
2.注意:
(1)必须是强酸与强碱反应,且为稀溶液。
(3)中和热的热化学方程式可写为:
H+(aq) + OH-(aq) = H2O(l) ΔH
2、实验原理
利用反应放出的热量使溶液温度升高,通过实验测量数据,计算出反应热。先测出盐酸和氢氧化钠的起始温度,求其平均温度t1,两溶液混合充分反应后,读取混合液温度t2。
五、中和反应反应热的测定
1、实验目的
了解中和热测定的基本原理和测定方法,加深理解中和反应是放热反应。
反应放出的热量Q=cmΔt,再进一步计算中和热
3、实验用品
外壳、隔热层、内筒、杯盖、温度计、玻璃搅拌器;0.50mol/L盐酸、0.55mol/L NaOH溶液等。
4、实验步骤
(1)反应物温度的测量。
①用量筒量取50mL 0.50mol/L盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度(数据填入下表)。用水把温度计上的酸冲洗干净,擦干备用。
②用另一个量筒量取50mL 0.55mol/L NaOH溶液,用温度计测量并记录NaOH溶液的温度(数据填入下表)。
(2)反应后体系温度的测量。
打开杯盖,将量筒内的NaOH溶液迅速倒入量热计的内筒,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌。密切关注温度变化,将最高温度记为反应后体系的温度(t2)
(3)重复上述步骤(2)至步骤(2)两次。
5、数据处理
(1)取三次测量所得温度差的平均值作为计算依据。
为了使计算简便,可以近似地认为实验所用酸、碱稀溶液的密度、比热容与水的相同,并忽略量热计的比热容,则:
①50mL 0.5mol/L盐酸的质量m1=50g,50mL 0.55mol/L氢氧化钠溶液的质量m2=50g;②反应后生成的溶液的比热容c=4.18J/(g·℃),50mL 0.5mol/L盐酸与50mL 0.55mol/L氢氧化钠溶液发生中和反应放出的热量为:Q=(m1+m2)×c×(t2-t1)=0.418(t2-t1)kJ。
①50mL 0.5mol/L盐酸和50mL 0.55mol/L氢氧化钠溶液的密度都是1g·cm-3,则盐酸质量m1=50g,氢氧化钠质量m2=50g。近似认为混合溶液的比热容c=4.18J/(g·℃),所以中和反应放出的热量是:Q=(m1+m2)×c×(t2-t1)=0.418(t2-t1)kJ。
②又因50mL 0.5mol/L盐酸中含有0.025mol 的H+,它跟0.025 mol 的OH-发生中和反应,生成0.025mol 的水,放出热量为Q,所以:
【实验用品】大烧杯(500mL)、小烧杯(100mL)、量筒(50mL)两个、温度计、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个孔)、环形玻璃搅拌棒;0.50mol/L盐酸、0.55mol/L NaOH溶液、0.50mol/L 硝酸、0.55mol/L KOH溶液。
【实验步骤】以盐酸和NaOH溶液的反应为例。
①组装绝热装置。在大烧杯底部垫上泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平;然后在大、小烧杯之间填满泡沫塑料(或纸条);再在大烧杯上用泡沫塑料板或硬纸板作盖板(如右图所示)。
②向小烧杯中加入0.50mol/L的盐酸50mL,并用温度计测量盐酸的温度,然后把温度计上的酸用水冲洗干净。
③在另一小烧杯中加入50mL 0.55mol/L的NaOH溶液,并用温度计测量 NaOH溶液的温度。
④把温度计和环形玻璃搅拌棒放入盛有盐酸的小烧杯中,并把NaOH溶液一次倒入盛有盐酸的小烧杯中,用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度(为保证上述反应能充分进行,实验时可以使酸或碱略过量)。
⑤重复:重复实验两次(取测量所得数据的平均值作为计算依据)。
⑥根据数据计算中和热。
⑦可用同样的方法分别测定同体积的KOH溶液与盐酸反应,NaOH溶液与硝酸反应的中和热。
【注意事项】①作为量热的仪器装置,要尽量减少热量散失。a.其保温隔热的效果一定要好,在两烧杯缝隙一定要塞满泡沫塑料(或纸条);b.小烧杯杯口与大烧杯杯口相平;c.泡沫塑料板上的两个小孔要恰好使温度计和环形玻璃搅拌棒通过;d.可改用保温杯来做,也可用块状聚苯乙烯泡沫塑料制成与小烧杯外径相近的绝缘外套来做。
②盐酸和NaOH溶液浓度的配制必须准确,NaOH溶液的浓度必须稍大于盐酸的浓度,两者的浓度均宜小不宜大,若浓度偏大,则测定结果误差较大。
③盐酸和NaOH溶液的体积必须量取准确。
④温度计的读数要准确。a.水银球部分要完全浸没在溶液中,且要稳定一段时间后再读数;b.读数时应谨慎细心,把握并读准温度且由同一个人来读;c.测量盐酸的温度后,要将温度计上的酸冲洗干净后再测量NaOH溶液的温度。
⑤实验操作要快。
思考:所测得的三个反应的中和热相同,为什么?
提示:以上三组溶液中所发生的反应均为H++OH-=H2O。由于三次实验中所用溶液的体积相同,溶液中H+和OH-的浓度也是相同的,反应温度又一样,因此三个反应的中和热也是相同的。
【例】 实验室用50mL 0.5mol/L盐酸、50mL 0.55mol/L NaOH溶液和如图所示装置进行测定中和热的实验,得到下表中的数据:
实验次数 起始温度t1/℃ 终止温度t2/℃
盐酸 NaOH溶液
1 20.2 20.3 23.7
2 20.3 20.5 23.8
3 21.5 21.6 24.9
完成下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是______,不能用铜丝搅拌棒代替环形玻璃棒的理由是______。
(2)经数据处理,t2-t1=3.4℃。则该实验测得的中和热ΔH=________[盐酸和NaOH溶液的密度按1g/cm3计算,反应后混合溶液的比热容(C)按4.18J/(g·℃)计算]。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1和ΔH的关系为:ΔH1________(填“<”“>”或“=”)ΔH,理由是________。
[解析] (1)对于本实验,让氢氧化钠和盐酸尽可能地完全反应是减小误差的一个方面,所以实验时用环形玻璃棒上下搅动(以防将温度计损坏);做好保温工作是减小误差的另一个重要方面,所以选用铜丝搅拌棒会散热。
(2)ΔH=-[100g×4.18×10-3kJ/(g·℃)×3.4℃]÷0.025mol≈-56.8kJ/mol。
(3)因为弱电解质的电离过程是吸热的,将NaOH溶液改为相同体积、相同浓度的氨水后反应放出的热量减少,所以ΔH1>ΔH。
[答案] (1)上下搅动(或轻轻搅动);铜传热快,热量损失大 (2)-56.8kJ/mol (3)>;NH3·H2O电离吸热
【例2】 某些化学键的键能如下表(kJ·mol-1)
(1)1mol H2在2mol Cl2中燃烧,放出热量________kJ。
(2)在一定条件下,1mol H2与足量的Cl2、Br2、I2分别反应,放出热量由多到少的顺序是________。
a.Cl2>Br2>I2 b.I2>Br2>Cl2
预测1mol H2在足量F2中燃烧比在Cl2中放热________。
键 H—H Br—Br I—I Cl—Cl H—Cl H—I H—Br
键能 436 193 151 247 431 299 356
练习:下列反应热可表示中和热的有( )
A.含1molH2SO4的稀硫酸与足量盐酸反应 ΔH1
B.HNO3(aq) + NaOH(aq) = NaNO3(aq) + H2O(l) ΔH2
C.CH3COOH(aq) + KOH(aq) = CH3COONa(aq) + H2O(l) ΔH3
D.H2SO4(aq) + Ca(OH)2(aq) = CaSO4(aq) + 2H2O(l) ΔH4
B
第一节 反应热
回顾旧知
化学反应都伴随着能量的变化,化学上把释放热量的化学反应称为放热反应,吸收热量的化学反应称为吸热反应。
常见的放热反应和吸热反应
放热反应
燃料的燃烧
酸碱中和反应
金属与酸或水的反应
物质的缓慢氧化
大多数的化合反应
吸热反应
Ba(OH)2·8H2O与NH4Cl的反应
C+CO2==== 2CO
C+H2O ==== CO + H2
以C、CO为还原剂的氧化还原反应
大多数的分解反应
高温
高温
断裂化学键吸收的总能量<形成化学键放出的总能量
放热反应
断裂化学键吸收的总能量>形成化学键放出的总能量
吸热反应
反应物的总能量>生成物的总能量
放热反应
反应物的总能量<生成物的总能量
吸热反应
一、反应热 焓变
1.反应热:在等温条件下,化学反应体系向环境释放或从环境吸收的热量,称为化学反应的热效应,简称反应热。
化学反应为什么会产生反应热?这是因为化学反应前后体系的内能(符号为U)发生了变化。为了描述等压条件下的反应热,科学上引入了一个与内能有关的物理量——焓(符号为H)。
研究表明,在等压条件下进行的化学反应(严格来说,对反应体系做功还有限定,中学阶段一般不考虑),其反应热等于反应的焓变,用符号 H表示。常用单位:kJ/mol
2.焓变
H = H生成物-H反应物
反应物
生成物
焓(H)
H = H生成物-H反应物 < 0
放热反应
反应物
生成物
焓(H)
H = H生成物-H反应物 > 0
吸热反应
例如:在25℃和101kPa下,1mol H2与1mol Cl2反应生成2mol HCl 时放出184.6 kJ的热量,则该反应的反应热为:
H = -184.6 kJ/mol
在25℃和101kPa下,1mol C(如无特别说明,C均指石墨)与1mol H2O(g)反应,生成1mol CO和1mol H2,需要吸收131.5 kJ的热量,则该反应的反应热为:
H = +131.5 kJ/mol(一般“+”号不能省略)
从微观角度来讨论反应热的实质
在25℃和101kPa下,1mol H2中的化学键断裂时需要吸收436kJ的能量,1mol Cl2中的化学键断裂时需要吸收243kJ的能量,而2mol HCl的化学键形成时要释放431kJ/mol×2mol=862kJ的能量。
1mol H2与1mol Cl2反应生成2mol HCl时放出
862kJ-436kJ-243kJ=183kJ
分析结果与实验测得的反应热 H = -184.6 kJ/mol很接近(一般用实验数据表示反应热)
H = 反应物的总键能-生成物的总键能
二、热化学方程式
1.概念:表明反应所释放或吸收的热量的化学方程式,叫做热化学方程式
例如:在25℃和101kPa下,1mol 气态H2与1mol气态Cl2反应生成2mol气态HCl 时放出184.6 kJ的热量,则该反应的热化学方程式为:
H2(g) + Cl2(g) = 2HCl(g) ΔH= -184.6 kJ/mol
2.书写热化学方程式时注意:
(1)需注明反应时的温度和压强。温度和压强不同,其ΔH也不同。常用的ΔH的数据一般反应都是在25℃和101kPa时的数据,因此可不特别注明。
(2)需注明反应物和生成物的聚焦状态。
固体:s 液体:l 气体:g 溶液:aq
(3)热化学方程式中各物质前的化学计量数可以是整数,也可以是分数。化学计量数不同,ΔH也不同。
H2(g) + Cl2(g) = 2HCl(g) ΔH= -184.6 kJ/mol
练习1:依据事实,写出下列反应的热化学方程式
(1)1mol CO(g)与适量O2(g)反应生成CO2,放出283kJ 的热量。
(2)H2与O2反应生成1mol水蒸气,放出241.8kJ的热量。
(3)6g C(s)与适量水蒸气反应生成CO和H2,吸收65.75kJ的热量
(1) CO(g) + 1/2O2(g) = CO2(g) ΔH=-283kJ/mol
或2CO(g) + O2(g) = 2CO2(g) ΔH=-566kJ/mol
(2)H2(g) + 1/2O2(g) = H2O(g) ΔH=-241.8kJ/mol
或2H2(g) + O2(g) = 2H2O(g) ΔH=-483.6kJ/mol
(3) C(s) + H2O(g) = CO(g) + H2(g) ΔH=+131.5kJ/mol
练习2:在标准状况下,将1mol气态分子AB(g)解离为气态原子A(g),B(g)所需的能量称为键能。已知下列化学键的键能:
化学键 H—H O=O H—O
键能kJ/mol a b c
三、燃烧热
1.概念:在101kPa时,1mol纯物质完全燃烧生成指定产物时所放出的热量,叫做该物质的燃烧热。
(2)生成指定产物:碳元素变为CO2(g),氢元素变为H2O(l),硫元素变为SO2(g),氮元素变为N2(g)等。
例如,实验测得在25℃和101kPa时,1mol H2完全燃烧生成液态水,放出285.8kJ的热量,这就是H2的燃烧热。
则表示H2的燃烧热热化学方程式为:
2.注意:
(1)表示燃烧热时,燃烧的物质为纯物质且为1mol,即热化学方程式中燃料的系数为1 。
H2(g) + 1/2O2(g) = H2O(l) ΔH=-285.8kJ/mol
BE
1.概念:在稀溶液中,强酸与强碱中和生成1mol H2O时所放出的热量,叫做中和热。
四、中和热
练习:下列可表示中和热的热化学方程式有( )
A.1/2H2SO4(aq) + 1/2Ba(OH)2(aq) = 1/2BaSO4(s) + H2O(l) ΔH1
B.HNO3(aq) + NaOH(aq) = NaNO3(aq) + H2O(l) ΔH2
C.CH3COOH(aq) + KOH(aq) = CH3COONa(aq) + H2O(l) ΔH3
D.H2SO4(aq) + Ca(OH)2(aq) = CaSO4(aq) + 2H2O(l) ΔH4
B
1.概念:在稀溶液中,强酸与强碱中和生成1mol H2O时所放出的热量,叫做中和热。
四、中和热
(2)生成的水必须是1mol,即热化学方程式中水的系数为1。
2.注意:
(1)必须是强酸与强碱反应,且为稀溶液。
(3)中和热的热化学方程式可写为:
H+(aq) + OH-(aq) = H2O(l) ΔH
2、实验原理
利用反应放出的热量使溶液温度升高,通过实验测量数据,计算出反应热。先测出盐酸和氢氧化钠的起始温度,求其平均温度t1,两溶液混合充分反应后,读取混合液温度t2。
五、中和反应反应热的测定
1、实验目的
了解中和热测定的基本原理和测定方法,加深理解中和反应是放热反应。
反应放出的热量Q=cmΔt,再进一步计算中和热
3、实验用品
外壳、隔热层、内筒、杯盖、温度计、玻璃搅拌器;0.50mol/L盐酸、0.55mol/L NaOH溶液等。
4、实验步骤
(1)反应物温度的测量。
①用量筒量取50mL 0.50mol/L盐酸,打开杯盖,倒入量热计的内筒,盖上杯盖,插入温度计,测量并记录盐酸的温度(数据填入下表)。用水把温度计上的酸冲洗干净,擦干备用。
②用另一个量筒量取50mL 0.55mol/L NaOH溶液,用温度计测量并记录NaOH溶液的温度(数据填入下表)。
(2)反应后体系温度的测量。
打开杯盖,将量筒内的NaOH溶液迅速倒入量热计的内筒,立即盖上杯盖,插入温度计,用搅拌器匀速搅拌。密切关注温度变化,将最高温度记为反应后体系的温度(t2)
(3)重复上述步骤(2)至步骤(2)两次。
5、数据处理
(1)取三次测量所得温度差的平均值作为计算依据。
为了使计算简便,可以近似地认为实验所用酸、碱稀溶液的密度、比热容与水的相同,并忽略量热计的比热容,则:
①50mL 0.5mol/L盐酸的质量m1=50g,50mL 0.55mol/L氢氧化钠溶液的质量m2=50g;②反应后生成的溶液的比热容c=4.18J/(g·℃),50mL 0.5mol/L盐酸与50mL 0.55mol/L氢氧化钠溶液发生中和反应放出的热量为:Q=(m1+m2)×c×(t2-t1)=0.418(t2-t1)kJ。
①50mL 0.5mol/L盐酸和50mL 0.55mol/L氢氧化钠溶液的密度都是1g·cm-3,则盐酸质量m1=50g,氢氧化钠质量m2=50g。近似认为混合溶液的比热容c=4.18J/(g·℃),所以中和反应放出的热量是:Q=(m1+m2)×c×(t2-t1)=0.418(t2-t1)kJ。
②又因50mL 0.5mol/L盐酸中含有0.025mol 的H+,它跟0.025 mol 的OH-发生中和反应,生成0.025mol 的水,放出热量为Q,所以:
【实验用品】大烧杯(500mL)、小烧杯(100mL)、量筒(50mL)两个、温度计、泡沫塑料或纸条、泡沫塑料板或硬纸板(中心有两个孔)、环形玻璃搅拌棒;0.50mol/L盐酸、0.55mol/L NaOH溶液、0.50mol/L 硝酸、0.55mol/L KOH溶液。
【实验步骤】以盐酸和NaOH溶液的反应为例。
①组装绝热装置。在大烧杯底部垫上泡沫塑料(或纸条),使放入的小烧杯杯口与大烧杯杯口相平;然后在大、小烧杯之间填满泡沫塑料(或纸条);再在大烧杯上用泡沫塑料板或硬纸板作盖板(如右图所示)。
②向小烧杯中加入0.50mol/L的盐酸50mL,并用温度计测量盐酸的温度,然后把温度计上的酸用水冲洗干净。
③在另一小烧杯中加入50mL 0.55mol/L的NaOH溶液,并用温度计测量 NaOH溶液的温度。
④把温度计和环形玻璃搅拌棒放入盛有盐酸的小烧杯中,并把NaOH溶液一次倒入盛有盐酸的小烧杯中,用环形玻璃搅拌棒轻轻搅动溶液,并准确读取混合溶液的最高温度(为保证上述反应能充分进行,实验时可以使酸或碱略过量)。
⑤重复:重复实验两次(取测量所得数据的平均值作为计算依据)。
⑥根据数据计算中和热。
⑦可用同样的方法分别测定同体积的KOH溶液与盐酸反应,NaOH溶液与硝酸反应的中和热。
【注意事项】①作为量热的仪器装置,要尽量减少热量散失。a.其保温隔热的效果一定要好,在两烧杯缝隙一定要塞满泡沫塑料(或纸条);b.小烧杯杯口与大烧杯杯口相平;c.泡沫塑料板上的两个小孔要恰好使温度计和环形玻璃搅拌棒通过;d.可改用保温杯来做,也可用块状聚苯乙烯泡沫塑料制成与小烧杯外径相近的绝缘外套来做。
②盐酸和NaOH溶液浓度的配制必须准确,NaOH溶液的浓度必须稍大于盐酸的浓度,两者的浓度均宜小不宜大,若浓度偏大,则测定结果误差较大。
③盐酸和NaOH溶液的体积必须量取准确。
④温度计的读数要准确。a.水银球部分要完全浸没在溶液中,且要稳定一段时间后再读数;b.读数时应谨慎细心,把握并读准温度且由同一个人来读;c.测量盐酸的温度后,要将温度计上的酸冲洗干净后再测量NaOH溶液的温度。
⑤实验操作要快。
思考:所测得的三个反应的中和热相同,为什么?
提示:以上三组溶液中所发生的反应均为H++OH-=H2O。由于三次实验中所用溶液的体积相同,溶液中H+和OH-的浓度也是相同的,反应温度又一样,因此三个反应的中和热也是相同的。
【例】 实验室用50mL 0.5mol/L盐酸、50mL 0.55mol/L NaOH溶液和如图所示装置进行测定中和热的实验,得到下表中的数据:
实验次数 起始温度t1/℃ 终止温度t2/℃
盐酸 NaOH溶液
1 20.2 20.3 23.7
2 20.3 20.5 23.8
3 21.5 21.6 24.9
完成下列问题:
(1)实验时用环形玻璃棒搅拌溶液的方法是______,不能用铜丝搅拌棒代替环形玻璃棒的理由是______。
(2)经数据处理,t2-t1=3.4℃。则该实验测得的中和热ΔH=________[盐酸和NaOH溶液的密度按1g/cm3计算,反应后混合溶液的比热容(C)按4.18J/(g·℃)计算]。
(3)若将NaOH溶液改为相同体积、相同浓度的氨水,测得中和热为ΔH1,则ΔH1和ΔH的关系为:ΔH1________(填“<”“>”或“=”)ΔH,理由是________。
[解析] (1)对于本实验,让氢氧化钠和盐酸尽可能地完全反应是减小误差的一个方面,所以实验时用环形玻璃棒上下搅动(以防将温度计损坏);做好保温工作是减小误差的另一个重要方面,所以选用铜丝搅拌棒会散热。
(2)ΔH=-[100g×4.18×10-3kJ/(g·℃)×3.4℃]÷0.025mol≈-56.8kJ/mol。
(3)因为弱电解质的电离过程是吸热的,将NaOH溶液改为相同体积、相同浓度的氨水后反应放出的热量减少,所以ΔH1>ΔH。
[答案] (1)上下搅动(或轻轻搅动);铜传热快,热量损失大 (2)-56.8kJ/mol (3)>;NH3·H2O电离吸热
【例2】 某些化学键的键能如下表(kJ·mol-1)
(1)1mol H2在2mol Cl2中燃烧,放出热量________kJ。
(2)在一定条件下,1mol H2与足量的Cl2、Br2、I2分别反应,放出热量由多到少的顺序是________。
a.Cl2>Br2>I2 b.I2>Br2>Cl2
预测1mol H2在足量F2中燃烧比在Cl2中放热________。
键 H—H Br—Br I—I Cl—Cl H—Cl H—I H—Br
键能 436 193 151 247 431 299 356
练习:下列反应热可表示中和热的有( )
A.含1molH2SO4的稀硫酸与足量盐酸反应 ΔH1
B.HNO3(aq) + NaOH(aq) = NaNO3(aq) + H2O(l) ΔH2
C.CH3COOH(aq) + KOH(aq) = CH3COONa(aq) + H2O(l) ΔH3
D.H2SO4(aq) + Ca(OH)2(aq) = CaSO4(aq) + 2H2O(l) ΔH4
B
