高中化学人教版(2019)选择性必修3第三章第二节醇酚(共57张ppt)
文档属性
| 名称 | 高中化学人教版(2019)选择性必修3第三章第二节醇酚(共57张ppt) |
|
|
| 格式 | zip | ||
| 文件大小 | 8.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-20 09:49:54 | ||
图片预览






文档简介
(共57张PPT)
【温故知新】
烃分子中的氢原子可以被羟基(-OH)取代而衍生出含羟基(-OH)的化合物,如:
C2H5OH
OH
CH2OH
CH3
OH
CH3-CH2-CH-CH3
OH
第二节 醇 酚
⒈定义:
羟基(—OH)与饱和碳原子相连的化合物称为醇。
⒉分类:
⑴根据醇分子中所含羟基的数目
一元醇:如甲醇:CH3OH;乙醇:CH3CH2OH;
二元醇:含两个羟基。如乙二醇:
CH2OH
CH2OH
多元醇:含多个羟基。如丙三醇:
CH2OH
CH2OH
CHOH
一、醇
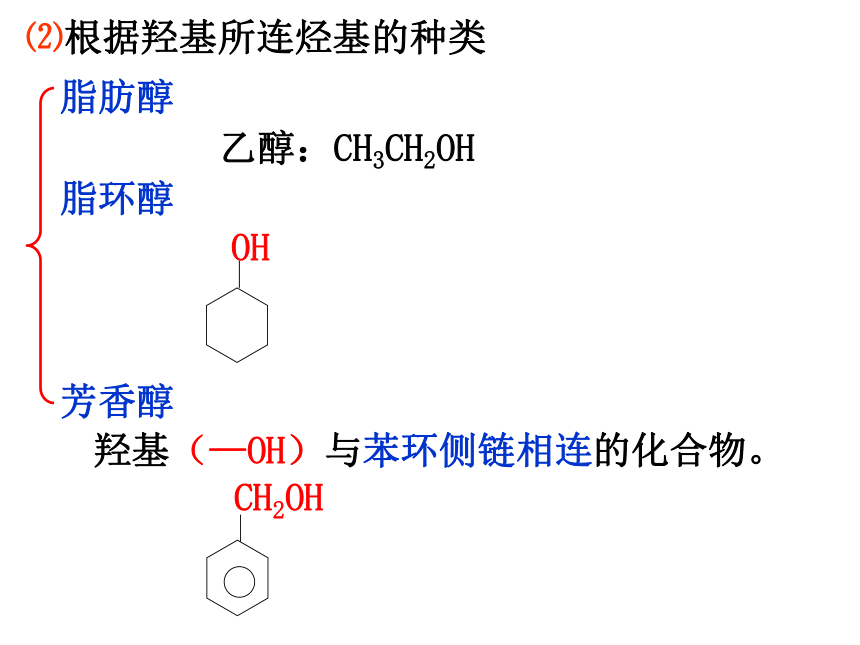
⑵根据羟基所连烃基的种类
脂肪醇
脂环醇
芳香醇
OH
CH2OH
羟基(—OH)与苯环侧链相连的化合物。
乙醇:CH3CH2OH
乙醇:CH3CH2OH
饱和醇
不饱和醇
丙烯醇:CH2=CHCH2OH
⑵根据羟基所连烃基是否饱和
由烷烃所衍生的一元醇叫做饱和一元醇,通式:CnH2n+1OH,可简写为:R-OH
甲醇(Methanol)又称羟基甲烷,是结构最为简单的饱和一元醇,因在干馏木材中首次发现,故又称“木醇”或“木精”。无色、具有挥发性的液体,易溶于水,沸点为65℃。
三种重要的醇
甲醇(CH3OH)有毒,误服会损伤视神经,甚至致人死亡。甲醇广泛应用于化工生产,用于制造甲醛和农药等,并用作有机物的萃取剂和酒精的变性剂等。也可作为车用燃料,属于可再生能源。
⒊醇的物理性质
乙二醇和丙三醇都是无色、黏稠、有甜味的液体,都易溶于水和乙醇,
是重要的化工原料。
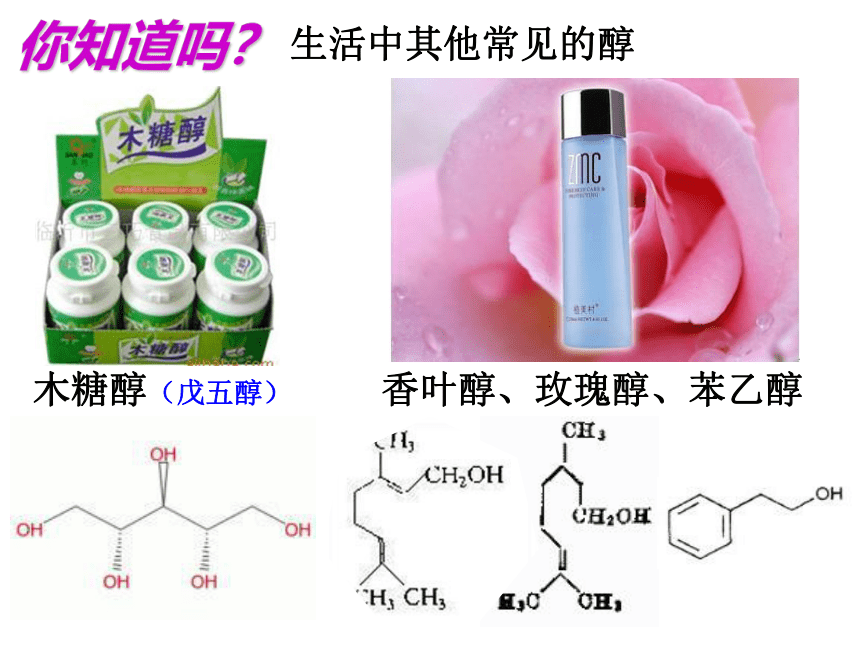
香叶醇、玫瑰醇、苯乙醇
生活中其他常见的醇
木糖醇(戊五醇)
你知道吗?
薄荷醇
menthol
这些形形色色的各种醇,除了在生活中直接应用之外,还是重要的有机合成原料。
⒊醇的物理性质
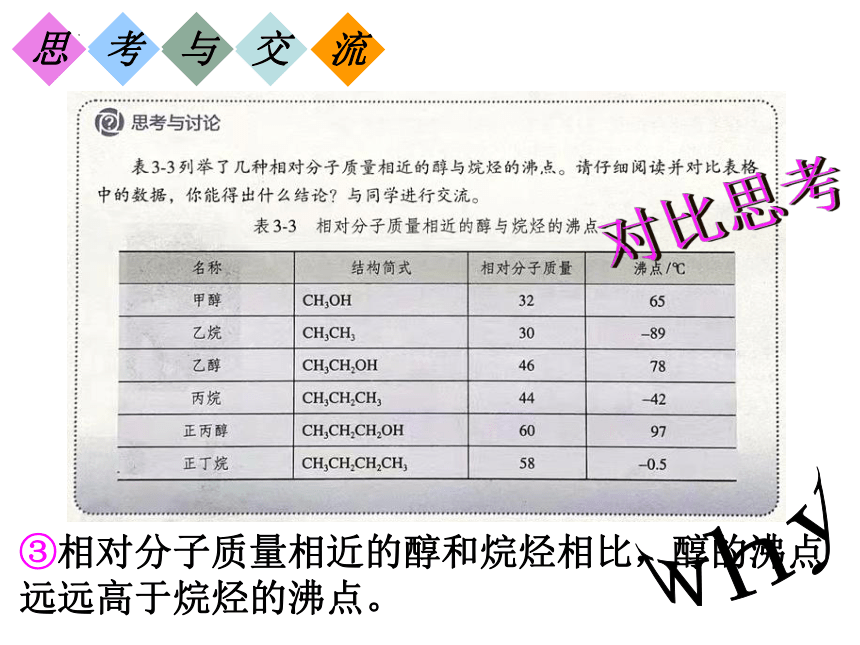
对比思考
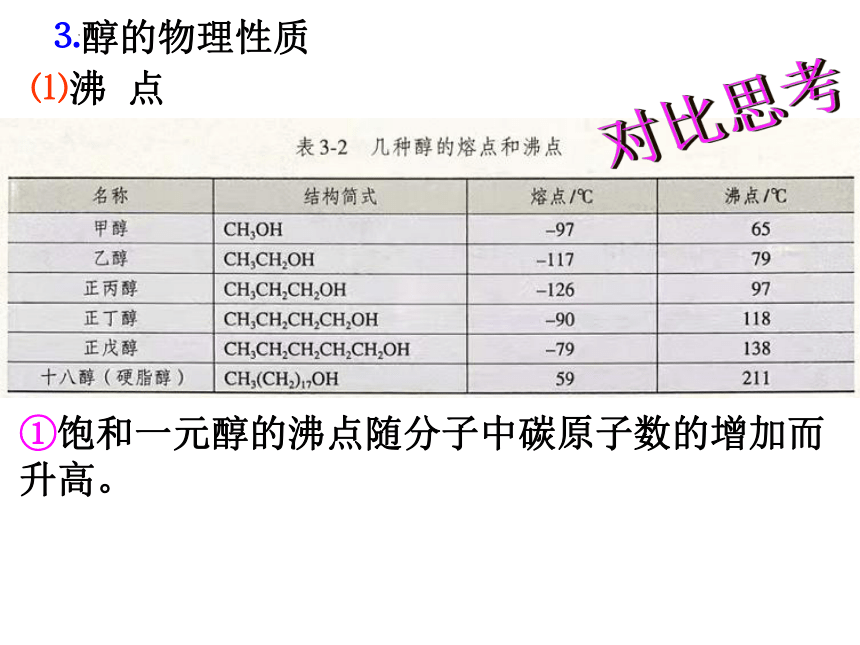
⑴沸 点
①饱和一元醇的沸点随分子中碳原子数的增加而升高。
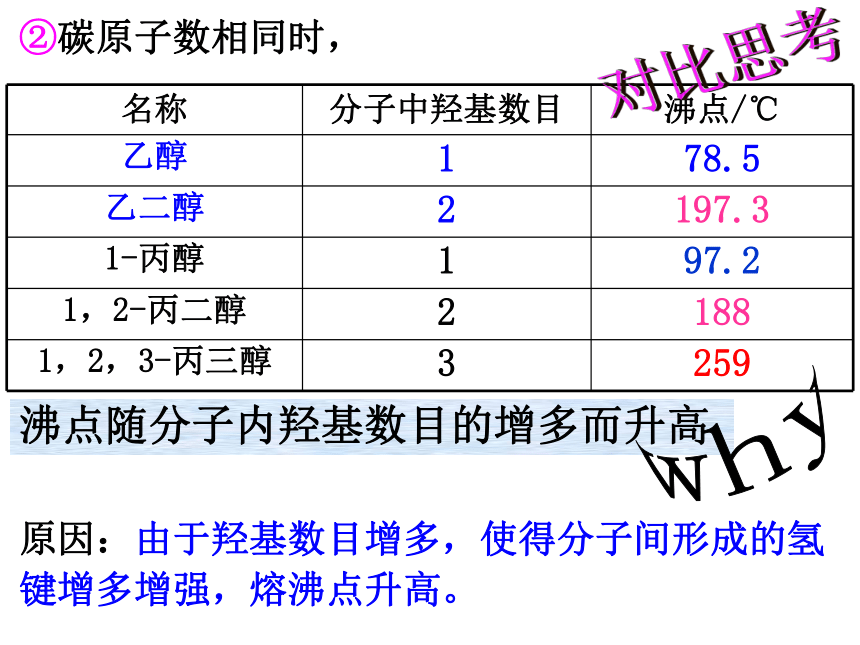
名称 分子中羟基数目 沸点/℃
乙醇 1 78.5
乙二醇 2 197.3
1-丙醇 1 97.2
1,2-丙二醇 2 188
1,2,3-丙三醇 3 259
对比思考
②碳原子数相同时,
沸点随分子内羟基数目的增多而升高
原因:由于羟基数目增多,使得分子间形成的氢键增多增强,熔沸点升高。
why
对比思考
交
与
考
思
流
why
③相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃的沸点。
R
R
R
R
R
R
O
O
O
O
O
O
H
H
H
H
H
H
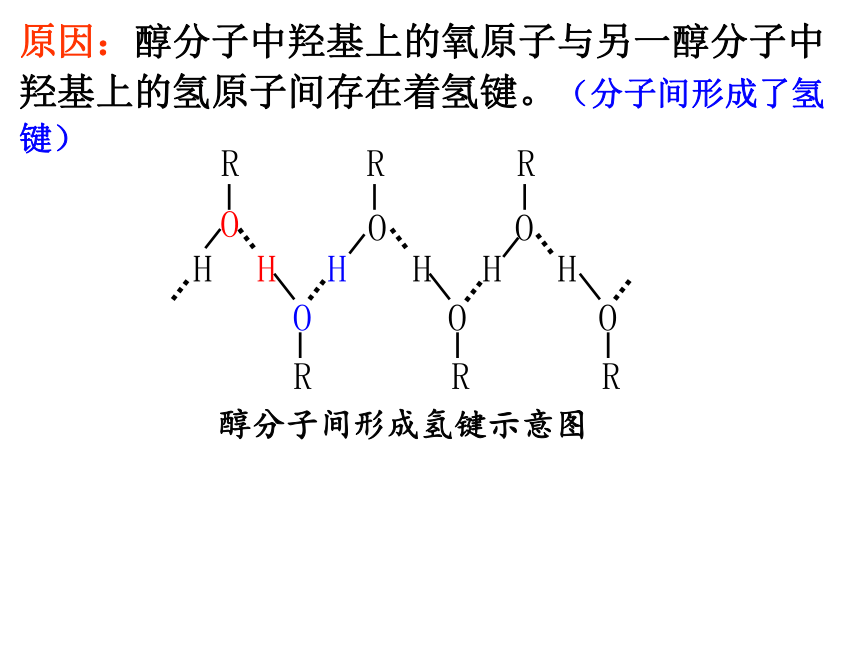
醇分子间形成氢键示意图
原因:醇分子中羟基上的氧原子与另一醇分子中羟基上的氢原子间存在着氢键。(分子间形成了氢键)
甲醇、乙醇、丙醇、乙二醇、丙三醇等低级醇均可与水以任意比例混溶,这也是因为醇分子与水分子之间形成了氢键。
醇在水中的溶解度一般随分子中碳原子数的增加而降低(原因)
⑵溶解性
⑶密 度
醇的密度比水的密度小。
⒋醇的化学性质
⑴与活泼金属(如Na)反应
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
⑶氧化反应
浓H2SO4
CH3COOH + HOC2H5 CH3COOC2H5 + H2O
⑵酯化反应
①可燃性(彻底氧化)
CH3CH2OH + 3O2 2CO2 + 2H2O
点燃
②乙醇的催化氧化
2C2H5OH + O2 2CH3CHO + 2H2O
Cu
Δ
灼烧
插入乙醇
现象:
C2H5OH + CuO CH3CHO + H2O + Cu
Δ
2C2H5OH + O2 2CH3CHO + 2H2O
Cu
Δ
2Cu + O2 = 2CuO
Δ
在酒精灯上加热时铜丝由红变黑,插入乙醇后,铜丝又由黑变红,并可闻到刺激性气味。
C
H
H
H
O
C
H
反应机理:
H H
2H C C O
H
O2
H
H
乙醇催化氧化的机理
醇催化氧化的机理
C—C—H
H
H
H
H
O—H
2H2O
两个H脱去与O结合成水
醇催化氧化的规律
本碳二氢 →氧化成 醛
本碳一氢 →氧化成 酮
本碳无氢 → 不能被催化氧化
Ⅰ.乙醇与酸性高锰酸钾溶液反应
③ 乙醇与强氧化剂反应
氧化过程可分为两个阶段:
实验现象:
CH3CH2OH
CH3CHO
CH3COOH
氧化
氧化
乙醇
乙醛
乙酸
溶液褪色
实验结论:
乙醇能被酸性高锰酸钾溶液氧化
Ⅱ.乙醇与酸性重铬酸钾溶液反应
乙醇与酸性重铬酸钾溶液的反应.mp4
氧化过程可分为两个阶段:
CH3CH2OH
CH3CHO
CH3COOH
氧化
氧化
乙醇
乙醛
乙酸
实验现象:
溶液由橙红色变为绿色
实验结论:
乙醇能被酸性重铬酸钾溶液氧化
有机物的氧化、还原反应
氧化反应:
还原反应:
CH3CH2OH→CH3CHO ?
举例:
CH3CHO→CH3COOH ?
CH3CHO→CH3CH2OH ? CH3COOH→CH3CHO ?
有机化合物分子中失去氢原子或加入氧原子的反应(失H或加O)
有机化合物分子中加入氢原子或失去氧原子的反应(加H或失O)
醇的化学性质主要由羟基官能团所决定。
C—C—O—H
H
H
H
H
H
因此,醇在发生反应时,O—H容易断裂,使羟基中的氢原子被取代,同样,C—O也易断裂,使羟基被取代或脱去,从而发生取代反应或消去反应。
在醇分子中,由于氧原子吸引电子的能力比氢原子和碳原子的强,使O—H和C—O的电子都向氧原子偏移。
羟基
C2H5—OH + H—Br C2H5Br + H2O
△
①醇可以与氢卤酸发生取代反应生成卤代烃和水。反应时醇分子中的C—O断裂,卤素原子取代了羟基而生成卤代烃。
⑷取代反应
乙醇和浓氢溴酸混合加热,生成溴乙烷:
②乙醇和浓硫酸的混合物的温度控制在140℃左右,乙醇将以另一种方式脱水,即每两个乙醇分子间会脱去一个水分子而生成乙醚。
CH3CH2O-H + HO-CH2CH3 CH3CH2OCH2CH3 + H2O
浓硫酸
140℃
乙醇的分子间脱水成醚
乙醚是一种无色、易挥发的液体,沸点34.5℃,有特殊气味,具有麻醉作用。乙醚微溶于水,易溶于有机溶剂,乙醚本身是一种优良溶剂,能溶解多种有机化合物。
醚
由两个烃基通过一个氧原子连接起来的化合物。
醚的结构可用R—O—R'来表示,R和R'都是烃基,可以相同,也可以不同。
C O C
⑴概念
⑵结构
⑶官能团
实验现象:
⑴酸性高锰酸钾溶液褪色;
⑵溴的四氯化碳溶液褪色。
实验结论:
乙醇在浓硫酸的作用下,加热到170 ℃时生成乙烯。
⑸消去反应
乙醇的消去反应.mp4
浓硫酸
CH2—CH2
H
OH
170℃
CH2 = CH2↑ + H2O
反应机理
分子内脱水
拓展延伸!
邻碳●有氢
催化剂和脱水剂
任何醇都能发生消去反应吗
拓展延伸!
乙烯的实验室制法
浓硫酸的作用是什么?
酒精与浓硫酸混合液如何配置
放入几片碎瓷片作用是什么?
为何使液体温度迅速升到170℃,不能过高或高低?
温度计的位置?
有何杂质气体?如何除去?
用排水集气法收集
混合液颜色如何变化?为什么?
吸收二氧化硫和乙醇
现象 结论
烧瓶中液体逐渐变黑
溴的CCl4溶液褪色
酸性高锰酸钾溶液褪色
浓硫酸与乙醇作用生成碳单质
乙烯与溴单质发生加成反应
乙烯被酸性高锰酸钾氧化
乙醇与浓硫酸的混合物在170 ℃和140 ℃两
种条件下反应的类型相同吗 浓硫酸在该反
应中的作用是什么
不同,前者为消去反应,后者为取代反应。前者中浓硫酸起催化剂和脱水剂的作用,后者中浓硫酸起催化剂的作用。
CH3CH2Br CH3CH2OH
反应条件
化学键断裂
化学键生成
反应产物
NaOH乙醇溶液加热
C—Br、C—H
C—O、C—H
CH2=CH2、NaBr、H2O
CH2=CH2、H2O
浓硫酸,加热至170℃
—C—C—C—
—C—C—C—
小结
反应 断键位置
与金属钠反应
Cu或Ag催化氧化
浓硫酸加热到170℃消去反应
浓硫酸加热到140℃分子间脱水
浓硫酸条件下与乙酸加热酯化反应
与HX加热反应
② ④
②
① ③
① ②
①
①
①
H---C---C--O--H
H
H
H
H
②
③
④
乙醛脱氢酶
乙醇脱氢酶
醉酒
乙醇脱氢酶
不醉酒
身边的化学
饱和一元醇的命名
⑵编碳号
⑴选主链
⑶写名称
取代基位置— 取代基名称 — 羟基位置— 母体名称
2-丁醇
3-甲基-2-戊醇
拓展延伸!
选择连有羟基的最长碳链作主链,按主链所含碳原子数称为某醇
从离羟基最近的一端开始编号;距离相同时,使取代基位次和最小
CH3-CH-CH2-CH3
OH
CH3—CH—CH—CH3
OH
CH2—CH3
CH3—CH2—CH—CH3
OH
CH3—CH—C—OH
CH3
CH2—CH
CH3
②
③
CH3—CH—CH2—OH
CH3
①
2—甲基—1—丙醇
2—丁醇
2,3—二甲基—3—戊醇
【练习】写出下列醇的名称
醇的同分异构体
⒈碳架异构;
⒉位置异构;
⒊官能团异构(相同碳原子数的芳香醇、芳香醚和酚的官能团异构)。
【练习1】写出分子式为C4H10O的所有同分异构体的结构简式
【练习2】写出分子式为C8H10O的所有同分异构体的结构简式
拓展延伸!
化学史
二、酚
羟基(—OH)与苯环直接相连而形成的化合物称为酚。
开拓视野
含有芝麻酚
鼻舒
烹饪调料
含有丁香酚
漱口水
含有麝香草酚
石炭酸皂
医院常用的“来苏水”消毒剂便是甲酚的肥皂溶液。
罂粟花
吗啡 结构简式
含有羟基连接苯环上
苯分子里只有一个氢原子被羟基取代后的生成物称作一元酚,苯酚是酚类化合物中最简单的一元酚。
-OH
⒈苯酚的结构
分子式 结构简式 官能团 空间填充模型 球棍模型
C6H6O
注意:
苯酚中所有原子不一定都在同一个平面上。
纯净的苯酚是无色的晶体,具有特殊的气味(露置在空气中因部分苯酚发生氧化而呈粉红色)。熔点:43℃。室温下在水中溶解度为9.3g,当温度高于65℃时能与水混溶,易溶于乙醇等有机溶剂。
苯酚有毒,对皮肤有腐蚀性,使用时一定要小心。如不慎沾到皮肤上,应立即用酒精冲洗,再用水冲洗。
用后拧紧瓶盖
⒉苯酚的物理性质
室温下,在水中溶解度是9.2g,温度高于65℃时,能与水混溶
探究⒈ 苯酚溶解性
科学探究
⒊苯酚的化学性质
⑴酸性
得到浑浊液体
浑浊的液体变澄清
溶液由澄清变浑浊
苯酚的酸性.mp4
苯酚表现出酸性
酸性:盐酸 >苯酚
室温下,苯酚在水中溶解度很小
由于苯酚中的羟基和苯环直接相连,苯环与羟基之间的相互作用,使酚羟基在性质上与醇羟基有显著差异。
酚羟基中的氢原子比醇羟基中的氢原子更活泼,苯酚的羟基在水溶液中能够发生部分电离,显示弱酸性。
-OH
-O-
+ H+
苯酚酸性很弱,不能使酸碱指示剂(石蕊)变色。
苯酚浊溶液
紫色石蕊试液
通入CO2后,澄清溶液又变浑浊
-ONa
+ CO2 + H2O
-OH
+ NaHCO3
苯酚具有弱酸性,俗称石炭酸,比碳酸还弱。
③
探究⒉ 苯酚与碳酸的酸性比较
科学探究
苯酚与碳酸钠的反应
-ONa
+ NaHCO3
-OH
+ Na2CO3
结论:
酸性: HCl>H2CO3>苯酚>HCO3-
因此苯酚钠与CO2、水反应时,无论CO2是否过量,均生成NaHCO3,而不能生成Na2CO3。
科学探究
羟基对苯环有没有影响呢
现象:
有白色沉淀生成
⑵取代反应
此反应很灵敏,常用于苯酚的定性检验和定量测定
只取代羟基的邻,对位氢原子,间位氢原子不取代。
苯酚的取代反应.mp4
实验中苯酚采用稀溶液且不能过量,溴水的浓度要尽量大一些,以免生成的三溴苯酚溶于过量的苯酚中而观察不到明显的沉淀现象。
注意:
结论:
羟基对苯环的影响使得苯环上与羟基位于邻、对位的氢原子更活泼,易被取代。
⑵由于羟基对苯环的影响,苯环上处于羟基邻位、对位的氢原子活性增强,从而使苯酚比苯更易与溴发生取代反应。
由此可见:不同的烃基与羟基相连,可以影响物质的化学性质。
⑴由于苯环对羟基的
影响,O-H极性变强
使得苯酚羟基中的氢原子易电离,而使苯酚表现弱酸性。而乙醇分子中-OH与乙基相连,-OH上H原子比水分子中H原子更难电离,因此乙醇不显酸性。
现象:
溶液变为紫色
苯酚与FeCl3溶液作用显紫色,利用此性质可以检验苯酚的存在,也可利用苯酚的这一性质检验FeCl3。
⑶显色反应
苯酚的显色反应.mp4
酚类物质一般都可以与FeCl3作用显色,可用于检验酚羟基的存在。
①燃烧
②被氧气氧化
③被高锰酸钾酸性溶液氧化
苯酚能使酸性高锰酸钾溶液褪色
+ 3H2
-OH
-OH
Ni
△
⑷氧化反应(具有强还原性)
⑸加成反应
OH + nHCHO
n
浓盐酸
热水浴
CH2
H [
OH
] OHn
+(n-1)H2O
⑹苯酚的缩聚反应
酚醛树脂俗称“电木”,它不易燃烧,具有良好的电绝缘性能,被广泛用来生产电闸、电灯开关、灯口、电话机等电器用品。
酚醛树脂
合成纤维
合成香料
医 药
染 料
农 药
防腐剂
消毒剂
②苯酚的稀溶液直接做防腐剂和消毒剂。日常用的药皂中掺入少量苯酚
①制酚醛树脂(俗称电木)、染料、医药、农药、合成纤维、合成香料等
⒋苯酚的用途
你知道吗?
日本利用蟹壳清除工业废水中有毒物质—苯酚
酚---与芳香醚、芳香醇之间会产生同分异构现象
含酚类物质的废水对生物具有毒害作用,会对水体造成严重污染。化工厂和炼焦厂的废水中常含有酚类物质,在排放前必须经过处理。
⒌苯酚的危害
1.利用苯和苯酚性质上的差异分离苯酚和苯的混合物?
加足量NaOH溶液→分液得到苯 →苯酚钠溶液中加酸或通入足量CO2→分液得到苯酚
2.只用一试种剂把下列四种无色溶液鉴别开:苯酚、乙醇、NaOH、KSCN,现象分别怎样?
FeCl3溶液
物质 苯酚 乙醇 NaOH KSCN
现象
紫色溶液
无现象
红褐色沉淀
血红色
【温故知新】
烃分子中的氢原子可以被羟基(-OH)取代而衍生出含羟基(-OH)的化合物,如:
C2H5OH
OH
CH2OH
CH3
OH
CH3-CH2-CH-CH3
OH
第二节 醇 酚
⒈定义:
羟基(—OH)与饱和碳原子相连的化合物称为醇。
⒉分类:
⑴根据醇分子中所含羟基的数目
一元醇:如甲醇:CH3OH;乙醇:CH3CH2OH;
二元醇:含两个羟基。如乙二醇:
CH2OH
CH2OH
多元醇:含多个羟基。如丙三醇:
CH2OH
CH2OH
CHOH
一、醇
⑵根据羟基所连烃基的种类
脂肪醇
脂环醇
芳香醇
OH
CH2OH
羟基(—OH)与苯环侧链相连的化合物。
乙醇:CH3CH2OH
乙醇:CH3CH2OH
饱和醇
不饱和醇
丙烯醇:CH2=CHCH2OH
⑵根据羟基所连烃基是否饱和
由烷烃所衍生的一元醇叫做饱和一元醇,通式:CnH2n+1OH,可简写为:R-OH
甲醇(Methanol)又称羟基甲烷,是结构最为简单的饱和一元醇,因在干馏木材中首次发现,故又称“木醇”或“木精”。无色、具有挥发性的液体,易溶于水,沸点为65℃。
三种重要的醇
甲醇(CH3OH)有毒,误服会损伤视神经,甚至致人死亡。甲醇广泛应用于化工生产,用于制造甲醛和农药等,并用作有机物的萃取剂和酒精的变性剂等。也可作为车用燃料,属于可再生能源。
⒊醇的物理性质
乙二醇和丙三醇都是无色、黏稠、有甜味的液体,都易溶于水和乙醇,
是重要的化工原料。
香叶醇、玫瑰醇、苯乙醇
生活中其他常见的醇
木糖醇(戊五醇)
你知道吗?
薄荷醇
menthol
这些形形色色的各种醇,除了在生活中直接应用之外,还是重要的有机合成原料。
⒊醇的物理性质
对比思考
⑴沸 点
①饱和一元醇的沸点随分子中碳原子数的增加而升高。
名称 分子中羟基数目 沸点/℃
乙醇 1 78.5
乙二醇 2 197.3
1-丙醇 1 97.2
1,2-丙二醇 2 188
1,2,3-丙三醇 3 259
对比思考
②碳原子数相同时,
沸点随分子内羟基数目的增多而升高
原因:由于羟基数目增多,使得分子间形成的氢键增多增强,熔沸点升高。
why
对比思考
交
与
考
思
流
why
③相对分子质量相近的醇和烷烃相比,醇的沸点远远高于烷烃的沸点。
R
R
R
R
R
R
O
O
O
O
O
O
H
H
H
H
H
H
醇分子间形成氢键示意图
原因:醇分子中羟基上的氧原子与另一醇分子中羟基上的氢原子间存在着氢键。(分子间形成了氢键)
甲醇、乙醇、丙醇、乙二醇、丙三醇等低级醇均可与水以任意比例混溶,这也是因为醇分子与水分子之间形成了氢键。
醇在水中的溶解度一般随分子中碳原子数的增加而降低(原因)
⑵溶解性
⑶密 度
醇的密度比水的密度小。
⒋醇的化学性质
⑴与活泼金属(如Na)反应
2CH3CH2OH + 2Na → 2CH3CH2ONa + H2↑
⑶氧化反应
浓H2SO4
CH3COOH + HOC2H5 CH3COOC2H5 + H2O
⑵酯化反应
①可燃性(彻底氧化)
CH3CH2OH + 3O2 2CO2 + 2H2O
点燃
②乙醇的催化氧化
2C2H5OH + O2 2CH3CHO + 2H2O
Cu
Δ
灼烧
插入乙醇
现象:
C2H5OH + CuO CH3CHO + H2O + Cu
Δ
2C2H5OH + O2 2CH3CHO + 2H2O
Cu
Δ
2Cu + O2 = 2CuO
Δ
在酒精灯上加热时铜丝由红变黑,插入乙醇后,铜丝又由黑变红,并可闻到刺激性气味。
C
H
H
H
O
C
H
反应机理:
H H
2H C C O
H
O2
H
H
乙醇催化氧化的机理
醇催化氧化的机理
C—C—H
H
H
H
H
O—H
2H2O
两个H脱去与O结合成水
醇催化氧化的规律
本碳二氢 →氧化成 醛
本碳一氢 →氧化成 酮
本碳无氢 → 不能被催化氧化
Ⅰ.乙醇与酸性高锰酸钾溶液反应
③ 乙醇与强氧化剂反应
氧化过程可分为两个阶段:
实验现象:
CH3CH2OH
CH3CHO
CH3COOH
氧化
氧化
乙醇
乙醛
乙酸
溶液褪色
实验结论:
乙醇能被酸性高锰酸钾溶液氧化
Ⅱ.乙醇与酸性重铬酸钾溶液反应
乙醇与酸性重铬酸钾溶液的反应.mp4
氧化过程可分为两个阶段:
CH3CH2OH
CH3CHO
CH3COOH
氧化
氧化
乙醇
乙醛
乙酸
实验现象:
溶液由橙红色变为绿色
实验结论:
乙醇能被酸性重铬酸钾溶液氧化
有机物的氧化、还原反应
氧化反应:
还原反应:
CH3CH2OH→CH3CHO ?
举例:
CH3CHO→CH3COOH ?
CH3CHO→CH3CH2OH ? CH3COOH→CH3CHO ?
有机化合物分子中失去氢原子或加入氧原子的反应(失H或加O)
有机化合物分子中加入氢原子或失去氧原子的反应(加H或失O)
醇的化学性质主要由羟基官能团所决定。
C—C—O—H
H
H
H
H
H
因此,醇在发生反应时,O—H容易断裂,使羟基中的氢原子被取代,同样,C—O也易断裂,使羟基被取代或脱去,从而发生取代反应或消去反应。
在醇分子中,由于氧原子吸引电子的能力比氢原子和碳原子的强,使O—H和C—O的电子都向氧原子偏移。
羟基
C2H5—OH + H—Br C2H5Br + H2O
△
①醇可以与氢卤酸发生取代反应生成卤代烃和水。反应时醇分子中的C—O断裂,卤素原子取代了羟基而生成卤代烃。
⑷取代反应
乙醇和浓氢溴酸混合加热,生成溴乙烷:
②乙醇和浓硫酸的混合物的温度控制在140℃左右,乙醇将以另一种方式脱水,即每两个乙醇分子间会脱去一个水分子而生成乙醚。
CH3CH2O-H + HO-CH2CH3 CH3CH2OCH2CH3 + H2O
浓硫酸
140℃
乙醇的分子间脱水成醚
乙醚是一种无色、易挥发的液体,沸点34.5℃,有特殊气味,具有麻醉作用。乙醚微溶于水,易溶于有机溶剂,乙醚本身是一种优良溶剂,能溶解多种有机化合物。
醚
由两个烃基通过一个氧原子连接起来的化合物。
醚的结构可用R—O—R'来表示,R和R'都是烃基,可以相同,也可以不同。
C O C
⑴概念
⑵结构
⑶官能团
实验现象:
⑴酸性高锰酸钾溶液褪色;
⑵溴的四氯化碳溶液褪色。
实验结论:
乙醇在浓硫酸的作用下,加热到170 ℃时生成乙烯。
⑸消去反应
乙醇的消去反应.mp4
浓硫酸
CH2—CH2
H
OH
170℃
CH2 = CH2↑ + H2O
反应机理
分子内脱水
拓展延伸!
邻碳●有氢
催化剂和脱水剂
任何醇都能发生消去反应吗
拓展延伸!
乙烯的实验室制法
浓硫酸的作用是什么?
酒精与浓硫酸混合液如何配置
放入几片碎瓷片作用是什么?
为何使液体温度迅速升到170℃,不能过高或高低?
温度计的位置?
有何杂质气体?如何除去?
用排水集气法收集
混合液颜色如何变化?为什么?
吸收二氧化硫和乙醇
现象 结论
烧瓶中液体逐渐变黑
溴的CCl4溶液褪色
酸性高锰酸钾溶液褪色
浓硫酸与乙醇作用生成碳单质
乙烯与溴单质发生加成反应
乙烯被酸性高锰酸钾氧化
乙醇与浓硫酸的混合物在170 ℃和140 ℃两
种条件下反应的类型相同吗 浓硫酸在该反
应中的作用是什么
不同,前者为消去反应,后者为取代反应。前者中浓硫酸起催化剂和脱水剂的作用,后者中浓硫酸起催化剂的作用。
CH3CH2Br CH3CH2OH
反应条件
化学键断裂
化学键生成
反应产物
NaOH乙醇溶液加热
C—Br、C—H
C—O、C—H
CH2=CH2、NaBr、H2O
CH2=CH2、H2O
浓硫酸,加热至170℃
—C—C—C—
—C—C—C—
小结
反应 断键位置
与金属钠反应
Cu或Ag催化氧化
浓硫酸加热到170℃消去反应
浓硫酸加热到140℃分子间脱水
浓硫酸条件下与乙酸加热酯化反应
与HX加热反应
② ④
②
① ③
① ②
①
①
①
H---C---C--O--H
H
H
H
H
②
③
④
乙醛脱氢酶
乙醇脱氢酶
醉酒
乙醇脱氢酶
不醉酒
身边的化学
饱和一元醇的命名
⑵编碳号
⑴选主链
⑶写名称
取代基位置— 取代基名称 — 羟基位置— 母体名称
2-丁醇
3-甲基-2-戊醇
拓展延伸!
选择连有羟基的最长碳链作主链,按主链所含碳原子数称为某醇
从离羟基最近的一端开始编号;距离相同时,使取代基位次和最小
CH3-CH-CH2-CH3
OH
CH3—CH—CH—CH3
OH
CH2—CH3
CH3—CH2—CH—CH3
OH
CH3—CH—C—OH
CH3
CH2—CH
CH3
②
③
CH3—CH—CH2—OH
CH3
①
2—甲基—1—丙醇
2—丁醇
2,3—二甲基—3—戊醇
【练习】写出下列醇的名称
醇的同分异构体
⒈碳架异构;
⒉位置异构;
⒊官能团异构(相同碳原子数的芳香醇、芳香醚和酚的官能团异构)。
【练习1】写出分子式为C4H10O的所有同分异构体的结构简式
【练习2】写出分子式为C8H10O的所有同分异构体的结构简式
拓展延伸!
化学史
二、酚
羟基(—OH)与苯环直接相连而形成的化合物称为酚。
开拓视野
含有芝麻酚
鼻舒
烹饪调料
含有丁香酚
漱口水
含有麝香草酚
石炭酸皂
医院常用的“来苏水”消毒剂便是甲酚的肥皂溶液。
罂粟花
吗啡 结构简式
含有羟基连接苯环上
苯分子里只有一个氢原子被羟基取代后的生成物称作一元酚,苯酚是酚类化合物中最简单的一元酚。
-OH
⒈苯酚的结构
分子式 结构简式 官能团 空间填充模型 球棍模型
C6H6O
注意:
苯酚中所有原子不一定都在同一个平面上。
纯净的苯酚是无色的晶体,具有特殊的气味(露置在空气中因部分苯酚发生氧化而呈粉红色)。熔点:43℃。室温下在水中溶解度为9.3g,当温度高于65℃时能与水混溶,易溶于乙醇等有机溶剂。
苯酚有毒,对皮肤有腐蚀性,使用时一定要小心。如不慎沾到皮肤上,应立即用酒精冲洗,再用水冲洗。
用后拧紧瓶盖
⒉苯酚的物理性质
室温下,在水中溶解度是9.2g,温度高于65℃时,能与水混溶
探究⒈ 苯酚溶解性
科学探究
⒊苯酚的化学性质
⑴酸性
得到浑浊液体
浑浊的液体变澄清
溶液由澄清变浑浊
苯酚的酸性.mp4
苯酚表现出酸性
酸性:盐酸 >苯酚
室温下,苯酚在水中溶解度很小
由于苯酚中的羟基和苯环直接相连,苯环与羟基之间的相互作用,使酚羟基在性质上与醇羟基有显著差异。
酚羟基中的氢原子比醇羟基中的氢原子更活泼,苯酚的羟基在水溶液中能够发生部分电离,显示弱酸性。
-OH
-O-
+ H+
苯酚酸性很弱,不能使酸碱指示剂(石蕊)变色。
苯酚浊溶液
紫色石蕊试液
通入CO2后,澄清溶液又变浑浊
-ONa
+ CO2 + H2O
-OH
+ NaHCO3
苯酚具有弱酸性,俗称石炭酸,比碳酸还弱。
③
探究⒉ 苯酚与碳酸的酸性比较
科学探究
苯酚与碳酸钠的反应
-ONa
+ NaHCO3
-OH
+ Na2CO3
结论:
酸性: HCl>H2CO3>苯酚>HCO3-
因此苯酚钠与CO2、水反应时,无论CO2是否过量,均生成NaHCO3,而不能生成Na2CO3。
科学探究
羟基对苯环有没有影响呢
现象:
有白色沉淀生成
⑵取代反应
此反应很灵敏,常用于苯酚的定性检验和定量测定
只取代羟基的邻,对位氢原子,间位氢原子不取代。
苯酚的取代反应.mp4
实验中苯酚采用稀溶液且不能过量,溴水的浓度要尽量大一些,以免生成的三溴苯酚溶于过量的苯酚中而观察不到明显的沉淀现象。
注意:
结论:
羟基对苯环的影响使得苯环上与羟基位于邻、对位的氢原子更活泼,易被取代。
⑵由于羟基对苯环的影响,苯环上处于羟基邻位、对位的氢原子活性增强,从而使苯酚比苯更易与溴发生取代反应。
由此可见:不同的烃基与羟基相连,可以影响物质的化学性质。
⑴由于苯环对羟基的
影响,O-H极性变强
使得苯酚羟基中的氢原子易电离,而使苯酚表现弱酸性。而乙醇分子中-OH与乙基相连,-OH上H原子比水分子中H原子更难电离,因此乙醇不显酸性。
现象:
溶液变为紫色
苯酚与FeCl3溶液作用显紫色,利用此性质可以检验苯酚的存在,也可利用苯酚的这一性质检验FeCl3。
⑶显色反应
苯酚的显色反应.mp4
酚类物质一般都可以与FeCl3作用显色,可用于检验酚羟基的存在。
①燃烧
②被氧气氧化
③被高锰酸钾酸性溶液氧化
苯酚能使酸性高锰酸钾溶液褪色
+ 3H2
-OH
-OH
Ni
△
⑷氧化反应(具有强还原性)
⑸加成反应
OH + nHCHO
n
浓盐酸
热水浴
CH2
H [
OH
] OHn
+(n-1)H2O
⑹苯酚的缩聚反应
酚醛树脂俗称“电木”,它不易燃烧,具有良好的电绝缘性能,被广泛用来生产电闸、电灯开关、灯口、电话机等电器用品。
酚醛树脂
合成纤维
合成香料
医 药
染 料
农 药
防腐剂
消毒剂
②苯酚的稀溶液直接做防腐剂和消毒剂。日常用的药皂中掺入少量苯酚
①制酚醛树脂(俗称电木)、染料、医药、农药、合成纤维、合成香料等
⒋苯酚的用途
你知道吗?
日本利用蟹壳清除工业废水中有毒物质—苯酚
酚---与芳香醚、芳香醇之间会产生同分异构现象
含酚类物质的废水对生物具有毒害作用,会对水体造成严重污染。化工厂和炼焦厂的废水中常含有酚类物质,在排放前必须经过处理。
⒌苯酚的危害
1.利用苯和苯酚性质上的差异分离苯酚和苯的混合物?
加足量NaOH溶液→分液得到苯 →苯酚钠溶液中加酸或通入足量CO2→分液得到苯酚
2.只用一试种剂把下列四种无色溶液鉴别开:苯酚、乙醇、NaOH、KSCN,现象分别怎样?
FeCl3溶液
物质 苯酚 乙醇 NaOH KSCN
现象
紫色溶液
无现象
红褐色沉淀
血红色
