【化学】2.2 化学能与电能(人教版必修2)课件2
文档属性
| 名称 | 【化学】2.2 化学能与电能(人教版必修2)课件2 |  | |
| 格式 | zip | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-04-12 12:14:09 | ||
图片预览











文档简介
课件59张PPT。第二章 化学反应与能量第二节 化学能与电能
电能——又称电力(二次能源)
二次能源:
经一次能源加工转移得到的能源.
一次能源:
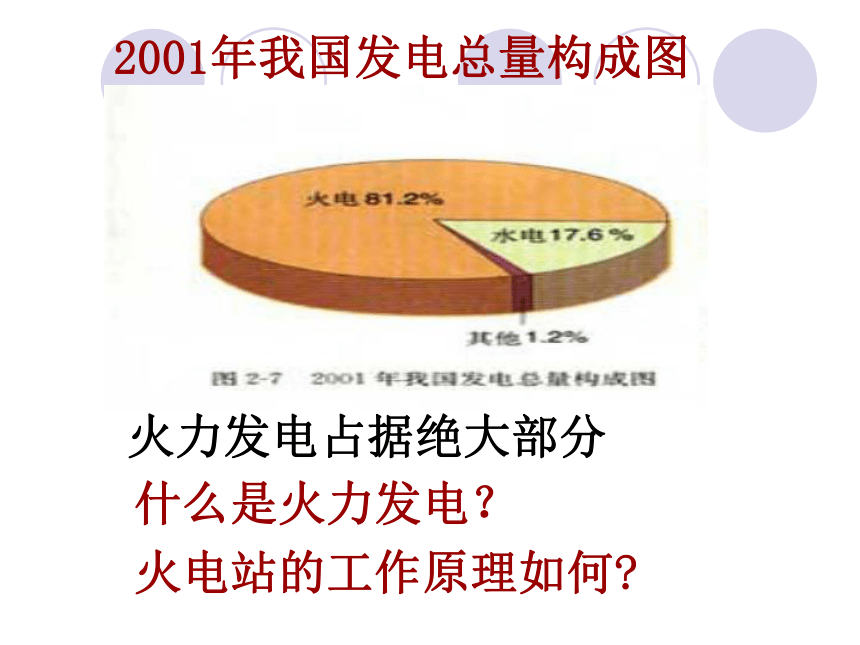
从自然界中直接取得的能源.如:煤,石油,天然气等.2001年我国发电总量构成图火力发电占据绝大部分什么是火力发电?
火电站的工作原理如何?火力发电工作原理示意图火电站从开始到结束能量是如何转化的?化石燃料化学能燃烧热能蒸汽机械能电能发电机一.发电站将化学能转化为电能火力发电有哪些缺点?讨论存
在
缺
点 化学能 电能 ?化学史:化学能转变为电能的探索1791年他在解剖时在实验室将悬有去了皮的青蛙腿的铜钩挂在铁架台上,当青蛙碰到铁杆时,发现蛙腿会有肌肉抽搐的现象。伽伏尼认为动物的组织会产生电流,而金属是传递电流的导体。 他从独特的角度认为电流是由两种不同的金属产生的,经过一系列的实验,终于在1800年成功研制了世界上第一个能产生稳定电流的电池(见右图)。 (意大利生物学家伽伏尼)(法国物理学家、化学家伏特)锌表面有气泡产生,铜表面无明显现象1.反应中,哪种物质失电子,哪种物质得电子用导线将锌表面的电子引出来Zn +2H+ = Zn 2+ +H2↑2.什么方法可使Zn与H+分开,不让H+直接在Zn表面得电子? 演示探究Cu起传导电子的作用。Zn + 2H+ = Zn 2+ +H2↑大量气泡从铜片逸出,锌片部分溶解1.H+得到的电子是Cu失去的吗?
2.在这个过程中Cu起什么作用?3.你怎样才能知道导线中有电子通过?可用电流表测电流及方向。演示探究化学能直接转化为电能1.电子从Zn到H+经历了哪些途径?
2.你认为这个过程能量是如何转化的?锌表面无气泡,
铜表面有气泡,
电流表发生偏转。二.化学能直接转化为电能1.原电池的概念、前提 将化学能转化为电能的装置 概念:前提: 能自发发生氧化还原反应(一)、原电池e-→⊕外电路:内电路:阳离子→正极阴离子→负极这样整个电路构成了闭合回路,带电粒子的定向移动产生电流(一)、原电池2.工作原理:(一)、原电池3.正极、负极:负极正极Zn-2e-=Zn2+2H++2e-=H2↑氧化反应还原反应Zn+2H+=Zn2++H2↑(两个电极反应之和)你是如何判定装置的正、负极?思考与交流4.如何书写电极反应方程式负极(锌片): Zn -2e - = Zn 2+负极(锌片): Zn -2e - = Zn 2+正极(石墨): 2H++2e - = H2 ↑ 正极(铜片): Cu2+ + 2e - = Cu 总反应: Zn + 2H+ = Zn 2+ + H2 ↑ 总反应: Zn + Cu2+ = Zn 2+ + Cu 电极反应方程式的书写方法负极:较活泼金属(a)
电极反应:a-ne-=an+ (氧化反应)
正极:较不活泼金属或非金属(b)
电极反应: Cm+ + me- = C(还原反应)
回忆思考:通过以上实验想想原电池是由哪几部分组成的,构成原电池的条件又有哪些组成:两电极、导线、电解质溶液以及容器构成条件猜想:电极有关-----相同的电极材料导线有关-----切断导线电解质溶液有关-----非电解质试着说说原电池的构成有什么条件?**************************************************************************************************************************************************************************① ② ③ ④ ⑤ ⑥ 实验探究偏转两极材料不同有两种活泼性不同的金
属(或非金属)作电极不偏转①②实验探究不偏转溶液不同电极材料均插入
电解质溶液中偏转③④实验探究⑤不偏转电极材料不同能自发地发生氧化还原反应不偏转容器不同两极相连形成闭合回路
实验探究⑥ 1).有两种活泼性不同的金属(或非金属)
作电极3).能自发地发生氧化还原反应5.原电池的构成条件4).两极相连形成闭合回路2).电极材料均插入电解质溶液中小结化
学
能
与
电
能间接:直接:装置原电池概
念构成条件工作原理病 例 分 析病 例 分 析病 例 分 析
你能为她开一个药方吗?1.下列装置中能组成原电池形成电流的是( )
习题一:C原电池的判断Zn CuFe C(石墨) Zn CuZn ZnFe CuSi C(石墨) 稀H2SO4 CuSO4 溶液 稀H2SO4 稀H2SO4
A B C DZn Cu稀H2SO4 酒精 稀H2SO4
E F G H√√√×××××2.2.某金属能跟稀盐酸作用放出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.Cu
原电池的工作原理B3.由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 PH( )
A.不 B先变大后变小
C逐渐变大 D.逐渐变小
C习题二习题三4.一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu,
该反应的的原电池正确组合是( )C原电池构成条件习题四4.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为( )
A.a > b > c > d B.a > c > d > b
C.c > a > b > d D.b > d > c > a B利用原电池电极判断金属性强弱第二课时 化学电源空气电池锂电池1、干电池(锌锰电池)负极:Zn – 2e- == Zn2+
正极:
2NH4+ +2MnO2 + 2e-
== 2NH3 + Mn2O3 + H2O 总反应:Zn+2NH4+ +2MnO2 =Zn2++2NH3 +Mn2O3 + H2O一、化学电源总反应:
Pb + PbO2 + 2H2SO4 == 2PbSO4 + 2H2O 负极:Pb + SO42- - 2e- == PbSO4正极:PbO2 + 4H+ + SO42- + 2e- == PbSO4 + 2H2O2、充电电池已知:PbSO4难溶于水铅蓄电池构造示意图汽车用的蓄电池3、燃料电池:⑴ 氢氧燃料电池总反应:2H2 + O2
== 2H2O碱性条件下 电解质溶液的酸碱性对电极反应的影响负极:2H2 – 4e- == 4H+正极:O2 + 4H+ + 4e- == 2H2O酸性条件下负极:2H2 + 4OH- – 4e- == 4H2O正极:O2 + 2H2O + 4e- == 4OH-— 有效地防止电解质溶液对外壳的腐蚀总反应:2H2 + O2 = 2H2O总反应:2H2 + O2 = 2H2O 改变燃料H2正极:2O2 + 4H2O + 8e- == 8OH-负极:CH4 + 10OH- – 8e- ==
CO32- + 7H2OCH4 +2O2 == CO2 + 2H2OCH4 +2O2 + 2OH- == CO32- + 2H2OCH4O2总反应:Zn2+Zn2+Zn2+Zn2+Zn2+Zn2+Zn2+eeeeeeeeeeeeeeZn2+Zn2+Zn2+Zn2+eeeeeeeeeeeZn2+eeK+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+K+K+NO3-NO3-NO3-Zn2+Zn2+Zn2+Zn2+我们的骄傲…2009年2月 安徽奇瑞电动汽车下线国内新能源汽车的先行者Zn(s) + 2H+(aq) = Zn2+(aq) + H2(g) △H < 0 2、设计合理的原电池装置二、设计原电池1、选择合适的化学反应Zn - 2e- = Zn2+ 2H+ + 2e- = H2↑ 【设计要点】
1、正负极、内电路、外电路各需要哪些仪器和药品?
2、如何判断化学能转化为了电能?CuZnZn2+H+H+Zn-2e-=Zn2+2H++2e-=H2↑ 氧化反应还原反应负极正极电子沿导线传递,产生电流阳离子失去电子溶液中阳离子得到电子阴离子正极负极SO42-原电池小结较活泼金属不活泼金属或石墨工作原理:较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过外电路流向较不活泼的金属(正极)。 三、电池的发展史 电池的诞生电池的诞生,基于人们对于获取持续而稳定的电流的需要。不过,发明电池的灵感是来源于一次青蛙的解剖实验,多少有些偶然。 第一个电池──“伏达电池”1799年,伏达把一块锌板和一块银板浸盐水里,发现连接两块金属的导线中有电流通过。用手触摸两端时,会感到强烈的电流刺激。伏达用这种方法成功的制成了世界上第一个电池──“伏达电池”。电池高速发展的年代 始于 ——20世纪50年代1、1950年代,碱性锌锰电池问世2、 1960年代,燃料电池研制成功3、 1970年代,锂电池开发成功 4、1980年代,氢镍电池问世5、1990年代,锂离子电池被用于生活电池的危害废电池是危害我们生存环境的一大杀手!一粒小小的钮扣电池可污染600吨水,相当于一个人一生的饮水量!一节一号电池烂在地里,能使一平方米的土地失去利用价值,并造成永久性公害!回收湿电池与干电池1860年法国的雷克兰士发明了世界广受使用的电池——碳锌电池。负极和正极都被浸在氯化铵溶液中。此系统被称为“湿电池”。
1887年,英国人赫勒森发明了最早的干电池。由于此电池的电解液为糊状,不会溢漏,便于携带,因此获得了广泛应用。 在巴格达博物馆中,有一只简陋的约有两千年历史的小陶罐—内有一根铜管,管内有一根下端由沥青包裹的铁棒。外观虽不起眼,却被誉为考古学领域最令人吃惊的发现。英国物理学家沃尔特·温顿对它做了仔细研究。他说: “在铜制容器内放上一些酸,随便什么,醋也可以。”于是他把这根管子放入出土的陶罐里,再向瓶里倒进了酸性葡萄酒,在铜管和铁棒间连上有电流计的导线,奇迹出现了……巴格达之谜化学趣话 自由女神的外壳为铜,内层支架为铁,中间用油毛毡隔开。时间长了,设计者预先没想到的事发生了:那层油毛毡失去了隔离作用,而大西洋潮湿的夹带盐分的空气向女神不断地吹来,无数的 在女神身上形成,结果加速了铁的腐蚀。尽管女神有万般灵验,现在也自身难保。怎样免除她的厄运呢?
面对自由女神的腐蚀,应采取什么措施和方法?把你好的建议上网发给美国纽约市长吧!原电池救救自由女神!化学趣话
电能——又称电力(二次能源)
二次能源:
经一次能源加工转移得到的能源.
一次能源:
从自然界中直接取得的能源.如:煤,石油,天然气等.2001年我国发电总量构成图火力发电占据绝大部分什么是火力发电?
火电站的工作原理如何?火力发电工作原理示意图火电站从开始到结束能量是如何转化的?化石燃料化学能燃烧热能蒸汽机械能电能发电机一.发电站将化学能转化为电能火力发电有哪些缺点?讨论存
在
缺
点 化学能 电能 ?化学史:化学能转变为电能的探索1791年他在解剖时在实验室将悬有去了皮的青蛙腿的铜钩挂在铁架台上,当青蛙碰到铁杆时,发现蛙腿会有肌肉抽搐的现象。伽伏尼认为动物的组织会产生电流,而金属是传递电流的导体。 他从独特的角度认为电流是由两种不同的金属产生的,经过一系列的实验,终于在1800年成功研制了世界上第一个能产生稳定电流的电池(见右图)。 (意大利生物学家伽伏尼)(法国物理学家、化学家伏特)锌表面有气泡产生,铜表面无明显现象1.反应中,哪种物质失电子,哪种物质得电子用导线将锌表面的电子引出来Zn +2H+ = Zn 2+ +H2↑2.什么方法可使Zn与H+分开,不让H+直接在Zn表面得电子? 演示探究Cu起传导电子的作用。Zn + 2H+ = Zn 2+ +H2↑大量气泡从铜片逸出,锌片部分溶解1.H+得到的电子是Cu失去的吗?
2.在这个过程中Cu起什么作用?3.你怎样才能知道导线中有电子通过?可用电流表测电流及方向。演示探究化学能直接转化为电能1.电子从Zn到H+经历了哪些途径?
2.你认为这个过程能量是如何转化的?锌表面无气泡,
铜表面有气泡,
电流表发生偏转。二.化学能直接转化为电能1.原电池的概念、前提 将化学能转化为电能的装置 概念:前提: 能自发发生氧化还原反应(一)、原电池e-→⊕外电路:内电路:阳离子→正极阴离子→负极这样整个电路构成了闭合回路,带电粒子的定向移动产生电流(一)、原电池2.工作原理:(一)、原电池3.正极、负极:负极正极Zn-2e-=Zn2+2H++2e-=H2↑氧化反应还原反应Zn+2H+=Zn2++H2↑(两个电极反应之和)你是如何判定装置的正、负极?思考与交流4.如何书写电极反应方程式负极(锌片): Zn -2e - = Zn 2+负极(锌片): Zn -2e - = Zn 2+正极(石墨): 2H++2e - = H2 ↑ 正极(铜片): Cu2+ + 2e - = Cu 总反应: Zn + 2H+ = Zn 2+ + H2 ↑ 总反应: Zn + Cu2+ = Zn 2+ + Cu 电极反应方程式的书写方法负极:较活泼金属(a)
电极反应:a-ne-=an+ (氧化反应)
正极:较不活泼金属或非金属(b)
电极反应: Cm+ + me- = C(还原反应)
回忆思考:通过以上实验想想原电池是由哪几部分组成的,构成原电池的条件又有哪些组成:两电极、导线、电解质溶液以及容器构成条件猜想:电极有关-----相同的电极材料导线有关-----切断导线电解质溶液有关-----非电解质试着说说原电池的构成有什么条件?**************************************************************************************************************************************************************************① ② ③ ④ ⑤ ⑥ 实验探究偏转两极材料不同有两种活泼性不同的金
属(或非金属)作电极不偏转①②实验探究不偏转溶液不同电极材料均插入
电解质溶液中偏转③④实验探究⑤不偏转电极材料不同能自发地发生氧化还原反应不偏转容器不同两极相连形成闭合回路
实验探究⑥ 1).有两种活泼性不同的金属(或非金属)
作电极3).能自发地发生氧化还原反应5.原电池的构成条件4).两极相连形成闭合回路2).电极材料均插入电解质溶液中小结化
学
能
与
电
能间接:直接:装置原电池概
念构成条件工作原理病 例 分 析病 例 分 析病 例 分 析
你能为她开一个药方吗?1.下列装置中能组成原电池形成电流的是( )
习题一:C原电池的判断Zn CuFe C(石墨) Zn CuZn ZnFe CuSi C(石墨) 稀H2SO4 CuSO4 溶液 稀H2SO4 稀H2SO4
A B C DZn Cu稀H2SO4 酒精 稀H2SO4
E F G H√√√×××××2.2.某金属能跟稀盐酸作用放出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.Cu
原电池的工作原理B3.由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 PH( )
A.不 B先变大后变小
C逐渐变大 D.逐渐变小
C习题二习题三4.一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu,
该反应的的原电池正确组合是( )C原电池构成条件习题四4.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为( )
A.a > b > c > d B.a > c > d > b
C.c > a > b > d D.b > d > c > a B利用原电池电极判断金属性强弱第二课时 化学电源空气电池锂电池1、干电池(锌锰电池)负极:Zn – 2e- == Zn2+
正极:
2NH4+ +2MnO2 + 2e-
== 2NH3 + Mn2O3 + H2O 总反应:Zn+2NH4+ +2MnO2 =Zn2++2NH3 +Mn2O3 + H2O一、化学电源总反应:
Pb + PbO2 + 2H2SO4 == 2PbSO4 + 2H2O 负极:Pb + SO42- - 2e- == PbSO4正极:PbO2 + 4H+ + SO42- + 2e- == PbSO4 + 2H2O2、充电电池已知:PbSO4难溶于水铅蓄电池构造示意图汽车用的蓄电池3、燃料电池:⑴ 氢氧燃料电池总反应:2H2 + O2
== 2H2O碱性条件下 电解质溶液的酸碱性对电极反应的影响负极:2H2 – 4e- == 4H+正极:O2 + 4H+ + 4e- == 2H2O酸性条件下负极:2H2 + 4OH- – 4e- == 4H2O正极:O2 + 2H2O + 4e- == 4OH-— 有效地防止电解质溶液对外壳的腐蚀总反应:2H2 + O2 = 2H2O总反应:2H2 + O2 = 2H2O 改变燃料H2正极:2O2 + 4H2O + 8e- == 8OH-负极:CH4 + 10OH- – 8e- ==
CO32- + 7H2OCH4 +2O2 == CO2 + 2H2OCH4 +2O2 + 2OH- == CO32- + 2H2OCH4O2总反应:Zn2+Zn2+Zn2+Zn2+Zn2+Zn2+Zn2+eeeeeeeeeeeeeeZn2+Zn2+Zn2+Zn2+eeeeeeeeeeeZn2+eeK+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+Cu2+K+K+NO3-NO3-NO3-Zn2+Zn2+Zn2+Zn2+我们的骄傲…2009年2月 安徽奇瑞电动汽车下线国内新能源汽车的先行者Zn(s) + 2H+(aq) = Zn2+(aq) + H2(g) △H < 0 2、设计合理的原电池装置二、设计原电池1、选择合适的化学反应Zn - 2e- = Zn2+ 2H+ + 2e- = H2↑ 【设计要点】
1、正负极、内电路、外电路各需要哪些仪器和药品?
2、如何判断化学能转化为了电能?CuZnZn2+H+H+Zn-2e-=Zn2+2H++2e-=H2↑ 氧化反应还原反应负极正极电子沿导线传递,产生电流阳离子失去电子溶液中阳离子得到电子阴离子正极负极SO42-原电池小结较活泼金属不活泼金属或石墨工作原理:较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过外电路流向较不活泼的金属(正极)。 三、电池的发展史 电池的诞生电池的诞生,基于人们对于获取持续而稳定的电流的需要。不过,发明电池的灵感是来源于一次青蛙的解剖实验,多少有些偶然。 第一个电池──“伏达电池”1799年,伏达把一块锌板和一块银板浸盐水里,发现连接两块金属的导线中有电流通过。用手触摸两端时,会感到强烈的电流刺激。伏达用这种方法成功的制成了世界上第一个电池──“伏达电池”。电池高速发展的年代 始于 ——20世纪50年代1、1950年代,碱性锌锰电池问世2、 1960年代,燃料电池研制成功3、 1970年代,锂电池开发成功 4、1980年代,氢镍电池问世5、1990年代,锂离子电池被用于生活电池的危害废电池是危害我们生存环境的一大杀手!一粒小小的钮扣电池可污染600吨水,相当于一个人一生的饮水量!一节一号电池烂在地里,能使一平方米的土地失去利用价值,并造成永久性公害!回收湿电池与干电池1860年法国的雷克兰士发明了世界广受使用的电池——碳锌电池。负极和正极都被浸在氯化铵溶液中。此系统被称为“湿电池”。
1887年,英国人赫勒森发明了最早的干电池。由于此电池的电解液为糊状,不会溢漏,便于携带,因此获得了广泛应用。 在巴格达博物馆中,有一只简陋的约有两千年历史的小陶罐—内有一根铜管,管内有一根下端由沥青包裹的铁棒。外观虽不起眼,却被誉为考古学领域最令人吃惊的发现。英国物理学家沃尔特·温顿对它做了仔细研究。他说: “在铜制容器内放上一些酸,随便什么,醋也可以。”于是他把这根管子放入出土的陶罐里,再向瓶里倒进了酸性葡萄酒,在铜管和铁棒间连上有电流计的导线,奇迹出现了……巴格达之谜化学趣话 自由女神的外壳为铜,内层支架为铁,中间用油毛毡隔开。时间长了,设计者预先没想到的事发生了:那层油毛毡失去了隔离作用,而大西洋潮湿的夹带盐分的空气向女神不断地吹来,无数的 在女神身上形成,结果加速了铁的腐蚀。尽管女神有万般灵验,现在也自身难保。怎样免除她的厄运呢?
面对自由女神的腐蚀,应采取什么措施和方法?把你好的建议上网发给美国纽约市长吧!原电池救救自由女神!化学趣话
