第六章 化学反应与能量 培优提升单元练习—2021-2022学年高一下学期化学人教版(2019)必修第二册
文档属性
| 名称 | 第六章 化学反应与能量 培优提升单元练习—2021-2022学年高一下学期化学人教版(2019)必修第二册 |  | |
| 格式 | zip | ||
| 文件大小 | 575.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-21 08:40:03 | ||
图片预览




文档简介
第六章 化学反应与能量
一、单选题
1.下列变化中属于吸热反应的是
①液态水汽化 ②将胆矾加热变为白色粉末 ③苛性钠固体溶于水 ④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰 ⑥干冰升华
A.②④ B.①②④⑥ C.③⑤ D.②③④
2.下列关于化学反应的速率和限度的说法不正确的是
A.任何可逆反应都有一定的限度
B.影响化学反应速率的条件有温度、催化剂、浓度等
C.化学平衡状态指的是反应物和生成物浓度相等时的状态
D.决定化学反应速率的主要因素是物质本身的性质
3.下列说法不正确的是
A.任何反应都存在化学平衡状态
B.化学反应的限度可以通过改变条件来改变
C.达到化学平衡状态时,正反应速率等于逆反应速率
D.化学平衡状态是反应在该条件下所能达到的最大反应限度
4.肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1molN-H所需的能量(kJ)是
A.194 B.391 C.516 D.658
5.N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如下,用、、分别表示N2、H2、NH3,已知:N2(g)+3H2(g) 2NH3(g),该反应属于放热反应。下列说法不正确的是
A.②→③过程,是吸热过程
B.③→④过程,N原子和H原子形成了含有极性键的NH3
C.合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量
D.合成氨反应中,反应物总能量大于生成物总能量
6.下列有关原电池的说法中正确的是
A.在外电路中,电子由负极经导线流向正极
B.在内电路中,电子由正极经电解质溶液流向负极
C.原电池工作时,正极表面一定有气泡产生
D.原电池工作时,一定不会伴随着热能变化
7.已知某反应的能量变化如图所示,下列说法正确的是
A.该反应可用于表示Mg与硫酸反应
B.该反应只有在加热条件下才能进行
C.反应物的总能量高于生成物的总能量
D.该反应可以用于表示CaCO3受热分解的反应
8.某原电池的总反应的离子方程式为2Fe3++Fe=3Fe2+,不能实现该反应的原电池是
选项 正极 负极 电解质溶液
A Cu Fe FeCl3溶液
B C Fe Fe(NO3)3溶液
C Fe Zn Fe2(SO4)3溶液
D Ag Fe Fe2(SO4)3溶液
A.A B.B C.C D.D
9.将4molA气体和2molB气体在2L的密闭容器中混合,并在一定条件下发生如下反应:,反应2s后达到平衡状态,测得C的物质的量为1.2mol。下列说法正确的是
A.用物质A表示2s内的平均反应速率为
B.用物质B表示2s内的平均反应速率为
C.单位时间内有a mol A生成,同时有2a mol C生成,说明反应达到平衡状态
D.当A、B、C的反应速率之比为1∶1∶2时达到平衡状态
10.下列关于原电池的叙述正确的是( )
A.构成原电池的正极和负极的材料必须是两种不同的金属
B.原电池是将化学能转化为电能的装置
C.在原电池中,电子流出的一极是正极
D.原电池工作时,电路中的电流是从负极到正极
11.一定温度时,向2.0L恒容密闭容器中充入2molSO2和1mol O2,发生反应:2SO2(g)+O2(g)2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s 0 2 4 6 8
n(SO3)/mol 0 0.8 1.4 1.8 1.8
下列说法正确的是( )A.反应在前2s的平均速率v(O2)=0.2mol·L-1·s-1
B.保持其他条件不变,体积压缩到1.0L,平衡常数将增大
C.相同温度下,起始时向容器中充入4molSO3,达到平衡时,SO3的转化率大于10%
D.保持温度不变向该容器中再充入2molSO2、1molO2,反应达到新平衡时增大
12.下列说法正确的是
A.吸热反应中反应物的总能量大于生成物的总能量
B.将Mg、A1片用导线连接后放入氢氧化钠溶液中组成原电池,Al为负极,Mg为正极
C.由CO、空气和稀硫酸构成的燃料电池的负极反应是2CO+4e-+2H2O=2CO2↑+4H+
D.充电电池可以无限制地反复放电、充电
13.下列有关叙述不正确的是
选项 已知 解释与结论
A 活泼金属Al、不活泼金属Cu和浓硝酸可以形成原电池 Al作正极,Cu作负极
B 该反应在常温下能自发进行 该反应的
C 常温下,、 向溶液中加入和KBr,当AgCl、AgBr两种沉淀共存时,
D 向溶液中滴入硫酸酸化的溶液,振荡,溶液变为黄色 氧化性:
A.A B.B C.C D.D
14.一定温度下,在恒容密闭容器中充入CO和H2,发生反应:2H2(g)+CO(g) CH3OH(g) △H<0。下列图像符合实际且t0时达到平衡状态的是( )
A. B.
C. D.
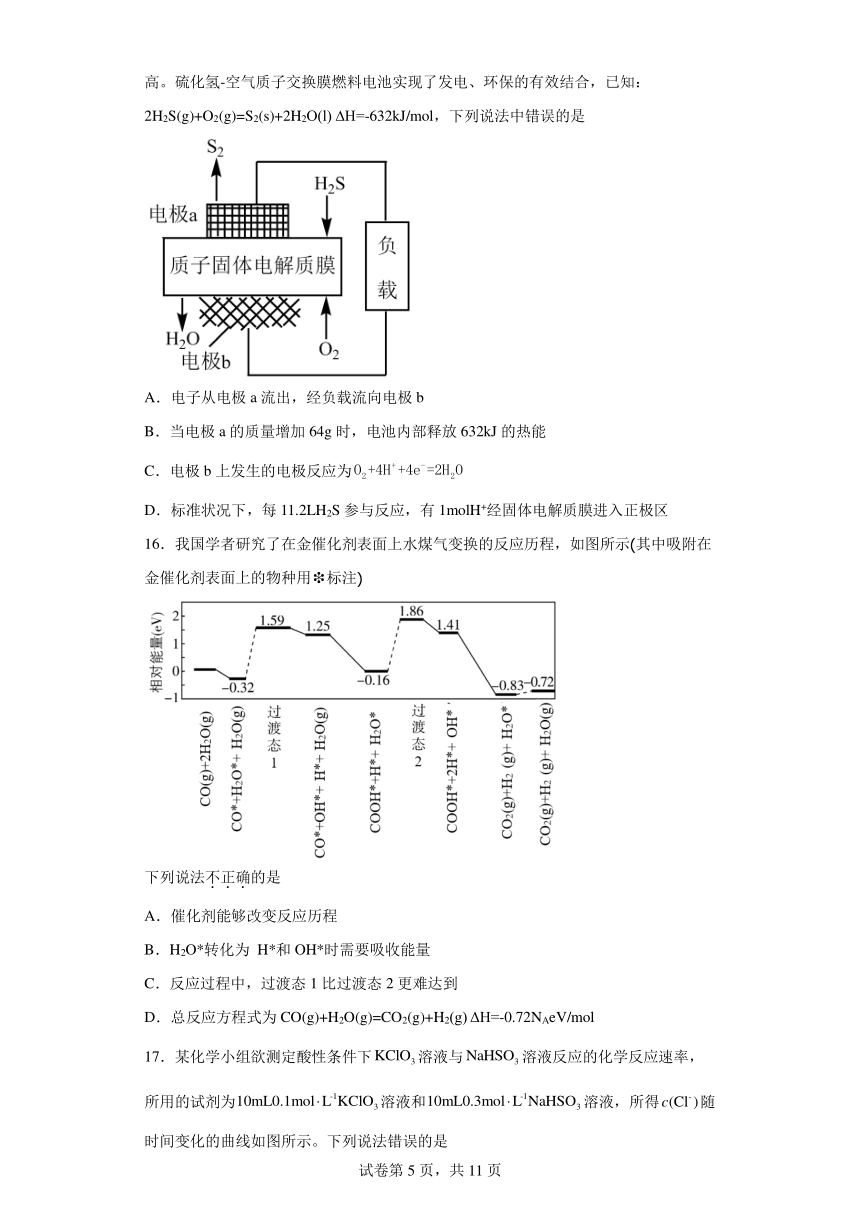
15.十九大报告中提出要“打赢蓝天保卫战”,意味着对大气污染防治比过去要求更高。硫化氢-空气质子交换膜燃料电池实现了发电、环保的有效结合,已知:2H2S(g)+O2(g)=S2(s)+2H2O(l) H=-632kJ/mol,下列说法中错误的是
A.电子从电极a流出,经负载流向电极b
B.当电极a的质量增加64g时,电池内部释放632kJ的热能
C.电极b上发生的电极反应为
D.标准状况下,每11.2LH2S参与反应,有1molH+经固体电解质膜进入正极区
16.我国学者研究了在金催化剂表面上水煤气变换的反应历程,如图所示(其中吸附在金催化剂表面上的物种用 标注)
下列说法不正确的是
A.催化剂能够改变反应历程
B.H2O*转化为 H*和OH*时需要吸收能量
C.反应过程中,过渡态1比过渡态2更难达到
D.总反应方程式为CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-0.72NAeV/mol
17.某化学小组欲测定酸性条件下溶液与溶液反应的化学反应速率,所用的试剂为溶液和溶液,所得随时间变化的曲线如图所示。下列说法错误的是
A.该反应的离子方程式为
B.该反应在的平均反应速率
C.在反应过程中,该反应的化学反应速率变化趋势为先增大后减小
D.起初反应很慢,一段时间后反应速率明显增大,一定是反应放热温度升高的结果
18.在一定条件下,利用CO2合成CH3OH的反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1,研究发现,反应过程中会发生副反应为CO2(g)+H2(g) CO(g)+H2O(g) △H2,温度对CH3OH、CO的产率影响如图所示。下列说法中不正确的是
A.△H1<0,△H2>0
B.增大压强有利于加快合成反应的速率
C.选用合适的催化剂可以减弱副反应的发生
D.生产过程中,温度越高越有利于提高CH3OH的产率
19.混合动力汽车(HEV)中使用了镍氢电池,其工作原理如图所示:其中M为储氢合金,为吸附了氢原子的储氢合金,溶液作电解液。关于镍氢电池,下列说法正确的是
A.充电时,阴极附近降低
B.发电机工作时溶液中向甲移动
C.放电时正极反应式为:
D.电极总反应式为:
20.下列关于原电池的叙述正确的是( )
A.构成原电池的正极和负极的材料必须是两种不同的金属
B.原电池是将化学能转化为电能的装置
C.在原电池中,电子流出的一极是正极
D.原电池工作时,电路中的电流是从负极到正极
第II卷(非选择题)
请点击修改第II卷的文字说明
二、工业流程题
21.硼及其化合物在工业上有许多用途。工业上用硼矿石主要成分为,还有少量MgO、等为原料制备粗硼的工艺流程如图所示。
已知:①偏硼酸钠易溶于水,在碱性条件下稳定存在。②硼砂的化学式为。回答下列问题:
(1)欲提高硼矿石的溶解速率,可采取的措施有______写出两条。
(2)滤渣主要成分是______。
(3)硼砂中B的化合价为______,溶于热水后,常用调pH到2~3制取,反应的离子方程式为______。
(4)为晶体加热脱水的产物其与Mg反应制取粗硼的化学方程式为______。
(5)以硼酸为原料可制得硼氢化钠,它与水反应的离子方程式为,该反应中氧化剂是______;硼氢化钠能把许多金属离子还原为金属单质,为抑制它与水的反应反应可在______填“酸性”“中性”或“碱性“条件下进行。
(6)硼酸熔点为,露置空气中无变化,加热至时失水而变成偏硼酸:。已知是弱酸,将等体积等物质的量浓度的与NaOH溶液混合,所得溶液中离子浓度从大到小的顺序是______。
三、元素或物质推断题
22.A、B、C、D、E为短周期元素,原子序数依次增大,质子数之和为40,B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E是地壳中含量最多的金属元素,问:
(1)B元素在周期表中的位置为_________________;
(2)D的单质投入A2C中得到一种无色溶液。E的单质在该无色溶液中反应的离子方程式为_____________________。
(3)用电子式表示由A、C两元素组成的四核18电子的共价化合物的形成过程_____________。
(4)以往回收电路板中铜的方法是灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2C2和稀硫酸浸泡既达到了上述目的,又保护了环境,该反应的化学方程式为___________________。
(5)乙醇(C2H5OH)燃料电池(Pt为电极),以KOH为电解质溶液,写出负极电极反应式__________,当转移电子1.2mol时,消耗氧气标况下体积为______________。
四、填空题
23.根据所学知识,回答下列问题:
(1)在反应N2(g)+3H2(g) 2NH3(g)中,若以N2表示的该反应的化学反应速率为0.2 mol/(L·min),则以H2表示此反应的化学反应速率为 _____________ mol/(L·min)
(2)在5 L的恒容密闭容器中,充人0.1 mol N2和0.4 mol H2,在一定条件下发生反应,2s后测得N2的物质的量为0.09mol,则以NH3的浓度变化表示的反应速率为 ___________ mol/(L·s)
(3)将0.2 mol NH3充人容积为10 L的恒容密闭容器中,某温度下发生反应2NH3(g)N2(g) + 3H2(g),在0~2s内,消耗NH3的平均速率为0.002 mol/(L·s),则在2s时,容器中生成_____________molH2,此时NH3的物质的量浓度为______________ mol/L。
五、计算题
24.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2 L的密闭容器中加入0.2 mol的N2和0.6 mol的H2在一定条件下发生反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)=_______。
(2)平衡后,若提高H2的转化率,可以采取的措施有_______。
A.加了催化剂 B.增大容器体积
C.降低反应体系的温度 D.加入一定量N2
(3)若在0.5 L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
T/℃ 200 300 400
K K1 K3 0.5
请完成下列问题:
①试比较K1、K2的大小,K1_______K2(填“<”“>”或“=”);
②400℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数为_______。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正_______v(N2)逆(填“<”“>”或“=”)。
六、实验题
25.宏观辨识、微观探析和符号表征是体现化学学科特征的思维方式.某化学兴趣小组设计实验,探究离子反应及氧化还原反应的本质。
I.离子反应
(1)向溶液中滴入几滴酚酞溶液,装置如图。接通电源,向该溶液中滴入溶液。
回答下列问题:
①接通电源前,能说明在水中电离的实验现象为_______。
②随着溶液的滴入,观察到烧杯中溶液红色逐渐褪去,产生白色沉淀,小灯泡亮度变暗,这些现象说明该反应的微观本质是和浓度降低,写出该反应的离子方程式_______。
(2)向溶液中滴入的盐酸,测定电导率的变化如图所示。
回答下列问题:
①B点恰好完全反应,此时溶液中存在的主要微粒有、_______。
②下列化学反应的离子方程式与溶液和稀盐酸反应相同的是_______。
A.溶液和稀硫酸 B.澄清石灰水和稀硝酸
C.溶液和溶液 D.浓氨水和浓盐酸
II.氧化还原反应
(3)将铁片和石墨棒用导线连接,平行放置在的硫酸铜溶液中,装置如图,观察到电流表指针偏转,铁片逐渐溶解,石墨棒上有红色物质析出。
回答下列问题:
①下列图示能正确表示实验过程的是_______(填序号)。
②能证明氧化还原反应的实质是电子转移的现象是_______。
③当硫酸铜溶液的浓度变为时,烧杯中溶液的质量变化_______g[(反应后)(反应前);假设反应前后溶液体积不发生变化]。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【解析】
【详解】
①水汽化是物理变化,不属于吸热反应,故①错误;
②胆矾CuSO4 5H2O受热分解生成CuSO4和H2O,属于吸热反应,故②正确;
③苛性钠固体溶于水是放热过程,属于物理变化,故③错误;
④氯酸钾分解制氧气属于吸热反应,故④正确;
⑤生石灰跟水反应生成熟石灰是化合反应,属于放热反应,故⑤错误;
⑥干冰升华为物理变化,故⑥错误;
属于吸热反应的有②④;
故选A。
2.C
【解析】
【分析】
【详解】
A.任何可逆反应都有一定的限度,符合可逆反应的规律,故A正确;
B. 影响化学反应速率的条件有温度、催化剂、浓度等,符合影响反应速率的因素,故B正确;
C. 化学平衡状态指的是反应物和生成物浓度不再变化时的状态,而不一定是相等的状态,故C错误;
D. 决定化学反应速率的主要因素是物质本身的性质(内因),符合影响反应速率的因素,故D正确。
答案选C。
3.A
【解析】
【分析】
【详解】
A.只有可逆反应才存在化学平衡状态,A项错误;
B.化学反应的限度可以通过改变条件来改变,B项正确;
C.达到化学平衡状态时,正反应速率等于逆反应速率,C项正确;
D.化学平衡状态是反应在该条件下所能达到的最大反应限度,D项正确;
答案选A。
4.B
【解析】
【分析】
【详解】
根据图中内容,可以看出N2H4(g)+O2(g)=2N(g)+4H(g)+2O(g), E1=2752J-534kJ=2218kJ,E(N-N)+E(O=O)+4E(N-H)=2218kJ,154kJ+500kJ+4E(N-H) =2218kJ,解得E(N-H)=391kJ,故选B。
5.C
【解析】
【分析】
【详解】
A.②→③过程是化学键断裂的过程,是吸热过程,A正确;
B.③→④过程,N原子和H原子形成了含有极性键的NH3,B正确;
C.合成氨反应是放热非农业,反应物断键吸收的能量小于生成物形成新键释放的能量,C错误;
D.合成氨反应是放热反应,说明反应物总能量大于生成物总能量,D正确;
故选C。
6.A
【解析】
【详解】
A.外电路中电子由负极流向正极,A正确,
B.在内电路中,是阴、阳离子移动,B错误;
C.原电池工作时,正极上一般是溶液中的阳离子得电子,则正极表面可能有气泡产生,也可能生成金属单质,C错误;
D.原电池工作时,化学能转化为电能,同时可能会伴随着热能变化,D错误。
故选A。
7.D
【解析】
【分析】
【详解】
由图得出的信息是反应物能量低于生成物能量,是吸热反应;
A.Mg与硫酸反应是放热反应,与图示不一致,故A 错误;
B.反应是吸热还是放热与反应条件无关,故B错误;
C.从图看出反应物的总能量低于生成物的总能量,故C错误;
D.CaCO3受热分解的反应是吸热反应,符合图示,故D正确;
故答案为:D
8.C
【解析】
【详解】
根据2Fe3++Fe=3Fe2+知,铁易失电子而作负极,不如铁活泼的金属或导电的非金属作正极,铁离子得电子发生还原反应,所以电解质溶液为可溶性的铁盐:
A.铜作正极,铁作负极,电解质为可溶性的氯化铁,则符合题意,故A不选;
B.铁作负极,碳作正极,电解质为Fe(NO3)3溶液,能发生氧化还原反应,则符合题意,故B不选;
C.Zn的金属活泼性比Fe强,则Zn作负极,Fe作正极,电解质为可溶性的硫酸铁,所以不能构成该条件下的原电池,则不符合题意,故C选;
D.Fe作负极,银作正极,电解质为Fe2(SO4)3溶液,发生反应为2Fe3++Fe═3Fe2+,符合题意,故D不选;
故选C。
9.C
【解析】
【详解】
A.反应2s后测得C的物质的最为1.2mol,用物质C表示2s内的平均反应速率为,根据反应速率之比等于化学计量数之比可知,用物质A表示2s内的平均反应速率为,A错误;
B.用物质B表示2s内的平均反应速率为,B错误;
C.单位时间内有a mol A生成同时有2a mol C生成,说明正、逆反应速率相等,反应达到平衡状态,C正确;
D.当A、B、C的反应速率之比为1∶1∶2时,并不能够说明正、逆反应速率相等,不能证明反应达到平衡状态,D错误。
答案选C。
10.B
【解析】
【分析】
【详解】
A.构成原电池的电极可以是金属与金属,也可以是金属与非金属,A项错误;
B.原电池是将化学能转化为电能的装置,B项正确;
C.原电池中电子流出的一极是负极,C项错误;
D.原电池工作时,电流是从正极到负极,D项错误。
故选:B。
11.D
【解析】
【详解】
A.反应反应在前2s的平均速率v(SO3),同一反应中速率之比等于计量数之比,所以v(O2)=×0.2mol·L-1·s-1=0.1mol·L-1·s-1,故A错误;
B.平衡常数只受温度的影响,保持其他条件不变,体积压缩到1.0L,平衡常数不变,故B错误;
C. 充入2molSO2和1mol O2,相当于充入2molSO3,此时SO3的转化率为 ,相同温度下,起始时向容器中充入4molSO3,假设达到的是等效平衡,则转化率不变,实际上相当于增大压强,平衡会右移,降低三氧化硫的转化率,故C错误;
D. 温度不变,向该容器中再充入2mol SO2、1mol O2,若保持与原平衡的压强相同,则可达到等效平衡,不变;然后将容器压缩到原容器的体积,则平衡正向移动,二氧化硫的转化率增大,氧气的的转化率也增大,所以该比值增大,故D正确。
故答案为D。
【点睛】
注意“等效平衡”和“虚拟状态”法在分析转化率、物质浓度等变化问题中的应用。
12.B
【解析】
【详解】
A.吸热反应中反应物的总能量小于生成物的总能量,故A错误;
B.铝能与氢氧化钠溶液反应生成偏铝酸钠和氢气,将Mg、A1片用导线连接后放入氢氧化钠溶液中组成原电池,Al为负极,Mg为正极,故B正确;
C.原电池负极失电子发生氧化反应,由CO、空气和稀硫酸构成的燃料电池的负极反应是2CO-4e-+2H2O=2CO2↑+4H+,故C错误;
D.充电电池的充放电次数也是一定的,不能无限制的使用,故D错误;
选B。
13.D
【解析】
【详解】
A.在浓硝酸、Al、Cu原电池中,Cu作负极,发生氧化反应,Al钝化作正极,A正确;
B.该反应的△S<0,常温下能自发进行,必须△H<0,B正确;
C.当两种沉淀共存时,溶液中Ag+离子浓度相同,根据溶度积常数计算, , ,则。C正确;
D.硝酸根离子在酸性条件下也能将亚铁离子氧化为铁离子,所以不能判断氧化性,D错误;
答案选D。
14.D
【解析】
【详解】
A. 该反应中气体总质量、容器容积为定值,则密度始终不变,图示曲线不符合实际,且不能根据密度不变判断平衡状态,故A不符合题意;
B. 初始时CH3OH(g)的体积分数应该为0,图示曲线与实际不符,故B不符合题意;
C. 2H2(g)+CO(g) CH3OH(g)为气体体积缩小的反应,混合气体总质量为定值,则建立平衡过程中混合气体的平均摩尔质量逐渐增大,图示曲线与实际不符,故C不符合题意;
D. 2H2(g)+CO(g) CH3OH(g)为气体体积缩小的反应,反应过程中压强逐渐减小,当压强不再变化,t0min时,表明达到平衡状态,故D符合题意;
故选:D。
15.B
【解析】
【详解】
A.a为负极,b为正极,电子从电极a流出,经负载流向电极b,选项A正确;
B.当电极a的质量增加64g时,即生成1molS2(s),反应中化学能主要转化为电能,则电池内部释放的热能远小于632kJ,选项B错误;
C.该电池是质子固体做电解质,所以电极b反应式为,选项C正确;
D.由电极反应式2H2S-4e-=4H++S2可知,标准状况下,每11.2LH2S 物质的量=,H2S 参与反应,有1molH+经固体电解质膜进入正极区,选项D正确;
答案选B。
16.C
【解析】
【分析】
【详解】
A.由反应历程图可知:在过渡态中,催化剂能够改变反应过程中的相对能量,改变的是反应的历程,但是最终反应物和生成物不会改变,故A正确;
B.根据反应历程图可知,CO(g)+H2O(g)+H2O*的能垒为-0.32eV;CO(g)+H2O(g)+ H*+OH*的能垒为-0.16eV,所以H2O*转化为 H*和OH*时需要吸收能量,故B正确;
C.由反应历程图可知:反应过程中生成过渡态1比过渡态2的能垒小,所以过渡态1反应更容易,故C错误;
D.根据反应历程图可知,整个反应历程中1 mol CO(g)和2 mol H2O(g)生成1 mol CO2(g).和1 mol H2O(g)和1 mol H2(g)时,放出0.72 NAeV的能量,而△H为每1 mol反应对应的能量变化,所以该反应的总反应方程式为CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-0.72NAeV/mol,故D正确;
故答案:C。
17.D
【解析】
【分析】
【详解】
A.根据题意,KClO3溶液和NaHSO3溶液反应生成Cl-,Cl元素化合价降低,KClO3为氧化剂,则NaHSO3为还原剂,被氧化生成Na2SO4,该反应的离子方程式为,故A正确;
B.由图中数据可知,该反应在0~4min的平均反应速率,根据速率之比等于化学计量数之比,,故B正确;
C.由图像可知:在反应过程中,该反应的化学反应速率变化趋势为先增大后减小,故C正确;
D.起初反应很慢,一段时间后反应速率明显增大,可能温度升高,可能生成的Cl-对反应有催化作用,可能溶液酸性增强,加快了化学反应速率,故D错误;
故选D。
18.D
【解析】
【详解】
A.根据图示升高温度CH3OH的产率降低,反应CO2(g)+3H2(g)CH3OH (g)+H2O(g) 向逆反应方向移动,ΔH10,升高温度CO的产率增大,反应CO2(g)+H2(g)CO(g)+H2O(g)向正反应方向移动,ΔH20,选项A正确;
B.反应有气体参与,增大压强有利于加快合成反应的速率,选项B正确;
C.催化剂有一定的选择性,选用合适的催化剂可以减弱副反应的发生,选项C正确;
D.由图像可见,温度越高CH3OH的产率越低,选项D错误;
答案选C。
19.C
【解析】
【分析】
放电过程为原电池,NiOOH转变为Ni(OH)2,镍元素化合价由+3价降到+2价,乙为正极,电极反应式为NiOOH+H2O+e-═Ni(OH)2+OH-,甲为负极,MH中氢元素化合价由0价升高到+1价,发生氧化反应与溶液中的氢氧根离子结合成水,电极反应为MH-e-+OH-═M+H2O;充电是放电的逆过程,此时甲为阴极,发生还原反应,乙为阳极,发生氧化反应。
【详解】
A. 充电时,阴极发生还原反应,电极反应为M+H2O+e ═MH+OH ,生成氢氧根,pH增大,A错误;
B. 发电机工作时是充电过程,电解池原理,溶液中氢氧根离子向阳极移动,即乙电极迁移,B错误;
C. 正极得电子,发生还原反应,其电极反应式为NiOOH+H2O+e ═Ni(OH)2+OH ,C正确;
D. 放电过程的正极反应为:NiOOH+H2O+e ═Ni(OH)2+OH ,负极反应为:MH-e-+OH-═M+H2O,则电池总反应为:,D错误;故答案为:C。
20.B
【解析】
【分析】
【详解】
A.构成原电池的电极可以是金属与金属,也可以是金属与非金属,A项错误;
B.原电池是将化学能转化为电能的装置,B项正确;
C.原电池中电子流出的一极是负极,C项错误;
D.原电池工作时,电流是从正极到负极,D项错误。
故选:B。
21. 将硼矿石粉碎、搅拌、增大NaOH溶液的浓度、升温等 MgO、 B4O72 +2H++5H2O=4H3BO3 碱性
【解析】
【分析】
浓NaOH溶液溶解硼矿石主要成分为,还有少量MgO、等,MgO、不溶,溶解生成,过滤,滤渣为MgO、,滤液为溶液,通入适量二氧化碳得到硼砂,将硼砂溶于热水后,用调pH到2~3制取,将得到的晶体加热脱水得到,与Mg高温反应制得硼,据此解答。
【详解】
(1)将硼矿石粉碎、搅拌、增大NaOH溶液的浓度、升温等都可以加快其溶解速率,故答案为:将硼矿石粉碎、搅拌、增大NaOH溶液的浓度、升温等;
(2)、MgO不溶于NaOH,也不溶于水,故滤渣为MgO、,故答案为:MgO、;
(3)硼砂中钠元素价,氧元素价,化合物中元素化合价代数和为0,则B元素化合价为价;硼砂溶于热水后,常用调pH到2~3制取,反应的离子方程式为:B4O72 +2H++5H2O=4H3BO3。故答案为:;B4O72 +2H++5H2O=4H3BO3;
(4)晶体加热脱水的产物X为,与Mg发生置换反应,反应为:,故答案为:;
(5)因反应中,水中氢元素化合价降低,得到电子,则为氧化剂;因易与结合,而碱性溶液可抑制它与水反应,故答案为:;碱性;
(6)将等体积等物质的量浓度的与NaOH溶液混合,恰好反应完得到溶液,发生水解,减少,则,水解反应为:,溶液显碱性,则,水解程度微弱,故,故答案为:。
22.(1)第二周期第VA族
(2)2Al+2H2O+2OH-=2AlO2-+3H2↑
(3)
(4)H2O2+H2SO4+Cu=CuSO4+2H2O
(5) C2H5OH - 12e- +16OH- =2CO+ 11H2O 6.72L
【解析】
【分析】
A、B、C、D、E为短周期元素,A到E原子序数依次增大,E是地壳中含量最多的金属元素,则E为Al;A、C能形成两种液态化合物A2C和A2C2,则A为H,C为O;A、D同主族,由A、D的原子序数相差大于2,所以D为Na;元素的质子数之和为40,则B的原子序数为40-1-8-11-13=7,所以B为N,据此进行解答。
(1)
根据上述分析,A为H,B为N,C为O,D为Na,E为Al。
B为N,原子序数为7,位于元素周期表中第二周期ⅤA族,故答案为第二周期ⅤA族;
(2)
Na与水反应生成NaOH,Al与NaOH溶液反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2H2O+2OH-=2AlO+3H2↑,故答案为2Al+2H2O+2OH-=2AlO+3H2↑;
(3)
由A、C两元素组成的四核18电子的共价化合物为过氧化氢,用电子式表示过氧化氢的的形成过程为,故答案为;
(4)
A2C2为H2O2,与Cu、硫酸发生氧化还原反应生成硫酸铜和水,该反应方程式为:H2O2+H2SO4+Cu=CuSO4+2H2O,故答案为H2O2+H2SO4+Cu=CuSO4+2H2O;
(5)
乙醇(C2H5OH)燃料电池(Pt为电极),以KOH为电解质溶液,乙醇在负极发生氧化反应生成碳酸钾,电极反应式为C2H5OH - 12e- +16OH- =2CO + 11H2O,氧气在正极发生还原反应,电极反应式为O2+2H2O+4e- =4OH-,当转移电子1.2mol时,消耗氧气=0.3mol,标况下体积为0.3mol×22.4L/mol=6.72L,故答案为C2H5OH - 12e- +16OH- =2CO + 11H2O;6.72L。
23. 0.6 0.002 0.06 0.016
【解析】
【详解】
(1)化学反应速率之比等于化学反应系数之比,,故答案为:0.6。
(2)2s后测得N2的物质的量为0.09mol,在2s内N2反应了0.1 mol-0.09mol=0.01mol,,则以NH3的浓度变化表示的反应速率为:,故答案为:0.002。
(3)2s内NH3转化的物质的量为,则在2s时,容器中生成的H2的物质的量为:,此时NH3的物质的量浓度为,故答案为:0.06;0.016。
24. 0.01mol·L-1·min-1 CD > 2 >
【解析】
【分析】
【详解】
(1)若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol,因此消耗氢气的物质的量是0.2mol×=0.3mol,由方程式可知,消耗氮气为0.1mol,浓度是=0.05mol/L,则v(N2)==0.01mol·L-1·min-1;
(2)A.加了催化剂加快反应速率,不影响平衡移动,氢气转化率不变,选项A错误;
B.增大容器体积,压强减小,平衡向逆反应方向移动,氢气转化率减小,选项B错误;
C.正反应为放热反应,降低反应体系的温度,平衡正向移动,氢气转化率增大,选项C正确;
D.加入一定量N2,平衡正向移动,氢气转化率增大,选项D正确,
故答案选CD;
(3)①正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,故K1>K2;
②400℃时,反应2NH3(g)N2(g)+3H2(g)的化学平衡常数与N2(g)+3H2(g) 2NH3(g)的平衡常数互为倒数,则400℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数K==2;此时浓度商Qc==<K=2,反应向正反应进行,则该反应的v(N2)正>v(N2)逆。
25.(1) 溶液变红
(2) 、 B
(3) C 电流表指针偏转 -1.28
【解析】
【分析】
本题是一道探究类的实验题,探究了两个方面的问题,首先探究了溶液的导电性和离子浓度的关系,主要是通过离子反应进行的探究;之后探究了氧化还原反应的本质,主要是通过原电池装置进行的探究,以此解题。
(1)
①酚酞遇碱变红,故接通电源前,能说明在水中电离的实验现象为:溶液变红;
②随着硫酸的不断加入,和不断被消耗,而导致浓度降低,导电能力下降,对应的离子方程式为:
(2)
①向溶液中滴入的盐酸,氢氧根离子生成水,离子浓度降低,导电能力下降,到B点时恰好反应完全,此时溶液中的溶质为氯化钡,故此时主要微粒有、、;
②A.溶液和稀硫酸反应有硫酸钡生成,A不符合题意;
B.澄清石灰水和稀硝酸反应只是氢离子和氢氧根离子的反应,B符合题意;
C.溶液和溶液反应时,其中碳酸氢根离子不能拆,C不符合题意;
D.浓氨水和浓盐酸反应时,其中浓氨水应该写成一水合氨的形式,D不符合题意;
故选B;
(3)
①A.铁失去电子逐渐溶解,铁片质量减轻,A错误;
B.在右侧石墨棒上溶液中的铜离子得到电子生成铜单质,溶液中铜离子物质的量减少,B错误;
C.硫酸根不参加反应,硫酸根物质的量不变,C正确;
故选C;
②电流表指针偏转,说明导线中有电流通过,即有电子定向移动,故能证明氧化还原反应的实质是电子转移的现象是电流表指针偏转;
③当硫酸铜溶液的浓度变为时,则参加反应的铜离子的物质的量为:n(Cu
2+)=(1-0.2)×0.2=0.16mol,烧杯中的变化为,每减少一个铜离子就增加一个二价铁离子,质量减少64-56=8g,故当参加反应的铜离子为0.16摩尔时,溶液质量减少0.16×8=1.28g,故答案为-1.28g。
答案第1页,共2页
答案第1页,共2页
一、单选题
1.下列变化中属于吸热反应的是
①液态水汽化 ②将胆矾加热变为白色粉末 ③苛性钠固体溶于水 ④氯酸钾分解制氧气 ⑤生石灰跟水反应生成熟石灰 ⑥干冰升华
A.②④ B.①②④⑥ C.③⑤ D.②③④
2.下列关于化学反应的速率和限度的说法不正确的是
A.任何可逆反应都有一定的限度
B.影响化学反应速率的条件有温度、催化剂、浓度等
C.化学平衡状态指的是反应物和生成物浓度相等时的状态
D.决定化学反应速率的主要因素是物质本身的性质
3.下列说法不正确的是
A.任何反应都存在化学平衡状态
B.化学反应的限度可以通过改变条件来改变
C.达到化学平衡状态时,正反应速率等于逆反应速率
D.化学平衡状态是反应在该条件下所能达到的最大反应限度
4.肼(H2NNH2)是一种高能燃料,有关化学反应的能量变化如图所示,已知断裂1mol化学键所需的能量(kJ):N≡N为942、O=O为500、N-N为154,则断裂1molN-H所需的能量(kJ)是
A.194 B.391 C.516 D.658
5.N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如下,用、、分别表示N2、H2、NH3,已知:N2(g)+3H2(g) 2NH3(g),该反应属于放热反应。下列说法不正确的是
A.②→③过程,是吸热过程
B.③→④过程,N原子和H原子形成了含有极性键的NH3
C.合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量
D.合成氨反应中,反应物总能量大于生成物总能量
6.下列有关原电池的说法中正确的是
A.在外电路中,电子由负极经导线流向正极
B.在内电路中,电子由正极经电解质溶液流向负极
C.原电池工作时,正极表面一定有气泡产生
D.原电池工作时,一定不会伴随着热能变化
7.已知某反应的能量变化如图所示,下列说法正确的是
A.该反应可用于表示Mg与硫酸反应
B.该反应只有在加热条件下才能进行
C.反应物的总能量高于生成物的总能量
D.该反应可以用于表示CaCO3受热分解的反应
8.某原电池的总反应的离子方程式为2Fe3++Fe=3Fe2+,不能实现该反应的原电池是
选项 正极 负极 电解质溶液
A Cu Fe FeCl3溶液
B C Fe Fe(NO3)3溶液
C Fe Zn Fe2(SO4)3溶液
D Ag Fe Fe2(SO4)3溶液
A.A B.B C.C D.D
9.将4molA气体和2molB气体在2L的密闭容器中混合,并在一定条件下发生如下反应:,反应2s后达到平衡状态,测得C的物质的量为1.2mol。下列说法正确的是
A.用物质A表示2s内的平均反应速率为
B.用物质B表示2s内的平均反应速率为
C.单位时间内有a mol A生成,同时有2a mol C生成,说明反应达到平衡状态
D.当A、B、C的反应速率之比为1∶1∶2时达到平衡状态
10.下列关于原电池的叙述正确的是( )
A.构成原电池的正极和负极的材料必须是两种不同的金属
B.原电池是将化学能转化为电能的装置
C.在原电池中,电子流出的一极是正极
D.原电池工作时,电路中的电流是从负极到正极
11.一定温度时,向2.0L恒容密闭容器中充入2molSO2和1mol O2,发生反应:2SO2(g)+O2(g)2SO3(g)。经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s 0 2 4 6 8
n(SO3)/mol 0 0.8 1.4 1.8 1.8
下列说法正确的是( )A.反应在前2s的平均速率v(O2)=0.2mol·L-1·s-1
B.保持其他条件不变,体积压缩到1.0L,平衡常数将增大
C.相同温度下,起始时向容器中充入4molSO3,达到平衡时,SO3的转化率大于10%
D.保持温度不变向该容器中再充入2molSO2、1molO2,反应达到新平衡时增大
12.下列说法正确的是
A.吸热反应中反应物的总能量大于生成物的总能量
B.将Mg、A1片用导线连接后放入氢氧化钠溶液中组成原电池,Al为负极,Mg为正极
C.由CO、空气和稀硫酸构成的燃料电池的负极反应是2CO+4e-+2H2O=2CO2↑+4H+
D.充电电池可以无限制地反复放电、充电
13.下列有关叙述不正确的是
选项 已知 解释与结论
A 活泼金属Al、不活泼金属Cu和浓硝酸可以形成原电池 Al作正极,Cu作负极
B 该反应在常温下能自发进行 该反应的
C 常温下,、 向溶液中加入和KBr,当AgCl、AgBr两种沉淀共存时,
D 向溶液中滴入硫酸酸化的溶液,振荡,溶液变为黄色 氧化性:
A.A B.B C.C D.D
14.一定温度下,在恒容密闭容器中充入CO和H2,发生反应:2H2(g)+CO(g) CH3OH(g) △H<0。下列图像符合实际且t0时达到平衡状态的是( )
A. B.
C. D.
15.十九大报告中提出要“打赢蓝天保卫战”,意味着对大气污染防治比过去要求更高。硫化氢-空气质子交换膜燃料电池实现了发电、环保的有效结合,已知:2H2S(g)+O2(g)=S2(s)+2H2O(l) H=-632kJ/mol,下列说法中错误的是
A.电子从电极a流出,经负载流向电极b
B.当电极a的质量增加64g时,电池内部释放632kJ的热能
C.电极b上发生的电极反应为
D.标准状况下,每11.2LH2S参与反应,有1molH+经固体电解质膜进入正极区
16.我国学者研究了在金催化剂表面上水煤气变换的反应历程,如图所示(其中吸附在金催化剂表面上的物种用 标注)
下列说法不正确的是
A.催化剂能够改变反应历程
B.H2O*转化为 H*和OH*时需要吸收能量
C.反应过程中,过渡态1比过渡态2更难达到
D.总反应方程式为CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-0.72NAeV/mol
17.某化学小组欲测定酸性条件下溶液与溶液反应的化学反应速率,所用的试剂为溶液和溶液,所得随时间变化的曲线如图所示。下列说法错误的是
A.该反应的离子方程式为
B.该反应在的平均反应速率
C.在反应过程中,该反应的化学反应速率变化趋势为先增大后减小
D.起初反应很慢,一段时间后反应速率明显增大,一定是反应放热温度升高的结果
18.在一定条件下,利用CO2合成CH3OH的反应为CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H1,研究发现,反应过程中会发生副反应为CO2(g)+H2(g) CO(g)+H2O(g) △H2,温度对CH3OH、CO的产率影响如图所示。下列说法中不正确的是
A.△H1<0,△H2>0
B.增大压强有利于加快合成反应的速率
C.选用合适的催化剂可以减弱副反应的发生
D.生产过程中,温度越高越有利于提高CH3OH的产率
19.混合动力汽车(HEV)中使用了镍氢电池,其工作原理如图所示:其中M为储氢合金,为吸附了氢原子的储氢合金,溶液作电解液。关于镍氢电池,下列说法正确的是
A.充电时,阴极附近降低
B.发电机工作时溶液中向甲移动
C.放电时正极反应式为:
D.电极总反应式为:
20.下列关于原电池的叙述正确的是( )
A.构成原电池的正极和负极的材料必须是两种不同的金属
B.原电池是将化学能转化为电能的装置
C.在原电池中,电子流出的一极是正极
D.原电池工作时,电路中的电流是从负极到正极
第II卷(非选择题)
请点击修改第II卷的文字说明
二、工业流程题
21.硼及其化合物在工业上有许多用途。工业上用硼矿石主要成分为,还有少量MgO、等为原料制备粗硼的工艺流程如图所示。
已知:①偏硼酸钠易溶于水,在碱性条件下稳定存在。②硼砂的化学式为。回答下列问题:
(1)欲提高硼矿石的溶解速率,可采取的措施有______写出两条。
(2)滤渣主要成分是______。
(3)硼砂中B的化合价为______,溶于热水后,常用调pH到2~3制取,反应的离子方程式为______。
(4)为晶体加热脱水的产物其与Mg反应制取粗硼的化学方程式为______。
(5)以硼酸为原料可制得硼氢化钠,它与水反应的离子方程式为,该反应中氧化剂是______;硼氢化钠能把许多金属离子还原为金属单质,为抑制它与水的反应反应可在______填“酸性”“中性”或“碱性“条件下进行。
(6)硼酸熔点为,露置空气中无变化,加热至时失水而变成偏硼酸:。已知是弱酸,将等体积等物质的量浓度的与NaOH溶液混合,所得溶液中离子浓度从大到小的顺序是______。
三、元素或物质推断题
22.A、B、C、D、E为短周期元素,原子序数依次增大,质子数之和为40,B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E是地壳中含量最多的金属元素,问:
(1)B元素在周期表中的位置为_________________;
(2)D的单质投入A2C中得到一种无色溶液。E的单质在该无色溶液中反应的离子方程式为_____________________。
(3)用电子式表示由A、C两元素组成的四核18电子的共价化合物的形成过程_____________。
(4)以往回收电路板中铜的方法是灼烧使铜转化为氧化铜,再用硫酸溶解。现改用A2C2和稀硫酸浸泡既达到了上述目的,又保护了环境,该反应的化学方程式为___________________。
(5)乙醇(C2H5OH)燃料电池(Pt为电极),以KOH为电解质溶液,写出负极电极反应式__________,当转移电子1.2mol时,消耗氧气标况下体积为______________。
四、填空题
23.根据所学知识,回答下列问题:
(1)在反应N2(g)+3H2(g) 2NH3(g)中,若以N2表示的该反应的化学反应速率为0.2 mol/(L·min),则以H2表示此反应的化学反应速率为 _____________ mol/(L·min)
(2)在5 L的恒容密闭容器中,充人0.1 mol N2和0.4 mol H2,在一定条件下发生反应,2s后测得N2的物质的量为0.09mol,则以NH3的浓度变化表示的反应速率为 ___________ mol/(L·s)
(3)将0.2 mol NH3充人容积为10 L的恒容密闭容器中,某温度下发生反应2NH3(g)N2(g) + 3H2(g),在0~2s内,消耗NH3的平均速率为0.002 mol/(L·s),则在2s时,容器中生成_____________molH2,此时NH3的物质的量浓度为______________ mol/L。
五、计算题
24.氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用,合成氨工业在国民生产中有重要意义。以下是关于合成氨的有关问题,请回答:
(1)若在一容积为2 L的密闭容器中加入0.2 mol的N2和0.6 mol的H2在一定条件下发生反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol。则前5分钟的平均反应速率v(N2)=_______。
(2)平衡后,若提高H2的转化率,可以采取的措施有_______。
A.加了催化剂 B.增大容器体积
C.降低反应体系的温度 D.加入一定量N2
(3)若在0.5 L的密闭容器中,一定量的氮气和氢气进行如下反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,其化学平衡常数K与温度T的关系如表所示:
T/℃ 200 300 400
K K1 K3 0.5
请完成下列问题:
①试比较K1、K2的大小,K1_______K2(填“<”“>”或“=”);
②400℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数为_______。当测得NH3、N2和H2物质的量分别为3 mol、2 mol和 1 mol时,则该反应的v(N2)正_______v(N2)逆(填“<”“>”或“=”)。
六、实验题
25.宏观辨识、微观探析和符号表征是体现化学学科特征的思维方式.某化学兴趣小组设计实验,探究离子反应及氧化还原反应的本质。
I.离子反应
(1)向溶液中滴入几滴酚酞溶液,装置如图。接通电源,向该溶液中滴入溶液。
回答下列问题:
①接通电源前,能说明在水中电离的实验现象为_______。
②随着溶液的滴入,观察到烧杯中溶液红色逐渐褪去,产生白色沉淀,小灯泡亮度变暗,这些现象说明该反应的微观本质是和浓度降低,写出该反应的离子方程式_______。
(2)向溶液中滴入的盐酸,测定电导率的变化如图所示。
回答下列问题:
①B点恰好完全反应,此时溶液中存在的主要微粒有、_______。
②下列化学反应的离子方程式与溶液和稀盐酸反应相同的是_______。
A.溶液和稀硫酸 B.澄清石灰水和稀硝酸
C.溶液和溶液 D.浓氨水和浓盐酸
II.氧化还原反应
(3)将铁片和石墨棒用导线连接,平行放置在的硫酸铜溶液中,装置如图,观察到电流表指针偏转,铁片逐渐溶解,石墨棒上有红色物质析出。
回答下列问题:
①下列图示能正确表示实验过程的是_______(填序号)。
②能证明氧化还原反应的实质是电子转移的现象是_______。
③当硫酸铜溶液的浓度变为时,烧杯中溶液的质量变化_______g[(反应后)(反应前);假设反应前后溶液体积不发生变化]。
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.A
【解析】
【详解】
①水汽化是物理变化,不属于吸热反应,故①错误;
②胆矾CuSO4 5H2O受热分解生成CuSO4和H2O,属于吸热反应,故②正确;
③苛性钠固体溶于水是放热过程,属于物理变化,故③错误;
④氯酸钾分解制氧气属于吸热反应,故④正确;
⑤生石灰跟水反应生成熟石灰是化合反应,属于放热反应,故⑤错误;
⑥干冰升华为物理变化,故⑥错误;
属于吸热反应的有②④;
故选A。
2.C
【解析】
【分析】
【详解】
A.任何可逆反应都有一定的限度,符合可逆反应的规律,故A正确;
B. 影响化学反应速率的条件有温度、催化剂、浓度等,符合影响反应速率的因素,故B正确;
C. 化学平衡状态指的是反应物和生成物浓度不再变化时的状态,而不一定是相等的状态,故C错误;
D. 决定化学反应速率的主要因素是物质本身的性质(内因),符合影响反应速率的因素,故D正确。
答案选C。
3.A
【解析】
【分析】
【详解】
A.只有可逆反应才存在化学平衡状态,A项错误;
B.化学反应的限度可以通过改变条件来改变,B项正确;
C.达到化学平衡状态时,正反应速率等于逆反应速率,C项正确;
D.化学平衡状态是反应在该条件下所能达到的最大反应限度,D项正确;
答案选A。
4.B
【解析】
【分析】
【详解】
根据图中内容,可以看出N2H4(g)+O2(g)=2N(g)+4H(g)+2O(g), E1=2752J-534kJ=2218kJ,E(N-N)+E(O=O)+4E(N-H)=2218kJ,154kJ+500kJ+4E(N-H) =2218kJ,解得E(N-H)=391kJ,故选B。
5.C
【解析】
【分析】
【详解】
A.②→③过程是化学键断裂的过程,是吸热过程,A正确;
B.③→④过程,N原子和H原子形成了含有极性键的NH3,B正确;
C.合成氨反应是放热非农业,反应物断键吸收的能量小于生成物形成新键释放的能量,C错误;
D.合成氨反应是放热反应,说明反应物总能量大于生成物总能量,D正确;
故选C。
6.A
【解析】
【详解】
A.外电路中电子由负极流向正极,A正确,
B.在内电路中,是阴、阳离子移动,B错误;
C.原电池工作时,正极上一般是溶液中的阳离子得电子,则正极表面可能有气泡产生,也可能生成金属单质,C错误;
D.原电池工作时,化学能转化为电能,同时可能会伴随着热能变化,D错误。
故选A。
7.D
【解析】
【分析】
【详解】
由图得出的信息是反应物能量低于生成物能量,是吸热反应;
A.Mg与硫酸反应是放热反应,与图示不一致,故A 错误;
B.反应是吸热还是放热与反应条件无关,故B错误;
C.从图看出反应物的总能量低于生成物的总能量,故C错误;
D.CaCO3受热分解的反应是吸热反应,符合图示,故D正确;
故答案为:D
8.C
【解析】
【详解】
根据2Fe3++Fe=3Fe2+知,铁易失电子而作负极,不如铁活泼的金属或导电的非金属作正极,铁离子得电子发生还原反应,所以电解质溶液为可溶性的铁盐:
A.铜作正极,铁作负极,电解质为可溶性的氯化铁,则符合题意,故A不选;
B.铁作负极,碳作正极,电解质为Fe(NO3)3溶液,能发生氧化还原反应,则符合题意,故B不选;
C.Zn的金属活泼性比Fe强,则Zn作负极,Fe作正极,电解质为可溶性的硫酸铁,所以不能构成该条件下的原电池,则不符合题意,故C选;
D.Fe作负极,银作正极,电解质为Fe2(SO4)3溶液,发生反应为2Fe3++Fe═3Fe2+,符合题意,故D不选;
故选C。
9.C
【解析】
【详解】
A.反应2s后测得C的物质的最为1.2mol,用物质C表示2s内的平均反应速率为,根据反应速率之比等于化学计量数之比可知,用物质A表示2s内的平均反应速率为,A错误;
B.用物质B表示2s内的平均反应速率为,B错误;
C.单位时间内有a mol A生成同时有2a mol C生成,说明正、逆反应速率相等,反应达到平衡状态,C正确;
D.当A、B、C的反应速率之比为1∶1∶2时,并不能够说明正、逆反应速率相等,不能证明反应达到平衡状态,D错误。
答案选C。
10.B
【解析】
【分析】
【详解】
A.构成原电池的电极可以是金属与金属,也可以是金属与非金属,A项错误;
B.原电池是将化学能转化为电能的装置,B项正确;
C.原电池中电子流出的一极是负极,C项错误;
D.原电池工作时,电流是从正极到负极,D项错误。
故选:B。
11.D
【解析】
【详解】
A.反应反应在前2s的平均速率v(SO3),同一反应中速率之比等于计量数之比,所以v(O2)=×0.2mol·L-1·s-1=0.1mol·L-1·s-1,故A错误;
B.平衡常数只受温度的影响,保持其他条件不变,体积压缩到1.0L,平衡常数不变,故B错误;
C. 充入2molSO2和1mol O2,相当于充入2molSO3,此时SO3的转化率为 ,相同温度下,起始时向容器中充入4molSO3,假设达到的是等效平衡,则转化率不变,实际上相当于增大压强,平衡会右移,降低三氧化硫的转化率,故C错误;
D. 温度不变,向该容器中再充入2mol SO2、1mol O2,若保持与原平衡的压强相同,则可达到等效平衡,不变;然后将容器压缩到原容器的体积,则平衡正向移动,二氧化硫的转化率增大,氧气的的转化率也增大,所以该比值增大,故D正确。
故答案为D。
【点睛】
注意“等效平衡”和“虚拟状态”法在分析转化率、物质浓度等变化问题中的应用。
12.B
【解析】
【详解】
A.吸热反应中反应物的总能量小于生成物的总能量,故A错误;
B.铝能与氢氧化钠溶液反应生成偏铝酸钠和氢气,将Mg、A1片用导线连接后放入氢氧化钠溶液中组成原电池,Al为负极,Mg为正极,故B正确;
C.原电池负极失电子发生氧化反应,由CO、空气和稀硫酸构成的燃料电池的负极反应是2CO-4e-+2H2O=2CO2↑+4H+,故C错误;
D.充电电池的充放电次数也是一定的,不能无限制的使用,故D错误;
选B。
13.D
【解析】
【详解】
A.在浓硝酸、Al、Cu原电池中,Cu作负极,发生氧化反应,Al钝化作正极,A正确;
B.该反应的△S<0,常温下能自发进行,必须△H<0,B正确;
C.当两种沉淀共存时,溶液中Ag+离子浓度相同,根据溶度积常数计算, , ,则。C正确;
D.硝酸根离子在酸性条件下也能将亚铁离子氧化为铁离子,所以不能判断氧化性,D错误;
答案选D。
14.D
【解析】
【详解】
A. 该反应中气体总质量、容器容积为定值,则密度始终不变,图示曲线不符合实际,且不能根据密度不变判断平衡状态,故A不符合题意;
B. 初始时CH3OH(g)的体积分数应该为0,图示曲线与实际不符,故B不符合题意;
C. 2H2(g)+CO(g) CH3OH(g)为气体体积缩小的反应,混合气体总质量为定值,则建立平衡过程中混合气体的平均摩尔质量逐渐增大,图示曲线与实际不符,故C不符合题意;
D. 2H2(g)+CO(g) CH3OH(g)为气体体积缩小的反应,反应过程中压强逐渐减小,当压强不再变化,t0min时,表明达到平衡状态,故D符合题意;
故选:D。
15.B
【解析】
【详解】
A.a为负极,b为正极,电子从电极a流出,经负载流向电极b,选项A正确;
B.当电极a的质量增加64g时,即生成1molS2(s),反应中化学能主要转化为电能,则电池内部释放的热能远小于632kJ,选项B错误;
C.该电池是质子固体做电解质,所以电极b反应式为,选项C正确;
D.由电极反应式2H2S-4e-=4H++S2可知,标准状况下,每11.2LH2S 物质的量=,H2S 参与反应,有1molH+经固体电解质膜进入正极区,选项D正确;
答案选B。
16.C
【解析】
【分析】
【详解】
A.由反应历程图可知:在过渡态中,催化剂能够改变反应过程中的相对能量,改变的是反应的历程,但是最终反应物和生成物不会改变,故A正确;
B.根据反应历程图可知,CO(g)+H2O(g)+H2O*的能垒为-0.32eV;CO(g)+H2O(g)+ H*+OH*的能垒为-0.16eV,所以H2O*转化为 H*和OH*时需要吸收能量,故B正确;
C.由反应历程图可知:反应过程中生成过渡态1比过渡态2的能垒小,所以过渡态1反应更容易,故C错误;
D.根据反应历程图可知,整个反应历程中1 mol CO(g)和2 mol H2O(g)生成1 mol CO2(g).和1 mol H2O(g)和1 mol H2(g)时,放出0.72 NAeV的能量,而△H为每1 mol反应对应的能量变化,所以该反应的总反应方程式为CO(g)+H2O(g)=CO2(g)+H2(g) ΔH=-0.72NAeV/mol,故D正确;
故答案:C。
17.D
【解析】
【分析】
【详解】
A.根据题意,KClO3溶液和NaHSO3溶液反应生成Cl-,Cl元素化合价降低,KClO3为氧化剂,则NaHSO3为还原剂,被氧化生成Na2SO4,该反应的离子方程式为,故A正确;
B.由图中数据可知,该反应在0~4min的平均反应速率,根据速率之比等于化学计量数之比,,故B正确;
C.由图像可知:在反应过程中,该反应的化学反应速率变化趋势为先增大后减小,故C正确;
D.起初反应很慢,一段时间后反应速率明显增大,可能温度升高,可能生成的Cl-对反应有催化作用,可能溶液酸性增强,加快了化学反应速率,故D错误;
故选D。
18.D
【解析】
【详解】
A.根据图示升高温度CH3OH的产率降低,反应CO2(g)+3H2(g)CH3OH (g)+H2O(g) 向逆反应方向移动,ΔH10,升高温度CO的产率增大,反应CO2(g)+H2(g)CO(g)+H2O(g)向正反应方向移动,ΔH20,选项A正确;
B.反应有气体参与,增大压强有利于加快合成反应的速率,选项B正确;
C.催化剂有一定的选择性,选用合适的催化剂可以减弱副反应的发生,选项C正确;
D.由图像可见,温度越高CH3OH的产率越低,选项D错误;
答案选C。
19.C
【解析】
【分析】
放电过程为原电池,NiOOH转变为Ni(OH)2,镍元素化合价由+3价降到+2价,乙为正极,电极反应式为NiOOH+H2O+e-═Ni(OH)2+OH-,甲为负极,MH中氢元素化合价由0价升高到+1价,发生氧化反应与溶液中的氢氧根离子结合成水,电极反应为MH-e-+OH-═M+H2O;充电是放电的逆过程,此时甲为阴极,发生还原反应,乙为阳极,发生氧化反应。
【详解】
A. 充电时,阴极发生还原反应,电极反应为M+H2O+e ═MH+OH ,生成氢氧根,pH增大,A错误;
B. 发电机工作时是充电过程,电解池原理,溶液中氢氧根离子向阳极移动,即乙电极迁移,B错误;
C. 正极得电子,发生还原反应,其电极反应式为NiOOH+H2O+e ═Ni(OH)2+OH ,C正确;
D. 放电过程的正极反应为:NiOOH+H2O+e ═Ni(OH)2+OH ,负极反应为:MH-e-+OH-═M+H2O,则电池总反应为:,D错误;故答案为:C。
20.B
【解析】
【分析】
【详解】
A.构成原电池的电极可以是金属与金属,也可以是金属与非金属,A项错误;
B.原电池是将化学能转化为电能的装置,B项正确;
C.原电池中电子流出的一极是负极,C项错误;
D.原电池工作时,电流是从正极到负极,D项错误。
故选:B。
21. 将硼矿石粉碎、搅拌、增大NaOH溶液的浓度、升温等 MgO、 B4O72 +2H++5H2O=4H3BO3 碱性
【解析】
【分析】
浓NaOH溶液溶解硼矿石主要成分为,还有少量MgO、等,MgO、不溶,溶解生成,过滤,滤渣为MgO、,滤液为溶液,通入适量二氧化碳得到硼砂,将硼砂溶于热水后,用调pH到2~3制取,将得到的晶体加热脱水得到,与Mg高温反应制得硼,据此解答。
【详解】
(1)将硼矿石粉碎、搅拌、增大NaOH溶液的浓度、升温等都可以加快其溶解速率,故答案为:将硼矿石粉碎、搅拌、增大NaOH溶液的浓度、升温等;
(2)、MgO不溶于NaOH,也不溶于水,故滤渣为MgO、,故答案为:MgO、;
(3)硼砂中钠元素价,氧元素价,化合物中元素化合价代数和为0,则B元素化合价为价;硼砂溶于热水后,常用调pH到2~3制取,反应的离子方程式为:B4O72 +2H++5H2O=4H3BO3。故答案为:;B4O72 +2H++5H2O=4H3BO3;
(4)晶体加热脱水的产物X为,与Mg发生置换反应,反应为:,故答案为:;
(5)因反应中,水中氢元素化合价降低,得到电子,则为氧化剂;因易与结合,而碱性溶液可抑制它与水反应,故答案为:;碱性;
(6)将等体积等物质的量浓度的与NaOH溶液混合,恰好反应完得到溶液,发生水解,减少,则,水解反应为:,溶液显碱性,则,水解程度微弱,故,故答案为:。
22.(1)第二周期第VA族
(2)2Al+2H2O+2OH-=2AlO2-+3H2↑
(3)
(4)H2O2+H2SO4+Cu=CuSO4+2H2O
(5) C2H5OH - 12e- +16OH- =2CO+ 11H2O 6.72L
【解析】
【分析】
A、B、C、D、E为短周期元素,A到E原子序数依次增大,E是地壳中含量最多的金属元素,则E为Al;A、C能形成两种液态化合物A2C和A2C2,则A为H,C为O;A、D同主族,由A、D的原子序数相差大于2,所以D为Na;元素的质子数之和为40,则B的原子序数为40-1-8-11-13=7,所以B为N,据此进行解答。
(1)
根据上述分析,A为H,B为N,C为O,D为Na,E为Al。
B为N,原子序数为7,位于元素周期表中第二周期ⅤA族,故答案为第二周期ⅤA族;
(2)
Na与水反应生成NaOH,Al与NaOH溶液反应生成偏铝酸钠和氢气,反应的离子方程式为:2Al+2H2O+2OH-=2AlO+3H2↑,故答案为2Al+2H2O+2OH-=2AlO+3H2↑;
(3)
由A、C两元素组成的四核18电子的共价化合物为过氧化氢,用电子式表示过氧化氢的的形成过程为,故答案为;
(4)
A2C2为H2O2,与Cu、硫酸发生氧化还原反应生成硫酸铜和水,该反应方程式为:H2O2+H2SO4+Cu=CuSO4+2H2O,故答案为H2O2+H2SO4+Cu=CuSO4+2H2O;
(5)
乙醇(C2H5OH)燃料电池(Pt为电极),以KOH为电解质溶液,乙醇在负极发生氧化反应生成碳酸钾,电极反应式为C2H5OH - 12e- +16OH- =2CO + 11H2O,氧气在正极发生还原反应,电极反应式为O2+2H2O+4e- =4OH-,当转移电子1.2mol时,消耗氧气=0.3mol,标况下体积为0.3mol×22.4L/mol=6.72L,故答案为C2H5OH - 12e- +16OH- =2CO + 11H2O;6.72L。
23. 0.6 0.002 0.06 0.016
【解析】
【详解】
(1)化学反应速率之比等于化学反应系数之比,,故答案为:0.6。
(2)2s后测得N2的物质的量为0.09mol,在2s内N2反应了0.1 mol-0.09mol=0.01mol,,则以NH3的浓度变化表示的反应速率为:,故答案为:0.002。
(3)2s内NH3转化的物质的量为,则在2s时,容器中生成的H2的物质的量为:,此时NH3的物质的量浓度为,故答案为:0.06;0.016。
24. 0.01mol·L-1·min-1 CD > 2 >
【解析】
【分析】
【详解】
(1)若在5分钟时反应达到平衡,此时测得NH3的物质的量为0.2 mol,因此消耗氢气的物质的量是0.2mol×=0.3mol,由方程式可知,消耗氮气为0.1mol,浓度是=0.05mol/L,则v(N2)==0.01mol·L-1·min-1;
(2)A.加了催化剂加快反应速率,不影响平衡移动,氢气转化率不变,选项A错误;
B.增大容器体积,压强减小,平衡向逆反应方向移动,氢气转化率减小,选项B错误;
C.正反应为放热反应,降低反应体系的温度,平衡正向移动,氢气转化率增大,选项C正确;
D.加入一定量N2,平衡正向移动,氢气转化率增大,选项D正确,
故答案选CD;
(3)①正反应为放热反应,升高温度平衡逆向移动,平衡常数减小,故K1>K2;
②400℃时,反应2NH3(g)N2(g)+3H2(g)的化学平衡常数与N2(g)+3H2(g) 2NH3(g)的平衡常数互为倒数,则400℃时,反应2NH3(g) N2(g)+3H2(g)的化学平衡常数K==2;此时浓度商Qc==<K=2,反应向正反应进行,则该反应的v(N2)正>v(N2)逆。
25.(1) 溶液变红
(2) 、 B
(3) C 电流表指针偏转 -1.28
【解析】
【分析】
本题是一道探究类的实验题,探究了两个方面的问题,首先探究了溶液的导电性和离子浓度的关系,主要是通过离子反应进行的探究;之后探究了氧化还原反应的本质,主要是通过原电池装置进行的探究,以此解题。
(1)
①酚酞遇碱变红,故接通电源前,能说明在水中电离的实验现象为:溶液变红;
②随着硫酸的不断加入,和不断被消耗,而导致浓度降低,导电能力下降,对应的离子方程式为:
(2)
①向溶液中滴入的盐酸,氢氧根离子生成水,离子浓度降低,导电能力下降,到B点时恰好反应完全,此时溶液中的溶质为氯化钡,故此时主要微粒有、、;
②A.溶液和稀硫酸反应有硫酸钡生成,A不符合题意;
B.澄清石灰水和稀硝酸反应只是氢离子和氢氧根离子的反应,B符合题意;
C.溶液和溶液反应时,其中碳酸氢根离子不能拆,C不符合题意;
D.浓氨水和浓盐酸反应时,其中浓氨水应该写成一水合氨的形式,D不符合题意;
故选B;
(3)
①A.铁失去电子逐渐溶解,铁片质量减轻,A错误;
B.在右侧石墨棒上溶液中的铜离子得到电子生成铜单质,溶液中铜离子物质的量减少,B错误;
C.硫酸根不参加反应,硫酸根物质的量不变,C正确;
故选C;
②电流表指针偏转,说明导线中有电流通过,即有电子定向移动,故能证明氧化还原反应的实质是电子转移的现象是电流表指针偏转;
③当硫酸铜溶液的浓度变为时,则参加反应的铜离子的物质的量为:n(Cu
2+)=(1-0.2)×0.2=0.16mol,烧杯中的变化为,每减少一个铜离子就增加一个二价铁离子,质量减少64-56=8g,故当参加反应的铜离子为0.16摩尔时,溶液质量减少0.16×8=1.28g,故答案为-1.28g。
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
