人教版化学九年级下册 第九单元溶液课题3溶液的浓度-课件(共20张PPT)
文档属性
| 名称 | 人教版化学九年级下册 第九单元溶液课题3溶液的浓度-课件(共20张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 419.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-20 15:40:58 | ||
图片预览








文档简介
(共20张PPT)
第九单元 溶液
课题3 溶液的浓度
硫酸铜溶液
淡蓝
蓝色
深蓝
如何准确表示溶液的浓稀程度?
溶液的浓度
一定量的溶液里所含溶质的量。
(一)溶质质量分数
1.定义:溶质的质量与溶液的质量之比
2.定义式:
溶液的溶质质量分数= ×100%
溶质质量
溶液质量
合作探究1
实验9-7,完成以下表格
烧杯编号 溶液颜色比较 溶剂质量/g 溶质质量/g 溶液质量/g 溶质的质量分数
1
2
3
发现:溶质质量分数和溶液的颜色相比更能准确
表示溶液中溶质和溶液的关系。
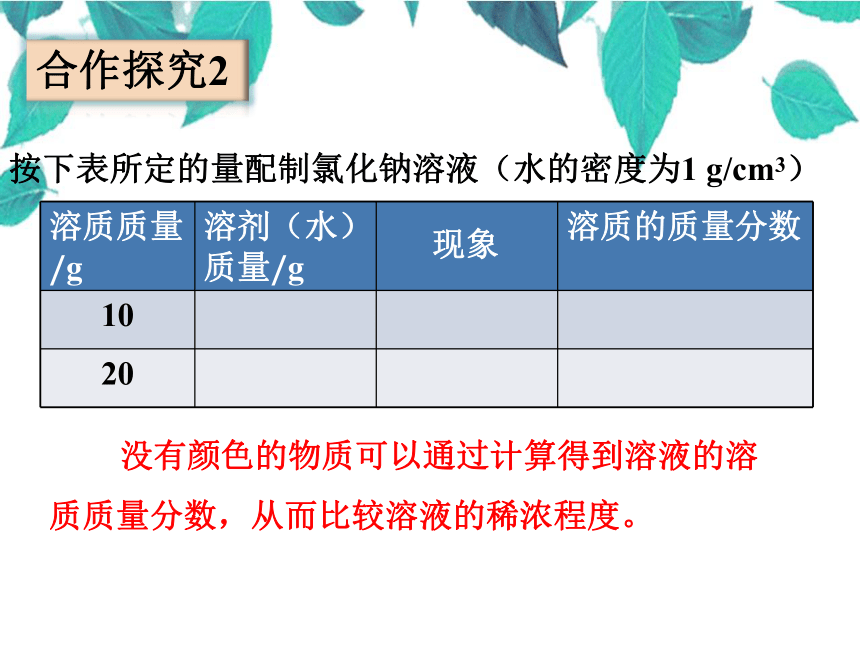
溶质质量/g 溶剂(水)质量/g 溶质的质量分数
10
20
按下表所定的量配制氯化钠溶液(水的密度为1 g/cm3)
合作探究2
没有颜色的物质可以通过计算得到溶液的溶质质量分数,从而比较溶液的稀浓程度。
现象
【计算题注意事项】
1.溶液参加化学反应,一般来讲真正反应的物质
是溶液中的溶质。
2.在计算过程中对待溶液要一分为二,例如:
100 g 10%的氯化钠溶液。
一是溶质质量为:100 g×10% = 10 g;
二是溶剂质量为:100 g-10 g = 90 g。
3.配制一定溶质质量分数的溶液步骤。
【例题1】
在农业生产中,常需要用质量分数为16%的氯化钠溶液选种。现需要配置150 kg这种溶液,需要氯化钠和水的质量各是多少?
解:
溶质的质量分数= ×100%
溶质质量=溶液质量×溶质的质量分数
=150 kg×16%=24 kg
溶剂质量=溶液质量-溶质质量
=150 kg-24 kg=126 kg
答:配置150 kg质量分数为16%的氯化钠溶液,需24 kg氯化钠和126 kg水。
溶质质量
溶液质量
【例题2】
化学实验室现有质量分数为98%的浓硫酸,但在实验室中常需要用较稀的硫酸。要把50 g上述浓硫酸稀释为质量分数为20%的硫酸,需要水的质量是多少?
分析:溶液稀释前后,溶质质量不变。
解 设:稀释后溶液的质量为 x。
50 g×98%= x×20%
解方程: x =245 g
需要水的质量=245 g-50 g=195 g
答:要把50 g质量分数为98%的硫酸稀释为
质量分数为20%的硫酸,需要水195 g。
【例题3】
100 g某硫酸溶液恰好与13 g锌完全反应。试计算这种硫酸溶液中溶质的质量分数。
65
13 g
98
x
=
x =19.6 g
x =
98×13 g
65
溶质的质量分数= ×100% = 19.6%
19.6 g
100 g
答:这种硫酸溶液中溶质的质量分数为19.6%。
分析:与化学方程式结合起来的题目寻找溶质、溶剂、溶液的量。
解 设:这种硫酸中溶质的质量为 x。
Zn+H2SO4 ZnSO4+H2
65 98
13 g x
配制一定溶质质量分数的溶液
1. 计算 2.称量 3.量取 4.溶解
步骤:
仪器:
托盘天平、药匙、量筒、玻璃杯、胶头滴管、烧杯
下图是小明配制100 g溶质质量分数为12%的NaCl溶液的有关实验操作示意图。
(1)配制过程中使用的四种玻璃仪器,分别是广口瓶、_______、
________、______。
(2)正确的操作顺序应该是____________。
(3)请你指出图中一处错误操作,并分析该操作可能造成的后
果。______________________________________________。
(4)图②、图③表示的操作步骤分别是____________。
烧杯
玻璃棒
称量过程中氯化钠和砝码放反,造成氯化钠质量偏小
称量、溶解
量筒
④②①⑤③
谈体会说收获
练一练
1.向l00 g 10% NaOH溶液中加入12.5 g NaOH固体,
完全溶解后,所得溶液中溶质质量分数为( )
A.12. 5% B.20.0%
C.22.5% D.25%
B
2.农业上常用16%的氯化钠溶液来选种。下列方法能
配制出该选种溶液的是( )
A.4 g氯化钠和16 g水
B.16 g 20%的氯化钠溶液和5 g水
C.10 g 8%的氯化钠溶液蒸发4 g水
D.14 g 10%的氯化钠溶液和1 g氯化钠
D
3. 有100 g 10%的食盐溶液,要使其质量分数变为
20%,有三种方法,按要求填空:
(1)继续加入食盐,其质量为______g;
(2)蒸发水分,其质量为____g;
(3)与质量分数大于20%的浓食盐溶液混合,若混入
25%的食盐溶液,其溶液质量为____ g。
12.5
50
200
再见
第九单元 溶液
课题3 溶液的浓度
硫酸铜溶液
淡蓝
蓝色
深蓝
如何准确表示溶液的浓稀程度?
溶液的浓度
一定量的溶液里所含溶质的量。
(一)溶质质量分数
1.定义:溶质的质量与溶液的质量之比
2.定义式:
溶液的溶质质量分数= ×100%
溶质质量
溶液质量
合作探究1
实验9-7,完成以下表格
烧杯编号 溶液颜色比较 溶剂质量/g 溶质质量/g 溶液质量/g 溶质的质量分数
1
2
3
发现:溶质质量分数和溶液的颜色相比更能准确
表示溶液中溶质和溶液的关系。
溶质质量/g 溶剂(水)质量/g 溶质的质量分数
10
20
按下表所定的量配制氯化钠溶液(水的密度为1 g/cm3)
合作探究2
没有颜色的物质可以通过计算得到溶液的溶质质量分数,从而比较溶液的稀浓程度。
现象
【计算题注意事项】
1.溶液参加化学反应,一般来讲真正反应的物质
是溶液中的溶质。
2.在计算过程中对待溶液要一分为二,例如:
100 g 10%的氯化钠溶液。
一是溶质质量为:100 g×10% = 10 g;
二是溶剂质量为:100 g-10 g = 90 g。
3.配制一定溶质质量分数的溶液步骤。
【例题1】
在农业生产中,常需要用质量分数为16%的氯化钠溶液选种。现需要配置150 kg这种溶液,需要氯化钠和水的质量各是多少?
解:
溶质的质量分数= ×100%
溶质质量=溶液质量×溶质的质量分数
=150 kg×16%=24 kg
溶剂质量=溶液质量-溶质质量
=150 kg-24 kg=126 kg
答:配置150 kg质量分数为16%的氯化钠溶液,需24 kg氯化钠和126 kg水。
溶质质量
溶液质量
【例题2】
化学实验室现有质量分数为98%的浓硫酸,但在实验室中常需要用较稀的硫酸。要把50 g上述浓硫酸稀释为质量分数为20%的硫酸,需要水的质量是多少?
分析:溶液稀释前后,溶质质量不变。
解 设:稀释后溶液的质量为 x。
50 g×98%= x×20%
解方程: x =245 g
需要水的质量=245 g-50 g=195 g
答:要把50 g质量分数为98%的硫酸稀释为
质量分数为20%的硫酸,需要水195 g。
【例题3】
100 g某硫酸溶液恰好与13 g锌完全反应。试计算这种硫酸溶液中溶质的质量分数。
65
13 g
98
x
=
x =19.6 g
x =
98×13 g
65
溶质的质量分数= ×100% = 19.6%
19.6 g
100 g
答:这种硫酸溶液中溶质的质量分数为19.6%。
分析:与化学方程式结合起来的题目寻找溶质、溶剂、溶液的量。
解 设:这种硫酸中溶质的质量为 x。
Zn+H2SO4 ZnSO4+H2
65 98
13 g x
配制一定溶质质量分数的溶液
1. 计算 2.称量 3.量取 4.溶解
步骤:
仪器:
托盘天平、药匙、量筒、玻璃杯、胶头滴管、烧杯
下图是小明配制100 g溶质质量分数为12%的NaCl溶液的有关实验操作示意图。
(1)配制过程中使用的四种玻璃仪器,分别是广口瓶、_______、
________、______。
(2)正确的操作顺序应该是____________。
(3)请你指出图中一处错误操作,并分析该操作可能造成的后
果。______________________________________________。
(4)图②、图③表示的操作步骤分别是____________。
烧杯
玻璃棒
称量过程中氯化钠和砝码放反,造成氯化钠质量偏小
称量、溶解
量筒
④②①⑤③
谈体会说收获
练一练
1.向l00 g 10% NaOH溶液中加入12.5 g NaOH固体,
完全溶解后,所得溶液中溶质质量分数为( )
A.12. 5% B.20.0%
C.22.5% D.25%
B
2.农业上常用16%的氯化钠溶液来选种。下列方法能
配制出该选种溶液的是( )
A.4 g氯化钠和16 g水
B.16 g 20%的氯化钠溶液和5 g水
C.10 g 8%的氯化钠溶液蒸发4 g水
D.14 g 10%的氯化钠溶液和1 g氯化钠
D
3. 有100 g 10%的食盐溶液,要使其质量分数变为
20%,有三种方法,按要求填空:
(1)继续加入食盐,其质量为______g;
(2)蒸发水分,其质量为____g;
(3)与质量分数大于20%的浓食盐溶液混合,若混入
25%的食盐溶液,其溶液质量为____ g。
12.5
50
200
再见
同课章节目录
