2022年最新人教版化学九年级上册第七单元燃料及其利用章节测评试题(word版 含详细解析)
文档属性
| 名称 | 2022年最新人教版化学九年级上册第七单元燃料及其利用章节测评试题(word版 含详细解析) |  | |
| 格式 | zip | ||
| 文件大小 | 222.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-20 15:19:35 | ||
图片预览


文档简介
化学九年级上册第七单元燃料及其利用章节测评
考试时间:90分钟;命题人:化学教研组
考生注意:
1、本卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,考试时间90分钟
2、答卷前,考生务必用0.5毫米黑色签字笔将自己的姓名、班级填写在试卷规定位置上
3、答案必须写在试卷各个题目指定区域内相应的位置,如需改动,先划掉原来的答案,然后再写上新的答案;不准使用涂改液、胶带纸、修正带,不按以上要求作答的答案无效。
第I卷(选择题 30分)
一、单选题(10小题,每小题3分,共计30分)
1、下列有关的燃烧和灭火的说法正确的是:
A.燃烧一定要氧气参与 B.通过降低着火点就可以阻止燃烧
C.油锅着火可以浇水扑灭 D.煤矿矿井、棉织厂、加油站等场所都要严禁烟火
2、加油站是要确保消防安全的重要场所,据此判断加油站最醒目位置不需要出现的图标是
A. B.
C. D.
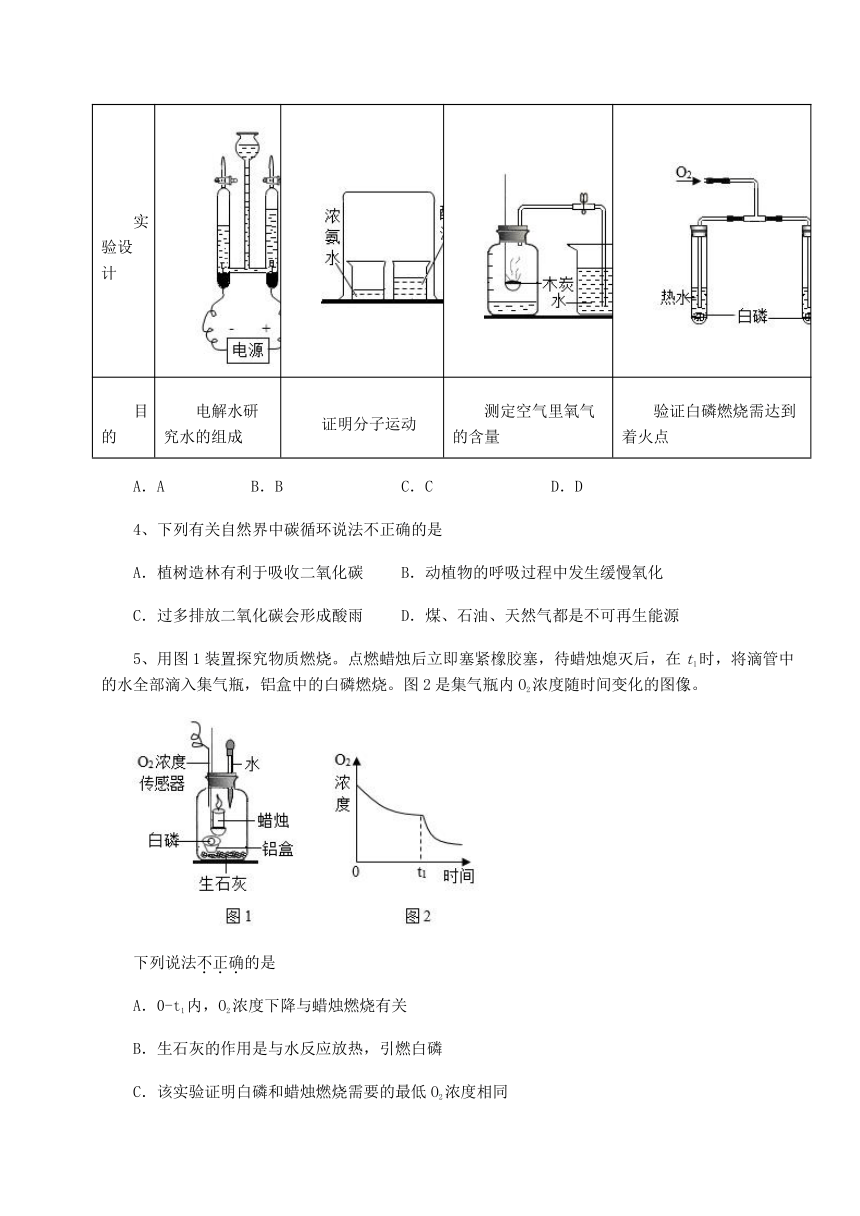
3、下列实验设计不能达到实验目的是选项
选项 A B C D
实验设计
目的 电解水研究水的组成 证明分子运动 测定空气里氧气的含量 验证白磷燃烧需达到着火点
A.A B.B C.C D.D
4、下列有关自然界中碳循环说法不正确的是
A.植树造林有利于吸收二氧化碳 B.动植物的呼吸过程中发生缓慢氧化
C.过多排放二氧化碳会形成酸雨 D.煤、石油、天然气都是不可再生能源
5、用图1装置探究物质燃烧。点燃蜡烛后立即塞紧橡胶塞,待蜡烛熄灭后,在t1时,将滴管中的水全部滴入集气瓶,铝盒中的白磷燃烧。图2是集气瓶内O2浓度随时间变化的图像。
下列说法不正确的是
A.0-t1内,O2浓度下降与蜡烛燃烧有关
B.生石灰的作用是与水反应放热,引燃白磷
C.该实验证明白磷和蜡烛燃烧需要的最低O2浓度相同
D.滴入水后,CO2浓度可能下降
6、下列标志中,表示“禁止烟火”的是
A. B. C. D.
7、下列有关做法,不符合安全要求的是
A.油锅着火,可倒入蔬菜,降温灭火
B.加油站不应建有围墙
C.煤矿井下应保持通风良好,严禁烟火
D.夜间闻到“燃气”气味,应开灯及时查明漏点
8、下列有关燃烧和灭火的方法正确的是
A.室内着火,应迅速打开所有门窗通风 B.炒菜时油锅着火,立即用水浇灭
C.进入久未开启的地窖,要做灯火实验 D.家里煤气泄漏,应立即打开排风扇通风
9、蒙冲斗舰数十艘,实以薪草,膏油灌其中,……盖放诸船,同时发火,时风盛猛,悉延烧岸上营落。(晋·陈寿《三国志》)下列认知有误的是
A.“薪草”“膏油”是可燃物 B.“同时发火”降低了“诸船”的着火点
C.“时风盛猛”提供充足的氧气 D.“膏油”着火不宜用水灭火
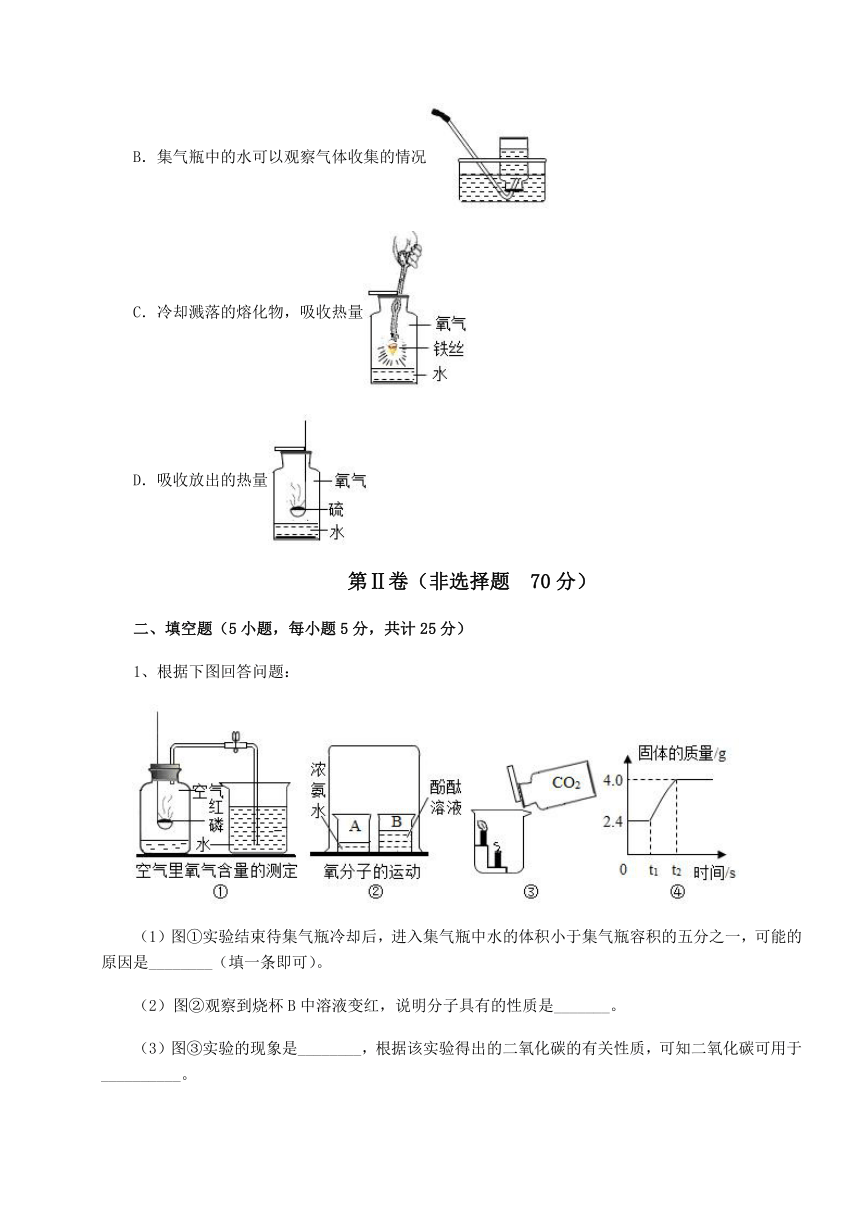
10、下列实验对水的主要作用解释错误的是
A.隔绝白磷与氧气接触,并提供热量
B.集气瓶中的水可以观察气体收集的情况
C.冷却溅落的熔化物,吸收热量
D.吸收放出的热量
第Ⅱ卷(非选择题 70分)
二、填空题(5小题,每小题5分,共计25分)
1、根据下图回答问题:
(1)图①实验结束待集气瓶冷却后,进入集气瓶中水的体积小于集气瓶容积的五分之一,可能的原因是________(填一条即可)。
(2)图②观察到烧杯B中溶液变红,说明分子具有的性质是_______。
(3)图③实验的现象是________,根据该实验得出的二氧化碳的有关性质,可知二氧化碳可用于__________。
(4)图④为在足量的氧气中点燃镁条的实验过程中固体质量变化图,从燃烧条件分析,固体质量在t1前没有发生变化的原因是_________。
2、小明同学利用W形玻璃管,利用下图所示微型装置完成了课本中的两个实验。
(1)燃烧条件的探究:在下图所示装置中(提示:省略夹持仪器,红磷的着火点是240°C,白磷的着火点是40℃,向W形玻璃管中放入过量红磷和白磷,塞好橡胶塞,关闭弹簧夹,然后将其放入80℃的热水中,观察到红磷不燃烧而白磷燃烧,白磷燃烧的化学方程式为________,对比得出可燃物燃烧的条件是________;一段时间后白磷熄灭,由此得出可燃物燃烧的另一个条件是_______。
(2)空气中氧气含量的粗略测定:已知W形玻璃管的容积为300mL,待(1)实验中白磷熄灭,装置冷却至室温后,打开弹簧夹,可观察到量筒中的水减少了约_______mL。
3、化学与生活和生产密切相关:
(1)市场上有“补铁口服液”、“高钙牛奶”、“加氟牙膏”、“葡萄糖酸锌”等商品,这些铁、钙、氟、锌应理解为(填编号)______。
①元素 ②原子 ③分子 ④离子
(2)家庭中常使用的燃料是天然气,其燃烧的化学方程式为______。
(3)用灯帽盖灭酒精灯能灭火的原因是______。
4、天湖中学的同学们学习了第七单元之后懂得了,氢气被称为理想的能源是因为______(一条即可),“釜底抽薪”能起到灭火的根本原因是______。
5、用下图实验验证可燃物燃烧的条件。已知:白磷的着火点为40℃。
(1)实验1中试管中80℃热水的作用是_____________;①中观察到的现象是___________,②中的现象是___________;由此可以得到的结论是___________。
(2)实验2观察到①中纸片燃烧,②中纸片未燃烧,请你分析②中纸片未燃烧的原因是___________。
三、计算题(3小题,每小题7分,共计21分)
1、有CO和CH4的混合气体4.8g,其中碳元素的质量分数为50%,将混合气体和氧气充分反应后,再通过足量的澄清石灰水,若每一步反应均完全,则最终得到的白色沉淀的质量为_______。
2、1 mL水约20滴,某容器若每秒漏2滴水,一昼夜所漏的水可供一个人补充水分多少天?(以一个人日补充水2.5 L计)
3、随着经济发展,能源和环境日益成为人们关注的焦点。
(1)煤、石油和_______通常成为化石燃料,燃煤发电时,将煤块粉碎成煤粉的目的是__________。
(2)人类目前所消耗的能源主要来自化石能源,化石能源的大量使用会产生CO2、SO2、NO2、CO等气体和粉尘,其中在大气中的含量不断上升,导致温室效应增强,全球气候变暖的是________,能形成酸雨的是_________(只写出一种)。
(3)氢能是一种既高效又干净的新能源。根据化学方程式,试计算4g氢气在氧气中燃烧,生成水的质量是多少________?(写出计算过程)
四、实验探究(2小题,每小题12分,共计24分)
1、实验室常用加热氯酸钾(KClO3)与二氧化锰(MnO2)混合物的方法制取氧气,该反应的符号表达式为___________。小芳发现氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
(提出猜想)除二氧化锰(MnO2)、氧化铜(CuO)外,氧化铁(Fe2O3)也可以作氯酸钾(KClO3)分解的催化剂。
(完成实验)按下表进行实验:测定分解产生氧气的温度(分解温度越低,催化效果越好)。
实验编号 实验药品 分解温度(℃)
① KC1O3 580
② KC1O3、MnO2(质量比1:1): 350
③ KC1O3、CuO(质量比1:1) 370
④ KC1O3、Fe2O3(质量比1:1) 390
(分析数据、得出结论)
(1)分解所需温度越高,说明反应加热时间越________(填“长”或“短”),反应速度越________(填“快”或“慢”)。
(2)由实验___________与实验④对比,证明猜想合理;
(3)实验所用的MnO2、CuO、Fe2O3,催化效果最好的是___________。
(反思)
(1)若要证明Fe2O3是该反应的催化剂,还要验证它在化学反应前后质量和___________不变;
(2)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证___________。
2、实验课上,同学们利用澄清石灰水检验空气中的二氧化碳,实验中发现各组石灰水浑浊程度存在较大差异,于是设计实验探究影响石灰水浑浊程度的因素。
(查阅资料)本实验条件下CO2气体的密度是2g/L。
(进行实验)装置图如图所示。
实验1:取饱和澄清石灰水进行实验。
实验序号 1-1 1-2 1-3 1-4
饱和澄清石灰水体积/mL 2.0 1.5 1.0 0.5
缓慢通入2L空气后的浑浊程度 不明显 明显 非常明显 明显
实验2:利用向饱和石灰水中添加蒸馏水来调节石灰水的浓度进行实验(溶液浓度变化引起的溶液密度变化忽略不计)。
实验序号 2-1 2-2 2-3 2-4
饱和澄清石灰水体积/mL 2.0 1.5 1.0 0.5
加入蒸馏水体积/mL 0 a b c
缓慢通入3L空气后的浑浊程度 非常明显 明显 不明显 无现象
(解释与结论)
(1)小试管中发生反应的化学方程式为___________。
(2)实验1的目的为___________。
(3)实验2中a、b、c三处数据,设计合理的是___________。
A 0.5 0.5 0.5 B 0.5 1.0 1.5
C 1.0 1.5 2.0 D 1.0 2.0 3.0
(4)实验2的结论是___________。
(反思与评价)
(5)通过对比实验1-1和2-1,可得出影响石灰水浑浊程度的另一因素是___________,理由是___________。
(拓展延伸)同学们查阅资料得知: 。于是他们又补充做了下列一组实验。
实验3:室温下,向含0.074gCa(OH)2的澄清石灰水中缓慢、匀速通入CO2气体,记录不同时间点的实验现象。
实验序号 3-1 3-2 3-3 3-4 3-5
缓慢通入CO2的时间 第10s 第20s 第25s 第30s t
缓慢通入CO2后的浑浊程度 稍浑浊 浑浊 最浑浊 稍浑浊 恰好完全澄清
(6)由此可以推知Ca(HCO3)2的一条物理性质是___________。
(7)实验中通入CO2气体的速度是___________mL/s。
(8)上表中t=___________s。
-参考答案-
一、单选题
1、D
【详解】
A、燃烧不一定有氧气参与,例如镁可以在二氧化碳中燃烧,不符合题意;
B、一般情况下物质的着火点是物质的属性,不能改变,可以通过降低温度阻止燃烧,不符合题意;
C、油锅着火应该用锅盖盖灭不能用水浇灭,不符合题意;
D、煤矿矿井、棉织厂、加油站等场所具有可燃性的气体或粉尘,都要严禁烟火,符合题意;
故选D。
2、C
【分析】
加油站有汽油、柴油等易燃性物质,属于易发生火灾的公共场所,应远离火源,注意防火。
【详解】
A、图中所示为禁止吸烟标识,应该在加油站最醒目位置出现,不符合题意;
B、图中所示为易燃物标识,应该在加油站最醒目位置出现,不符合题意;
C、图中所示为节约用水标识,不需要出现在加油站最醒目位置,符合题意;
D、图中所示为灭火器标识,应该在加油站最醒目位置出现,不符合题意;
故选D。
3、C
【详解】
A.通过电解水实验可得,电源正极产生的是氧气,负极产生的是氢气,由此可知水是由氢元素和氧元素组成的,能达到实验目的;
B.浓氨水具有挥发性,挥发出来的氨分子运动到无色酚酞溶液中与水结合形成氨水,氨水显碱性,能使无色酚酞溶液变红,故该实验可以证明分子是不断运动的,能达到实验目的;
C.木炭在空气中燃烧生成二氧化碳,虽然消耗了装置内的氧气,但是生成的二氧化碳重新填充了消耗氧气的空间,所以装置内的压强无明显变化,故不能用木炭来测定空气中氧气的含量,不能达到实验目的;
D.物质燃烧需要同时满足三个条件:①物质为可燃物;②与氧气(或空气)接触;③温度达到可燃物的着火点;白磷的着火点为40℃,该实验中白磷均与氧气接触,但其中一个与热水接触,一个与冷水接触,可观察到的现象是热水中的白磷燃烧,冷水中的白磷不燃烧,据此可以验证白磷燃烧需要到着火点,能达到实验目的;
故选C。
4、C
【详解】
A、植物光合作用可以吸收二氧化碳,所以植树造林有利于吸收二氧化碳,选项A正确;
B、动植物的呼吸过程中与空气中的氧气发生不易被人察觉的缓慢氧化,选项B正确;
C、过多排放CO2会加剧温室效应,而不是形成酸雨,酸雨主要是由二氧化硫、氮氧化物造成的,选项C错误;
D、煤、石油和天然气是化石能源,在短期内得不到补充,所以均属于不可再生能源,选项D正确。
故选:C。
5、C
【详解】
A:在0-t1时间内,蜡烛燃烧消耗瓶内空气中的氧气,使瓶内压强浓度下降。A正确。
B:生石灰与水反应放出大量的热,使瓶内温度升高,温度易得到白磷的着火点40℃。B正确。
C:据图2可知白磷和蜡烛燃烧需要的最低O2浓度不同。C错。
D:瓶内滴入水后,部分二氧化碳能溶于水或与水反应,CO2浓度可能下降。D正确。
综上所述:选择C。
【点睛】
6、B
【详解】
A、图为腐蚀品标志,故选项不符合题意;
B、图为禁止烟火标志,故选项符合题意;
C、图为禁止燃放鞭炮,故选项不符合题意;
D、图为国家节水标志,故选项不符合题意。
故选B。
7、D
【详解】
A、灭火的原理:隔绝空气、降低温度到着火点以下、移除可燃物,油锅着火,可倒入蔬菜,降温灭火,说法正确;
B、加油站不应建有围墙,符合安全要求;
C、煤矿井下应保持通风良好,严禁烟火,符合安全要求;
D、夜间闻到“燃气”气味,开灯会产生电火花,发生火灾,不符合安全要求;
答案:D。
8、C
【详解】
A 、室内着火时不能立即打开门窗,开窗后新鲜空气涌入,会让火势更猛烈,故A错误;
B、炒菜时油锅着火,立即用水浇到油上,容易使油溅落出来烫伤他人,故B错误;
C、久未开启的地窖中二氧化碳含量较高,直接进入容易造成危险,先用灯火实验后再进入,故C正确;
D、煤气泄漏,应立刻开窗通风,不能使用电器和火源,否则容易引起火灾或爆炸,故D错误;
故选C。
9、B
【详解】
A、“薪草”“膏油”均能够燃烧,是可燃物,故A正确;
B、“同时发火”提高了温度,使其达到可燃物的着火点开始燃烧。着火点为可燃物固有属性,一般不随外界条件的变化而变化,故B错误;
C、“时风盛猛”提供充足的氧气,燃烧会更剧烈,故C正确;
D、油的密度比水小,着火时若用水扑火,油会浮在水面继续燃烧,因此不宜用水灭火,故D正确;
故选B。
10、D
【详解】
A、探究燃烧条件的实验中,水的主要作用是隔绝白磷与氧气接触,并提供热量,正确;
B、排水法收集气体时集气瓶中的水可以观察气体收集的情况,正确;
C、铁丝燃烧放出大量的热,生成黑色固体,水可以冷却溅落的熔化物,吸收热量,正确;
D、硫和氧气生成有毒气体二氧化硫,水可以吸收二氧化硫减少污染,错误。
故选D。
二、填空题
1、
(1)红磷不足
(2)分子在不断的运动
(3) 蜡烛由下到上依次熄灭 灭火
(4)温度没有达到镁条的着火点
【解析】
(1)
红磷量不足时就不能不瓶内的氧气消耗完全,故会导致进入集气瓶中水的体积偏小;或者弹簧夹未加紧时,红磷燃烧放热,会有部分气体溢出,此时也会导致进入集气瓶中水的体积偏小。)
(2)
分子在不断运动,氨分子运动到了酚酞溶液中使溶液变红了,故此现象说明分子在不断运动。
(3)
低处的蜡烛先熄灭,高处的蜡烛后熄灭。该实验说明二氧化碳不能燃烧,也不能支持燃烧,且密度比空气大,故二氧化碳可用于灭火。
(4)
分析该反应中固体质量的变化,从开始点燃到t1时,固体的质量不变,说明此时镁未开始燃烧,其原因是其温度还未达到镁的着火点。
2、
(1) 温度达到着火点 氧气(或O2)
(2)60
【解析】
(1)
白磷和氧气点燃生成五氧化二磷,方程式为:;
向 W 形玻璃管中放入足量红磷和白磷,塞好橡皮塞。然后将其放入80℃的热水中,观察到红磷不燃烧而白磷燃烧。说明可燃物燃烧的条件是温度达到着火点;
一段时间后白磷熄灭的原因是氧气完全反应,故填:氧气;
(2)
空气中氧气含量的测定:已知 W 形玻璃管的容积为300mL,待白磷熄灭,装置冷却至室温后,打开弹簧夹,观察到量筒中的水减少了60mL,是因为氧气约占空气总体积的五分之一.
3、
(1)①
(2)
(3)隔绝氧气
【解析】
(1)
铁、钙、氟、锌应理解为元素,故选:①。
(2)
天然气主要成分是甲烷,甲烷燃烧生成二氧化碳和水,故填:。
(3)
用灯帽盖灭酒精灯能灭火的原因是隔绝氧气,故填:隔绝氧气。
4、产物无污染等 撤离了可燃物
【详解】
氢气的热值高,且燃烧后的产物是水,不污染空气,故氢能是理想的能源;
“釜底抽薪”能起到灭火的根本原因是撤离了可燃物,没有了可燃物就无法燃烧。
5、
(1) 提供热量使温度达到白磷的着火点并隔绝空气 水中的白磷没有燃烧 水中的白磷燃烧了 可燃物燃烧需要足够的氧气(或空气)
(2)试管中的水吸收了部分热量,试管壁的温度未达到纸片的着火点(能说明是试管中的水吸收了热量,使得试管的温度没达到纸片的着火点即可得分)
【分析】
本题考查燃烧的条件。燃烧是可燃物与氧气发生的一种发光、发热的剧烈的氧化反应。燃烧需要三个条件:第一,可燃物;第二,氧气或空气;第三,达到燃烧所需的最低温度即着火点。
(1)
①中热水提供热量使温度达到白磷的着火点并隔绝空气,白磷虽达到了着火点,但未接触到空气,故水中的白磷没有燃烧。②中,满足燃烧的三个条件,故水中的白磷燃烧了。①②的变量是是否与氧气接触。得到的结论是可燃物燃烧要有足够的氧气或空气;
(2)
①中满足燃烧的三个条件,故纸片发生燃烧,②中,纸片与空气接触,是可燃物。不燃烧是因为温度未达到着火点。试管中的水吸收了部分热量,试管壁的温度未达到纸片的着火点所以不燃烧。
【点睛】
三、计算题
1、20g
【详解】
根据质量守恒,反应前后元素种类不变质量不变,反应前碳元素质量4.8g50%=2.4g,设碳酸钙质量为x,反应前后碳元素质量不变,故x=2.4g,x=20g,故填:20g。
2、可供个人补充水分3.5天=8.640 L
【解析】
【详解】
一昼夜为24小时,每小时有3600秒,所以一昼夜有24×3600=86400秒,由于每秒钟漏一滴水,平均每20滴水为1毫升,所以2486400秒可以漏248600×2÷20=8640mL=8.64L ,故8.64÷2.5=3.5(天)
答:一个坏水龙头一昼夜漏水可供1个人补充水分3.5天。
3、(1)天然气;增大与氧气接触面积,使燃烧更充分(2)CO2;SO2或NO2(3)36g
【详解】
(1)煤、石油和 天然气通常称为化石燃料。反应物接触面积越大,反应越快,转化越彻底,所以燃煤发电时,将煤块粉碎成煤粉的目的是增大与氧气接触面积,使燃烧更充分;
(2)在大气中的含量不断上升,导致温室效应增强,全球气候变暖的是CO2;SO2和NO2在空气中易形成硫酸和硝酸,所以能形成酸雨的是 SO2或NO2;
(3)设:4g氢气在氧气中燃烧,生成水的质量为x。
2H2+O22H2O
4 36
4g x
x=36g。
四、实验探究
1、 长 慢 ① MnO2 化学性质 将两份相同质量的氯酸钾,分别与颗粒大小不同的同种、同质量的催化剂充分混合,加热测定分解温度
【详解】
实验室常用加热氯酸钾(KClO3)与二氧化锰(MnO2)混合物的方法制取氧气,加热条件下二氧化锰催化氯酸钾反应生成氯化钾和氧气,该反应的符号表达式为。
分析数据、得出结论:
(1)分解所需温度越高,说明反应加热时间越长,反应速度越慢。
(2)要证明氧化铁能作催化剂,则要对比单独加热氯酸钾、加热氯酸钾和氧化铁混合物,两个实验产生氧气的速率,由实验①与实验④对比,证明猜想合理;
(3)由表中数据可知,使用MnO2时氯酸钾分解所需温度最低,实验所用的MnO2、CuO、Fe2O3,催化效果最好的是MnO2。
反思:
(1)若要证明Fe2O3是该反应的催化剂,还要验证它在化学反应前后质量和化学性质不变;
(2)验证同种催化剂,颗粒大小可能影响催化效果,将两份相同质量的氯酸钾,分别与颗粒大小不同的同种、同质量的催化剂充分混合,加热测定分解温度。
2、 探究在通入空气体积相同、石灰水浓度相同的条件下,石灰水的体积是否影响石灰水变浑浊的程度 B 实验范围内,其他条件相同时,石灰水浓度越大石灰水浑浊程度越大 空气的体积 空气含二氧化碳,空气体积大则二氧化碳含量更多 能够溶于水 实验中第25s时最浑浊,说明此时二氧化碳与氢氧化钙恰好完全反应生成碳酸钙,设该过程累计通入二氧化碳的质量为x,则
解得x=0.044g;
通入CO2气体的速度是。 通入CO2的时间为t时,溶液恰好澄清,说明二氧化碳、氢氧化钙恰好完全反应生成碳酸氢钙,设该过程累计通入二氧化碳的质量为y,则
解得y=0.088g;
所需时间。
【详解】
解释与结论:
(1)小试管中石灰水变浑浊,是因为二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为。
(2)实验1饱和澄清石灰水体积为单一变量,目的是:探究在通入空气体积相同、石灰水浓度相同的条件下,石灰水的体积是否影响石灰水变浑浊的程度。
(3)实验2需要调节石灰水的浓度进行对比,实验2中a、b、c的合理数据是0.5、1.0、1.5;
故填:B。。
(4)实验2的结论是实验范围内,其他条件相同时,石灰水浓度越大石灰水浑浊程度越大。
反思与评价:
(5)通过对比实验1-1和2-1,可得出影响石灰水浑浊程度的另一因素是空气的体积,理由是空气含二氧化碳,空气体积大则二氧化碳含量更多。
拓展延伸:
(6)氢氧化钙溶液中通入过量的二氧化碳,反应生成碳酸氢钙,溶液显澄清,由此可以推测出Ca(HCO3)2的一条物理性质是能够溶于水;
(7)见答案。
(8)见答案。
考试时间:90分钟;命题人:化学教研组
考生注意:
1、本卷分第I卷(选择题)和第Ⅱ卷(非选择题)两部分,满分100分,考试时间90分钟
2、答卷前,考生务必用0.5毫米黑色签字笔将自己的姓名、班级填写在试卷规定位置上
3、答案必须写在试卷各个题目指定区域内相应的位置,如需改动,先划掉原来的答案,然后再写上新的答案;不准使用涂改液、胶带纸、修正带,不按以上要求作答的答案无效。
第I卷(选择题 30分)
一、单选题(10小题,每小题3分,共计30分)
1、下列有关的燃烧和灭火的说法正确的是:
A.燃烧一定要氧气参与 B.通过降低着火点就可以阻止燃烧
C.油锅着火可以浇水扑灭 D.煤矿矿井、棉织厂、加油站等场所都要严禁烟火
2、加油站是要确保消防安全的重要场所,据此判断加油站最醒目位置不需要出现的图标是
A. B.
C. D.
3、下列实验设计不能达到实验目的是选项
选项 A B C D
实验设计
目的 电解水研究水的组成 证明分子运动 测定空气里氧气的含量 验证白磷燃烧需达到着火点
A.A B.B C.C D.D
4、下列有关自然界中碳循环说法不正确的是
A.植树造林有利于吸收二氧化碳 B.动植物的呼吸过程中发生缓慢氧化
C.过多排放二氧化碳会形成酸雨 D.煤、石油、天然气都是不可再生能源
5、用图1装置探究物质燃烧。点燃蜡烛后立即塞紧橡胶塞,待蜡烛熄灭后,在t1时,将滴管中的水全部滴入集气瓶,铝盒中的白磷燃烧。图2是集气瓶内O2浓度随时间变化的图像。
下列说法不正确的是
A.0-t1内,O2浓度下降与蜡烛燃烧有关
B.生石灰的作用是与水反应放热,引燃白磷
C.该实验证明白磷和蜡烛燃烧需要的最低O2浓度相同
D.滴入水后,CO2浓度可能下降
6、下列标志中,表示“禁止烟火”的是
A. B. C. D.
7、下列有关做法,不符合安全要求的是
A.油锅着火,可倒入蔬菜,降温灭火
B.加油站不应建有围墙
C.煤矿井下应保持通风良好,严禁烟火
D.夜间闻到“燃气”气味,应开灯及时查明漏点
8、下列有关燃烧和灭火的方法正确的是
A.室内着火,应迅速打开所有门窗通风 B.炒菜时油锅着火,立即用水浇灭
C.进入久未开启的地窖,要做灯火实验 D.家里煤气泄漏,应立即打开排风扇通风
9、蒙冲斗舰数十艘,实以薪草,膏油灌其中,……盖放诸船,同时发火,时风盛猛,悉延烧岸上营落。(晋·陈寿《三国志》)下列认知有误的是
A.“薪草”“膏油”是可燃物 B.“同时发火”降低了“诸船”的着火点
C.“时风盛猛”提供充足的氧气 D.“膏油”着火不宜用水灭火
10、下列实验对水的主要作用解释错误的是
A.隔绝白磷与氧气接触,并提供热量
B.集气瓶中的水可以观察气体收集的情况
C.冷却溅落的熔化物,吸收热量
D.吸收放出的热量
第Ⅱ卷(非选择题 70分)
二、填空题(5小题,每小题5分,共计25分)
1、根据下图回答问题:
(1)图①实验结束待集气瓶冷却后,进入集气瓶中水的体积小于集气瓶容积的五分之一,可能的原因是________(填一条即可)。
(2)图②观察到烧杯B中溶液变红,说明分子具有的性质是_______。
(3)图③实验的现象是________,根据该实验得出的二氧化碳的有关性质,可知二氧化碳可用于__________。
(4)图④为在足量的氧气中点燃镁条的实验过程中固体质量变化图,从燃烧条件分析,固体质量在t1前没有发生变化的原因是_________。
2、小明同学利用W形玻璃管,利用下图所示微型装置完成了课本中的两个实验。
(1)燃烧条件的探究:在下图所示装置中(提示:省略夹持仪器,红磷的着火点是240°C,白磷的着火点是40℃,向W形玻璃管中放入过量红磷和白磷,塞好橡胶塞,关闭弹簧夹,然后将其放入80℃的热水中,观察到红磷不燃烧而白磷燃烧,白磷燃烧的化学方程式为________,对比得出可燃物燃烧的条件是________;一段时间后白磷熄灭,由此得出可燃物燃烧的另一个条件是_______。
(2)空气中氧气含量的粗略测定:已知W形玻璃管的容积为300mL,待(1)实验中白磷熄灭,装置冷却至室温后,打开弹簧夹,可观察到量筒中的水减少了约_______mL。
3、化学与生活和生产密切相关:
(1)市场上有“补铁口服液”、“高钙牛奶”、“加氟牙膏”、“葡萄糖酸锌”等商品,这些铁、钙、氟、锌应理解为(填编号)______。
①元素 ②原子 ③分子 ④离子
(2)家庭中常使用的燃料是天然气,其燃烧的化学方程式为______。
(3)用灯帽盖灭酒精灯能灭火的原因是______。
4、天湖中学的同学们学习了第七单元之后懂得了,氢气被称为理想的能源是因为______(一条即可),“釜底抽薪”能起到灭火的根本原因是______。
5、用下图实验验证可燃物燃烧的条件。已知:白磷的着火点为40℃。
(1)实验1中试管中80℃热水的作用是_____________;①中观察到的现象是___________,②中的现象是___________;由此可以得到的结论是___________。
(2)实验2观察到①中纸片燃烧,②中纸片未燃烧,请你分析②中纸片未燃烧的原因是___________。
三、计算题(3小题,每小题7分,共计21分)
1、有CO和CH4的混合气体4.8g,其中碳元素的质量分数为50%,将混合气体和氧气充分反应后,再通过足量的澄清石灰水,若每一步反应均完全,则最终得到的白色沉淀的质量为_______。
2、1 mL水约20滴,某容器若每秒漏2滴水,一昼夜所漏的水可供一个人补充水分多少天?(以一个人日补充水2.5 L计)
3、随着经济发展,能源和环境日益成为人们关注的焦点。
(1)煤、石油和_______通常成为化石燃料,燃煤发电时,将煤块粉碎成煤粉的目的是__________。
(2)人类目前所消耗的能源主要来自化石能源,化石能源的大量使用会产生CO2、SO2、NO2、CO等气体和粉尘,其中在大气中的含量不断上升,导致温室效应增强,全球气候变暖的是________,能形成酸雨的是_________(只写出一种)。
(3)氢能是一种既高效又干净的新能源。根据化学方程式,试计算4g氢气在氧气中燃烧,生成水的质量是多少________?(写出计算过程)
四、实验探究(2小题,每小题12分,共计24分)
1、实验室常用加热氯酸钾(KClO3)与二氧化锰(MnO2)混合物的方法制取氧气,该反应的符号表达式为___________。小芳发现氯酸钾与氧化铜混合加热,也能较快产生氧气,于是进行如下探究:
(提出猜想)除二氧化锰(MnO2)、氧化铜(CuO)外,氧化铁(Fe2O3)也可以作氯酸钾(KClO3)分解的催化剂。
(完成实验)按下表进行实验:测定分解产生氧气的温度(分解温度越低,催化效果越好)。
实验编号 实验药品 分解温度(℃)
① KC1O3 580
② KC1O3、MnO2(质量比1:1): 350
③ KC1O3、CuO(质量比1:1) 370
④ KC1O3、Fe2O3(质量比1:1) 390
(分析数据、得出结论)
(1)分解所需温度越高,说明反应加热时间越________(填“长”或“短”),反应速度越________(填“快”或“慢”)。
(2)由实验___________与实验④对比,证明猜想合理;
(3)实验所用的MnO2、CuO、Fe2O3,催化效果最好的是___________。
(反思)
(1)若要证明Fe2O3是该反应的催化剂,还要验证它在化学反应前后质量和___________不变;
(2)同种催化剂,颗粒大小可能影响催化效果,请设计实验方案进行验证___________。
2、实验课上,同学们利用澄清石灰水检验空气中的二氧化碳,实验中发现各组石灰水浑浊程度存在较大差异,于是设计实验探究影响石灰水浑浊程度的因素。
(查阅资料)本实验条件下CO2气体的密度是2g/L。
(进行实验)装置图如图所示。
实验1:取饱和澄清石灰水进行实验。
实验序号 1-1 1-2 1-3 1-4
饱和澄清石灰水体积/mL 2.0 1.5 1.0 0.5
缓慢通入2L空气后的浑浊程度 不明显 明显 非常明显 明显
实验2:利用向饱和石灰水中添加蒸馏水来调节石灰水的浓度进行实验(溶液浓度变化引起的溶液密度变化忽略不计)。
实验序号 2-1 2-2 2-3 2-4
饱和澄清石灰水体积/mL 2.0 1.5 1.0 0.5
加入蒸馏水体积/mL 0 a b c
缓慢通入3L空气后的浑浊程度 非常明显 明显 不明显 无现象
(解释与结论)
(1)小试管中发生反应的化学方程式为___________。
(2)实验1的目的为___________。
(3)实验2中a、b、c三处数据,设计合理的是___________。
A 0.5 0.5 0.5 B 0.5 1.0 1.5
C 1.0 1.5 2.0 D 1.0 2.0 3.0
(4)实验2的结论是___________。
(反思与评价)
(5)通过对比实验1-1和2-1,可得出影响石灰水浑浊程度的另一因素是___________,理由是___________。
(拓展延伸)同学们查阅资料得知: 。于是他们又补充做了下列一组实验。
实验3:室温下,向含0.074gCa(OH)2的澄清石灰水中缓慢、匀速通入CO2气体,记录不同时间点的实验现象。
实验序号 3-1 3-2 3-3 3-4 3-5
缓慢通入CO2的时间 第10s 第20s 第25s 第30s t
缓慢通入CO2后的浑浊程度 稍浑浊 浑浊 最浑浊 稍浑浊 恰好完全澄清
(6)由此可以推知Ca(HCO3)2的一条物理性质是___________。
(7)实验中通入CO2气体的速度是___________mL/s。
(8)上表中t=___________s。
-参考答案-
一、单选题
1、D
【详解】
A、燃烧不一定有氧气参与,例如镁可以在二氧化碳中燃烧,不符合题意;
B、一般情况下物质的着火点是物质的属性,不能改变,可以通过降低温度阻止燃烧,不符合题意;
C、油锅着火应该用锅盖盖灭不能用水浇灭,不符合题意;
D、煤矿矿井、棉织厂、加油站等场所具有可燃性的气体或粉尘,都要严禁烟火,符合题意;
故选D。
2、C
【分析】
加油站有汽油、柴油等易燃性物质,属于易发生火灾的公共场所,应远离火源,注意防火。
【详解】
A、图中所示为禁止吸烟标识,应该在加油站最醒目位置出现,不符合题意;
B、图中所示为易燃物标识,应该在加油站最醒目位置出现,不符合题意;
C、图中所示为节约用水标识,不需要出现在加油站最醒目位置,符合题意;
D、图中所示为灭火器标识,应该在加油站最醒目位置出现,不符合题意;
故选D。
3、C
【详解】
A.通过电解水实验可得,电源正极产生的是氧气,负极产生的是氢气,由此可知水是由氢元素和氧元素组成的,能达到实验目的;
B.浓氨水具有挥发性,挥发出来的氨分子运动到无色酚酞溶液中与水结合形成氨水,氨水显碱性,能使无色酚酞溶液变红,故该实验可以证明分子是不断运动的,能达到实验目的;
C.木炭在空气中燃烧生成二氧化碳,虽然消耗了装置内的氧气,但是生成的二氧化碳重新填充了消耗氧气的空间,所以装置内的压强无明显变化,故不能用木炭来测定空气中氧气的含量,不能达到实验目的;
D.物质燃烧需要同时满足三个条件:①物质为可燃物;②与氧气(或空气)接触;③温度达到可燃物的着火点;白磷的着火点为40℃,该实验中白磷均与氧气接触,但其中一个与热水接触,一个与冷水接触,可观察到的现象是热水中的白磷燃烧,冷水中的白磷不燃烧,据此可以验证白磷燃烧需要到着火点,能达到实验目的;
故选C。
4、C
【详解】
A、植物光合作用可以吸收二氧化碳,所以植树造林有利于吸收二氧化碳,选项A正确;
B、动植物的呼吸过程中与空气中的氧气发生不易被人察觉的缓慢氧化,选项B正确;
C、过多排放CO2会加剧温室效应,而不是形成酸雨,酸雨主要是由二氧化硫、氮氧化物造成的,选项C错误;
D、煤、石油和天然气是化石能源,在短期内得不到补充,所以均属于不可再生能源,选项D正确。
故选:C。
5、C
【详解】
A:在0-t1时间内,蜡烛燃烧消耗瓶内空气中的氧气,使瓶内压强浓度下降。A正确。
B:生石灰与水反应放出大量的热,使瓶内温度升高,温度易得到白磷的着火点40℃。B正确。
C:据图2可知白磷和蜡烛燃烧需要的最低O2浓度不同。C错。
D:瓶内滴入水后,部分二氧化碳能溶于水或与水反应,CO2浓度可能下降。D正确。
综上所述:选择C。
【点睛】
6、B
【详解】
A、图为腐蚀品标志,故选项不符合题意;
B、图为禁止烟火标志,故选项符合题意;
C、图为禁止燃放鞭炮,故选项不符合题意;
D、图为国家节水标志,故选项不符合题意。
故选B。
7、D
【详解】
A、灭火的原理:隔绝空气、降低温度到着火点以下、移除可燃物,油锅着火,可倒入蔬菜,降温灭火,说法正确;
B、加油站不应建有围墙,符合安全要求;
C、煤矿井下应保持通风良好,严禁烟火,符合安全要求;
D、夜间闻到“燃气”气味,开灯会产生电火花,发生火灾,不符合安全要求;
答案:D。
8、C
【详解】
A 、室内着火时不能立即打开门窗,开窗后新鲜空气涌入,会让火势更猛烈,故A错误;
B、炒菜时油锅着火,立即用水浇到油上,容易使油溅落出来烫伤他人,故B错误;
C、久未开启的地窖中二氧化碳含量较高,直接进入容易造成危险,先用灯火实验后再进入,故C正确;
D、煤气泄漏,应立刻开窗通风,不能使用电器和火源,否则容易引起火灾或爆炸,故D错误;
故选C。
9、B
【详解】
A、“薪草”“膏油”均能够燃烧,是可燃物,故A正确;
B、“同时发火”提高了温度,使其达到可燃物的着火点开始燃烧。着火点为可燃物固有属性,一般不随外界条件的变化而变化,故B错误;
C、“时风盛猛”提供充足的氧气,燃烧会更剧烈,故C正确;
D、油的密度比水小,着火时若用水扑火,油会浮在水面继续燃烧,因此不宜用水灭火,故D正确;
故选B。
10、D
【详解】
A、探究燃烧条件的实验中,水的主要作用是隔绝白磷与氧气接触,并提供热量,正确;
B、排水法收集气体时集气瓶中的水可以观察气体收集的情况,正确;
C、铁丝燃烧放出大量的热,生成黑色固体,水可以冷却溅落的熔化物,吸收热量,正确;
D、硫和氧气生成有毒气体二氧化硫,水可以吸收二氧化硫减少污染,错误。
故选D。
二、填空题
1、
(1)红磷不足
(2)分子在不断的运动
(3) 蜡烛由下到上依次熄灭 灭火
(4)温度没有达到镁条的着火点
【解析】
(1)
红磷量不足时就不能不瓶内的氧气消耗完全,故会导致进入集气瓶中水的体积偏小;或者弹簧夹未加紧时,红磷燃烧放热,会有部分气体溢出,此时也会导致进入集气瓶中水的体积偏小。)
(2)
分子在不断运动,氨分子运动到了酚酞溶液中使溶液变红了,故此现象说明分子在不断运动。
(3)
低处的蜡烛先熄灭,高处的蜡烛后熄灭。该实验说明二氧化碳不能燃烧,也不能支持燃烧,且密度比空气大,故二氧化碳可用于灭火。
(4)
分析该反应中固体质量的变化,从开始点燃到t1时,固体的质量不变,说明此时镁未开始燃烧,其原因是其温度还未达到镁的着火点。
2、
(1) 温度达到着火点 氧气(或O2)
(2)60
【解析】
(1)
白磷和氧气点燃生成五氧化二磷,方程式为:;
向 W 形玻璃管中放入足量红磷和白磷,塞好橡皮塞。然后将其放入80℃的热水中,观察到红磷不燃烧而白磷燃烧。说明可燃物燃烧的条件是温度达到着火点;
一段时间后白磷熄灭的原因是氧气完全反应,故填:氧气;
(2)
空气中氧气含量的测定:已知 W 形玻璃管的容积为300mL,待白磷熄灭,装置冷却至室温后,打开弹簧夹,观察到量筒中的水减少了60mL,是因为氧气约占空气总体积的五分之一.
3、
(1)①
(2)
(3)隔绝氧气
【解析】
(1)
铁、钙、氟、锌应理解为元素,故选:①。
(2)
天然气主要成分是甲烷,甲烷燃烧生成二氧化碳和水,故填:。
(3)
用灯帽盖灭酒精灯能灭火的原因是隔绝氧气,故填:隔绝氧气。
4、产物无污染等 撤离了可燃物
【详解】
氢气的热值高,且燃烧后的产物是水,不污染空气,故氢能是理想的能源;
“釜底抽薪”能起到灭火的根本原因是撤离了可燃物,没有了可燃物就无法燃烧。
5、
(1) 提供热量使温度达到白磷的着火点并隔绝空气 水中的白磷没有燃烧 水中的白磷燃烧了 可燃物燃烧需要足够的氧气(或空气)
(2)试管中的水吸收了部分热量,试管壁的温度未达到纸片的着火点(能说明是试管中的水吸收了热量,使得试管的温度没达到纸片的着火点即可得分)
【分析】
本题考查燃烧的条件。燃烧是可燃物与氧气发生的一种发光、发热的剧烈的氧化反应。燃烧需要三个条件:第一,可燃物;第二,氧气或空气;第三,达到燃烧所需的最低温度即着火点。
(1)
①中热水提供热量使温度达到白磷的着火点并隔绝空气,白磷虽达到了着火点,但未接触到空气,故水中的白磷没有燃烧。②中,满足燃烧的三个条件,故水中的白磷燃烧了。①②的变量是是否与氧气接触。得到的结论是可燃物燃烧要有足够的氧气或空气;
(2)
①中满足燃烧的三个条件,故纸片发生燃烧,②中,纸片与空气接触,是可燃物。不燃烧是因为温度未达到着火点。试管中的水吸收了部分热量,试管壁的温度未达到纸片的着火点所以不燃烧。
【点睛】
三、计算题
1、20g
【详解】
根据质量守恒,反应前后元素种类不变质量不变,反应前碳元素质量4.8g50%=2.4g,设碳酸钙质量为x,反应前后碳元素质量不变,故x=2.4g,x=20g,故填:20g。
2、可供个人补充水分3.5天=8.640 L
【解析】
【详解】
一昼夜为24小时,每小时有3600秒,所以一昼夜有24×3600=86400秒,由于每秒钟漏一滴水,平均每20滴水为1毫升,所以2486400秒可以漏248600×2÷20=8640mL=8.64L ,故8.64÷2.5=3.5(天)
答:一个坏水龙头一昼夜漏水可供1个人补充水分3.5天。
3、(1)天然气;增大与氧气接触面积,使燃烧更充分(2)CO2;SO2或NO2(3)36g
【详解】
(1)煤、石油和 天然气通常称为化石燃料。反应物接触面积越大,反应越快,转化越彻底,所以燃煤发电时,将煤块粉碎成煤粉的目的是增大与氧气接触面积,使燃烧更充分;
(2)在大气中的含量不断上升,导致温室效应增强,全球气候变暖的是CO2;SO2和NO2在空气中易形成硫酸和硝酸,所以能形成酸雨的是 SO2或NO2;
(3)设:4g氢气在氧气中燃烧,生成水的质量为x。
2H2+O22H2O
4 36
4g x
x=36g。
四、实验探究
1、 长 慢 ① MnO2 化学性质 将两份相同质量的氯酸钾,分别与颗粒大小不同的同种、同质量的催化剂充分混合,加热测定分解温度
【详解】
实验室常用加热氯酸钾(KClO3)与二氧化锰(MnO2)混合物的方法制取氧气,加热条件下二氧化锰催化氯酸钾反应生成氯化钾和氧气,该反应的符号表达式为。
分析数据、得出结论:
(1)分解所需温度越高,说明反应加热时间越长,反应速度越慢。
(2)要证明氧化铁能作催化剂,则要对比单独加热氯酸钾、加热氯酸钾和氧化铁混合物,两个实验产生氧气的速率,由实验①与实验④对比,证明猜想合理;
(3)由表中数据可知,使用MnO2时氯酸钾分解所需温度最低,实验所用的MnO2、CuO、Fe2O3,催化效果最好的是MnO2。
反思:
(1)若要证明Fe2O3是该反应的催化剂,还要验证它在化学反应前后质量和化学性质不变;
(2)验证同种催化剂,颗粒大小可能影响催化效果,将两份相同质量的氯酸钾,分别与颗粒大小不同的同种、同质量的催化剂充分混合,加热测定分解温度。
2、 探究在通入空气体积相同、石灰水浓度相同的条件下,石灰水的体积是否影响石灰水变浑浊的程度 B 实验范围内,其他条件相同时,石灰水浓度越大石灰水浑浊程度越大 空气的体积 空气含二氧化碳,空气体积大则二氧化碳含量更多 能够溶于水 实验中第25s时最浑浊,说明此时二氧化碳与氢氧化钙恰好完全反应生成碳酸钙,设该过程累计通入二氧化碳的质量为x,则
解得x=0.044g;
通入CO2气体的速度是。 通入CO2的时间为t时,溶液恰好澄清,说明二氧化碳、氢氧化钙恰好完全反应生成碳酸氢钙,设该过程累计通入二氧化碳的质量为y,则
解得y=0.088g;
所需时间。
【详解】
解释与结论:
(1)小试管中石灰水变浑浊,是因为二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,反应的化学方程式为。
(2)实验1饱和澄清石灰水体积为单一变量,目的是:探究在通入空气体积相同、石灰水浓度相同的条件下,石灰水的体积是否影响石灰水变浑浊的程度。
(3)实验2需要调节石灰水的浓度进行对比,实验2中a、b、c的合理数据是0.5、1.0、1.5;
故填:B。。
(4)实验2的结论是实验范围内,其他条件相同时,石灰水浓度越大石灰水浑浊程度越大。
反思与评价:
(5)通过对比实验1-1和2-1,可得出影响石灰水浑浊程度的另一因素是空气的体积,理由是空气含二氧化碳,空气体积大则二氧化碳含量更多。
拓展延伸:
(6)氢氧化钙溶液中通入过量的二氧化碳,反应生成碳酸氢钙,溶液显澄清,由此可以推测出Ca(HCO3)2的一条物理性质是能够溶于水;
(7)见答案。
(8)见答案。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
