【化学】2.1 化学能与热能(人教版必修2)课件2
文档属性
| 名称 | 【化学】2.1 化学能与热能(人教版必修2)课件2 |  | |
| 格式 | zip | ||
| 文件大小 | 5.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-04-14 10:53:53 | ||
图片预览





文档简介
课件25张PPT。第二章 化学反应与能量第二节 化学能与热能化学变化的特征: 化学变化中除有新物质生成外,常伴随着放热、发光、变色、放出气体、生成沉淀等现象发生。利用化学反应:
一 是制取新物质;
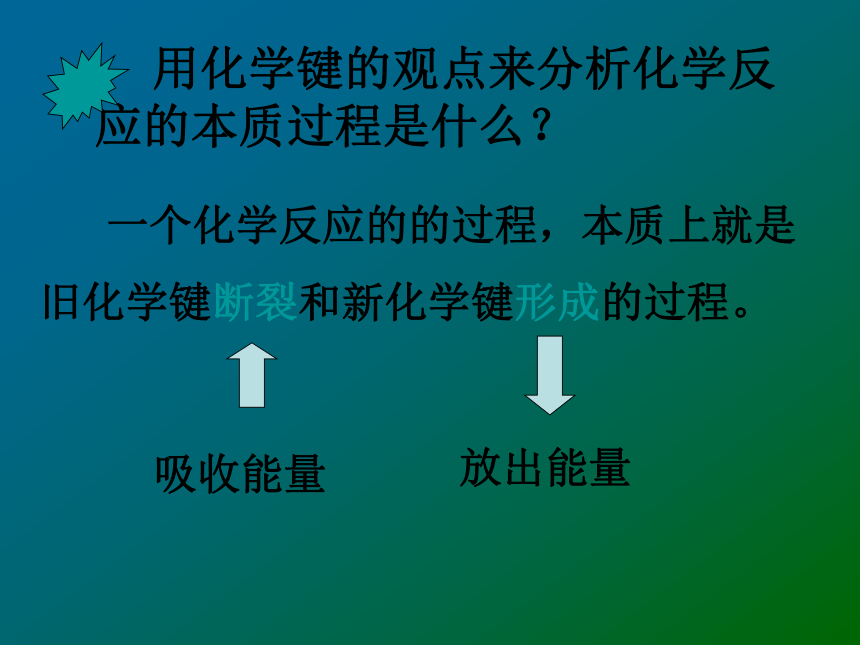
二 是利用反应中的能量. 用化学键的观点来分析化学反应的本质过程是什么? 一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。 吸收能量放出能量一、化学键与化学反应中能量变化的关系1、当物质发生化学反应时,断开反应物中
的化学键要吸收能量;而形成生成物中
的化学键要放出能量。
例如:断开H-H键要吸收能量。
形成H-H键要放出能量。2、化学键的断裂和形成是化学反应中能量
变化的主要原因。? 一个化学反应吸收能量还是放出能量是
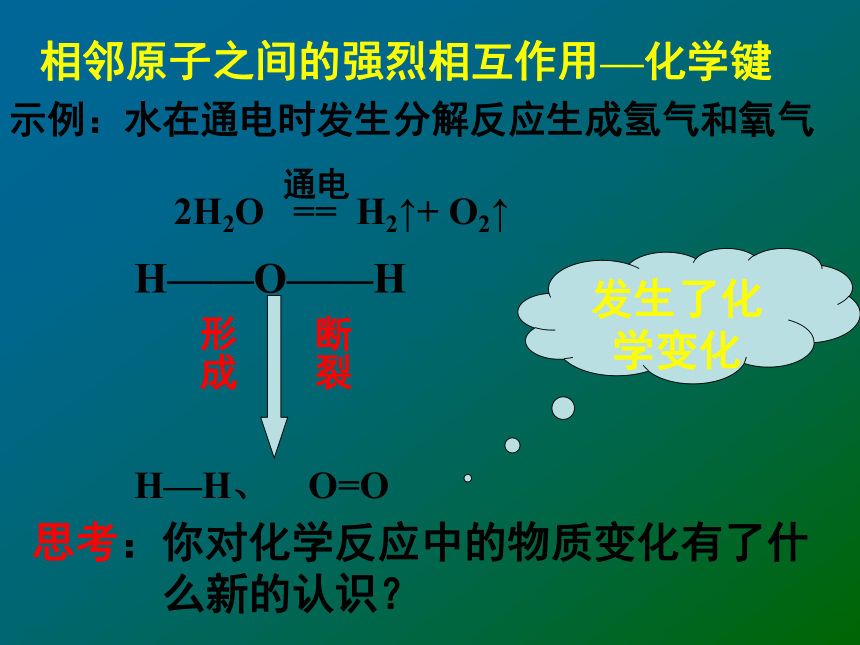
由什么决定的呢?从化学键的观点来分析能量的变化那么:一个化学反应是否为放热还是吸热取决于什么呢?相邻原子之间的强烈相互作用—化学键示例:水在通电时发生分解反应生成氢气和氧气
2H2O == H2↑+ O2↑思考:你对化学反应中的物质变化有了什
么新的认识?通电H——O——HH—H、 O=O断裂形成发生了化学变化一.化学键与化学反应中能量变化的关系1.旧键的断裂:新的认识:化学反应的实质:旧键的断裂
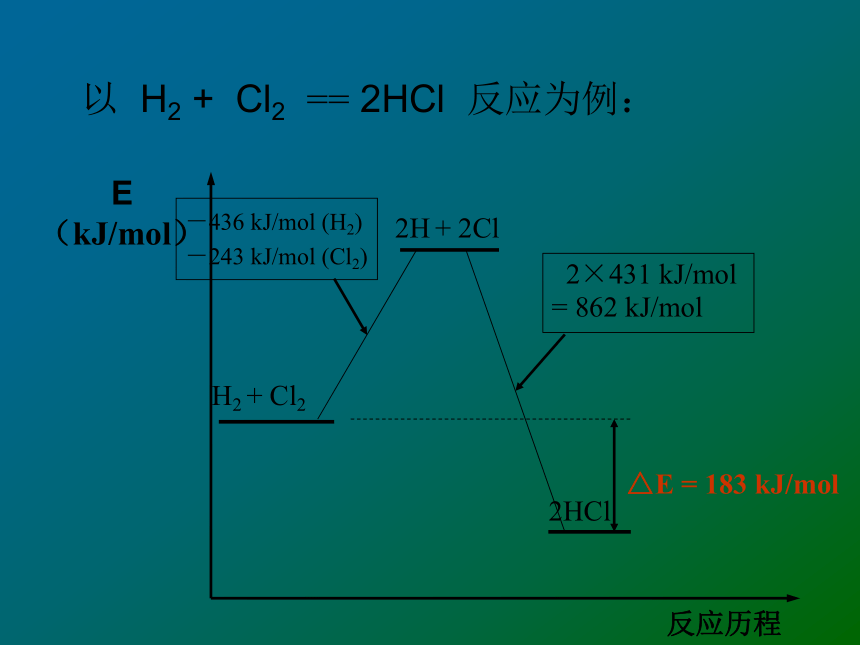
和新键的生成2.新键 的生成:结论:化学键的断裂和形成是化学反应中能量变化的主要原因。吸收能量放出能量△E = 183 kJ/mol-436 kJ/mol (H2)
-243 kJ/mol (Cl2) 2×431 kJ/mol
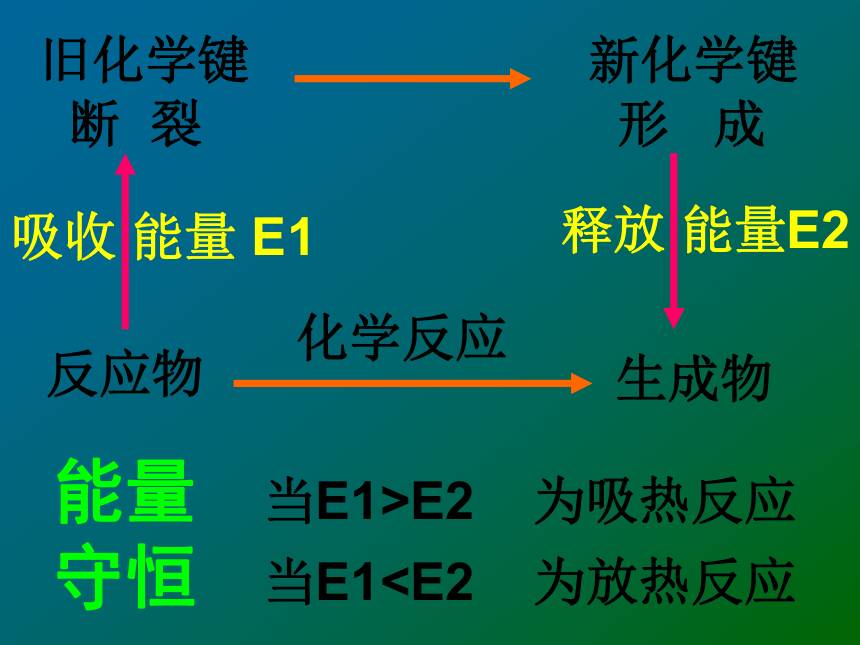
= 862 kJ/mol以 H2 + Cl2 == 2HCl 反应为例:旧化学键
断 裂新化学键
形 成吸收 能量 E1释放 能量E2反应物生成物当E1>E2 为吸热反应当E1 生成物总键能放热反应:吸热反应:小结:一个化学反应是否为放热还是吸热取
决于 取决于所有断键吸收的总能量与所有
形成新键放出的总能量的相对大小反应物的总能量高生成物的总能量低放出能量生成物的总能量高反应物的总能量低决定于反应物的总能量与生成物的总能量的相对大小。化学反应化学反应
吸收能量一个化学反应吸收能量还是放出能量放热吸热 从整体考虑的角度出发小结:能量公式化E(反应物)=E(生成物)+Q(能量守恒定律)E(反应物)-E(生成物)=QQ>0为放热反应Q<0为吸热反应提供能量:
电能转化为机械能再转化为势能反应物的总能量高生成物的总能量低生成物的总能量高反应物的总能量低放热反应吸热反应放热反应:反应物的总能量 = 生成物的总能量
+ 放出的热量吸热反应:生成物的总能量 = 反应物的总能量
+ 吸收的热量 化学反应的过程,可以看成是能量的“贮存”或“释放”的过程化学反应反应物的总能量=生成物的总能量+放出的热量生成物的总能量=反应物的总能量+吸收的热量结论:一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于反应物的总能量与生成物的总能量的相对大小。1、据反应物及生成物的总能量的大小反应物总能量>生成物总能量放热反应:吸热反应:反应物总能量<生成物总能量2、据反应物及生成物的总键能的大小判断吸热还是放热反应的方法:反应物总键能>生成物总键能反应物总键能<生成物总键能放热反应:吸热反应:1.下列各图中,表示正反应是吸热
反 应的是 ( )
练习A2、当物质发生化学反应时,断开反应物中的化学
键要 ;而形成生成物中的化
学键要 。一个化学反应
是释放能量还是吸收能量取决于
。吸收能量放出能量反应物总能量与生成物总能量的相对大小 3、若反应物的总能量>生成物的总能量,
化学反应 能量。
若反应物的总能量<生成物的总能量,
化学反应 能量。放出吸收4、已知反应A+B=C+D为放热反应,对
该反应的下列说法中正确的是( )
A、A的能量一定高于C
B、B的能量一定高于D
C、A和B的总能量一定高于C和D的总能量
D、该反应为放热反应,故不必加热就
一定能发生C 一个反应是吸热或放热与反应条件
没有直接联系,与反应物与生成物的总能量的相对大小有关。1、物质发生化学反应的同时还伴随着能量的变化,而这种能量变化又通常表现为热能变化。2、化学键的断裂和形成是化学反应中能量变化的主要原因。3、一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于反应物的总能量与生成物的总能量的相对大小。4、化学反应中遵循能量守恒原则。小结 据《参考消息》报道,有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。假如硅作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法中,你认为
不妥当的是 ( )
A.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料
B.硅的来源丰富,易于开采,且可再生
C.硅燃烧放出的热量大,且燃烧产物对环境污染程度低,容易有效控制
D.寻找高效新催化剂,使硅的生产耗能很低,是硅能源开发利用的关键技术√
一 是制取新物质;
二 是利用反应中的能量. 用化学键的观点来分析化学反应的本质过程是什么? 一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。 吸收能量放出能量一、化学键与化学反应中能量变化的关系1、当物质发生化学反应时,断开反应物中
的化学键要吸收能量;而形成生成物中
的化学键要放出能量。
例如:断开H-H键要吸收能量。
形成H-H键要放出能量。2、化学键的断裂和形成是化学反应中能量
变化的主要原因。? 一个化学反应吸收能量还是放出能量是
由什么决定的呢?从化学键的观点来分析能量的变化那么:一个化学反应是否为放热还是吸热取决于什么呢?相邻原子之间的强烈相互作用—化学键示例:水在通电时发生分解反应生成氢气和氧气
2H2O == H2↑+ O2↑思考:你对化学反应中的物质变化有了什
么新的认识?通电H——O——HH—H、 O=O断裂形成发生了化学变化一.化学键与化学反应中能量变化的关系1.旧键的断裂:新的认识:化学反应的实质:旧键的断裂
和新键的生成2.新键 的生成:结论:化学键的断裂和形成是化学反应中能量变化的主要原因。吸收能量放出能量△E = 183 kJ/mol-436 kJ/mol (H2)
-243 kJ/mol (Cl2) 2×431 kJ/mol
= 862 kJ/mol以 H2 + Cl2 == 2HCl 反应为例:旧化学键
断 裂新化学键
形 成吸收 能量 E1释放 能量E2反应物生成物当E1>E2 为吸热反应当E1
决于 取决于所有断键吸收的总能量与所有
形成新键放出的总能量的相对大小反应物的总能量高生成物的总能量低放出能量生成物的总能量高反应物的总能量低决定于反应物的总能量与生成物的总能量的相对大小。化学反应化学反应
吸收能量一个化学反应吸收能量还是放出能量放热吸热 从整体考虑的角度出发小结:能量公式化E(反应物)=E(生成物)+Q(能量守恒定律)E(反应物)-E(生成物)=QQ>0为放热反应Q<0为吸热反应提供能量:
电能转化为机械能再转化为势能反应物的总能量高生成物的总能量低生成物的总能量高反应物的总能量低放热反应吸热反应放热反应:反应物的总能量 = 生成物的总能量
+ 放出的热量吸热反应:生成物的总能量 = 反应物的总能量
+ 吸收的热量 化学反应的过程,可以看成是能量的“贮存”或“释放”的过程化学反应反应物的总能量=生成物的总能量+放出的热量生成物的总能量=反应物的总能量+吸收的热量结论:一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于反应物的总能量与生成物的总能量的相对大小。1、据反应物及生成物的总能量的大小反应物总能量>生成物总能量放热反应:吸热反应:反应物总能量<生成物总能量2、据反应物及生成物的总键能的大小判断吸热还是放热反应的方法:反应物总键能>生成物总键能反应物总键能<生成物总键能放热反应:吸热反应:1.下列各图中,表示正反应是吸热
反 应的是 ( )
练习A2、当物质发生化学反应时,断开反应物中的化学
键要 ;而形成生成物中的化
学键要 。一个化学反应
是释放能量还是吸收能量取决于
。吸收能量放出能量反应物总能量与生成物总能量的相对大小 3、若反应物的总能量>生成物的总能量,
化学反应 能量。
若反应物的总能量<生成物的总能量,
化学反应 能量。放出吸收4、已知反应A+B=C+D为放热反应,对
该反应的下列说法中正确的是( )
A、A的能量一定高于C
B、B的能量一定高于D
C、A和B的总能量一定高于C和D的总能量
D、该反应为放热反应,故不必加热就
一定能发生C 一个反应是吸热或放热与反应条件
没有直接联系,与反应物与生成物的总能量的相对大小有关。1、物质发生化学反应的同时还伴随着能量的变化,而这种能量变化又通常表现为热能变化。2、化学键的断裂和形成是化学反应中能量变化的主要原因。3、一个确定的化学反应在发生过程中是吸收能量还是放出能量,取决于反应物的总能量与生成物的总能量的相对大小。4、化学反应中遵循能量守恒原则。小结 据《参考消息》报道,有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。假如硅作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法中,你认为
不妥当的是 ( )
A.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料
B.硅的来源丰富,易于开采,且可再生
C.硅燃烧放出的热量大,且燃烧产物对环境污染程度低,容易有效控制
D.寻找高效新催化剂,使硅的生产耗能很低,是硅能源开发利用的关键技术√
