【化学】2.2 化学能与电能 (人教版必修2)课件1
文档属性
| 名称 | 【化学】2.2 化学能与电能 (人教版必修2)课件1 |  | |
| 格式 | zip | ||
| 文件大小 | 961.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-04-15 13:04:56 | ||
图片预览










文档简介
课件36张PPT。第二章 化学反应与能量第二节 化学能与电能第二节 化学能与电能第一课时——原电池【思考与交流】化学反应不仅有新物质生成,同时还伴随着能量的变化,但这种能量的变化通常以热能形式表现出来,那么有没有以电能形式表现出来的时候呢,试举例说明。思考:火力发电的过程能量是怎样转化的? 化学能(燃料)燃烧热能蒸汽 机械能
(涡轮机)发电机电能思考:火力发电有什么缺点?1.煤炭是非可再生资源,会造成能源危机2.煤炭燃烧会产生污染性气体3.经多次转换,能量损耗大,燃料的
利用率低 将铜片和锌片分别插入稀硫
酸溶液中,观察现象并解释原因。实验2一4现象:解释: Zn片上有气泡(H2), Zn片逐溶解;Cu片无明显现象。Zn + 2H+ == Zn2+ + H2↑ 将铜片和锌片用导线连接插
入稀硫酸溶液中,观察现象并解释原因。实验2-4现象:解释: Zn片逐渐溶解但无气泡;
Cu片上有气泡(H2);电流计指针偏转。
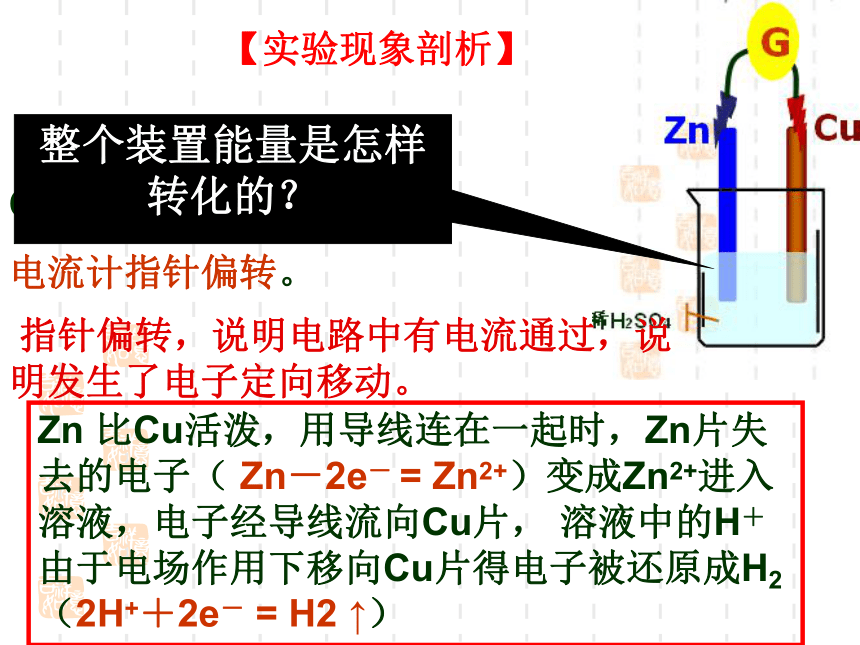
?G【实验现象剖析】 Zn片逐渐溶解但无气泡;
Cu片上有气泡(H2);
电流计指针偏转。 指针偏转,说明电路中有电流通过,说明发生了电子定向移动。Zn 比Cu活泼,用导线连在一起时,Zn片失去的电子( Zn-2e- = Zn2+)变成Zn2+进入溶液,电子经导线流向Cu片, 溶液中的H+由于电场作用下移向Cu片得电子被还原成H2(2H++2e- = H2 ↑)整个装置能量是怎样转化的?一、原电池1.定义:将化学能直接转变成电能的装置,
称为原电池电源2.正负极:负极:电子流进(或电流流出)的一极正极:电子流出(或电流流进)的一极一、原电池3.电极反应:负极正极Zn-2e-=Zn2+2H++2e-=H2↑氧化反应还原反应Zn+2H+=Zn2++H2↑(两个电极反应之和)小结:负极失去电子的一极氧化反应活性强正极得到电子的一极还原反应活性弱e-→⊕外电路:内电路:阳离子→正极阴离子→负极这样整个电路构成了闭合回路,带电粒子的定向移动产生电流一、原电池4.工作原理: H2SO4 (aq) CuSO4 (aq)负极( ): .
正极( ): .
总反应式: .负极( ): .
正极( ): .
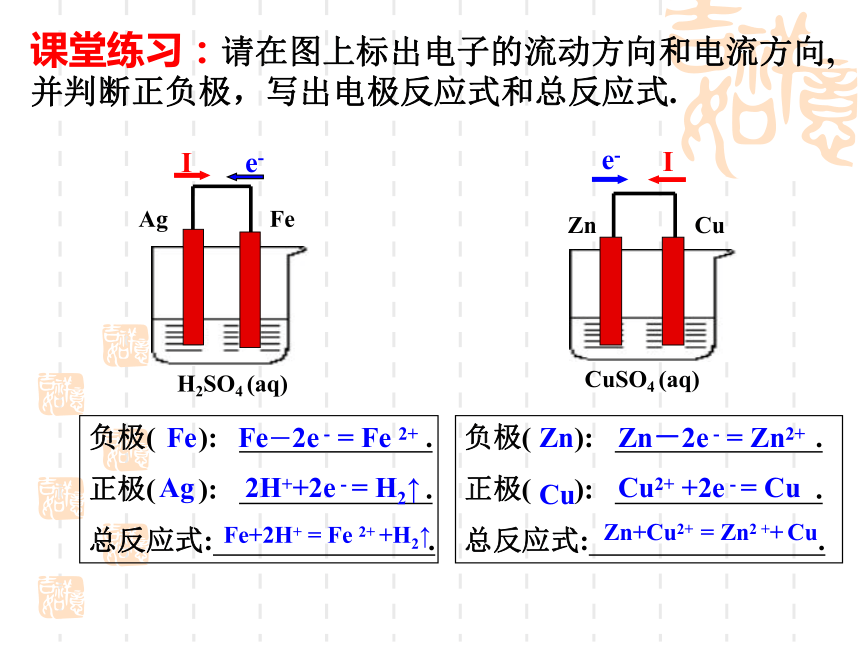
总反应式: .课堂练习:请在图上标出电子的流动方向和电流方向,并判断正负极,写出电极反应式和总反应式. AgFeFeAgFe-2e - = Fe 2+2H++2e - = H2↑Fe+2H+ = Fe 2+ +H2↑ZnCuZn-2e - = Zn2+ Cu2+ +2e - = CuZn+Cu2+ = Zn2 ++ Cu回忆思考:通过以上实验想想原电池是由哪几部分组成的,构成原电池的条件又有哪些一、原电池组成:两电极、导线、电解质溶液以及容器构成条件猜想:电极有关-----相同的电极材料导线有关-----切断导线电解质溶液有关-----非电解质不可实验探究:形成原电池的条件结论:有两种活动性不同的金属作电极实验探究:形成原电池的条件有两种活泼性不同的金属
(或一种是非金属导体)作电极其中:较活泼的金属作负极
较不活泼的金属、石墨等作正极可以结论:实验探究:形成原电池的条件结论:整个装置构成闭合电路不可实验探究:形成原电池的条件结论:电极材料均浸入的是电解质溶液不可实验探究:形成原电池的条件结论:一个自发进行的氧化还原反应 u不可一、原电池5.原电池的形成条件:两极一液一连线① 两种活泼性不同的金属(或其中一种为能导电的非金属,如“碳棒”)作电极
其中较活泼金属为负极。较不活泼金属(或非金属)为正极(正极一般不参与电极反应,只起导电作用);特殊AI-Mg-NaOH是Al作负极Fe-Cu-HNO3(浓)是Cu作负极 ② 电解质溶液③ 形成闭合回路 ④ 能自发地发生氧化还原反应酒精、蔗糖、四氯化碳不行Zn CuFe C(石墨) Zn CuZn ZnFe CuSi C(石墨) 稀H2SO4 CuSO4 溶液 稀H2SO4 稀H2SO4
A B C DZn Cu稀H2SO4 酒精 稀H2SO4
E F G H√√√习题一:原电池的判断×××××1.2.某金属能跟稀盐酸作用放出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.Cu
原电池的工作原理B3.由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 PH( )
A.不 B.先变大后变小
C逐渐变大 D.逐渐变小
C习题二4.如图装置,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的哪一组( ) A、A是锌,B是铜,C为稀H2SO4
B、A是铜,B是锌,C为稀硫酸
C、A是铁,B是银,C为AgNO3溶液
D、A是Ag,B是铁,C为AgNO3溶液 D习题二原电池的工作原理习题三5.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为( )
A.a > b > c > d B.a > c > d > b
C.c > a > b > d D.b > d > c > a B利用原电池电极判断金属性强弱判断原电池正、负极的方法1、由组成原电池的两极材料判断:一般是活泼的金属为负极
活泼性较弱的金属或能导电的非金属为正极2、根据电流方向或电子流动方向判断:电子流出的一极是负极,电子流进的一极是正极4、根据原电池两极发生的变化来判断:发生氧化反应的是负极,发生还原反应的是正极【归纳小结】5、电极反应现象: 不断溶解,质量减少为负极;有气体产生,或质量增加或不变为正极3、根据内电路离子移动的方向判断:阳离子移向的一极为正极,阴离子移向的为负极①制作化学电源
②加快反应速率:
例如,实验室制H2时,由于锌太纯,反应一般较慢,可加入少量CuSO4以加快反应速率。
③判断金属活动性的强弱
④揭示钢铁腐蚀的原因及防止钢铁的腐蚀。
钢铁中含有碳,可与Fe组成原电池,发生原电池反应而使钢铁遭到腐蚀一、原电池6.原电池原理的应用:.通常在轮船的尾部和在船壳的水线以下 部分,装有一定数量的锌块,请解释原 因。
学以致用思考题原因:轮船的船身一般是用铁做的,装上锌块后,铁跟锌形成原电池,此时锌作为负极发生氧化反应溶掉,而铁作为正极被保护起来不受腐蚀。第二课时 化学电源空气电池锂电池(1)干电池的构造是什么样的?
(2)干电池的负极和正极分别是什么?电解质溶液又是什么?
(3)干电池使用久了会发生什么现象?
思考题(4)什么叫做充电电池?铅蓄电池的构造是什么样的?
(5)铅蓄电池负极和正极分别是什么?电解质溶液又是什么?
(6)废旧电池是否应该回收?为什么?
?干
电
池 上图是锌-锰干电池负极:Zn-- 2e- ==Zn2+
正极(C):2NH4++ 2e- ==2NH3↑+2H2 ↑ 体积小、性能好的碱性锌-锰电池应运
而生。这类电池的重要特征是电解液由原来
的中性变为离子导电性更好的碱性,负极也由
锌片改为锌粉,反应面积成倍增长,使放电电
流大幅度提高。铅蓄电池锂电池 锂是密度最小的金属,用锂作为电池的负极,跟用相同质量的其他金属作负极相比较,使用寿命大大延长。新型燃料电池 燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池负极:2H2-4e- +4OH- ==4H2O
正极:O2+2H2O+4e- ==4OH-
总反应:2H2+O2==2H2O
电极:多孔镍 电解质:KOH
(涡轮机)发电机电能思考:火力发电有什么缺点?1.煤炭是非可再生资源,会造成能源危机2.煤炭燃烧会产生污染性气体3.经多次转换,能量损耗大,燃料的
利用率低 将铜片和锌片分别插入稀硫
酸溶液中,观察现象并解释原因。实验2一4现象:解释: Zn片上有气泡(H2), Zn片逐溶解;Cu片无明显现象。Zn + 2H+ == Zn2+ + H2↑ 将铜片和锌片用导线连接插
入稀硫酸溶液中,观察现象并解释原因。实验2-4现象:解释: Zn片逐渐溶解但无气泡;
Cu片上有气泡(H2);电流计指针偏转。
?G【实验现象剖析】 Zn片逐渐溶解但无气泡;
Cu片上有气泡(H2);
电流计指针偏转。 指针偏转,说明电路中有电流通过,说明发生了电子定向移动。Zn 比Cu活泼,用导线连在一起时,Zn片失去的电子( Zn-2e- = Zn2+)变成Zn2+进入溶液,电子经导线流向Cu片, 溶液中的H+由于电场作用下移向Cu片得电子被还原成H2(2H++2e- = H2 ↑)整个装置能量是怎样转化的?一、原电池1.定义:将化学能直接转变成电能的装置,
称为原电池电源2.正负极:负极:电子流进(或电流流出)的一极正极:电子流出(或电流流进)的一极一、原电池3.电极反应:负极正极Zn-2e-=Zn2+2H++2e-=H2↑氧化反应还原反应Zn+2H+=Zn2++H2↑(两个电极反应之和)小结:负极失去电子的一极氧化反应活性强正极得到电子的一极还原反应活性弱e-→⊕外电路:内电路:阳离子→正极阴离子→负极这样整个电路构成了闭合回路,带电粒子的定向移动产生电流一、原电池4.工作原理: H2SO4 (aq) CuSO4 (aq)负极( ): .
正极( ): .
总反应式: .负极( ): .
正极( ): .
总反应式: .课堂练习:请在图上标出电子的流动方向和电流方向,并判断正负极,写出电极反应式和总反应式. AgFeFeAgFe-2e - = Fe 2+2H++2e - = H2↑Fe+2H+ = Fe 2+ +H2↑ZnCuZn-2e - = Zn2+ Cu2+ +2e - = CuZn+Cu2+ = Zn2 ++ Cu回忆思考:通过以上实验想想原电池是由哪几部分组成的,构成原电池的条件又有哪些一、原电池组成:两电极、导线、电解质溶液以及容器构成条件猜想:电极有关-----相同的电极材料导线有关-----切断导线电解质溶液有关-----非电解质不可实验探究:形成原电池的条件结论:有两种活动性不同的金属作电极实验探究:形成原电池的条件有两种活泼性不同的金属
(或一种是非金属导体)作电极其中:较活泼的金属作负极
较不活泼的金属、石墨等作正极可以结论:实验探究:形成原电池的条件结论:整个装置构成闭合电路不可实验探究:形成原电池的条件结论:电极材料均浸入的是电解质溶液不可实验探究:形成原电池的条件结论:一个自发进行的氧化还原反应 u不可一、原电池5.原电池的形成条件:两极一液一连线① 两种活泼性不同的金属(或其中一种为能导电的非金属,如“碳棒”)作电极
其中较活泼金属为负极。较不活泼金属(或非金属)为正极(正极一般不参与电极反应,只起导电作用);特殊AI-Mg-NaOH是Al作负极Fe-Cu-HNO3(浓)是Cu作负极 ② 电解质溶液③ 形成闭合回路 ④ 能自发地发生氧化还原反应酒精、蔗糖、四氯化碳不行Zn CuFe C(石墨) Zn CuZn ZnFe CuSi C(石墨) 稀H2SO4 CuSO4 溶液 稀H2SO4 稀H2SO4
A B C DZn Cu稀H2SO4 酒精 稀H2SO4
E F G H√√√习题一:原电池的判断×××××1.2.某金属能跟稀盐酸作用放出氢气,该金属与锌组成原电池时,锌为负极,此金属是( )
A.Mg B.Fe C.Al D.Cu
原电池的工作原理B3.由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 PH( )
A.不 B.先变大后变小
C逐渐变大 D.逐渐变小
C习题二4.如图装置,电流表G发生偏转,同时A极逐渐变粗,B极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的哪一组( ) A、A是锌,B是铜,C为稀H2SO4
B、A是铜,B是锌,C为稀硫酸
C、A是铁,B是银,C为AgNO3溶液
D、A是Ag,B是铁,C为AgNO3溶液 D习题二原电池的工作原理习题三5.把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为( )
A.a > b > c > d B.a > c > d > b
C.c > a > b > d D.b > d > c > a B利用原电池电极判断金属性强弱判断原电池正、负极的方法1、由组成原电池的两极材料判断:一般是活泼的金属为负极
活泼性较弱的金属或能导电的非金属为正极2、根据电流方向或电子流动方向判断:电子流出的一极是负极,电子流进的一极是正极4、根据原电池两极发生的变化来判断:发生氧化反应的是负极,发生还原反应的是正极【归纳小结】5、电极反应现象: 不断溶解,质量减少为负极;有气体产生,或质量增加或不变为正极3、根据内电路离子移动的方向判断:阳离子移向的一极为正极,阴离子移向的为负极①制作化学电源
②加快反应速率:
例如,实验室制H2时,由于锌太纯,反应一般较慢,可加入少量CuSO4以加快反应速率。
③判断金属活动性的强弱
④揭示钢铁腐蚀的原因及防止钢铁的腐蚀。
钢铁中含有碳,可与Fe组成原电池,发生原电池反应而使钢铁遭到腐蚀一、原电池6.原电池原理的应用:.通常在轮船的尾部和在船壳的水线以下 部分,装有一定数量的锌块,请解释原 因。
学以致用思考题原因:轮船的船身一般是用铁做的,装上锌块后,铁跟锌形成原电池,此时锌作为负极发生氧化反应溶掉,而铁作为正极被保护起来不受腐蚀。第二课时 化学电源空气电池锂电池(1)干电池的构造是什么样的?
(2)干电池的负极和正极分别是什么?电解质溶液又是什么?
(3)干电池使用久了会发生什么现象?
思考题(4)什么叫做充电电池?铅蓄电池的构造是什么样的?
(5)铅蓄电池负极和正极分别是什么?电解质溶液又是什么?
(6)废旧电池是否应该回收?为什么?
?干
电
池 上图是锌-锰干电池负极:Zn-- 2e- ==Zn2+
正极(C):2NH4++ 2e- ==2NH3↑+2H2 ↑ 体积小、性能好的碱性锌-锰电池应运
而生。这类电池的重要特征是电解液由原来
的中性变为离子导电性更好的碱性,负极也由
锌片改为锌粉,反应面积成倍增长,使放电电
流大幅度提高。铅蓄电池锂电池 锂是密度最小的金属,用锂作为电池的负极,跟用相同质量的其他金属作负极相比较,使用寿命大大延长。新型燃料电池 燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池负极:2H2-4e- +4OH- ==4H2O
正极:O2+2H2O+4e- ==4OH-
总反应:2H2+O2==2H2O
电极:多孔镍 电解质:KOH
