化学能与电能课件1
图片预览








文档简介
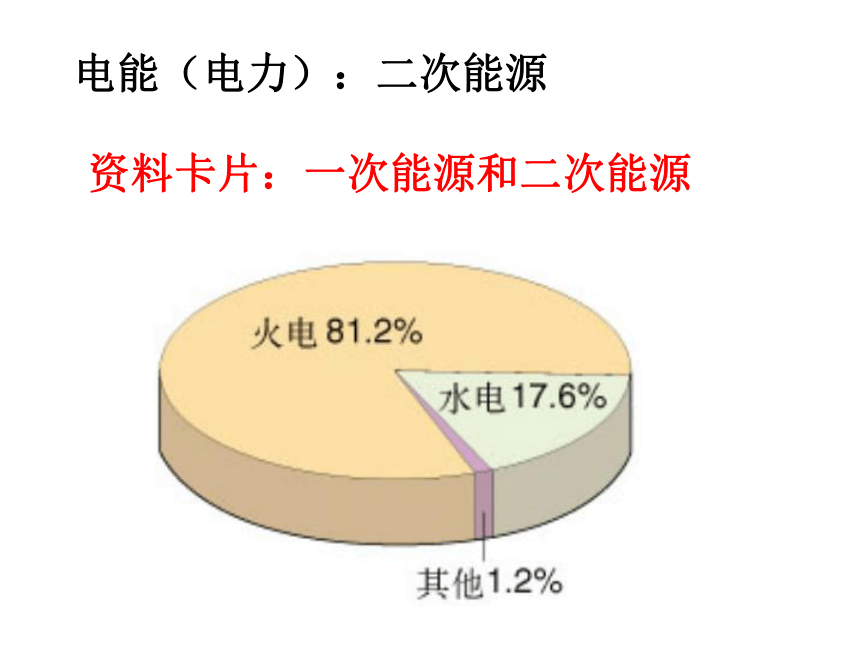
课件33张PPT。第二节 化学能与电能电能(电力):二次能源资料卡片:一次能源和二次能源(分析火力发电的利与弊)火力发电优点:1.我国煤炭资源丰富,廉价方便.
2.电能清洁安全,又快捷方便.火力发电缺点:1.排出大量的温室效应气体.
2.有废气可能导致酸雨
3.废料
4.废水
5.能量转换效率低1、当氧化剂和还原剂直接接触进行反应时,化学能要经过一系列能量转换才能转换为电能。
2、把氧化剂和还原剂分开,使氧化反应和还原反应在两个不同区域进行。
3、需要在氧化剂和还原剂之间架设桥梁使电子从氧化剂区域流向还原剂区域。
4、考虑氧化反应和还原反应发生的条件和环境,化学物质的选择。
5、从电学角度考虑仪器选择和组装问题。1、初步了解原电池的概念、原理、组成及应用。
2、通过实验探究从电子转移角度理解化学能向电能转化的本质及原电池的构成条件。
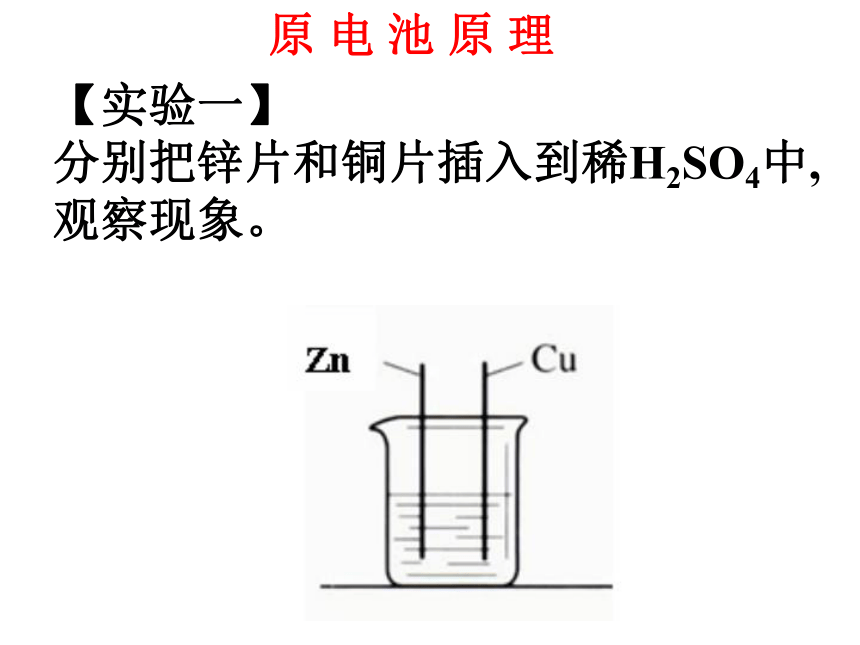
学习目标: 【实验一】
分别把锌片和铜片插入到稀H2SO4中,
观察现象。原 电 池 原 理【实验二】
再用导线把锌片和铜片连接起来,
观察铜片上有无气泡产生?原 电 池 原 理一、原电池
1、定义:把化学能转变为电能的装置.问题探究
你能找到原电池
的正负极吗?
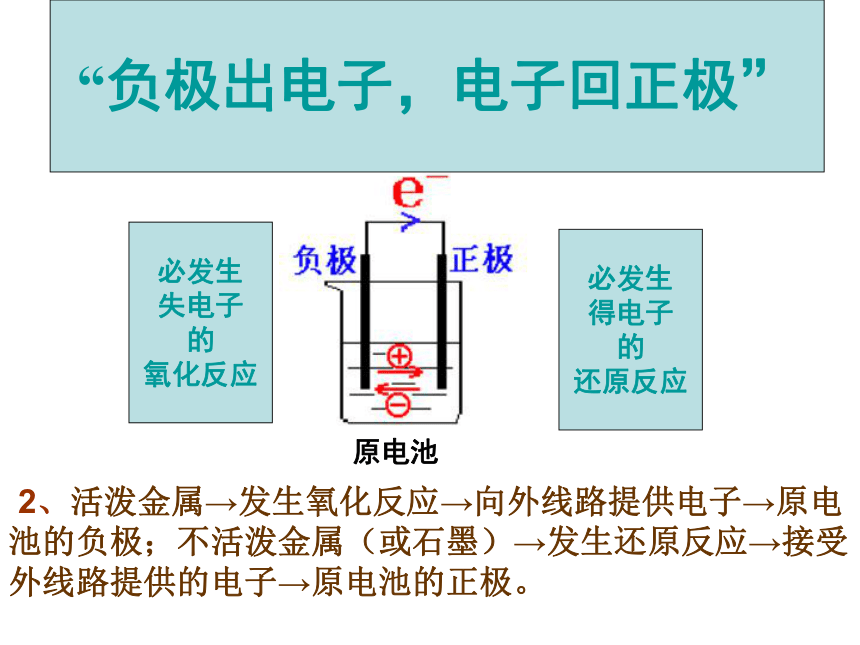
原 电 池 原 理原电池“负极出电子,电子回正极”必发生
失电子
的
氧化反应必发生
得电子
的
还原反应 2、活泼金属→发生氧化反应→向外线路提供电子→原电池的负极;不活泼金属(或石墨)→发生还原反应→接受外线路提供的电子→原电池的正极。
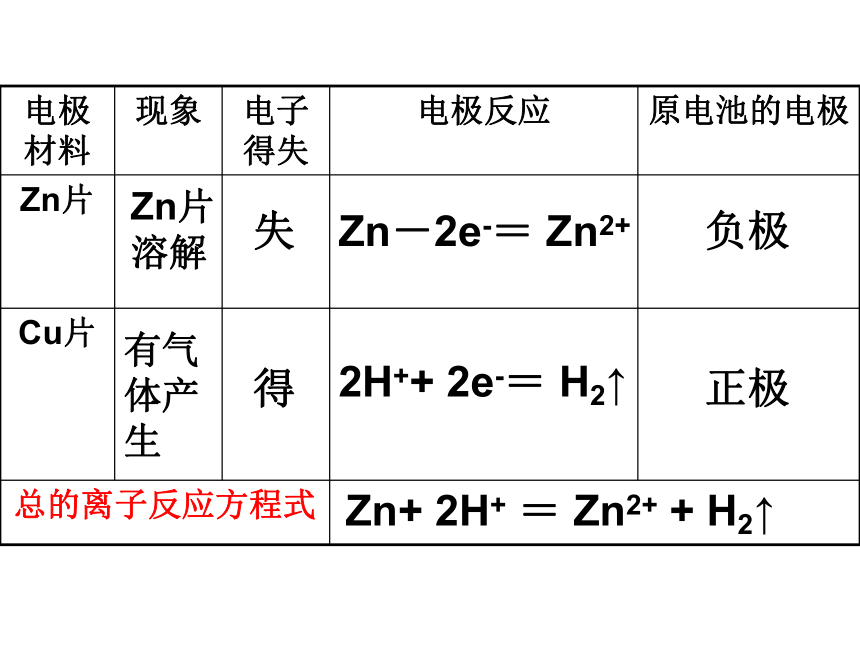
失得Zn-2e-= Zn2+2H++ 2e-= H2↑负极正极Zn+ 2H+ = Zn2+ + H2↑有气体产生Zn片溶解实验探究:Zn—Zn与稀硫酸进行实验.
Zn—石墨与稀硫酸进行实验.
Fe—Zn与稀硫酸进行实验.
Cu—Zn与乙醇进行实验.
Cu—Zn与一个西红柿(或一个苹果)进行实验.
Cu—Zn与两个西红柿进行实验.
Cu—Zn与橙汁进行实验.CH2SO4(不可以)(不可以)(可以)(不可以)4、原电池的构成条件 ①两种活泼性不同的金属(或一种金属和 另一种非金属导体)构成电极。
②电解质溶液。
③电极用导线相联构成闭合回路。思考与交流
通过以上实验和探究,试说明化学电池由几部分组成,它的组成条件是什么?3、化学电池由正极、负极、电解质溶液以及容器组成。4原电池化学反应本质: 较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过外电路流向较不活泼的金属(正极) 氧化还原反应6、原电池设计思路:①放能量的氧化还原反应(放热反应) ② 通常须两活性不同的电极 ③ 电解质溶液 ④ 还原剂在负极失电子,发生氧化反 应;氧 化剂在正极得电子,发生还原反应.二、化学能与电能的相互转化 请同学们根据原电池的原理,指出下列原电池的正极与负极分别是什么?写出电极反应方程式和总反应方程式。巩 固 练 习 相同条件下,纯锌粒和粗锌粒与同浓度的稀硫酸反应的速率一样吗?为什么?假如要求你设计实验来证明你的观点,你的实验方案是怎样的?证据和结论又是什么?病 例 分 析病 例 分 析病 例 分 析
你能为她开一个药方吗?原电池分析电极反应式的书写总反应方程式的书写化学电池的反应本质:氧化还原反应原电池电极名称的确定方法①根据电极材料的性质确定。通常是活泼金属是负极,不活泼金属、碳棒、化合物是正极。②根据电极反应的本身确定。失电子的反应→氧化反应→负极
得电子的反应→还原反应→正极总结思 考 题请根据反应
2Fe3+ + Fe = 3 Fe 2+
设计原电池,你有哪些可行方案?
Fe-Cu FeCl3Fe-C Fe(NO3)3Fe-Ag Fe(SO4)3 把a、b、c、d四块金属片浸入稀硫酸中,用
导线两两相连组成原电池。若a、b相连时,a为
负极;c、d相连时,电流由d到c;a、c相连时,
c极上产生大量气泡,b、d相连时,b上有大量气
泡产生,则四种金属的活动性顺序由强到弱的为:
( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a B练 习三、发展中的化学电源氢氧燃料电池1969年美国“阿波罗11号”登月成功。飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图示:两个电极均由多孔性碳制成,通入的气体由孔隙逸出,并在电极表面放电。
1、a是 极,
b是 极
电极反应式分别为:负正 2、氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等。请写出将图中氢气换成甲烷时所构成的甲烷燃料电池中a极的电极反应式:
,
此时电池内总的反应式
。
2.电能清洁安全,又快捷方便.火力发电缺点:1.排出大量的温室效应气体.
2.有废气可能导致酸雨
3.废料
4.废水
5.能量转换效率低1、当氧化剂和还原剂直接接触进行反应时,化学能要经过一系列能量转换才能转换为电能。
2、把氧化剂和还原剂分开,使氧化反应和还原反应在两个不同区域进行。
3、需要在氧化剂和还原剂之间架设桥梁使电子从氧化剂区域流向还原剂区域。
4、考虑氧化反应和还原反应发生的条件和环境,化学物质的选择。
5、从电学角度考虑仪器选择和组装问题。1、初步了解原电池的概念、原理、组成及应用。
2、通过实验探究从电子转移角度理解化学能向电能转化的本质及原电池的构成条件。
学习目标: 【实验一】
分别把锌片和铜片插入到稀H2SO4中,
观察现象。原 电 池 原 理【实验二】
再用导线把锌片和铜片连接起来,
观察铜片上有无气泡产生?原 电 池 原 理一、原电池
1、定义:把化学能转变为电能的装置.问题探究
你能找到原电池
的正负极吗?
原 电 池 原 理原电池“负极出电子,电子回正极”必发生
失电子
的
氧化反应必发生
得电子
的
还原反应 2、活泼金属→发生氧化反应→向外线路提供电子→原电池的负极;不活泼金属(或石墨)→发生还原反应→接受外线路提供的电子→原电池的正极。
失得Zn-2e-= Zn2+2H++ 2e-= H2↑负极正极Zn+ 2H+ = Zn2+ + H2↑有气体产生Zn片溶解实验探究:Zn—Zn与稀硫酸进行实验.
Zn—石墨与稀硫酸进行实验.
Fe—Zn与稀硫酸进行实验.
Cu—Zn与乙醇进行实验.
Cu—Zn与一个西红柿(或一个苹果)进行实验.
Cu—Zn与两个西红柿进行实验.
Cu—Zn与橙汁进行实验.CH2SO4(不可以)(不可以)(可以)(不可以)4、原电池的构成条件 ①两种活泼性不同的金属(或一种金属和 另一种非金属导体)构成电极。
②电解质溶液。
③电极用导线相联构成闭合回路。思考与交流
通过以上实验和探究,试说明化学电池由几部分组成,它的组成条件是什么?3、化学电池由正极、负极、电解质溶液以及容器组成。4原电池化学反应本质: 较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过外电路流向较不活泼的金属(正极) 氧化还原反应6、原电池设计思路:①放能量的氧化还原反应(放热反应) ② 通常须两活性不同的电极 ③ 电解质溶液 ④ 还原剂在负极失电子,发生氧化反 应;氧 化剂在正极得电子,发生还原反应.二、化学能与电能的相互转化 请同学们根据原电池的原理,指出下列原电池的正极与负极分别是什么?写出电极反应方程式和总反应方程式。巩 固 练 习 相同条件下,纯锌粒和粗锌粒与同浓度的稀硫酸反应的速率一样吗?为什么?假如要求你设计实验来证明你的观点,你的实验方案是怎样的?证据和结论又是什么?病 例 分 析病 例 分 析病 例 分 析
你能为她开一个药方吗?原电池分析电极反应式的书写总反应方程式的书写化学电池的反应本质:氧化还原反应原电池电极名称的确定方法①根据电极材料的性质确定。通常是活泼金属是负极,不活泼金属、碳棒、化合物是正极。②根据电极反应的本身确定。失电子的反应→氧化反应→负极
得电子的反应→还原反应→正极总结思 考 题请根据反应
2Fe3+ + Fe = 3 Fe 2+
设计原电池,你有哪些可行方案?
Fe-Cu FeCl3Fe-C Fe(NO3)3Fe-Ag Fe(SO4)3 把a、b、c、d四块金属片浸入稀硫酸中,用
导线两两相连组成原电池。若a、b相连时,a为
负极;c、d相连时,电流由d到c;a、c相连时,
c极上产生大量气泡,b、d相连时,b上有大量气
泡产生,则四种金属的活动性顺序由强到弱的为:
( )
A.a > b > c > d B.a > c > d > b
C.c > a > b .> d D.b > d > c > a B练 习三、发展中的化学电源氢氧燃料电池1969年美国“阿波罗11号”登月成功。飞船上使用的氢氧燃料电池是一种新型的化学电池,其构造如图示:两个电极均由多孔性碳制成,通入的气体由孔隙逸出,并在电极表面放电。
1、a是 极,
b是 极
电极反应式分别为:负正 2、氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等。请写出将图中氢气换成甲烷时所构成的甲烷燃料电池中a极的电极反应式:
,
此时电池内总的反应式
。
