人教版九年级化学 第五单元 课题3 利用化学方程式的简单计算 课时1 利用化学方程式的简单计算课件(共12张PPT)
文档属性
| 名称 | 人教版九年级化学 第五单元 课题3 利用化学方程式的简单计算 课时1 利用化学方程式的简单计算课件(共12张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 243.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-22 19:10:52 | ||
图片预览





文档简介
(共12张PPT)
课题3 利用化学方程式的简单计算
第五单元 化学方程式
课时1 利用化学方程式的简单计算
目录
01
课程要求
02
课前预习
03
知识点精讲
04
课堂检测
课程要求
进一步认识化学反应中各物质之间的质量关系;能根据化学反应方程式进行简单的计算。
课前预习
已知木炭燃烧的化学方程式为C+O2 ==== CO2,请根据化学方程式回答下列问题。
点燃
(1)12 g木炭完全燃烧,生成CO2的质量是多少?
化学方程式 C + O2 ==== CO2
相对分子质量 _______ _________ ________
实际质量 12 g x
计算结果 x=________
(2)生成44 g CO2时,消耗的氧气的质量是多少?
化学方程式 C + O2 ==== CO2
相对分子质量 _______ _________ ________
实际质量 x 44 g
计算结果 x=________
点燃
点燃
12
32
44
12
32
44
44 g
32 g
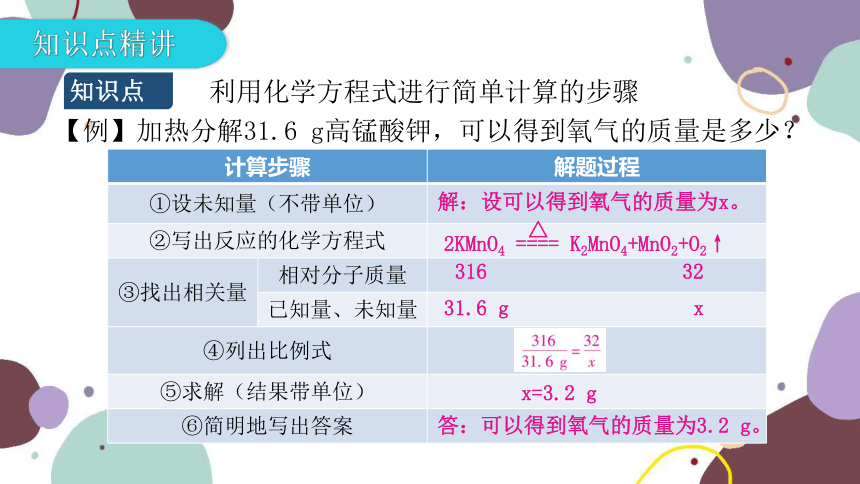
知识点精讲
知识点
利用化学方程式进行简单计算的步骤
计算步骤 解题过程
①设未知量(不带单位)
②写出反应的化学方程式
③找出相关量 相对分子质量
已知量、未知量
④列出比例式
⑤求解(结果带单位)
⑥简明地写出答案
【例】加热分解31.6 g高锰酸钾,可以得到氧气的质量是多少?
解:设可以得到氧气的质量为x。
△
2KMnO4 ==== K2MnO4+MnO2+O2↑
316 32
31.6 g x
x=3.2 g
答:可以得到氧气的质量为3.2 g。
课堂练习
1. 近期,我国科研团队发现:将铂(Pt)以原子级别分散在载体表面,可将CO2高效转化为甲醇,已知主要反应为CO2+3H2 ==== CH3OH+H2O。则11 t的CO2理论上可转化为几吨的甲醇?
Pt
解:设11 t的CO2理论上可转化为甲醇的质量为x。
CO2+3H2 ==== CH3OH+H2O
44 32
11 t x
x=8 t
答:11 t的CO2理论上可转化为8 t的甲醇。
Pt
甲同学 乙同学 丙同学 丁同学
解:设可得x g氢气。 HO2 ==== H↑+O2↑ 33 1 36 g x x=1.1 g 答:可得到1.1 g氢气。
解:设可得x氢气。 H2O ==== H2↑+O2↑ 18 2 36 x x=4 g 答:可得到4 g氢气。
解:设可得到x g氢气。 2H2O ==== 2H2↑+O2↑ 36 4 32 36 g x x=32 答:可得到32 g氢气。
解:设可得到氢气的质量为x。
2H2O ==== 2H2↑+O2↑
36 4
36 g x
x=4 g
答:可得到4 g氢气。
通电
通电
通电
通电
2. 电解36 g水可得到多少克氢气?下面是四位同学的解题过程和结果,请你仔细检查后分析他们做得对不对。分别有什么错误?
(1)甲同学的错误是_____________________________________
_________________________________________。
设未知数不正确,化学方程式不正确,结果不正确
(2)乙同学的错误是___________________________________
____________________________________。
(3)丙同学的错误是____________________________________
____________________________________。
(4)丁同学的错误是___________________________________
_____________________________________。
设未知数不正确,化学方程式不正确
设未知数不正确,对应关系不正确,结果不正确
没有列出计算的比例式
课堂检测
1. 氢气在氯气中燃烧生成氯化氢气体,燃烧100 g 氢气可以生成多少克氯化氢气体?
解:设燃烧100 g氢气可以生成氯化氢气体的质量为x。
H2+ Cl2 ==== 2HCl
2 73
100 g x
x=3 650 g
答:燃烧100 g氢气可以生成3 650 g氯化氢气体。
点燃
2. 工业上,高温煅烧石灰石(主要成分是CaCO3)可制得生石灰(CaO)和二氧化碳。如果要制取5.6 t氧化钙,需要碳酸钙的质量是多少?同时可产生多少质量的二氧化碳?(写出计算过程)
解:设需要碳酸钙的质量为x,同时生成二氧化碳的质量为y。
CaCO3 ==== CaO+CO2↑
100 56 44
x 5.6 t y
x=10 t y=4.4 t
答:需要碳酸钙的质量为10 t,同时生成二氧化碳4.4 t。
高温
3. 加热分解158 g高锰酸钾。
(1)可以得到多少克氧气?
(2)生成氧气的体积为多少?(计算结果精确到0.1,已知氧气的密度为1.43 g/L)
解:(1)设可以得到氧气的质量为x。
2KMnO4 ==== K2MnO4+MnO2+O2↑
316 32
158 g x
x=16 g
(2)V(O2)= =11.2 L
答:(1)可以得到16 g氧气。(2)生成氧气的体积为11.2 L。
△
课题3 利用化学方程式的简单计算
第五单元 化学方程式
课时1 利用化学方程式的简单计算
目录
01
课程要求
02
课前预习
03
知识点精讲
04
课堂检测
课程要求
进一步认识化学反应中各物质之间的质量关系;能根据化学反应方程式进行简单的计算。
课前预习
已知木炭燃烧的化学方程式为C+O2 ==== CO2,请根据化学方程式回答下列问题。
点燃
(1)12 g木炭完全燃烧,生成CO2的质量是多少?
化学方程式 C + O2 ==== CO2
相对分子质量 _______ _________ ________
实际质量 12 g x
计算结果 x=________
(2)生成44 g CO2时,消耗的氧气的质量是多少?
化学方程式 C + O2 ==== CO2
相对分子质量 _______ _________ ________
实际质量 x 44 g
计算结果 x=________
点燃
点燃
12
32
44
12
32
44
44 g
32 g
知识点精讲
知识点
利用化学方程式进行简单计算的步骤
计算步骤 解题过程
①设未知量(不带单位)
②写出反应的化学方程式
③找出相关量 相对分子质量
已知量、未知量
④列出比例式
⑤求解(结果带单位)
⑥简明地写出答案
【例】加热分解31.6 g高锰酸钾,可以得到氧气的质量是多少?
解:设可以得到氧气的质量为x。
△
2KMnO4 ==== K2MnO4+MnO2+O2↑
316 32
31.6 g x
x=3.2 g
答:可以得到氧气的质量为3.2 g。
课堂练习
1. 近期,我国科研团队发现:将铂(Pt)以原子级别分散在载体表面,可将CO2高效转化为甲醇,已知主要反应为CO2+3H2 ==== CH3OH+H2O。则11 t的CO2理论上可转化为几吨的甲醇?
Pt
解:设11 t的CO2理论上可转化为甲醇的质量为x。
CO2+3H2 ==== CH3OH+H2O
44 32
11 t x
x=8 t
答:11 t的CO2理论上可转化为8 t的甲醇。
Pt
甲同学 乙同学 丙同学 丁同学
解:设可得x g氢气。 HO2 ==== H↑+O2↑ 33 1 36 g x x=1.1 g 答:可得到1.1 g氢气。
解:设可得x氢气。 H2O ==== H2↑+O2↑ 18 2 36 x x=4 g 答:可得到4 g氢气。
解:设可得到x g氢气。 2H2O ==== 2H2↑+O2↑ 36 4 32 36 g x x=32 答:可得到32 g氢气。
解:设可得到氢气的质量为x。
2H2O ==== 2H2↑+O2↑
36 4
36 g x
x=4 g
答:可得到4 g氢气。
通电
通电
通电
通电
2. 电解36 g水可得到多少克氢气?下面是四位同学的解题过程和结果,请你仔细检查后分析他们做得对不对。分别有什么错误?
(1)甲同学的错误是_____________________________________
_________________________________________。
设未知数不正确,化学方程式不正确,结果不正确
(2)乙同学的错误是___________________________________
____________________________________。
(3)丙同学的错误是____________________________________
____________________________________。
(4)丁同学的错误是___________________________________
_____________________________________。
设未知数不正确,化学方程式不正确
设未知数不正确,对应关系不正确,结果不正确
没有列出计算的比例式
课堂检测
1. 氢气在氯气中燃烧生成氯化氢气体,燃烧100 g 氢气可以生成多少克氯化氢气体?
解:设燃烧100 g氢气可以生成氯化氢气体的质量为x。
H2+ Cl2 ==== 2HCl
2 73
100 g x
x=3 650 g
答:燃烧100 g氢气可以生成3 650 g氯化氢气体。
点燃
2. 工业上,高温煅烧石灰石(主要成分是CaCO3)可制得生石灰(CaO)和二氧化碳。如果要制取5.6 t氧化钙,需要碳酸钙的质量是多少?同时可产生多少质量的二氧化碳?(写出计算过程)
解:设需要碳酸钙的质量为x,同时生成二氧化碳的质量为y。
CaCO3 ==== CaO+CO2↑
100 56 44
x 5.6 t y
x=10 t y=4.4 t
答:需要碳酸钙的质量为10 t,同时生成二氧化碳4.4 t。
高温
3. 加热分解158 g高锰酸钾。
(1)可以得到多少克氧气?
(2)生成氧气的体积为多少?(计算结果精确到0.1,已知氧气的密度为1.43 g/L)
解:(1)设可以得到氧气的质量为x。
2KMnO4 ==== K2MnO4+MnO2+O2↑
316 32
158 g x
x=16 g
(2)V(O2)= =11.2 L
答:(1)可以得到16 g氧气。(2)生成氧气的体积为11.2 L。
△
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
