化学人教版(2019)必修第一册4.2元素周期律(共45张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册4.2元素周期律(共45张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 844.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-23 14:50:33 | ||
图片预览









文档简介
(共45张PPT)
随着原子序数的递增,
元素原子的核外电子排布
元素原子半径
元素化合价
元素的金属性和非金属性
呈现周期性变化
第二节 元素周期律
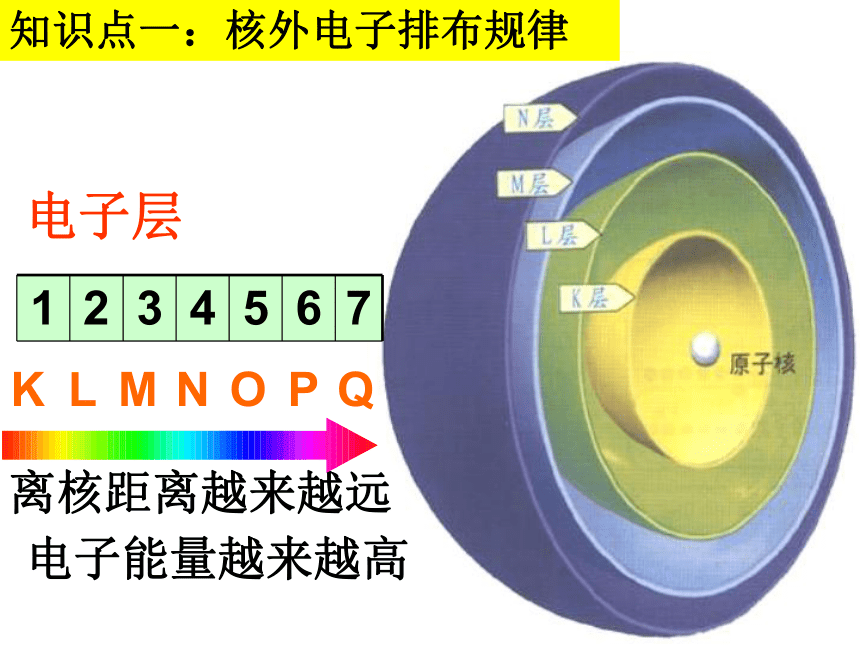
电子层
K L M N O P Q
1 2 3 4 5 6 7
离核距离越来越远
电子能量越来越高
知识点一:核外电子排布规律
(2)各电子层最多容纳2n2个电子;
(3)最外层不超过8个电子(K层为最外层时不超过2个);次外层不超过18个电子;倒数第三层不超过32个电子;
(1)核外电子总是先排能量低后排能量高。
核外电子排布规律
以上规律互相联系,不能孤立理解。
H
Li
Be
B
C
N
He
Na
K
Rb
Cs
Fr
Mg
Ca
Sr
Ba
Ra
Al
Ga
In
Tl
Si
Ge
Sn
Pb
P
As
Sb
Bi
O
S
Se
Te
Po
F
Cl
Br
I
At
Ne
Ar
Kr
Xe
Rn
知识点二:微粒半径的比较
微粒半径比较
第一步:比较核外电子层数
一般情况下,微粒的电子层数越多,半径越大。
第二步:比较核电荷数
当微粒的核外电子层数相同时,就比较核电荷数。核电荷数越大, 半径越小。
第三步:比较核外电子数目
当微粒的核外电子层数和核电荷数都相同时,就比较核外电子数目。核外电子数目越多, 半径越大。r(Cl) r(Cl -)
r(F) ___r(Cl)
<
r(Na) ___r(Mg)
>
<
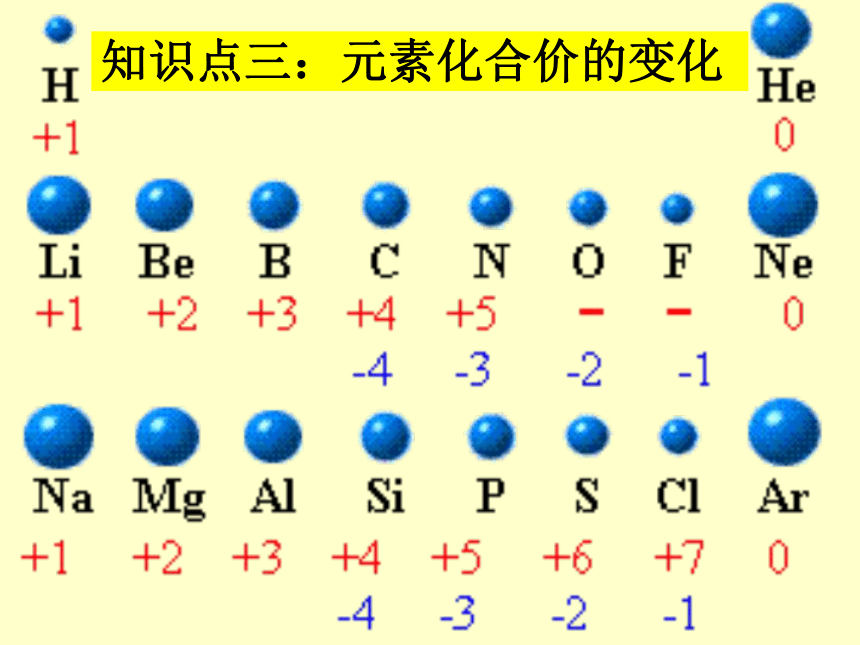
知识点三:元素化合价的变化
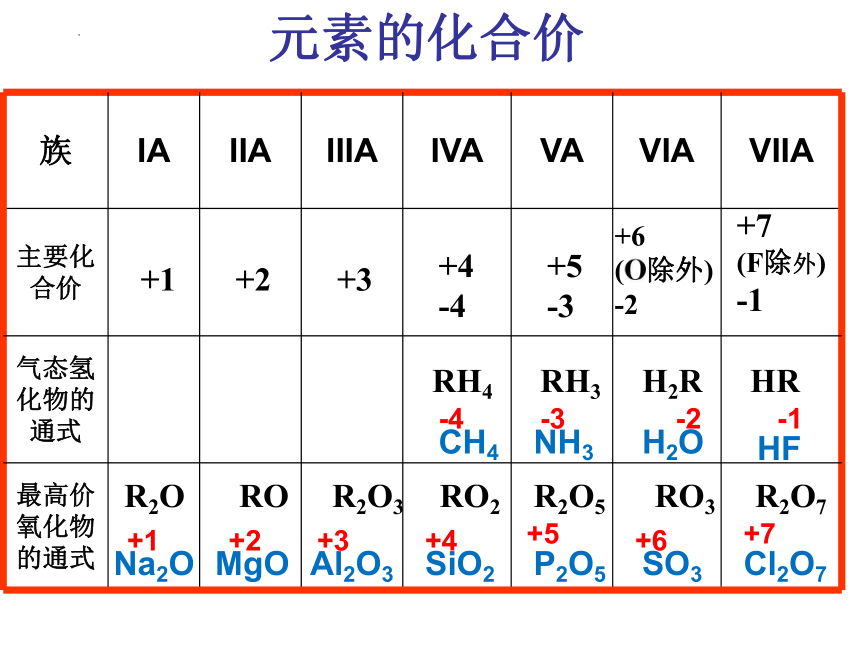
元素的化合价
族 IA IIA IIIA IVA VA VIA VIIA
主要化合价
气态氢化物的通式
最高价氧化物的通式
+1
+2
+3
+4
-4
+5
-3
+6
(O除外)
-2
+7
(F除外)
-1
RH4
RH3
H2R
HR
R2O
RO
R2O3
RO2
R2O5
RO3
R2O7
-4
-3
-2
-1
CH4
NH3
H2O
HF
Na2O
MgO
Al2O3
SiO2
P2O5
SO3
Cl2O7
+1
+2
+3
+4
+5
+6
+7
元素的主要化合价的变化规律
3、同周期元素
化合价:+1→+7 ;-4→-1
1、元素的最高正价=最外层电子数
元素的最低负价=最外层电子数-8
氧无最高正价,氟无正价
2、最高正价 + ︱最低负价 ︳=8
4、金属元素无负价;
1.某元素的气态氢化物化学式为H2R,此元素最高价氧化物对应水化物的化学式可能为 ( )
A.H2RO3 B.H2RO4 C.HRO3 D.H3RO4
B
最高正价数 = (主族)最外层电子数 = 主族序数
最低负价数 = 最外层电子数- 8
【知以致用】
2. 下列性质的递变中,正确的是 ( )
A. O、S、Na的原子半径依次增大
B. LiOH、KOH、CsOH的碱性依次增强
C. HF、HCl、HI的稳定性依次增强
D. HCl、HBr、HI的还原性依次减弱
AB
3. 下列元素的原子半径依次减小的是 ( )
A. Li、Na、K B. F、O、N
C. Si、P、C D. C、Si、Al
C
4.对Na、Mg、Al的有关性质的叙述正确的是 ( )
A.碱性:NaOH>Mg(OH)2>Al(OH)3
B.原子半径:Na<Mg<Al
C.离子半径:Na+<Mg2+<Al3+
D.单质的还原性:Al>Mg>Na
A
5.比较半径大小: Cl- Na+ O2- Mg2+ Fe F- Al3+
Fe > Cl- > O2- > F- > Na+ > Mg2+ > Al3+
金
属
性
(1)金属单质与水或酸反应置换出H2的难易
(2)金属最高价氧化物对应的水化物(最高价氢氧化物)的碱性强弱
判断元素金属性强弱的方法
判断元素非金属性强弱的方法
非
金
属
性
(1)非金属单质与H2化合的难易
(2)气态氢化物的稳定性
(3)最高价氧化物对应的水化物(最高价含氧酸)的酸性强弱
元素的金属性和非金属性是否也随原子序数的变化呈现周期性变化呢?
思考与交流
元素性质 Na Mg Al
单质和水(或酸) 的反应情况
最高价氧化物对应水化物碱性
跟冷水剧烈反应
NaOH
强碱
跟沸水反应放H2;
跟酸剧烈反应
Mg(OH)2
中强碱
跟水不反应;
跟酸较为迅速反应;
Al(OH)3
两性氢氧化物
金属性:Na > Mg > Al
①Na-Mg-Al元素金属性的递变规律
(2)第三周期元素金属性、非金属性的递变
结 论
14Si 15P 16S 17Cl
最高价氧化物
对应的水化物
酸性强弱
单质与H2反应条件
氢化物稳定性
SiO2
P2O5
SO3
Cl2O7
H2SiO3
H3PO4
H2SO4
HClO4
弱酸
中强酸
强酸
最强酸
逐 渐 增 强
高温
加热
加热
点燃或光照
SiH4
PH3
H2S
HCl
逐 渐 增 强
②Si、P、S、Cl元素非金属性的递变
结 论
Si、P、S、Cl元素非金属性逐渐增强
第三周期元素中:
Na Mg Al Si P S Cl
Ar
稀有气体
【结 论】
【规 律】
同周期元素,电子层数相同。从左至右,核电荷数逐渐 ,原子半径逐渐 ,失电子的能力逐渐 ,得电子的能力逐渐 ;元素的金属性逐渐 ,非金属性逐渐 。(稀有气体元素除外)
增多
减小
减弱
增强
减弱
增强
金属性逐渐减弱,非金属性逐渐增强
族 IA IIA IIIA IVA VA VIA VIIA
主要化合价
气态氢化物的通式
最高价氧化物的通式
最高价氧化物对应的水化物的通式
+1
+2
+3
+4
-4
+5
-3
+6
(O除外)
-2
+7
(F除外)
-1
RH4
RH3
H2R
HR
R2O
RO
R2O3
RO2
R2O5
RO3
R2O7
HRO4
ROH
R(OH)2
R(OH)3
H2RO4
H3RO4
或
HRO3
H4RO4
或
H2RO3
(1)定义: 元素的性质随着元素原子序数的递增而呈周期性的变化的规律。
(2)实质: 元素性质的周期性变化是元素原子核外电子排布周期性变化的必然结果。
3、 元素周期律
同周期元素,电子层数相同。从左至右,核电荷数逐渐 ,原子半径逐渐 ,失电子的能力逐渐 ,得电子的能力逐渐 ;元素的金属性逐渐 ,非金属性逐渐 。(稀有气体元素除外)
同主族元素,最外层电子数相同。从上到下,核电荷数逐渐 ,电子层数逐渐 ,原子半径逐渐 ,失电子的能力逐渐 ,得电子的能力逐渐 ;元素的金属性逐渐 ,非金属性逐渐 。
增多
减小
减弱
增强
减弱
增强
增多
增多
增大
增强
减弱
增强
减弱
项目 同周期(左→右) 同主族(上→下)
原 子结构 核电荷数
最外层电子数
电子层数
原子半径
性质 化合价
元素的金属性和非金属性
单质的氧化性还原性
最高价化合物对应水化物的酸碱性
气态氢化物的稳定性
同周期、同主族元素的递变规律
依次增大
逐渐增多
相同
逐渐减小
周期性变化
金属性减弱,
非金属性增强
还原性减弱,
氧化性增强
碱性减弱,酸性增强
逐渐增强
按周期元素数增加
相同
依次递增
逐渐增大
基本相同
非金属性减弱,
金属性增强
氧化性减弱,
还原性增强
酸性减弱,碱性增强
逐渐减弱
1、用元素符号(化学式)回答原子序数11~18的元素的有关问题:
(1)、除稀有气体外,原子半径最大的是 :
(2)、最高价氧化物的水化物碱性最强的是 ;最高价氧化物的水化物呈两性的是 ;最高价氧化物的水化物酸性最强的是 ;
(3)、能形成气态氢化物且最稳定的是 。
Na
NaOH
HClO4
Al(OH)3
HCl
【知以致用】
5.下列叙述中, 错误的是 ( )
A.原子半径:Cl>S>O
B.还原性:Na>Mg>Al
C.稳定性:HF>HCl>HBr
D.酸性:HClO4>H2SO4>H3PO4
A
6、下列事实能说明金属性Na>Mg的是 ( )
A、Na最外层有一个电子,Mg最外层有2个电子;
B、Na能与冷水反应,而Mg不能;
C、碱性:NaOH >Mg(OH)2
D、 Na不能从MgCl2的溶液中把Mg置换出来
BC
7、已知:
a.硫酸比次氯酸稳定;
b.高氯酸是比硫酸更强的酸;
c.S2-比Cl-易被氧化;
d.HCl比H2S稳定;
e.铜与盐酸不反应,与浓硫酸能反应。
可说明氯比硫非金属性强的是 ( )
全部 B. bcd C. abd D. 除a以外
B
8、同周期X、Y、Z三种元素,已知最高价氧化物对应的水化物的酸性是 HXO4 > H2YO4 > H3ZO4,则下列说法判断错误的是 ( )
A. 原子半径:X > Y > Z
B. 气态氢化物稳定性:HX > H2Y > ZH3
C. 元素的非金属性:X > Y > Z
D. 单质的氧化性: X > Y > Z
A
原子序数= 核电荷数
周期序数= 电子层数
主族序数=最外层电子数
同位素-化学性质相同
相似性
递变性(从上至下,金属性增强,非金属性减弱)
同周期
同主族
递变性(从左到右,金属性减弱,非金属性增强)
电子层数
最外层电子数
金属性、非金属性强弱
最高正价数=(主族)最外层电子数
=主族序数
最低负价数=最外层电子数- 8
原子结构
表中位置
元素性质
1、F 没有正价,O 通常不显示正价;
2、金属元素只有正化合价而无负价。
元素“位(位置)—构(结构)—性(性质)” 之间的关系
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
非金属区
金属区
零
族
元
素
最强
最强
1. 学习和研究化学的规律和工具
2. 研究发现新物质
3. 论证了量变引起质变的规律性
三. 元素周期律和元素周期表的应用
(3) 寻找半导体材料.
(1) 预言新元素
(2) 研究新农药
金属和非金属的交界处
预测它们的结构与性质
非金属右上方处
过渡元素
(4) 寻找催化剂、耐高温耐腐蚀材料.
1. 在周期表中金属和非金属的分界线附近能找到 ( )
A.制农药的元素 B.制催化剂的元素
C.做半导体的元素 D.制耐高温合金材料的元素
C
2.下列关于元素周期律和元素周期表的论述中正确的是
A.同一主族的元素从上到下单质熔点逐渐升高
B.元素周期表是元素周期律的具体表现形式
C.同一周期从左到右,元素原子半径逐渐增大
D.非金属元素的最高正化合价等于它的负化合价的绝对值
B
5.某元素的气态氢化物化学式为H2R,此元素最高价氧化物对应水化物的化学式可能为 ( )
A.H2RO3 B.H2RO4 C.HRO3 D.H3RO4
B
6、已知1—18号元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是 ( )
A.原子半径 A>B>D>C
B.原子序数 d>c>b>a
C.离子半径 C3- > D- >B+ >A2+
D.单质的还原性 A>B>D>C
C
【16年全国I卷】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01 mol·L–1 r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是 ( )
A.原子半径的大小WB.元素的非金属性Z>X>Y
C.Y的氢化物常温常压下为液态
D.X的最高价氧化物的水化物为强酸
C
1.【2016届怀化一模】元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构.下列推测不正确的是 ( )
A.同周期元素中X的金属性最强
B.原子半径X>Y,离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强
考点:原子结构和元素周期律的关系
B
Na Cl O
2.【2016届苏州一模】短周期主族元素X、Y、Z、W原子序数依次增大,X元素的单质可在自然界形成最硬的矿石,Y原子最外层有6个电子,Z元素的氧化物可做高温耐火材料且其最高价氧化物的水化物是难溶于水的碱性物质,W与X同主族。下列叙述正确的是 ( )
A.原子最外层电子数由少到多的顺序:X=W<Y<Z
B.原子半径由大到小的顺序:r(W)>r(X)>r(Y)>r(Z)
C.元素非金属性由强到弱的顺序:X、Y、W
D.元素的简单气态氢化物的稳定性由强到弱的顺序:Y、X、W
考点:考查结构、性质、位置关系应用
D
C O Mg
Si
H的位置:第IA族 PK 第VIIA族
有人认为在元素周期表中,位于IA族的氢元素,也可以放在VIIA族,能支持这种观点的是下列物质中的___
A、HF B、H3O+ C、NaH D、H2O2
C
质疑:现有元素周期表不完善的地方
2、对角线规则:
Li
Na
Be
Mg
B
Al
C
Si
质疑:现有元素周期表不完善的地方
(1)单质跟水(或酸)反应置换出氢的难易;
(2)最高价氧化物的水化物—氢氧化物的碱性强弱;
判断元素金属性强弱(即元素原子的失电子的难易)的方法:
(3)金属单质间的置换反应;
复习
判断元素非金属性强弱(即元素原子的得电子的难易)的方法
(2)最高价氧化物的水化物——含氧酸的酸性强弱
(1)单质与氢气生成气态氢化物的难易程度以及氢化物的稳定性
(3)非金属单质间的置换反应
知识点四:周期表中金属性和非金属性递变规律
原子序数 11 12 13 14 15 16 17 18
元素符号 Na Mg Al Si P S Cl Ar
单质和水(或酸)反应情况 冷水剧烈 热水较快 盐酸剧烈 盐酸较快
高温
磷蒸气与H2能反应
须加热
光照或点燃爆炸化合
NaOH
强碱
Mg(OH)2
中强碱
Al(OH)3
两性氢
氧化物
H4SiO4
弱酸
H3PO4
中强酸
H2SO4
强酸
HClO4
最强酸
稀有气体元素
非金属单质与氢气反应
最高价氧化物对应水化物的酸碱性
金属性和非金属性递变
金属性逐渐减弱,非金属性逐渐增强
金属性逐渐减弱,非金属性逐渐增强
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
BC
1、(双选)下列事实能说明金属性Na>Mg的是:
A、Na最外层有一个电子,Mg最外层有2个电子;
B、Na能与冷水反应,而Mg不能;
C、碱性NaOH >Mg(OH)2
D、 Na不能从MgCl2的溶液中把Mg置换出来
随堂练习
2、下列事实能说明非金属性Cl >S的是(双选):
A、Cl2比S易与H2化合
B、HCl比H2S稳定
C、酸性HCl >H2S
D、Cl的最高正价为+7,S的最高正价为+6
AB
3、已知1-18号元素的离子 aW3+、bX+、cY2-、dZ- 都具有相同的电子层结构, 下列关系正确的是
A.质子数c>b
B.离子的还原性Y2->Z-
C.氢化物的稳定性H2Y>HZ
D.原子半径XB
4、已知同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列判断中正确的是( )
A.单质的氧化性按X、Y、Z的顺序增强
B.阴离子的还原性按X、Y、Z的顺序减弱
C.气态氢化物的稳定性按X、Y、Z的顺序增强
D.元素非金属性按X、Y、Z的顺序减弱
D
在周期表中一定的区域内寻找特定性质的物质
寻找催化剂、耐高温、耐腐蚀的合金材料
寻找半导体材料
寻找用于制取农药的元素
周期表中特殊位置的元素(短周期)
(1)族序数等于周期数的元素:
H、Be、Al;
(2)族序数等于周期数3倍的元素:
(3)周期数是族序数2倍的元素:
(4)最外层电子数等于次外层3倍的元素是:
(5)最外层电子数与最内层电子数相等的元素
O
Li
O
Be、Mg
(6)最高正价与最低负价代数和为零的短周期元素:
C Si H
元素性质、存在、用途的特殊性
(1)形成化合物种类最多的元素:
(2)空气中含量最多的元素,或气态氢化物的水溶液呈碱性的元素:
(3)常温下呈液态的非金属单质元素是:
(4)最高价氧化物及其水化物既能与强酸反应,又能与强碱反应的元素是:
(5)元素的气态氢化物和它的最高价氧化物的水化物起化合反应的元素是: ,起氧化还原反应的元素是:
C
N
Br
Al
N
S
(7)所形成气态氢化物最稳定的是
最高价氧化物对应的水化物酸性最强的是
(8)与水反应最激烈的非金属元素是
F
Cl
F
(6)元素的气态氢化物能和它的氧化物在常温下反应生成该元素单质的元素是:
S
“10电子”的微粒小结
分子 离子
一核10电子的
二核10电子的
三核10电子的
四核10电子的
五核10电子的
Ne
N3-、O2-、F-、Na+、Mg2+、Al3+
HF
OH-
H2O
NH2-
NH3
H3O+
CH4
NH4+
根据下列数据推出元素① ② ③
④ ⑤ ⑥ ⑦ ⑧
随着原子序数的递增,
元素原子的核外电子排布
元素原子半径
元素化合价
元素的金属性和非金属性
呈现周期性变化
第二节 元素周期律
电子层
K L M N O P Q
1 2 3 4 5 6 7
离核距离越来越远
电子能量越来越高
知识点一:核外电子排布规律
(2)各电子层最多容纳2n2个电子;
(3)最外层不超过8个电子(K层为最外层时不超过2个);次外层不超过18个电子;倒数第三层不超过32个电子;
(1)核外电子总是先排能量低后排能量高。
核外电子排布规律
以上规律互相联系,不能孤立理解。
H
Li
Be
B
C
N
He
Na
K
Rb
Cs
Fr
Mg
Ca
Sr
Ba
Ra
Al
Ga
In
Tl
Si
Ge
Sn
Pb
P
As
Sb
Bi
O
S
Se
Te
Po
F
Cl
Br
I
At
Ne
Ar
Kr
Xe
Rn
知识点二:微粒半径的比较
微粒半径比较
第一步:比较核外电子层数
一般情况下,微粒的电子层数越多,半径越大。
第二步:比较核电荷数
当微粒的核外电子层数相同时,就比较核电荷数。核电荷数越大, 半径越小。
第三步:比较核外电子数目
当微粒的核外电子层数和核电荷数都相同时,就比较核外电子数目。核外电子数目越多, 半径越大。r(Cl) r(Cl -)
r(F) ___r(Cl)
<
r(Na) ___r(Mg)
>
<
知识点三:元素化合价的变化
元素的化合价
族 IA IIA IIIA IVA VA VIA VIIA
主要化合价
气态氢化物的通式
最高价氧化物的通式
+1
+2
+3
+4
-4
+5
-3
+6
(O除外)
-2
+7
(F除外)
-1
RH4
RH3
H2R
HR
R2O
RO
R2O3
RO2
R2O5
RO3
R2O7
-4
-3
-2
-1
CH4
NH3
H2O
HF
Na2O
MgO
Al2O3
SiO2
P2O5
SO3
Cl2O7
+1
+2
+3
+4
+5
+6
+7
元素的主要化合价的变化规律
3、同周期元素
化合价:+1→+7 ;-4→-1
1、元素的最高正价=最外层电子数
元素的最低负价=最外层电子数-8
氧无最高正价,氟无正价
2、最高正价 + ︱最低负价 ︳=8
4、金属元素无负价;
1.某元素的气态氢化物化学式为H2R,此元素最高价氧化物对应水化物的化学式可能为 ( )
A.H2RO3 B.H2RO4 C.HRO3 D.H3RO4
B
最高正价数 = (主族)最外层电子数 = 主族序数
最低负价数 = 最外层电子数- 8
【知以致用】
2. 下列性质的递变中,正确的是 ( )
A. O、S、Na的原子半径依次增大
B. LiOH、KOH、CsOH的碱性依次增强
C. HF、HCl、HI的稳定性依次增强
D. HCl、HBr、HI的还原性依次减弱
AB
3. 下列元素的原子半径依次减小的是 ( )
A. Li、Na、K B. F、O、N
C. Si、P、C D. C、Si、Al
C
4.对Na、Mg、Al的有关性质的叙述正确的是 ( )
A.碱性:NaOH>Mg(OH)2>Al(OH)3
B.原子半径:Na<Mg<Al
C.离子半径:Na+<Mg2+<Al3+
D.单质的还原性:Al>Mg>Na
A
5.比较半径大小: Cl- Na+ O2- Mg2+ Fe F- Al3+
Fe > Cl- > O2- > F- > Na+ > Mg2+ > Al3+
金
属
性
(1)金属单质与水或酸反应置换出H2的难易
(2)金属最高价氧化物对应的水化物(最高价氢氧化物)的碱性强弱
判断元素金属性强弱的方法
判断元素非金属性强弱的方法
非
金
属
性
(1)非金属单质与H2化合的难易
(2)气态氢化物的稳定性
(3)最高价氧化物对应的水化物(最高价含氧酸)的酸性强弱
元素的金属性和非金属性是否也随原子序数的变化呈现周期性变化呢?
思考与交流
元素性质 Na Mg Al
单质和水(或酸) 的反应情况
最高价氧化物对应水化物碱性
跟冷水剧烈反应
NaOH
强碱
跟沸水反应放H2;
跟酸剧烈反应
Mg(OH)2
中强碱
跟水不反应;
跟酸较为迅速反应;
Al(OH)3
两性氢氧化物
金属性:Na > Mg > Al
①Na-Mg-Al元素金属性的递变规律
(2)第三周期元素金属性、非金属性的递变
结 论
14Si 15P 16S 17Cl
最高价氧化物
对应的水化物
酸性强弱
单质与H2反应条件
氢化物稳定性
SiO2
P2O5
SO3
Cl2O7
H2SiO3
H3PO4
H2SO4
HClO4
弱酸
中强酸
强酸
最强酸
逐 渐 增 强
高温
加热
加热
点燃或光照
SiH4
PH3
H2S
HCl
逐 渐 增 强
②Si、P、S、Cl元素非金属性的递变
结 论
Si、P、S、Cl元素非金属性逐渐增强
第三周期元素中:
Na Mg Al Si P S Cl
Ar
稀有气体
【结 论】
【规 律】
同周期元素,电子层数相同。从左至右,核电荷数逐渐 ,原子半径逐渐 ,失电子的能力逐渐 ,得电子的能力逐渐 ;元素的金属性逐渐 ,非金属性逐渐 。(稀有气体元素除外)
增多
减小
减弱
增强
减弱
增强
金属性逐渐减弱,非金属性逐渐增强
族 IA IIA IIIA IVA VA VIA VIIA
主要化合价
气态氢化物的通式
最高价氧化物的通式
最高价氧化物对应的水化物的通式
+1
+2
+3
+4
-4
+5
-3
+6
(O除外)
-2
+7
(F除外)
-1
RH4
RH3
H2R
HR
R2O
RO
R2O3
RO2
R2O5
RO3
R2O7
HRO4
ROH
R(OH)2
R(OH)3
H2RO4
H3RO4
或
HRO3
H4RO4
或
H2RO3
(1)定义: 元素的性质随着元素原子序数的递增而呈周期性的变化的规律。
(2)实质: 元素性质的周期性变化是元素原子核外电子排布周期性变化的必然结果。
3、 元素周期律
同周期元素,电子层数相同。从左至右,核电荷数逐渐 ,原子半径逐渐 ,失电子的能力逐渐 ,得电子的能力逐渐 ;元素的金属性逐渐 ,非金属性逐渐 。(稀有气体元素除外)
同主族元素,最外层电子数相同。从上到下,核电荷数逐渐 ,电子层数逐渐 ,原子半径逐渐 ,失电子的能力逐渐 ,得电子的能力逐渐 ;元素的金属性逐渐 ,非金属性逐渐 。
增多
减小
减弱
增强
减弱
增强
增多
增多
增大
增强
减弱
增强
减弱
项目 同周期(左→右) 同主族(上→下)
原 子结构 核电荷数
最外层电子数
电子层数
原子半径
性质 化合价
元素的金属性和非金属性
单质的氧化性还原性
最高价化合物对应水化物的酸碱性
气态氢化物的稳定性
同周期、同主族元素的递变规律
依次增大
逐渐增多
相同
逐渐减小
周期性变化
金属性减弱,
非金属性增强
还原性减弱,
氧化性增强
碱性减弱,酸性增强
逐渐增强
按周期元素数增加
相同
依次递增
逐渐增大
基本相同
非金属性减弱,
金属性增强
氧化性减弱,
还原性增强
酸性减弱,碱性增强
逐渐减弱
1、用元素符号(化学式)回答原子序数11~18的元素的有关问题:
(1)、除稀有气体外,原子半径最大的是 :
(2)、最高价氧化物的水化物碱性最强的是 ;最高价氧化物的水化物呈两性的是 ;最高价氧化物的水化物酸性最强的是 ;
(3)、能形成气态氢化物且最稳定的是 。
Na
NaOH
HClO4
Al(OH)3
HCl
【知以致用】
5.下列叙述中, 错误的是 ( )
A.原子半径:Cl>S>O
B.还原性:Na>Mg>Al
C.稳定性:HF>HCl>HBr
D.酸性:HClO4>H2SO4>H3PO4
A
6、下列事实能说明金属性Na>Mg的是 ( )
A、Na最外层有一个电子,Mg最外层有2个电子;
B、Na能与冷水反应,而Mg不能;
C、碱性:NaOH >Mg(OH)2
D、 Na不能从MgCl2的溶液中把Mg置换出来
BC
7、已知:
a.硫酸比次氯酸稳定;
b.高氯酸是比硫酸更强的酸;
c.S2-比Cl-易被氧化;
d.HCl比H2S稳定;
e.铜与盐酸不反应,与浓硫酸能反应。
可说明氯比硫非金属性强的是 ( )
全部 B. bcd C. abd D. 除a以外
B
8、同周期X、Y、Z三种元素,已知最高价氧化物对应的水化物的酸性是 HXO4 > H2YO4 > H3ZO4,则下列说法判断错误的是 ( )
A. 原子半径:X > Y > Z
B. 气态氢化物稳定性:HX > H2Y > ZH3
C. 元素的非金属性:X > Y > Z
D. 单质的氧化性: X > Y > Z
A
原子序数= 核电荷数
周期序数= 电子层数
主族序数=最外层电子数
同位素-化学性质相同
相似性
递变性(从上至下,金属性增强,非金属性减弱)
同周期
同主族
递变性(从左到右,金属性减弱,非金属性增强)
电子层数
最外层电子数
金属性、非金属性强弱
最高正价数=(主族)最外层电子数
=主族序数
最低负价数=最外层电子数- 8
原子结构
表中位置
元素性质
1、F 没有正价,O 通常不显示正价;
2、金属元素只有正化合价而无负价。
元素“位(位置)—构(结构)—性(性质)” 之间的关系
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
非金属区
金属区
零
族
元
素
最强
最强
1. 学习和研究化学的规律和工具
2. 研究发现新物质
3. 论证了量变引起质变的规律性
三. 元素周期律和元素周期表的应用
(3) 寻找半导体材料.
(1) 预言新元素
(2) 研究新农药
金属和非金属的交界处
预测它们的结构与性质
非金属右上方处
过渡元素
(4) 寻找催化剂、耐高温耐腐蚀材料.
1. 在周期表中金属和非金属的分界线附近能找到 ( )
A.制农药的元素 B.制催化剂的元素
C.做半导体的元素 D.制耐高温合金材料的元素
C
2.下列关于元素周期律和元素周期表的论述中正确的是
A.同一主族的元素从上到下单质熔点逐渐升高
B.元素周期表是元素周期律的具体表现形式
C.同一周期从左到右,元素原子半径逐渐增大
D.非金属元素的最高正化合价等于它的负化合价的绝对值
B
5.某元素的气态氢化物化学式为H2R,此元素最高价氧化物对应水化物的化学式可能为 ( )
A.H2RO3 B.H2RO4 C.HRO3 D.H3RO4
B
6、已知1—18号元素的离子:aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是 ( )
A.原子半径 A>B>D>C
B.原子序数 d>c>b>a
C.离子半径 C3- > D- >B+ >A2+
D.单质的还原性 A>B>D>C
C
【16年全国I卷】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01 mol·L–1 r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是 ( )
A.原子半径的大小W
C.Y的氢化物常温常压下为液态
D.X的最高价氧化物的水化物为强酸
C
1.【2016届怀化一模】元素X、Y、Z原子序数之和为36,X、Y在同一周期,X+与Z2-具有相同的核外电子层结构.下列推测不正确的是 ( )
A.同周期元素中X的金属性最强
B.原子半径X>Y,离子半径X+>Z2-
C.同族元素中Z的氢化物稳定性最高
D.同周期元素中Y的最高价含氧酸的酸性最强
考点:原子结构和元素周期律的关系
B
Na Cl O
2.【2016届苏州一模】短周期主族元素X、Y、Z、W原子序数依次增大,X元素的单质可在自然界形成最硬的矿石,Y原子最外层有6个电子,Z元素的氧化物可做高温耐火材料且其最高价氧化物的水化物是难溶于水的碱性物质,W与X同主族。下列叙述正确的是 ( )
A.原子最外层电子数由少到多的顺序:X=W<Y<Z
B.原子半径由大到小的顺序:r(W)>r(X)>r(Y)>r(Z)
C.元素非金属性由强到弱的顺序:X、Y、W
D.元素的简单气态氢化物的稳定性由强到弱的顺序:Y、X、W
考点:考查结构、性质、位置关系应用
D
C O Mg
Si
H的位置:第IA族 PK 第VIIA族
有人认为在元素周期表中,位于IA族的氢元素,也可以放在VIIA族,能支持这种观点的是下列物质中的___
A、HF B、H3O+ C、NaH D、H2O2
C
质疑:现有元素周期表不完善的地方
2、对角线规则:
Li
Na
Be
Mg
B
Al
C
Si
质疑:现有元素周期表不完善的地方
(1)单质跟水(或酸)反应置换出氢的难易;
(2)最高价氧化物的水化物—氢氧化物的碱性强弱;
判断元素金属性强弱(即元素原子的失电子的难易)的方法:
(3)金属单质间的置换反应;
复习
判断元素非金属性强弱(即元素原子的得电子的难易)的方法
(2)最高价氧化物的水化物——含氧酸的酸性强弱
(1)单质与氢气生成气态氢化物的难易程度以及氢化物的稳定性
(3)非金属单质间的置换反应
知识点四:周期表中金属性和非金属性递变规律
原子序数 11 12 13 14 15 16 17 18
元素符号 Na Mg Al Si P S Cl Ar
单质和水(或酸)反应情况 冷水剧烈 热水较快 盐酸剧烈 盐酸较快
高温
磷蒸气与H2能反应
须加热
光照或点燃爆炸化合
NaOH
强碱
Mg(OH)2
中强碱
Al(OH)3
两性氢
氧化物
H4SiO4
弱酸
H3PO4
中强酸
H2SO4
强酸
HClO4
最强酸
稀有气体元素
非金属单质与氢气反应
最高价氧化物对应水化物的酸碱性
金属性和非金属性递变
金属性逐渐减弱,非金属性逐渐增强
金属性逐渐减弱,非金属性逐渐增强
1
B
Al
Si
Ge
As
Sb
Te
2
3
4
5
6
7
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0
Po
At
非金属性逐渐增强
金属性逐渐增强
金属性逐渐增强
非金属性逐渐增强
BC
1、(双选)下列事实能说明金属性Na>Mg的是:
A、Na最外层有一个电子,Mg最外层有2个电子;
B、Na能与冷水反应,而Mg不能;
C、碱性NaOH >Mg(OH)2
D、 Na不能从MgCl2的溶液中把Mg置换出来
随堂练习
2、下列事实能说明非金属性Cl >S的是(双选):
A、Cl2比S易与H2化合
B、HCl比H2S稳定
C、酸性HCl >H2S
D、Cl的最高正价为+7,S的最高正价为+6
AB
3、已知1-18号元素的离子 aW3+、bX+、cY2-、dZ- 都具有相同的电子层结构, 下列关系正确的是
A.质子数c>b
B.离子的还原性Y2->Z-
C.氢化物的稳定性H2Y>HZ
D.原子半径X
4、已知同周期X、Y、Z三种元素的最高价氧化物对应水化物酸性由强到弱的顺序为HXO4>H2YO4>H3ZO4,则下列判断中正确的是( )
A.单质的氧化性按X、Y、Z的顺序增强
B.阴离子的还原性按X、Y、Z的顺序减弱
C.气态氢化物的稳定性按X、Y、Z的顺序增强
D.元素非金属性按X、Y、Z的顺序减弱
D
在周期表中一定的区域内寻找特定性质的物质
寻找催化剂、耐高温、耐腐蚀的合金材料
寻找半导体材料
寻找用于制取农药的元素
周期表中特殊位置的元素(短周期)
(1)族序数等于周期数的元素:
H、Be、Al;
(2)族序数等于周期数3倍的元素:
(3)周期数是族序数2倍的元素:
(4)最外层电子数等于次外层3倍的元素是:
(5)最外层电子数与最内层电子数相等的元素
O
Li
O
Be、Mg
(6)最高正价与最低负价代数和为零的短周期元素:
C Si H
元素性质、存在、用途的特殊性
(1)形成化合物种类最多的元素:
(2)空气中含量最多的元素,或气态氢化物的水溶液呈碱性的元素:
(3)常温下呈液态的非金属单质元素是:
(4)最高价氧化物及其水化物既能与强酸反应,又能与强碱反应的元素是:
(5)元素的气态氢化物和它的最高价氧化物的水化物起化合反应的元素是: ,起氧化还原反应的元素是:
C
N
Br
Al
N
S
(7)所形成气态氢化物最稳定的是
最高价氧化物对应的水化物酸性最强的是
(8)与水反应最激烈的非金属元素是
F
Cl
F
(6)元素的气态氢化物能和它的氧化物在常温下反应生成该元素单质的元素是:
S
“10电子”的微粒小结
分子 离子
一核10电子的
二核10电子的
三核10电子的
四核10电子的
五核10电子的
Ne
N3-、O2-、F-、Na+、Mg2+、Al3+
HF
OH-
H2O
NH2-
NH3
H3O+
CH4
NH4+
根据下列数据推出元素① ② ③
④ ⑤ ⑥ ⑦ ⑧
