氯
图片预览





文档简介
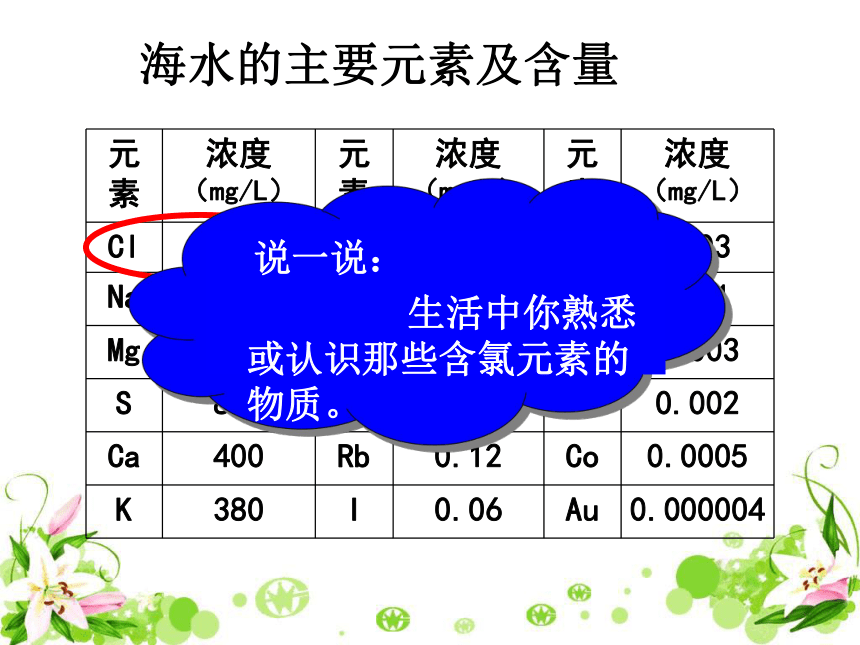
课件19张PPT。富集在海水中的元素—氯占岛28个占岛3个占岛7个 南沙群岛美丽富饶,自然资源极其丰富,是个聚宝盆: 是东南亚最大的渔场,如果合理利用,每年能捕2000万--3000万吨鱼;是世界巨型油气田,有200亿立方米的油气,石油储量350亿吨;各种矿产资源储量巨大……。 海水的主要元素及含量敌敌畏 洁厕灵的主要成分
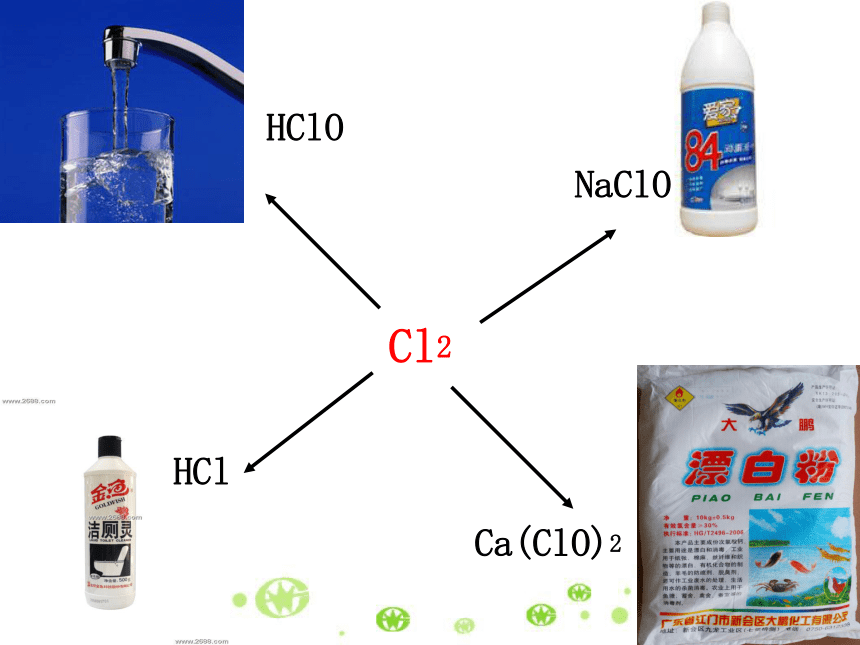
是盐酸(HCl)。制取的原料主要是氯气和氢气。生活中含氯元素的物质 消毒方法:
自来水消毒大都采用向水中通人氯气(Cl2)的方法来消毒,起消毒作用的物质是HClO。生活中含氯元素的物质 本品是以次氯酸钠(NaClO)为主要有效成分的消毒液。制取的原料主要是氯气和氢氧化钠。 本产品主要有效成分是次氯酸钙(Ca(ClO)2),主要用于漂白和消毒。制取的原料主要是氯气和石灰乳。Cl2HClNaClOCa(ClO)2HClOCl2HCl★氯气制取盐酸氢气在氯气里安静的燃烧,发出苍白色火焰,瓶口有白雾。
盐酸Cl2HCl①①H2H2O? 1、氯气呈_____色、新制氯水呈_____色、你得出的结论是_______________________。★研究氯气与水的作用黄绿黄绿氯气可溶于水 2、一干一湿两朵红花,伸入盛满氯气的集气瓶中,观察现象并推测产生该现象的原因是什么?现象是______________________________,原因是________________________________。干燥的红花无现象,湿润的红花褪色氯气与水发生反应而且其产物具有漂白性★研究氯气与水的作用 首先,根据你所学氧化还原知识和质量守恒原理相互讨论确定氯气与水反应除生成的次氯酸外,推测是否还有其他物质?如果没有,说出理由,如果有该物质是什么,说出理由。
然后,用我们提供的试剂设计实验方案并动手实验验证你的推断(注意试剂的用量2~3滴即可)。
提供的实验用品有:点滴板、氯水、酚酞溶液、PH试纸、固体Na2CO3、硝酸酸化的AgNO3、石蕊溶液。Cl2HCl①①H2H2OHClO(次氯酸)②②Cl2 + H2O = HClO + HClCl2HCl①①Cl2作________剂 氧化H2H2OHClO(次氯酸)②②Cl2 + H2O = HClO + HCl氧化剂和还原Cl2作___________剂Ca(ClO)2NaClO③④NaOHCa(OH)2③④Cl2+2NaOH=NaCl+NaClO+H2O2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2OCl2作___________剂Cl2作___________剂氧化剂和还原氧化剂和还原⑤FeFeCl3⑤3Cl2+2Fe = 2FeCl3点燃 试一试:
在氯气与水反应原理的基础上,写出由氯气制取NaClO、Ca(ClO)2的反应方程式。
4、归纳氯气的物理性质(Cl的相对原子质量为35.5)
颜色 ________ 状态 ________
密度比空气 ___ 气味 ________
溶解性 ________ 熔沸点 ________
毒性 ________ 黄绿色大刺激性气味可溶于水低,易液化气体有毒★氯气的物理性质 84消毒液使用说明书
[产品说明]:本品是以次氯酸钠为主要有效成分的消毒液,原液有效氯含量在5%~7%范围内。可杀灭肠道致病菌、化脓性球菌、致病性酵母菌和细菌芽胞,并能灭活病毒。 洁厕灵的主要成分是盐酸。还有微量表面活性剂、香精、缓蚀剂、助剂。 ★含氯化合物的使用及注意事项 讨论:当氯气泄漏时,我们如何减少氯气对自己、他人及环境的危害?Cl2HCl①①Cl2作________剂 氧化H2H2OHClO②②Cl2 + H2O = HClO + HCl氧化剂和还原Cl2作___________剂Ca(ClO)2NaClO③④NaOHCa(OH)2③④Cl2+2NaOH=NaCl+NaClO+H2O2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2OCl2作___________剂Cl2作___________剂氧化剂和还原氧化剂和还原⑤FeFeCl3⑤3Cl2+2Fe = 2FeCl3点燃 思考:通过本节课学习,我们从哪些方面研究了非金属单质Cl2的性质,结合你对O2的认识,你能否归纳出研究非金属单质的方法。★研究非金属单质的方法 非金属单质
O2
Cl2
等 从物质类别研究金属非金属水碱 从氧化还原角度分析
是盐酸(HCl)。制取的原料主要是氯气和氢气。生活中含氯元素的物质 消毒方法:
自来水消毒大都采用向水中通人氯气(Cl2)的方法来消毒,起消毒作用的物质是HClO。生活中含氯元素的物质 本品是以次氯酸钠(NaClO)为主要有效成分的消毒液。制取的原料主要是氯气和氢氧化钠。 本产品主要有效成分是次氯酸钙(Ca(ClO)2),主要用于漂白和消毒。制取的原料主要是氯气和石灰乳。Cl2HClNaClOCa(ClO)2HClOCl2HCl★氯气制取盐酸氢气在氯气里安静的燃烧,发出苍白色火焰,瓶口有白雾。
盐酸Cl2HCl①①H2H2O? 1、氯气呈_____色、新制氯水呈_____色、你得出的结论是_______________________。★研究氯气与水的作用黄绿黄绿氯气可溶于水 2、一干一湿两朵红花,伸入盛满氯气的集气瓶中,观察现象并推测产生该现象的原因是什么?现象是______________________________,原因是________________________________。干燥的红花无现象,湿润的红花褪色氯气与水发生反应而且其产物具有漂白性★研究氯气与水的作用 首先,根据你所学氧化还原知识和质量守恒原理相互讨论确定氯气与水反应除生成的次氯酸外,推测是否还有其他物质?如果没有,说出理由,如果有该物质是什么,说出理由。
然后,用我们提供的试剂设计实验方案并动手实验验证你的推断(注意试剂的用量2~3滴即可)。
提供的实验用品有:点滴板、氯水、酚酞溶液、PH试纸、固体Na2CO3、硝酸酸化的AgNO3、石蕊溶液。Cl2HCl①①H2H2OHClO(次氯酸)②②Cl2 + H2O = HClO + HClCl2HCl①①Cl2作________剂 氧化H2H2OHClO(次氯酸)②②Cl2 + H2O = HClO + HCl氧化剂和还原Cl2作___________剂Ca(ClO)2NaClO③④NaOHCa(OH)2③④Cl2+2NaOH=NaCl+NaClO+H2O2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2OCl2作___________剂Cl2作___________剂氧化剂和还原氧化剂和还原⑤FeFeCl3⑤3Cl2+2Fe = 2FeCl3点燃 试一试:
在氯气与水反应原理的基础上,写出由氯气制取NaClO、Ca(ClO)2的反应方程式。
4、归纳氯气的物理性质(Cl的相对原子质量为35.5)
颜色 ________ 状态 ________
密度比空气 ___ 气味 ________
溶解性 ________ 熔沸点 ________
毒性 ________ 黄绿色大刺激性气味可溶于水低,易液化气体有毒★氯气的物理性质 84消毒液使用说明书
[产品说明]:本品是以次氯酸钠为主要有效成分的消毒液,原液有效氯含量在5%~7%范围内。可杀灭肠道致病菌、化脓性球菌、致病性酵母菌和细菌芽胞,并能灭活病毒。 洁厕灵的主要成分是盐酸。还有微量表面活性剂、香精、缓蚀剂、助剂。 ★含氯化合物的使用及注意事项 讨论:当氯气泄漏时,我们如何减少氯气对自己、他人及环境的危害?Cl2HCl①①Cl2作________剂 氧化H2H2OHClO②②Cl2 + H2O = HClO + HCl氧化剂和还原Cl2作___________剂Ca(ClO)2NaClO③④NaOHCa(OH)2③④Cl2+2NaOH=NaCl+NaClO+H2O2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2OCl2作___________剂Cl2作___________剂氧化剂和还原氧化剂和还原⑤FeFeCl3⑤3Cl2+2Fe = 2FeCl3点燃 思考:通过本节课学习,我们从哪些方面研究了非金属单质Cl2的性质,结合你对O2的认识,你能否归纳出研究非金属单质的方法。★研究非金属单质的方法 非金属单质
O2
Cl2
等 从物质类别研究金属非金属水碱 从氧化还原角度分析
