第二章 第二节 烯烃 炔烃 课件(62张ppt) 2021-2022学年高二化学人教版(2019)选择性必修3
文档属性
| 名称 | 第二章 第二节 烯烃 炔烃 课件(62张ppt) 2021-2022学年高二化学人教版(2019)选择性必修3 |  | |
| 格式 | zip | ||
| 文件大小 | 8.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-25 10:49:32 | ||
图片预览








文档简介
(共62张PPT)
第二章 烃
第二节 烯烃 炔烃
【新课引入】
番茄中的番茄红素
鲨鱼油中的角鲨烯
烯烃
烯烃的结构和化学性质?
课时一 烯烃
不饱和烃:分子中有碳碳双键或碳碳叁键的烃
烯烃:分子中含有一个碳碳双键的不饱和链烃为烯烃
含有一个碳碳双键的通式:CnH2n (n≥2)
官能团:碳碳双键
当碳原子数相同时,烯烃与环烷烃互为官能团异构
乙烯是最简单的烯烃。
课堂练习
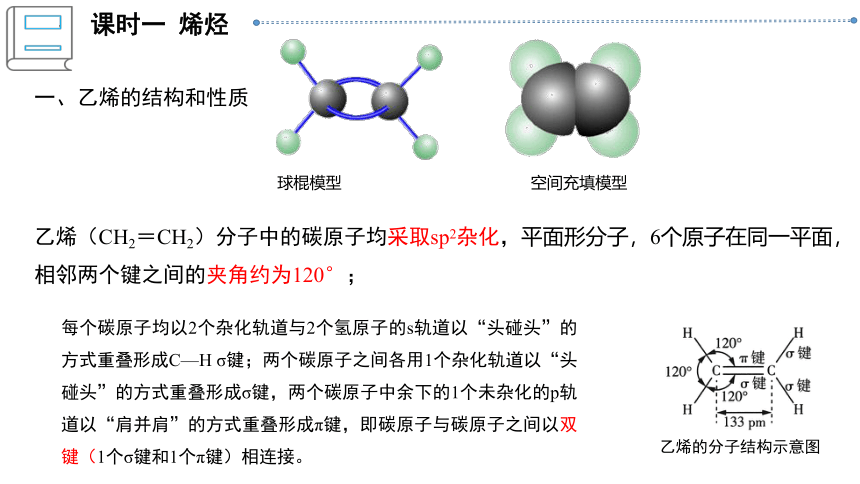
一、乙烯的结构和性质
乙烯(CH2=CH2)分子中的碳原子均采取sp2杂化,平面形分子,6个原子在同一平面,相邻两个键之间的夹角约为120°;
每个碳原子均以2个杂化轨道与2个氢原子的s轨道以“头碰头”的方式重叠形成C—H σ键;两个碳原子之间各用1个杂化轨道以“头碰头”的方式重叠形成σ键,两个碳原子中余下的1个未杂化的p轨道以“肩并肩”的方式重叠形成π键,即碳原子与碳原子之间以双键(1个σ键和1个π键)相连接。
乙烯的分子结构示意图
球棍模型
空间充填模型
课时一 烯烃
一、乙烯的结构和性质
★物理性质:无色、稍有气味的气体、难溶于水、密度比空气略小。
★化学性质:
① 可燃性
② 能被酸性高锰酸钾溶液氧化
③ 在一定条件下能与卤素单质、水、卤化氢、氢气等发生加成反应
④ 在一定条件下能发生加聚反应
课时一 烯烃
二、烯烃的结构和性质
烯烃的物理性质
物理性质
颜色:
无色
溶解性:
均难溶于水
密度:
熔沸点:一般随着分子中碳原子数n的增加而升高;
同碳时,支链越多熔沸点越低
状态:一般随着分子中碳原子数的增加,在常温下的状态
由气态变为液态再到固态
均小于水
递变性与烷烃的相似
课时一 烯烃
二、烯烃的结构和性质
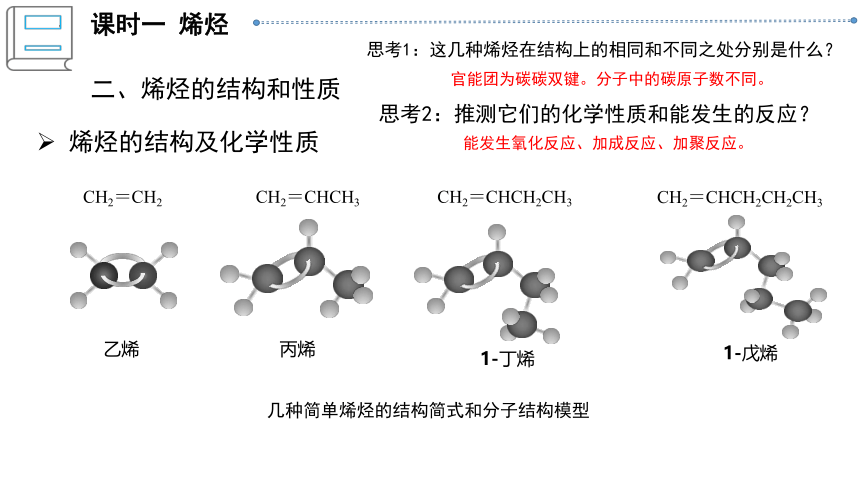
烯烃的结构及化学性质
几种简单烯烃的结构简式和分子结构模型
CH2=CH2
乙烯
CH2=CHCH3
丙烯
CH2=CHCH2CH3
1-丁烯
CH2=CHCH2CH2CH3
1-戊烯
官能团为碳碳双键。分子中的碳原子数不同。
思考1:这几种烯烃在结构上的相同和不同之处分别是什么?
能发生氧化反应、加成反应、加聚反应。
思考2:推测它们的化学性质和能发生的反应?
课时一 烯烃
二、烯烃的结构和性质
烯烃的结构及化学性质
①可燃性
O2
nCO2+nH2O
CnH2n+
②使酸性KMnO4溶液褪色
烯烃的氧化反应
课时一 烯烃
烯烃的结构及化学性质
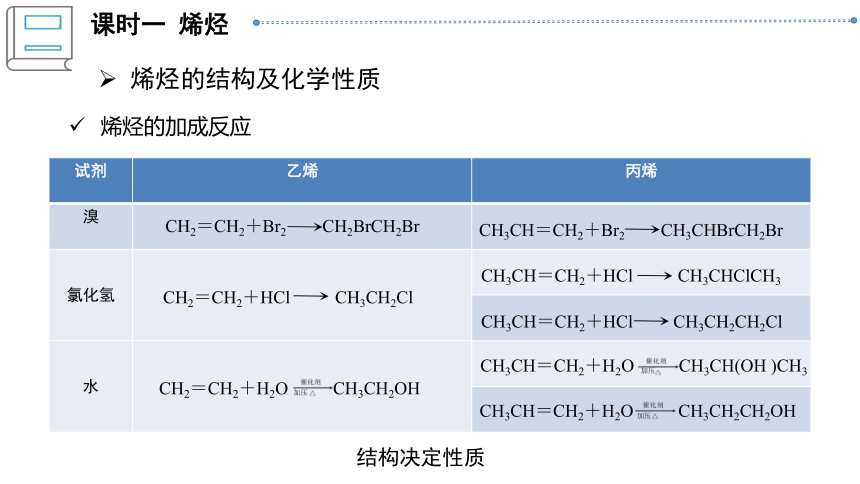
烯烃的加成反应
试剂 乙烯 丙烯
溴
氯化氢
水
CH3CH=CH2+Br2 CH3CHBrCH2Br
CH3CH=CH2+HCl CH3CHClCH3
CH3CH=CH2+HCl CH3CH2CH2Cl
CH3CH=CH2+H2O CH3CH(OH )CH3
CH3CH=CH2+H2O CH3CH2CH2OH
CH2=CH2+Br2 CH2BrCH2Br
CH2=CH2+HCl CH3CH2Cl
CH2=CH2+H2O CH3CH2OH
加压
加压
加压
结构决定性质
课时一 烯烃
烯烃的结构及化学性质
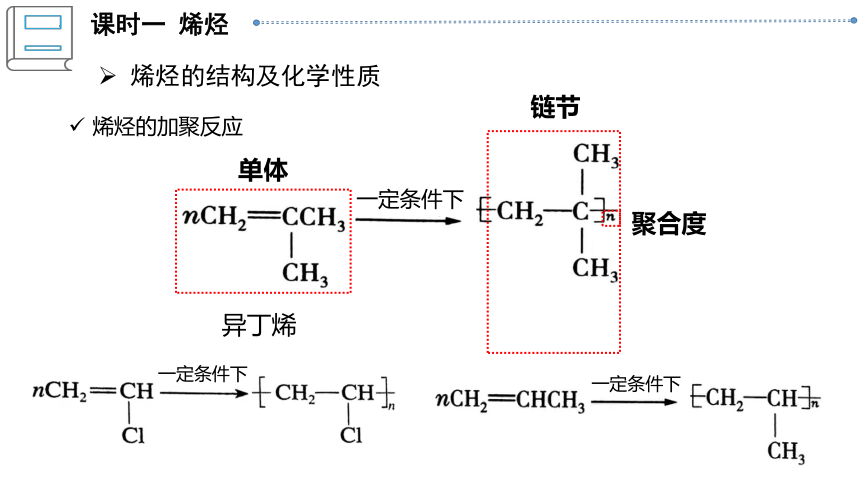
烯烃的加聚反应
一定条件下
异丁烯
单体
链节
聚合度
一定条件下
一定条件下
课时一 烯烃
课堂练习
1.乙烷、乙烯共同具有的性质是( )
A.都难溶于水,且密度比水小
B.能使溴水和酸性KMnO4溶液褪色
C.分子中各原子都处在同一平面内
D.都能发生加聚反应生成高分子
解析:乙烷分子中各原子不处于同一平面内;乙烷不能发生加聚反应,不能使溴水和酸性KMnO4溶液褪色。
√
课堂练习
2.下列关于烷烃与烯烃的性质及反应类型的对比中正确的是( )
A.烷烃中碳原子只含有饱和键,烯烃中碳原子只含有不饱和键
B.烷烃不能发生加成反应,烯烃不能发生取代反应
C.链状烷烃的通式一定是CnH2n+2,而烯烃的通式一定是CnH2n
D.烷烃与烯烃相比,能发生加成反应的一定是烯烃
解析:丙烯(CH2===CHCH3)中碳原子也含饱和键,A错;烯烃烷基中的氢原子也能发生取代反应,B错;只有单烯烃的通式才是CnH2n,C错。
√
课堂练习
不对称烯烃(如丙烯)与不对称加成试剂(如HBr)反应时,可能得到多种加成产物。事实表明,H 加成到含 H 较多的双键碳的产物更多,这个规律称为马氏规则。
主
次
CH3-CH=CH2 + HBr
CH3-CH-CH3
∣
Br
马氏加成,90%
催化剂
△
注:当存在过氧化物时,加成反应会违反马氏规则,以反马氏规则产物为主。
拓展延伸
课时一 烯烃
三、烯烃的立体异构
分类
定义:由于碳碳双键不能旋转而导致分子中原子或原子团在空间排列方式的不同所产生的异构现象。
◎顺式结构:两个相同的原子或原子团排列在双键的同一侧。
◎反式结构:两个相同的原子或原子团排列在双键的两侧。
性质:化学性质基本相同,物理性质有一定的差异。
顺-2-丁烯
反-2-丁烯
课时一 烯烃
课堂练习
1.CH2===CHCl、CHCl===CHCl二者是否都具有顺反异构体?
提示:否,CH2===CHCl没有顺反异构体,CHCl===CHCl有顺反异构体。
课堂练习
√
课堂练习
√
知识链接
链接教材P34【资料卡片】二烯烃
分子中含有2个碳碳双键的烯烃叫二烯烃,如1,3-丁二烯(CH2=CH—CH=CH2)。
二烯烃的通式为CnH2n-2(n≥3),与相同碳原子数的炔烃互为同分异构体。
累积二烯烃(C—C==C==C—C)
孤立二烯烃(C==C—C—C==C)
共轭二烯烃(C==C—C==C)
两个双键连在同一个碳
原子上的二烯烃
两个双键被两个或两个
以上单键隔开的二烯烃
两个双键被一个单键隔
开的二烯烃
二烯烃
课时一 烯烃
二烯烃中最重要的是共轭二烯烃。
(1)共轭二烯烃除具有烯烃的化学性质外,在发生加成反应时,由于反应条件的不同,可分别发生1,2-加成和1,4-加成,如1,3-丁二烯与Br2按物质的量比1∶1混合,可发生下列反应:
①1,2-加成
CH2=CH—CH=CH2+Br2—→CH2Br—CHBr—CH=CH2
知识链接
链接教材P34【资料卡片】二烯烃
课时一 烯烃
②1,4-加成
CH2=CH—CH=CH2+Br2—→CH2Br—CH=CH—CH2Br
1,3-丁二烯与Br2按物质的量比1∶2进行加成时只有一种情况:
CH2=CH—CH=CH2+2Br2—→CH2BrCHBrCHBrCH2Br。
(2)共轭二烯烃的加成可以作为成环反应,常出现在有机合成中,如
知识链接
链接教材P34【资料卡片】二烯烃
课时一 烯烃
四、烯烃的系统命名
选主链
写名称
将支链作为取代基,写在“某烯”的前面,并用阿拉伯数字标明碳碳双键的位置。
定编号
从距离碳碳双键最近的一端对主链上的碳原子进行编号。
将含有碳碳双键的最长碳链作为主链,称为“某烯”。
课时一 烯烃
四、烯烃的系统命名
CH3—C C —CH2—CH3
CH3 CH3
2,3—二甲基—2—戊烯
2,3—二甲基戊烷
H
H
取代基位置
取代基名称
双键位置
主链名称
取代基数目
CH2 C—CH— CH2—CH3
CH3CH3
2,3—二甲基—1—戊烯
课时一 烯烃
课堂练习
课堂练习
课堂练习
2.戊烯(C5H10)是无色、易挥发的可燃性液体,难溶于水,易溶于乙醇,可用于有机合成和脱氢制异戊二烯,也可作高辛烷汽油的添加剂。你能写出分子式为C5H10且属于烯烃的同分异构体(不包括顺反异构)吗?并用系统命名法命名。
课堂练习
课堂练习
√
课堂练习
√
第二章 烃
第二节 烯烃 炔烃
【新课引入】
你知道用于焊接和切割金属的氧炔焰吗?知道氧炔焰用的燃料是什么吗?
一、炔烃的结构
课时二 炔烃
官能团:碳碳三键(—C≡C—)
定义
分子里含有-C≡C-的不饱和链烃叫炔烃
通式:含一个碳碳三键的炔烃通式为CnH2n-2(n≥2)。每形成一个碳碳三键,就减少4个氢
最简单的炔烃——乙炔
二、乙炔
课时二 炔烃
分子式:C2H2 结构式:H—C≡C—H 结构简式:CH≡CH
分子结构特点:
线型分子,4个原子共线,-C≡C-键跟C-H键间的夹角是180°;
有一个碳碳三键,其中一个σ键结合较牢固,另两个π键结合不牢固,易断裂。
乙炔的结构(俗称电石气)
σ键
π键
二、乙炔
课时二 炔烃
乙炔的物理性质
乙炔是无色、无臭的气体,微溶于水,易溶于有机溶剂。
注意:纯净的乙炔是无色无味的气体。但在一般情况下,用电石制取的乙炔常带有一种令人极不愉悦的恶臭。这是由于在电石中含有少量硫化钙、砷化钙、磷化钙等杂质,当这些杂质与水作用时,生成了带有特殊臭味的硫化氢、砷化氢和磷化氢等气体。
课时二 炔烃
C-C C=C C≡C
347.7 kJ/mol
615 kJ/mol
812 kJ/mol
通过以上分析,请预测炔烃的化学性质是否活泼。
C≡C的键能和键长并不是C-C的三倍,也不是C=C和C—C之和。
分析以下数据,你有什么发现呢?
活泼
三键中有二个键不稳定,容易断裂,有一个键较稳定。
二、乙炔
课时二 炔烃
乙炔的化学性质
根据乙炔的分子结构,乙炔应该具有怎样的化学性质?
结构式:H—C≡C—H
氧化反应
加成反应
加聚反应
结合乙炔的实验室制备,设计实验验证乙炔的化学性质。
课时二 炔烃
CaC2+2H2O C2H2↑+Ca(OH)2
反应原理:
原料:电石(CaC2)与饱和食盐水
装置特点:
固体 +液体 气体
杂质气体及除杂试剂为H2S,CuSO4溶液。
收集方法:排水法。
【资料卡】阅读教材P35,总结实验室制备乙炔的实验原理,实验试剂,并选择合适的发生装置。
饱和食盐水
课时二 炔烃
乙炔的实验室制法
检验是否稳定
除去杂质
检验是否饱和
检验能否燃烧
电石(主要是CaC2,还含有 CaS、Ca3P2等)
课时二 炔烃
实验记录
实验内容 实验现象
(1)将饱和氯化钠溶液滴入盛有电石的烧瓶中
(2)将纯净的乙炔通入盛有酸性高锰酸钾溶液的试管中
(3)将纯净的乙炔通入盛有溴的四氯化碳溶液的试管中
(4)点燃纯净的乙炔
反应剧烈,放热,有气体产生
酸性高锰酸钾溶液褪色
溴的四氯化碳溶液褪色
产生明亮的火焰,有黑烟
课时二 炔烃
(1)乙炔通入酸性高锰酸钾溶液时的实验现象,说明乙炔具有怎样的化学性质?
(2)乙炔通入溴的四氯化碳溶液时的实验现象,说明乙炔具有怎样的化学性质?这与乙炔的哪些结构特点有关?
乙炔使溴的四氯化碳溶液褪色,说明乙炔能发生加成反应,这与乙炔碳碳三键中两个π键易断裂有关。
乙炔使酸性高锰酸钾溶液褪色,说明乙炔具有还原性,易发生氧化反应。
(3)乙炔在空气中燃烧的实验现象说明乙炔在组成上有哪些特点?
乙炔在空气中燃烧,火焰明亮,有黑烟,主要是因为乙炔含碳量高。
乙炔在氧气中燃烧时火焰温度可达3 000 ℃以上,故常用它来焊接或切割金属。
【结果与讨论】
课时二 炔烃
1. 制取乙炔时能否使用启普发生器?
①用饱和食盐水 ②控制饱和食盐水的滴加速度
3. 乙炔性质实验之前为什么要除去H2S、PH3,是如何除去呢?
放出的大量热量,操作不当会使启普发生器炸裂。
2. 电石与水反应非常剧烈,为了获得平稳的乙炔气流,需要采取哪些措施?
有还原性会干扰实验,使用硫酸铜溶液除去
收集一试管乙炔,验纯
[注意事项]
4. 在点燃乙炔之前需要进行的实验操作是什么?
课堂练习
1.乙炔是无臭气体,但电石和水反应生成的气体常有一股难闻的臭鸡蛋味,为什么?
提示:电石和水反应生成的气体中,常含有H2S,它具有臭鸡蛋味。
2.实验室制备乙炔能否用启普发生器?为什么?
提示:不能;原因为①CaC2与H2O反应剧烈,不能随用随停;②反应中放出大量的热,易发生爆炸;③生成的Ca(OH)2 呈糊状易堵塞球形漏斗。
课堂练习
3.(2021·北京丰台区高二检测)关于实验室制取乙炔,下列描述合理的是( )
A.制备的乙炔气体中常含有杂质,通常采用硫酸铜溶液洗气除杂
B.为了加快此反应的反应速率,通常往水中加入少许盐酸
C.将生成的气体直接通入溴水中,溴水褪色则证明产生了乙炔
D.通常采取向上排空气法收集乙炔
√
课时二 炔烃
乙炔的化学性质
氧化反应
可燃性
2C2H2+5O2 4CO2+2H2O
点燃
火焰明亮,并伴有浓烟
乙炔含碳量高
乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,点燃前要验纯!
甲烷
乙烯
乙炔
含碳量不同导致燃烧现象有所不同,可用于三者鉴别
课时二 炔烃
乙炔的化学性质
氧化反应
被氧化剂氧化
使酸性KMnO4溶液褪色
加成反应
乙炔能与溴的四氯化碳溶液(或溴水)、卤素单质、氢气、氢氰酸、氢卤酸、水等在一定条件下发生加成反应。
课时二 炔烃
乙炔的化学性质
加成反应
使溴水(溴的四氯化碳溶液)褪色
炔烃加成分步进行
1, 2—二溴乙烯
1, 1, 2, 2—四溴乙烷
课时二 炔烃
乙炔的化学性质
加成反应
催化加氢
△
CH≡CH+H2 CH2=CH2
△
CH2=CH2+H2 CH3—CH3
乙烯
乙烷
与HX、H2O等的反应
△
CH≡CH+H2O CH3CHO
△
CH≡CH+HCl CH2=CHCl
催化剂
氯乙烯
乙醛
课时二 炔烃
乙炔的化学性质
加成反应
加聚反应
nCH ≡ CH [ CH=CH ]n
催化剂
导电塑料——聚乙炔
(制导电高分子材料)
课时二 炔烃
乙炔的主要用途
(1)乙炔是一种重要的基本有机原料,可以用来制备氯乙烯、聚氯乙烯和乙醛等。
(2)乙炔在氧气中燃烧时产生的氧炔焰可用来切割或焊接金属。
课堂练习
1.下列有关乙炔性质的叙述中,既不同于乙烯又不同于乙烷的是( )
A.能燃烧生成二氧化碳和水
B.能与溴水发生加成反应
C.能与酸性KMnO4溶液发生氧化反应
D.能与HCl反应生成氯乙烯
解析:乙烷、乙烯、乙炔都能燃烧生成CO2和H2O;乙炔、乙烯都能与溴水发生加成反应;乙烯、乙炔都能与酸性KMnO4溶液发生氧化反应;只有乙炔可与HCl反应生成氯乙烯。
√
课堂练习
三、炔烃的物理性质
课时二 炔烃
颜色:无色
溶解性:难溶于水
密度:均小于水
熔沸点:一般随着分子中碳原子数n的增加而升高;同碳时,支链越多熔沸点越低
状态:一般随着分子中碳原子数的增加,在常温下的状态由气态;变为液态,再到固态
课时二 炔烃
四、炔烃的化学性质
氧化反应
可燃性:
与酸性高锰酸钾溶液反应:
将炔烃通入酸性高锰酸钾溶液中,使其褪色
加成反应
与乙炔相似
2CnH2n-2+(3n-1)O2 2nCO2+(2n-2) H2O
点燃
R—C≡C—R′+Br2 CRBr=CR′Br
加聚反应
一定条件下
nR—C≡C—R′ [ C=C ]n
R
R ′
课时二 炔烃
五、炔烃的系统命名法
与烯烃的命名方法相同,称为“某炔”。
CH≡C—CH(CH3)—CH(CH3)2
课堂练习
●用系统命名法命名以下物质
CH≡ C_ CH3
1_丙炔
CH≡CCH2CH3
1-丁炔
CH3C≡CCH3
2-丁炔
CH ≡C-CH- CH3
CH3
3-甲基-1-丁炔
课时二 炔烃
【思考与讨论】
1. 请写出戊炔所有属于炔烃的同分异构体的结构简式。
2. 请写出1-丁炔与足量氢气完全反应的化学方程式,并分析该反应中化学键和官能团的变化。
CH≡CCH2CH2CH3 CH3CH≡CCH2CH3 CH≡CCH(CH3)CH3
CH≡CCH2CH3 + 2H2→CH3CH2CH2CH3 该反应为加成反应。反应中碳原子之间形成的π键断裂,形成4个C—H σ键。
课时二 炔烃
【思考与讨论】
3. 某炔烃通过催化加氢反应得到2-甲基戊烷,请由此推断该炔经可能的结构简式,并命名。
课堂练习
1.丙炔分子中σ键与π键个数之比是多少?
提示:3∶1
2.某炔烃通过催化加氢反应得到2 -甲基戊烷,请推断该炔烃可能的结
构。
提示:CH≡C—CH2—CH(CH3)—CH3、
CH3—C≡C—CH(CH3)—CH3。
课堂练习
3.你能写出戊炔所有属于炔烃的同分异构体的结构简式吗?
提示:CH≡C—CH2—CH2—CH3、
CH3—C≡C—CH2—CH3、CH≡C—CH(CH3)—CH3。
课堂练习
4.下列关于炔烃的叙述正确的是( )
A.1 mol丙炔最多能与2 mol Cl2发生加成反应
B.炔烃的物理性质与烷烃的完全相同
C.乙炔与分子式为C4H6的烃一定互为同系物
D.乙炔分子中只含有极性键
√
课堂练习
5.某烃与溴的四氯化碳溶液反应生成 CHBr2CBr2CH2CH3,则下列物质与该烃属于不同类别的同分异构体的是( )
A.CH≡CCH2CH3 B.CH3C≡CH
C.CH3CH2CH===CH2 D.CH2===CH—CH===CH2
解析:由生成物的结构简式可知,该烃的结构简式为CH≡CCH2CH3,则与该烃属于不同类别的同分异构体的物质不再是炔烃,可能是二烯
烃,故选D。
√
第二章 烃
第二节 烯烃 炔烃
【新课引入】
番茄中的番茄红素
鲨鱼油中的角鲨烯
烯烃
烯烃的结构和化学性质?
课时一 烯烃
不饱和烃:分子中有碳碳双键或碳碳叁键的烃
烯烃:分子中含有一个碳碳双键的不饱和链烃为烯烃
含有一个碳碳双键的通式:CnH2n (n≥2)
官能团:碳碳双键
当碳原子数相同时,烯烃与环烷烃互为官能团异构
乙烯是最简单的烯烃。
课堂练习
一、乙烯的结构和性质
乙烯(CH2=CH2)分子中的碳原子均采取sp2杂化,平面形分子,6个原子在同一平面,相邻两个键之间的夹角约为120°;
每个碳原子均以2个杂化轨道与2个氢原子的s轨道以“头碰头”的方式重叠形成C—H σ键;两个碳原子之间各用1个杂化轨道以“头碰头”的方式重叠形成σ键,两个碳原子中余下的1个未杂化的p轨道以“肩并肩”的方式重叠形成π键,即碳原子与碳原子之间以双键(1个σ键和1个π键)相连接。
乙烯的分子结构示意图
球棍模型
空间充填模型
课时一 烯烃
一、乙烯的结构和性质
★物理性质:无色、稍有气味的气体、难溶于水、密度比空气略小。
★化学性质:
① 可燃性
② 能被酸性高锰酸钾溶液氧化
③ 在一定条件下能与卤素单质、水、卤化氢、氢气等发生加成反应
④ 在一定条件下能发生加聚反应
课时一 烯烃
二、烯烃的结构和性质
烯烃的物理性质
物理性质
颜色:
无色
溶解性:
均难溶于水
密度:
熔沸点:一般随着分子中碳原子数n的增加而升高;
同碳时,支链越多熔沸点越低
状态:一般随着分子中碳原子数的增加,在常温下的状态
由气态变为液态再到固态
均小于水
递变性与烷烃的相似
课时一 烯烃
二、烯烃的结构和性质
烯烃的结构及化学性质
几种简单烯烃的结构简式和分子结构模型
CH2=CH2
乙烯
CH2=CHCH3
丙烯
CH2=CHCH2CH3
1-丁烯
CH2=CHCH2CH2CH3
1-戊烯
官能团为碳碳双键。分子中的碳原子数不同。
思考1:这几种烯烃在结构上的相同和不同之处分别是什么?
能发生氧化反应、加成反应、加聚反应。
思考2:推测它们的化学性质和能发生的反应?
课时一 烯烃
二、烯烃的结构和性质
烯烃的结构及化学性质
①可燃性
O2
nCO2+nH2O
CnH2n+
②使酸性KMnO4溶液褪色
烯烃的氧化反应
课时一 烯烃
烯烃的结构及化学性质
烯烃的加成反应
试剂 乙烯 丙烯
溴
氯化氢
水
CH3CH=CH2+Br2 CH3CHBrCH2Br
CH3CH=CH2+HCl CH3CHClCH3
CH3CH=CH2+HCl CH3CH2CH2Cl
CH3CH=CH2+H2O CH3CH(OH )CH3
CH3CH=CH2+H2O CH3CH2CH2OH
CH2=CH2+Br2 CH2BrCH2Br
CH2=CH2+HCl CH3CH2Cl
CH2=CH2+H2O CH3CH2OH
加压
加压
加压
结构决定性质
课时一 烯烃
烯烃的结构及化学性质
烯烃的加聚反应
一定条件下
异丁烯
单体
链节
聚合度
一定条件下
一定条件下
课时一 烯烃
课堂练习
1.乙烷、乙烯共同具有的性质是( )
A.都难溶于水,且密度比水小
B.能使溴水和酸性KMnO4溶液褪色
C.分子中各原子都处在同一平面内
D.都能发生加聚反应生成高分子
解析:乙烷分子中各原子不处于同一平面内;乙烷不能发生加聚反应,不能使溴水和酸性KMnO4溶液褪色。
√
课堂练习
2.下列关于烷烃与烯烃的性质及反应类型的对比中正确的是( )
A.烷烃中碳原子只含有饱和键,烯烃中碳原子只含有不饱和键
B.烷烃不能发生加成反应,烯烃不能发生取代反应
C.链状烷烃的通式一定是CnH2n+2,而烯烃的通式一定是CnH2n
D.烷烃与烯烃相比,能发生加成反应的一定是烯烃
解析:丙烯(CH2===CHCH3)中碳原子也含饱和键,A错;烯烃烷基中的氢原子也能发生取代反应,B错;只有单烯烃的通式才是CnH2n,C错。
√
课堂练习
不对称烯烃(如丙烯)与不对称加成试剂(如HBr)反应时,可能得到多种加成产物。事实表明,H 加成到含 H 较多的双键碳的产物更多,这个规律称为马氏规则。
主
次
CH3-CH=CH2 + HBr
CH3-CH-CH3
∣
Br
马氏加成,90%
催化剂
△
注:当存在过氧化物时,加成反应会违反马氏规则,以反马氏规则产物为主。
拓展延伸
课时一 烯烃
三、烯烃的立体异构
分类
定义:由于碳碳双键不能旋转而导致分子中原子或原子团在空间排列方式的不同所产生的异构现象。
◎顺式结构:两个相同的原子或原子团排列在双键的同一侧。
◎反式结构:两个相同的原子或原子团排列在双键的两侧。
性质:化学性质基本相同,物理性质有一定的差异。
顺-2-丁烯
反-2-丁烯
课时一 烯烃
课堂练习
1.CH2===CHCl、CHCl===CHCl二者是否都具有顺反异构体?
提示:否,CH2===CHCl没有顺反异构体,CHCl===CHCl有顺反异构体。
课堂练习
√
课堂练习
√
知识链接
链接教材P34【资料卡片】二烯烃
分子中含有2个碳碳双键的烯烃叫二烯烃,如1,3-丁二烯(CH2=CH—CH=CH2)。
二烯烃的通式为CnH2n-2(n≥3),与相同碳原子数的炔烃互为同分异构体。
累积二烯烃(C—C==C==C—C)
孤立二烯烃(C==C—C—C==C)
共轭二烯烃(C==C—C==C)
两个双键连在同一个碳
原子上的二烯烃
两个双键被两个或两个
以上单键隔开的二烯烃
两个双键被一个单键隔
开的二烯烃
二烯烃
课时一 烯烃
二烯烃中最重要的是共轭二烯烃。
(1)共轭二烯烃除具有烯烃的化学性质外,在发生加成反应时,由于反应条件的不同,可分别发生1,2-加成和1,4-加成,如1,3-丁二烯与Br2按物质的量比1∶1混合,可发生下列反应:
①1,2-加成
CH2=CH—CH=CH2+Br2—→CH2Br—CHBr—CH=CH2
知识链接
链接教材P34【资料卡片】二烯烃
课时一 烯烃
②1,4-加成
CH2=CH—CH=CH2+Br2—→CH2Br—CH=CH—CH2Br
1,3-丁二烯与Br2按物质的量比1∶2进行加成时只有一种情况:
CH2=CH—CH=CH2+2Br2—→CH2BrCHBrCHBrCH2Br。
(2)共轭二烯烃的加成可以作为成环反应,常出现在有机合成中,如
知识链接
链接教材P34【资料卡片】二烯烃
课时一 烯烃
四、烯烃的系统命名
选主链
写名称
将支链作为取代基,写在“某烯”的前面,并用阿拉伯数字标明碳碳双键的位置。
定编号
从距离碳碳双键最近的一端对主链上的碳原子进行编号。
将含有碳碳双键的最长碳链作为主链,称为“某烯”。
课时一 烯烃
四、烯烃的系统命名
CH3—C C —CH2—CH3
CH3 CH3
2,3—二甲基—2—戊烯
2,3—二甲基戊烷
H
H
取代基位置
取代基名称
双键位置
主链名称
取代基数目
CH2 C—CH— CH2—CH3
CH3CH3
2,3—二甲基—1—戊烯
课时一 烯烃
课堂练习
课堂练习
课堂练习
2.戊烯(C5H10)是无色、易挥发的可燃性液体,难溶于水,易溶于乙醇,可用于有机合成和脱氢制异戊二烯,也可作高辛烷汽油的添加剂。你能写出分子式为C5H10且属于烯烃的同分异构体(不包括顺反异构)吗?并用系统命名法命名。
课堂练习
课堂练习
√
课堂练习
√
第二章 烃
第二节 烯烃 炔烃
【新课引入】
你知道用于焊接和切割金属的氧炔焰吗?知道氧炔焰用的燃料是什么吗?
一、炔烃的结构
课时二 炔烃
官能团:碳碳三键(—C≡C—)
定义
分子里含有-C≡C-的不饱和链烃叫炔烃
通式:含一个碳碳三键的炔烃通式为CnH2n-2(n≥2)。每形成一个碳碳三键,就减少4个氢
最简单的炔烃——乙炔
二、乙炔
课时二 炔烃
分子式:C2H2 结构式:H—C≡C—H 结构简式:CH≡CH
分子结构特点:
线型分子,4个原子共线,-C≡C-键跟C-H键间的夹角是180°;
有一个碳碳三键,其中一个σ键结合较牢固,另两个π键结合不牢固,易断裂。
乙炔的结构(俗称电石气)
σ键
π键
二、乙炔
课时二 炔烃
乙炔的物理性质
乙炔是无色、无臭的气体,微溶于水,易溶于有机溶剂。
注意:纯净的乙炔是无色无味的气体。但在一般情况下,用电石制取的乙炔常带有一种令人极不愉悦的恶臭。这是由于在电石中含有少量硫化钙、砷化钙、磷化钙等杂质,当这些杂质与水作用时,生成了带有特殊臭味的硫化氢、砷化氢和磷化氢等气体。
课时二 炔烃
C-C C=C C≡C
347.7 kJ/mol
615 kJ/mol
812 kJ/mol
通过以上分析,请预测炔烃的化学性质是否活泼。
C≡C的键能和键长并不是C-C的三倍,也不是C=C和C—C之和。
分析以下数据,你有什么发现呢?
活泼
三键中有二个键不稳定,容易断裂,有一个键较稳定。
二、乙炔
课时二 炔烃
乙炔的化学性质
根据乙炔的分子结构,乙炔应该具有怎样的化学性质?
结构式:H—C≡C—H
氧化反应
加成反应
加聚反应
结合乙炔的实验室制备,设计实验验证乙炔的化学性质。
课时二 炔烃
CaC2+2H2O C2H2↑+Ca(OH)2
反应原理:
原料:电石(CaC2)与饱和食盐水
装置特点:
固体 +液体 气体
杂质气体及除杂试剂为H2S,CuSO4溶液。
收集方法:排水法。
【资料卡】阅读教材P35,总结实验室制备乙炔的实验原理,实验试剂,并选择合适的发生装置。
饱和食盐水
课时二 炔烃
乙炔的实验室制法
检验是否稳定
除去杂质
检验是否饱和
检验能否燃烧
电石(主要是CaC2,还含有 CaS、Ca3P2等)
课时二 炔烃
实验记录
实验内容 实验现象
(1)将饱和氯化钠溶液滴入盛有电石的烧瓶中
(2)将纯净的乙炔通入盛有酸性高锰酸钾溶液的试管中
(3)将纯净的乙炔通入盛有溴的四氯化碳溶液的试管中
(4)点燃纯净的乙炔
反应剧烈,放热,有气体产生
酸性高锰酸钾溶液褪色
溴的四氯化碳溶液褪色
产生明亮的火焰,有黑烟
课时二 炔烃
(1)乙炔通入酸性高锰酸钾溶液时的实验现象,说明乙炔具有怎样的化学性质?
(2)乙炔通入溴的四氯化碳溶液时的实验现象,说明乙炔具有怎样的化学性质?这与乙炔的哪些结构特点有关?
乙炔使溴的四氯化碳溶液褪色,说明乙炔能发生加成反应,这与乙炔碳碳三键中两个π键易断裂有关。
乙炔使酸性高锰酸钾溶液褪色,说明乙炔具有还原性,易发生氧化反应。
(3)乙炔在空气中燃烧的实验现象说明乙炔在组成上有哪些特点?
乙炔在空气中燃烧,火焰明亮,有黑烟,主要是因为乙炔含碳量高。
乙炔在氧气中燃烧时火焰温度可达3 000 ℃以上,故常用它来焊接或切割金属。
【结果与讨论】
课时二 炔烃
1. 制取乙炔时能否使用启普发生器?
①用饱和食盐水 ②控制饱和食盐水的滴加速度
3. 乙炔性质实验之前为什么要除去H2S、PH3,是如何除去呢?
放出的大量热量,操作不当会使启普发生器炸裂。
2. 电石与水反应非常剧烈,为了获得平稳的乙炔气流,需要采取哪些措施?
有还原性会干扰实验,使用硫酸铜溶液除去
收集一试管乙炔,验纯
[注意事项]
4. 在点燃乙炔之前需要进行的实验操作是什么?
课堂练习
1.乙炔是无臭气体,但电石和水反应生成的气体常有一股难闻的臭鸡蛋味,为什么?
提示:电石和水反应生成的气体中,常含有H2S,它具有臭鸡蛋味。
2.实验室制备乙炔能否用启普发生器?为什么?
提示:不能;原因为①CaC2与H2O反应剧烈,不能随用随停;②反应中放出大量的热,易发生爆炸;③生成的Ca(OH)2 呈糊状易堵塞球形漏斗。
课堂练习
3.(2021·北京丰台区高二检测)关于实验室制取乙炔,下列描述合理的是( )
A.制备的乙炔气体中常含有杂质,通常采用硫酸铜溶液洗气除杂
B.为了加快此反应的反应速率,通常往水中加入少许盐酸
C.将生成的气体直接通入溴水中,溴水褪色则证明产生了乙炔
D.通常采取向上排空气法收集乙炔
√
课时二 炔烃
乙炔的化学性质
氧化反应
可燃性
2C2H2+5O2 4CO2+2H2O
点燃
火焰明亮,并伴有浓烟
乙炔含碳量高
乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,点燃前要验纯!
甲烷
乙烯
乙炔
含碳量不同导致燃烧现象有所不同,可用于三者鉴别
课时二 炔烃
乙炔的化学性质
氧化反应
被氧化剂氧化
使酸性KMnO4溶液褪色
加成反应
乙炔能与溴的四氯化碳溶液(或溴水)、卤素单质、氢气、氢氰酸、氢卤酸、水等在一定条件下发生加成反应。
课时二 炔烃
乙炔的化学性质
加成反应
使溴水(溴的四氯化碳溶液)褪色
炔烃加成分步进行
1, 2—二溴乙烯
1, 1, 2, 2—四溴乙烷
课时二 炔烃
乙炔的化学性质
加成反应
催化加氢
△
CH≡CH+H2 CH2=CH2
△
CH2=CH2+H2 CH3—CH3
乙烯
乙烷
与HX、H2O等的反应
△
CH≡CH+H2O CH3CHO
△
CH≡CH+HCl CH2=CHCl
催化剂
氯乙烯
乙醛
课时二 炔烃
乙炔的化学性质
加成反应
加聚反应
nCH ≡ CH [ CH=CH ]n
催化剂
导电塑料——聚乙炔
(制导电高分子材料)
课时二 炔烃
乙炔的主要用途
(1)乙炔是一种重要的基本有机原料,可以用来制备氯乙烯、聚氯乙烯和乙醛等。
(2)乙炔在氧气中燃烧时产生的氧炔焰可用来切割或焊接金属。
课堂练习
1.下列有关乙炔性质的叙述中,既不同于乙烯又不同于乙烷的是( )
A.能燃烧生成二氧化碳和水
B.能与溴水发生加成反应
C.能与酸性KMnO4溶液发生氧化反应
D.能与HCl反应生成氯乙烯
解析:乙烷、乙烯、乙炔都能燃烧生成CO2和H2O;乙炔、乙烯都能与溴水发生加成反应;乙烯、乙炔都能与酸性KMnO4溶液发生氧化反应;只有乙炔可与HCl反应生成氯乙烯。
√
课堂练习
三、炔烃的物理性质
课时二 炔烃
颜色:无色
溶解性:难溶于水
密度:均小于水
熔沸点:一般随着分子中碳原子数n的增加而升高;同碳时,支链越多熔沸点越低
状态:一般随着分子中碳原子数的增加,在常温下的状态由气态;变为液态,再到固态
课时二 炔烃
四、炔烃的化学性质
氧化反应
可燃性:
与酸性高锰酸钾溶液反应:
将炔烃通入酸性高锰酸钾溶液中,使其褪色
加成反应
与乙炔相似
2CnH2n-2+(3n-1)O2 2nCO2+(2n-2) H2O
点燃
R—C≡C—R′+Br2 CRBr=CR′Br
加聚反应
一定条件下
nR—C≡C—R′ [ C=C ]n
R
R ′
课时二 炔烃
五、炔烃的系统命名法
与烯烃的命名方法相同,称为“某炔”。
CH≡C—CH(CH3)—CH(CH3)2
课堂练习
●用系统命名法命名以下物质
CH≡ C_ CH3
1_丙炔
CH≡CCH2CH3
1-丁炔
CH3C≡CCH3
2-丁炔
CH ≡C-CH- CH3
CH3
3-甲基-1-丁炔
课时二 炔烃
【思考与讨论】
1. 请写出戊炔所有属于炔烃的同分异构体的结构简式。
2. 请写出1-丁炔与足量氢气完全反应的化学方程式,并分析该反应中化学键和官能团的变化。
CH≡CCH2CH2CH3 CH3CH≡CCH2CH3 CH≡CCH(CH3)CH3
CH≡CCH2CH3 + 2H2→CH3CH2CH2CH3 该反应为加成反应。反应中碳原子之间形成的π键断裂,形成4个C—H σ键。
课时二 炔烃
【思考与讨论】
3. 某炔烃通过催化加氢反应得到2-甲基戊烷,请由此推断该炔经可能的结构简式,并命名。
课堂练习
1.丙炔分子中σ键与π键个数之比是多少?
提示:3∶1
2.某炔烃通过催化加氢反应得到2 -甲基戊烷,请推断该炔烃可能的结
构。
提示:CH≡C—CH2—CH(CH3)—CH3、
CH3—C≡C—CH(CH3)—CH3。
课堂练习
3.你能写出戊炔所有属于炔烃的同分异构体的结构简式吗?
提示:CH≡C—CH2—CH2—CH3、
CH3—C≡C—CH2—CH3、CH≡C—CH(CH3)—CH3。
课堂练习
4.下列关于炔烃的叙述正确的是( )
A.1 mol丙炔最多能与2 mol Cl2发生加成反应
B.炔烃的物理性质与烷烃的完全相同
C.乙炔与分子式为C4H6的烃一定互为同系物
D.乙炔分子中只含有极性键
√
课堂练习
5.某烃与溴的四氯化碳溶液反应生成 CHBr2CBr2CH2CH3,则下列物质与该烃属于不同类别的同分异构体的是( )
A.CH≡CCH2CH3 B.CH3C≡CH
C.CH3CH2CH===CH2 D.CH2===CH—CH===CH2
解析:由生成物的结构简式可知,该烃的结构简式为CH≡CCH2CH3,则与该烃属于不同类别的同分异构体的物质不再是炔烃,可能是二烯
烃,故选D。
√
