盐类水解第一课时
图片预览





文档简介
课件21张PPT。高中化学选修4 第三章《水溶液中的离子平衡》 《盐类水解》
第一课时
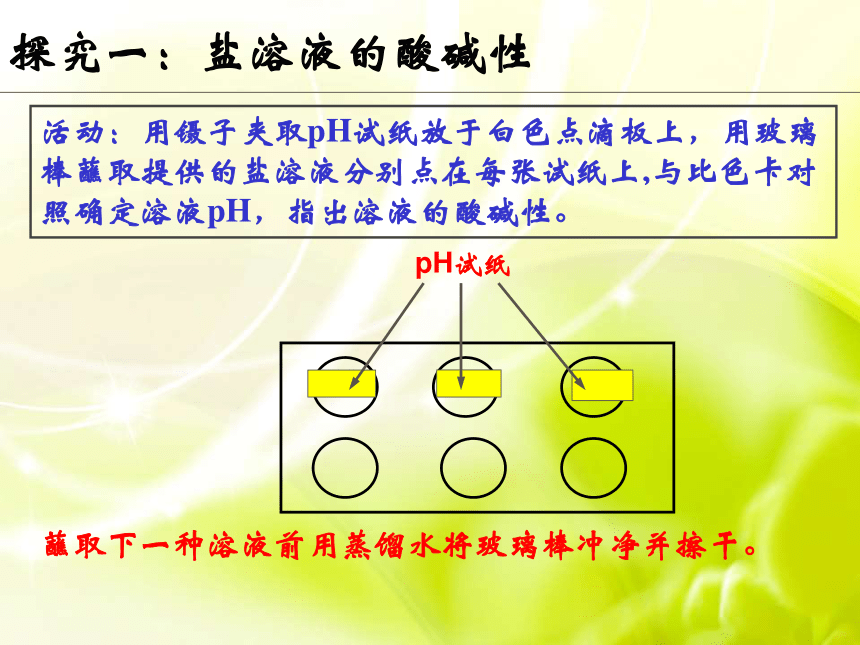
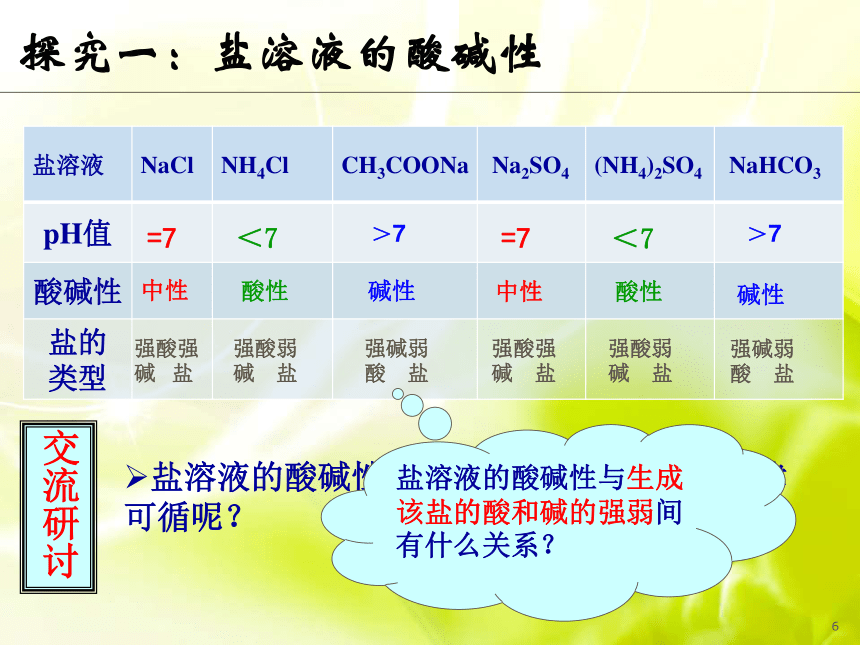
第三节魔术:清水变红花情境引入 猜想:喷洒的“清水”可能是什么?我不是碱我是盐!盐溶液一定呈中性吗??探究一:盐溶液的酸碱性活动:用镊子夹取pH试纸放于白色点滴板上,用玻璃棒蘸取提供的盐溶液分别点在每张试纸上,与比色卡对照确定溶液pH,指出溶液的酸碱性。蘸取下一种溶液前用蒸馏水将玻璃棒冲净并擦干。1探究一:盐溶液的酸碱性第一组第二组观察现象并完成学案。1中性酸性碱性中性碱性酸性=7>7<7=7>7<7强酸强碱 盐强碱弱酸 盐强碱弱酸 盐强酸弱碱 盐强酸强碱 盐强酸弱碱 盐探究一:盐溶液的酸碱性盐溶液的酸碱性是随机出现的,还是有规律
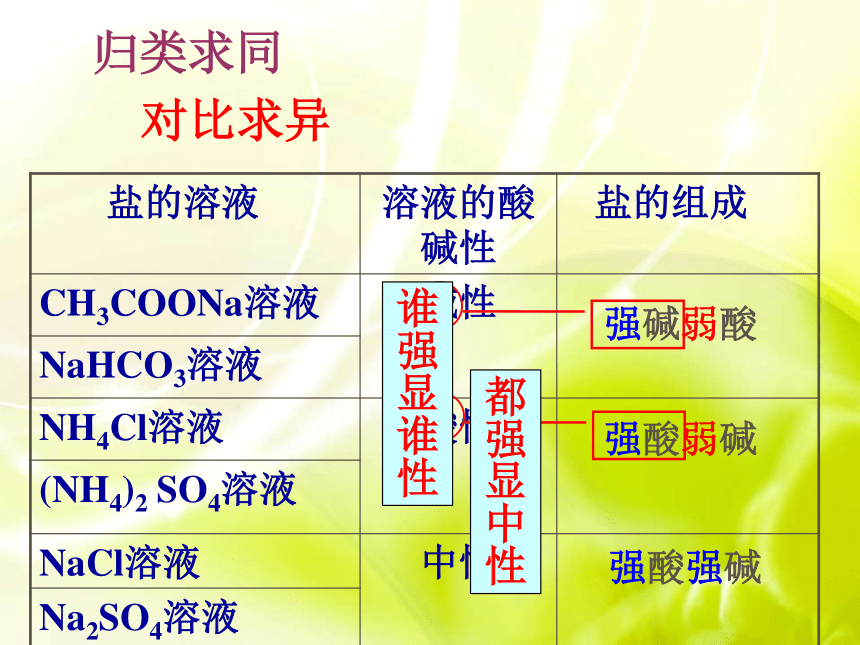
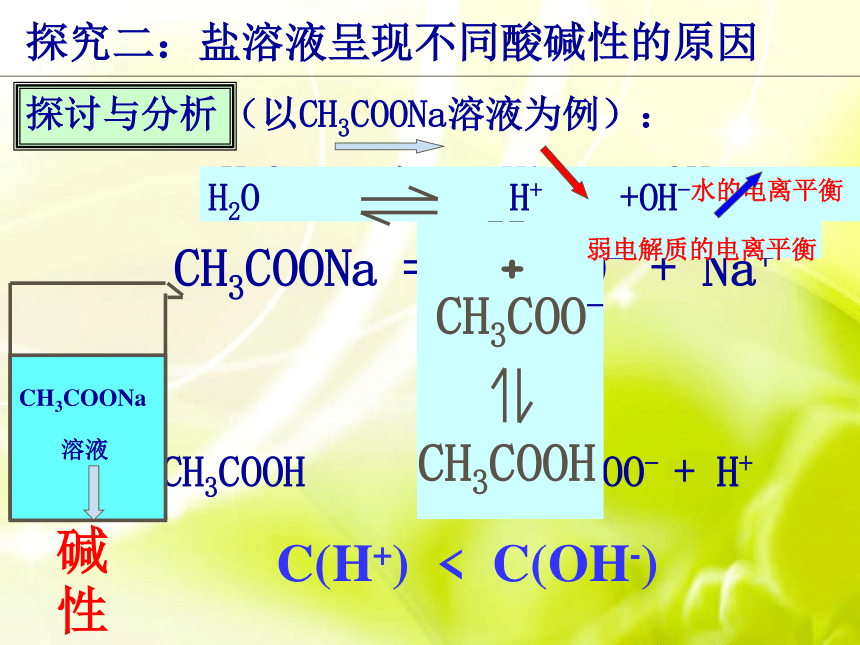
可循呢?交流研讨盐溶液的酸碱性与生成该盐的酸和碱的强弱间有什么关系? 归类求同 强碱弱酸强酸弱碱强酸强碱对比求异谁强显谁性都强显中性探究二:盐溶液呈现不同酸碱性的原因理论先行判断溶液酸碱性的标准是什么?C(H+) 与C(OH-)相对大小弱电解质的电离过程有什么特点?离子结合成分子分子电离成离子可逆平衡CH3COONa = CH3COO- + Na+(以CH3COONa溶液为例):C(H+) < C(OH-)探讨与分析探究二:盐溶液呈现不同酸碱性的原因NH4Cl = NH4+ + Cl-(以NH4Cl溶液为例):C(OH-) < C(H+) 探讨与分析探究二:盐溶液呈现不同酸碱性的原因OH- NH4Cl Cl- + NH4+ NH3·H2OH2O H+ + OH-都与生成弱电解质有关探究二:盐溶液呈现不同酸碱性的原因过程整合无弱电解质生成
溶液中:c(H+) = c(OH-) 溶液显中性(以NaCl溶液为例):探讨与分析探究二:盐溶液呈现不同酸碱性的原因盐电离产生的离子与水电离产生的H+或OH-生成弱电解质的反应。盐的离子破坏了水的电离平衡,使溶液中c (H+) ≠c (OH-),1.概念:2.本质:一、盐类的水解 导致溶液
呈现酸性或碱性。获得新知特点:酸碱中和的逆过程总反应:盐类水解的离子方程式总反应:巩固练习试写出CH3COONa水解的离子方程式? 盐的水解也属于离子反应。在认识水解反应原理的基础上,你对必修1所学的“离子反应发生的条件”有无新的认识?有沉淀、气体、水 生成学与问深入理解水弱电解质水解水解
不水解
弱碱
阳离子弱酸
阴离子无弱碱:NH3·H2O无C(H+)﹥C(OH-)无弱不水解, 有弱必水解;谁强显谁性,都强显中性。巩固练习弱酸:H2CO3C(H+) ﹤C(OH-)C(H+) =C(OH-)知识迁移魔术揭秘1.概念2.本质一、盐类的水解课堂小结3.水解的规律2.本质学以致用
结合生活生产分析哪些现象应用了盐类水解?
布置作业 谢谢!
第一课时
第三节魔术:清水变红花情境引入 猜想:喷洒的“清水”可能是什么?我不是碱我是盐!盐溶液一定呈中性吗??探究一:盐溶液的酸碱性活动:用镊子夹取pH试纸放于白色点滴板上,用玻璃棒蘸取提供的盐溶液分别点在每张试纸上,与比色卡对照确定溶液pH,指出溶液的酸碱性。蘸取下一种溶液前用蒸馏水将玻璃棒冲净并擦干。1探究一:盐溶液的酸碱性第一组第二组观察现象并完成学案。1中性酸性碱性中性碱性酸性=7>7<7=7>7<7强酸强碱 盐强碱弱酸 盐强碱弱酸 盐强酸弱碱 盐强酸强碱 盐强酸弱碱 盐探究一:盐溶液的酸碱性盐溶液的酸碱性是随机出现的,还是有规律
可循呢?交流研讨盐溶液的酸碱性与生成该盐的酸和碱的强弱间有什么关系? 归类求同 强碱弱酸强酸弱碱强酸强碱对比求异谁强显谁性都强显中性探究二:盐溶液呈现不同酸碱性的原因理论先行判断溶液酸碱性的标准是什么?C(H+) 与C(OH-)相对大小弱电解质的电离过程有什么特点?离子结合成分子分子电离成离子可逆平衡CH3COONa = CH3COO- + Na+(以CH3COONa溶液为例):C(H+) < C(OH-)探讨与分析探究二:盐溶液呈现不同酸碱性的原因NH4Cl = NH4+ + Cl-(以NH4Cl溶液为例):C(OH-) < C(H+) 探讨与分析探究二:盐溶液呈现不同酸碱性的原因OH- NH4Cl Cl- + NH4+ NH3·H2OH2O H+ + OH-都与生成弱电解质有关探究二:盐溶液呈现不同酸碱性的原因过程整合无弱电解质生成
溶液中:c(H+) = c(OH-) 溶液显中性(以NaCl溶液为例):探讨与分析探究二:盐溶液呈现不同酸碱性的原因盐电离产生的离子与水电离产生的H+或OH-生成弱电解质的反应。盐的离子破坏了水的电离平衡,使溶液中c (H+) ≠c (OH-),1.概念:2.本质:一、盐类的水解 导致溶液
呈现酸性或碱性。获得新知特点:酸碱中和的逆过程总反应:盐类水解的离子方程式总反应:巩固练习试写出CH3COONa水解的离子方程式? 盐的水解也属于离子反应。在认识水解反应原理的基础上,你对必修1所学的“离子反应发生的条件”有无新的认识?有沉淀、气体、水 生成学与问深入理解水弱电解质水解水解
不水解
弱碱
阳离子弱酸
阴离子无弱碱:NH3·H2O无C(H+)﹥C(OH-)无弱不水解, 有弱必水解;谁强显谁性,都强显中性。巩固练习弱酸:H2CO3C(H+) ﹤C(OH-)C(H+) =C(OH-)知识迁移魔术揭秘1.概念2.本质一、盐类的水解课堂小结3.水解的规律2.本质学以致用
结合生活生产分析哪些现象应用了盐类水解?
布置作业 谢谢!
