人教版九年级化学 第十一单元 课题1 生活中常见的盐 课时3 盐的化学性质课件(共19张PPT)
文档属性
| 名称 | 人教版九年级化学 第十一单元 课题1 生活中常见的盐 课时3 盐的化学性质课件(共19张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 330.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-25 23:13:41 | ||
图片预览





文档简介
(共19张PPT)
课题1 生活中常见的盐
第十一单元 盐 化肥
课时3 盐的化学性质
目录
01
知识点精讲
02
课堂检测
知识点精讲
知识点1
盐的化学性质
1. 盐(溶液)+金属→新盐+新金属 (________反应,前置后,盐可溶,K、Ca、Na除外)
如湿法炼铜:___________________________________。
2. 盐+酸→新盐+新酸(_____________反应)
如硝酸银溶液与盐酸:________________________________。
置换
CuSO4+Fe == FeSO4+Cu
复分解
AgNO3+HCl == AgCl↓+HNO3
3. 盐(溶液)+碱(溶液)→新盐+新碱 (________反应)
如纯碱溶液与氢氧化钡溶液:____________________________。
4. 盐1(溶液)+盐2(溶液)→新盐1+新盐2(________反应)
如氯化钡溶液与硫酸钠溶液:______________________________。
复分解
Na2CO3+Ba(OH)2 == BaCO3↓+2NaOH
复分解
BaCl2+Na2SO4 == BaSO4↓+2NaCl
课堂练习
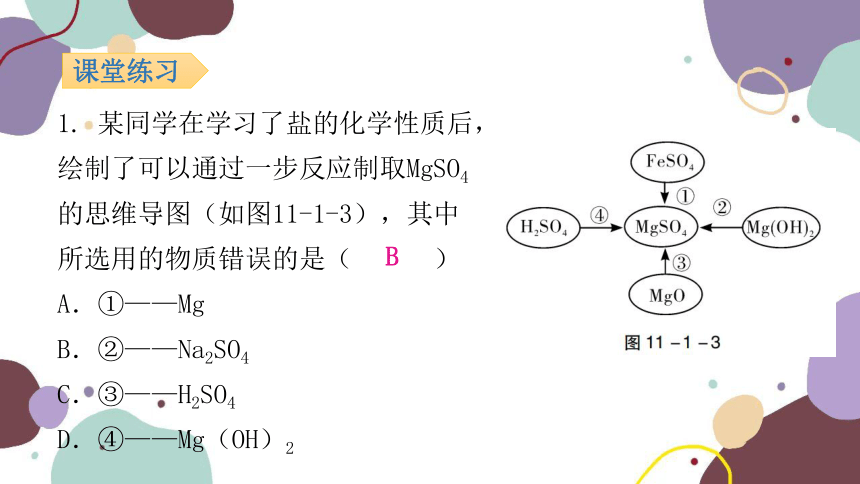
1. 某同学在学习了盐的化学性质后,绘制了可以通过一步反应制取MgSO4的思维导图(如图11-1-3),其中所选用的物质错误的是( )
A.①——Mg
B.②——Na2SO4
C.③——H2SO4
D.④——Mg(OH)2
B
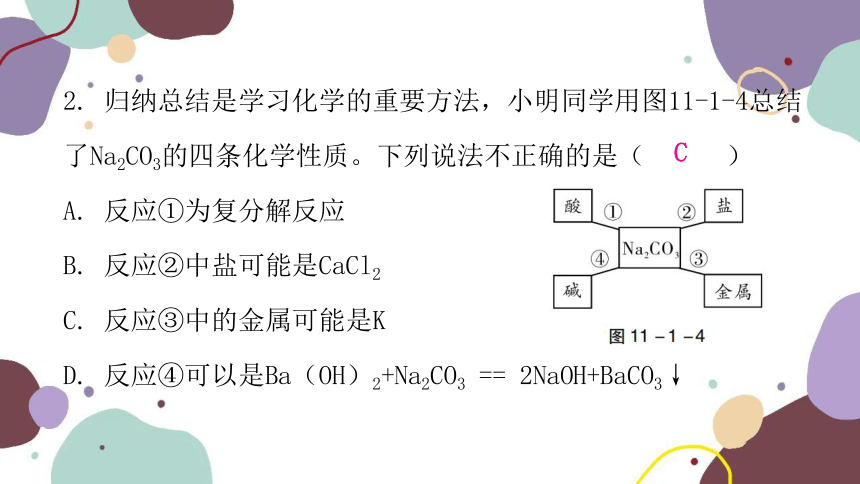
2. 归纳总结是学习化学的重要方法,小明同学用图11-1-4总结了Na2CO3的四条化学性质。下列说法不正确的是( )
A. 反应①为复分解反应
B. 反应②中盐可能是CaCl2
C. 反应③中的金属可能是K
D. 反应④可以是Ba(OH)2+Na2CO3 == 2NaOH+BaCO3↓
C
思路点拨
(1)盐能与酸、碱、盐发生复分解反应,能与金属发生置换反应(K、Ca、Na除外)。(2)盐与碱、盐反应时,两者都要可溶;与酸反应时,盐可以不溶。
知识点2
盐的化学性质的应用
1. 物质的转化:分析反应物与生成物的相同离子,根据复分解反应发生的条件,选择合适的药品使之转化为目的产物。
2. 物质的检验与鉴别:观察物质的颜色(如Cu2+显蓝色、Fe2+显浅绿色、Fe3+显黄色)、状态进行初步的判断,加入相应离子的检验试剂(如CO32-的检验用稀盐酸和澄清石灰水,H+、OH-的检验用酸碱指示剂),观察现象,根据现象分析、判断、得出结论。
3. 物质除杂:原则是不增(在除掉杂质的同时,不得引入其他杂质)、不减(所用试剂只能与杂质反应,不与被提纯物质反应)、易分离(反应后的生成物与被提纯物质要容易分离)。
4. 分离提纯的方法(优先考虑物理方法)
(1)物理方法:有两种固体的混合物,一种溶于水,一种不溶于水,分离的步骤是:溶解、过滤、洗涤、干燥得到难溶物,若想得到可溶物则需将滤液蒸发结晶。
(2)化学方法:
①转化法:将杂质转变为被提纯的物质。
②除去法:选择适当试剂将杂质直接除掉,或将杂质转变成沉淀或气体或水。
(3)液体除杂:一般为酸碱盐之间的除杂,其实质为除去液体中的杂质离子。
5. 混合溶液中反应的先后的判断,考虑物质的共存。
课堂练习
3. 下列物质间的转化不能直接完成的是( )
A.C→CO2→H2CO3→Na2CO3
B.Na→Na2O→NaOH→NaCl
C.Fe→Fe2O3→Fe(OH)3→Fe(NO3)3
D.S→SO2→H2SO3→K2SO3
C
4. 已知,常温下氯化钠、氯化钡的水溶液呈中性,向含有盐酸和氯化钡的混合溶液中逐滴滴入过量的X,溶液pH与滴入X的量的关系如图11-1-5所示,则X可能是下列物质中的( )
A. NaOH溶液
B. H2O
C. AgNO3溶液
D. Na2CO3溶液
D
5. 除去下列物质中的杂质(括号内为杂质),所选用的试剂正确的是( )
A. CaCl2(HCl):Ca(OH)2溶液
B. NaCl(NaHCO3):稀硫酸
C. FeCl2(FeCl3):NaOH溶液
D. NaOH(Na2CO3):Ba(OH)2溶液
A
课堂检测
1. 下列物质既能和硫酸反应,又能和纯碱反应的是( )
A. Ca(OH)2 B. CuSO4
C. FeCl3 D. HNO3
2. 下列各组物质在溶液中能发生反应,且生成白色沉淀的是( )
A. NaOH与Na2SO4 B. CaCO3与稀盐酸
C. CuSO4与KCl D. AgNO3与NaCl
A
D
加入的物质 稀硫酸 饱和石灰水 酚酞溶液
现象 有气泡冒出 有白色沉淀 变成红色
3. 无色液体X是下列四种物质中的一种。将其分成等量的三份,向其中分别加入少量的稀硫酸、饱和石灰水、酚酞溶液,产生的现象如下表。则X是下列选项中的( )
A.稀盐酸 B.NaOH溶液
C.NaCl溶液 D.Na2CO3溶液
D
4. 下列依据实验目的所选用的实验方案错误的是( )
B
选项 实验目的 实验方案
A 鉴别NaOH溶液和稀盐酸 分别取样,滴加紫色石蕊溶液
B 除去NaOH溶液中混有的NaCl 加入足量稀盐酸
C 除去NaCl溶液中的Na2SO4 加入适量的BaCl2溶液后过滤
D 除去CaO中少量CaCO3 高温灼烧
5. 向碳酸钠溶液中逐滴滴加稀盐酸至过量,该溶液中依次发生的反应如下:①Na2CO3+HCl == NaHCO3+NaCl;②NaHCO3+HCl == NaCl+H2O+CO2↑;向碳酸钠和碳酸氢钠的混合溶液中逐滴滴加稀盐酸,所产生CO2的质量与所加盐酸的质量图象关系正确的是( )
C
6. 如图11-1-6甲、乙、丙、丁、戊五种物质(或其溶液)俨然是滑冰赛道上参加接力比赛的“运动员”,相邻“运动员”之间能发生化学反应。已知:五种物质分别是Fe、HCl、NaOH、CaCO3和CuCl2中的一种,其中甲是单质,丁与戊反应产生的气体可以熄灭终点的火炬。
(1)甲能分别与另四种物质中的___________________(填化学式)反应。
(2)丁与戊反应的化学方程式为___________________________________。
HCl、CuCl2
2HCl+CaCO3 == CaCl2+H2O+CO2↑
(3)丙与丁的反应属于__________________(填基本反应类型)。
(4)若把无机物按单质、氧化物、酸、碱和盐进行分类,无机物X的类别不同于上述五种物质,如果用X替换戊,它也能与丁反应生成一种生活中常用的液态灭火剂,X是__________________(写一种)。
复分解反应
CaO(合理即可)
课题1 生活中常见的盐
第十一单元 盐 化肥
课时3 盐的化学性质
目录
01
知识点精讲
02
课堂检测
知识点精讲
知识点1
盐的化学性质
1. 盐(溶液)+金属→新盐+新金属 (________反应,前置后,盐可溶,K、Ca、Na除外)
如湿法炼铜:___________________________________。
2. 盐+酸→新盐+新酸(_____________反应)
如硝酸银溶液与盐酸:________________________________。
置换
CuSO4+Fe == FeSO4+Cu
复分解
AgNO3+HCl == AgCl↓+HNO3
3. 盐(溶液)+碱(溶液)→新盐+新碱 (________反应)
如纯碱溶液与氢氧化钡溶液:____________________________。
4. 盐1(溶液)+盐2(溶液)→新盐1+新盐2(________反应)
如氯化钡溶液与硫酸钠溶液:______________________________。
复分解
Na2CO3+Ba(OH)2 == BaCO3↓+2NaOH
复分解
BaCl2+Na2SO4 == BaSO4↓+2NaCl
课堂练习
1. 某同学在学习了盐的化学性质后,绘制了可以通过一步反应制取MgSO4的思维导图(如图11-1-3),其中所选用的物质错误的是( )
A.①——Mg
B.②——Na2SO4
C.③——H2SO4
D.④——Mg(OH)2
B
2. 归纳总结是学习化学的重要方法,小明同学用图11-1-4总结了Na2CO3的四条化学性质。下列说法不正确的是( )
A. 反应①为复分解反应
B. 反应②中盐可能是CaCl2
C. 反应③中的金属可能是K
D. 反应④可以是Ba(OH)2+Na2CO3 == 2NaOH+BaCO3↓
C
思路点拨
(1)盐能与酸、碱、盐发生复分解反应,能与金属发生置换反应(K、Ca、Na除外)。(2)盐与碱、盐反应时,两者都要可溶;与酸反应时,盐可以不溶。
知识点2
盐的化学性质的应用
1. 物质的转化:分析反应物与生成物的相同离子,根据复分解反应发生的条件,选择合适的药品使之转化为目的产物。
2. 物质的检验与鉴别:观察物质的颜色(如Cu2+显蓝色、Fe2+显浅绿色、Fe3+显黄色)、状态进行初步的判断,加入相应离子的检验试剂(如CO32-的检验用稀盐酸和澄清石灰水,H+、OH-的检验用酸碱指示剂),观察现象,根据现象分析、判断、得出结论。
3. 物质除杂:原则是不增(在除掉杂质的同时,不得引入其他杂质)、不减(所用试剂只能与杂质反应,不与被提纯物质反应)、易分离(反应后的生成物与被提纯物质要容易分离)。
4. 分离提纯的方法(优先考虑物理方法)
(1)物理方法:有两种固体的混合物,一种溶于水,一种不溶于水,分离的步骤是:溶解、过滤、洗涤、干燥得到难溶物,若想得到可溶物则需将滤液蒸发结晶。
(2)化学方法:
①转化法:将杂质转变为被提纯的物质。
②除去法:选择适当试剂将杂质直接除掉,或将杂质转变成沉淀或气体或水。
(3)液体除杂:一般为酸碱盐之间的除杂,其实质为除去液体中的杂质离子。
5. 混合溶液中反应的先后的判断,考虑物质的共存。
课堂练习
3. 下列物质间的转化不能直接完成的是( )
A.C→CO2→H2CO3→Na2CO3
B.Na→Na2O→NaOH→NaCl
C.Fe→Fe2O3→Fe(OH)3→Fe(NO3)3
D.S→SO2→H2SO3→K2SO3
C
4. 已知,常温下氯化钠、氯化钡的水溶液呈中性,向含有盐酸和氯化钡的混合溶液中逐滴滴入过量的X,溶液pH与滴入X的量的关系如图11-1-5所示,则X可能是下列物质中的( )
A. NaOH溶液
B. H2O
C. AgNO3溶液
D. Na2CO3溶液
D
5. 除去下列物质中的杂质(括号内为杂质),所选用的试剂正确的是( )
A. CaCl2(HCl):Ca(OH)2溶液
B. NaCl(NaHCO3):稀硫酸
C. FeCl2(FeCl3):NaOH溶液
D. NaOH(Na2CO3):Ba(OH)2溶液
A
课堂检测
1. 下列物质既能和硫酸反应,又能和纯碱反应的是( )
A. Ca(OH)2 B. CuSO4
C. FeCl3 D. HNO3
2. 下列各组物质在溶液中能发生反应,且生成白色沉淀的是( )
A. NaOH与Na2SO4 B. CaCO3与稀盐酸
C. CuSO4与KCl D. AgNO3与NaCl
A
D
加入的物质 稀硫酸 饱和石灰水 酚酞溶液
现象 有气泡冒出 有白色沉淀 变成红色
3. 无色液体X是下列四种物质中的一种。将其分成等量的三份,向其中分别加入少量的稀硫酸、饱和石灰水、酚酞溶液,产生的现象如下表。则X是下列选项中的( )
A.稀盐酸 B.NaOH溶液
C.NaCl溶液 D.Na2CO3溶液
D
4. 下列依据实验目的所选用的实验方案错误的是( )
B
选项 实验目的 实验方案
A 鉴别NaOH溶液和稀盐酸 分别取样,滴加紫色石蕊溶液
B 除去NaOH溶液中混有的NaCl 加入足量稀盐酸
C 除去NaCl溶液中的Na2SO4 加入适量的BaCl2溶液后过滤
D 除去CaO中少量CaCO3 高温灼烧
5. 向碳酸钠溶液中逐滴滴加稀盐酸至过量,该溶液中依次发生的反应如下:①Na2CO3+HCl == NaHCO3+NaCl;②NaHCO3+HCl == NaCl+H2O+CO2↑;向碳酸钠和碳酸氢钠的混合溶液中逐滴滴加稀盐酸,所产生CO2的质量与所加盐酸的质量图象关系正确的是( )
C
6. 如图11-1-6甲、乙、丙、丁、戊五种物质(或其溶液)俨然是滑冰赛道上参加接力比赛的“运动员”,相邻“运动员”之间能发生化学反应。已知:五种物质分别是Fe、HCl、NaOH、CaCO3和CuCl2中的一种,其中甲是单质,丁与戊反应产生的气体可以熄灭终点的火炬。
(1)甲能分别与另四种物质中的___________________(填化学式)反应。
(2)丁与戊反应的化学方程式为___________________________________。
HCl、CuCl2
2HCl+CaCO3 == CaCl2+H2O+CO2↑
(3)丙与丁的反应属于__________________(填基本反应类型)。
(4)若把无机物按单质、氧化物、酸、碱和盐进行分类,无机物X的类别不同于上述五种物质,如果用X替换戊,它也能与丁反应生成一种生活中常用的液态灭火剂,X是__________________(写一种)。
复分解反应
CaO(合理即可)
同课章节目录
