3.2.2共价晶体课件2021-2022学年高二化学人教版(2019)选择性必修2
文档属性
| 名称 | 3.2.2共价晶体课件2021-2022学年高二化学人教版(2019)选择性必修2 |  | |
| 格式 | zip | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-28 15:18:26 | ||
图片预览





文档简介
(共17张PPT)
新课导入
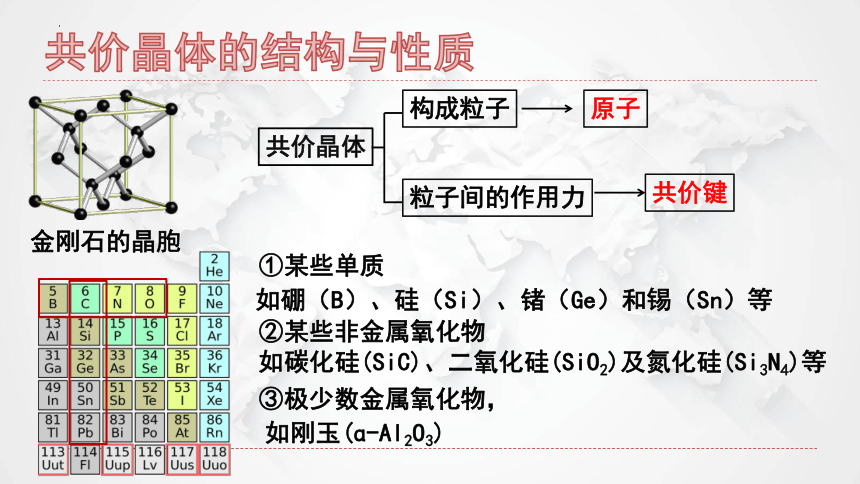
物质 熔点/℃ 沸点/℃
CO2 -56.2 (在527 kPa下测得) -78.5
SiO2 1 723 2 230
二氧化硅的熔沸点远高于二氧化碳的熔沸点,说明什么?
说明形成二氧化硅晶体的作用力是远强于分子间作用力的力。
第2节 分子晶体与共价晶体
第三章 晶体结构与性质
第2课时 共价晶体
单晶硅
金刚石
学习目标
1.借助共价晶体模型认识共价晶体的结构特点
2.能够从化学键的特征,分子理解共价晶体的物理特性
预习检测
1.什么是共价晶体?
2.共价晶体有哪些结构特点?
相邻原子间以共价键结合而形成具有空间立体网状结构的晶体。
1.由于共价键的方向性和饱和性,使每个中心原子周围排列的原子数目是固定的。
2.由于所有原子间均以共价键相结合,因此晶体中不存在单个分子。
2.典型的共价晶体有哪些?有什么特点?
金刚石和二氧化硅。
在金刚石晶体中,碳原子以sp3杂化轨道与周围4个碳原子以共价键相结合,C-C键间的夹角109°28′
在二氧化硅晶体中,每个硅原子周围结合4个氧原子,每个氧原子周围结合2个硅原子。
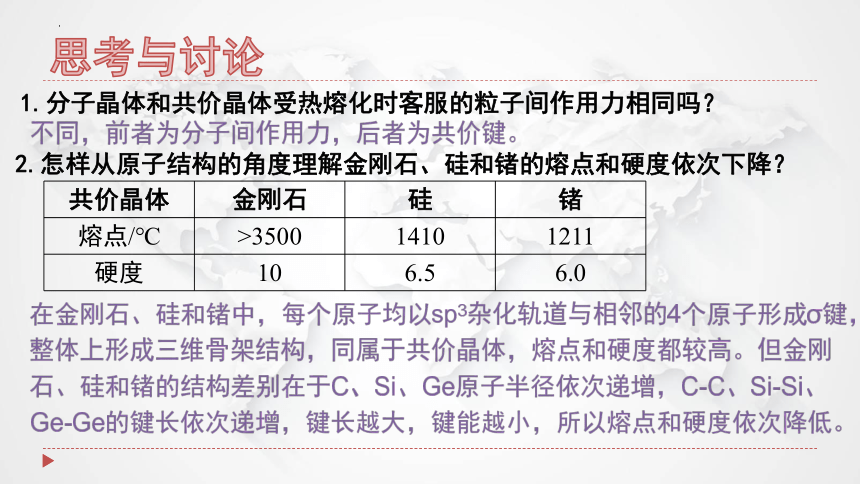
共价晶体的结构与性质
金刚石的晶胞
构成粒子
共价晶体
原子
粒子间的作用力
共价键
如硼(B)、硅(Si)、锗(Ge)和锡(Sn)等
如碳化硅(SiC)、二氧化硅(SiO2)及氮化硅(Si3N4)等
③极少数金属氧化物,
①某些单质
②某些非金属氧化物
如刚玉(ɑ-Al2O3)
思考与讨论
1.分子晶体和共价晶体受热熔化时客服的粒子间作用力相同吗?
不同,前者为分子间作用力,后者为共价键。
2.怎样从原子结构的角度理解金刚石、硅和锗的熔点和硬度依次下降?
共价晶体 金刚石 硅 锗
熔点/℃ >3500 1410 1211
硬度 10 6.5 6.0
在金刚石、硅和锗中,每个原子均以sp3杂化轨道与相邻的4个原子形成σ键,整体上形成三维骨架结构,同属于共价晶体,熔点和硬度都较高。但金刚石、硅和锗的结构差别在于C、Si、Ge原子半径依次递增,C-C、Si-Si、Ge-Ge的键长依次递增,键长越大,键能越小,所以熔点和硬度依次降低。
1.下列有关共价晶体的叙述错误的是( )
A.共价晶体中存在共价键
B.共价晶体具有空间网状结构
C.共价晶体中不存在独立的分子
D.共价晶体熔化时不破坏共价键
2.分析下列各物质的物理性质,判断其固态属于共价晶体的是( )
A.碳化铝,黄色晶体,熔点2200℃,熔融态不导电
B.溴化铝,无色晶体,熔点98℃,熔融态不导电
C.五氧化二钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中
D.溴化钾,无色晶体,熔融时或溶于水中都能导电
课堂练习
A
D
认识金刚石的结构和性质
2.金刚石中,每个碳原子与多少个碳原子成键?碳原子采取什么杂化方式?
1.一个金刚石晶胞中,含有几个碳原子?
8×1/8+6×1/2+4=8
在金刚石晶体中每个碳原子周围紧邻的碳原子有4个
sp3杂化
3.根据金刚石的结构特点,你能分析其硬度大的原因是什么吗?
在金刚石晶体内部,每个碳原子都与周围的4个碳原子紧密结合,形成一种致密的三维结构,破坏这种三维结构中的C-C共价键需要很高的能量,所以金刚石的硬度很大。
正四面体
最小环为六元环
认识金刚石的结构和性质
1.所有C-C键键长相等,键角相等,键角为109.28°
2.晶体中最小的碳环由6个碳原子构成,且不再同一个平面上。
3.每个碳原子可以形成12个六元环,每个碳碳键可形成6个六元环。
4.晶体中每个C参与了4条C-C键的形成,而每条键中的贡献只有一半。
故C原子与C-C键数之比为:
1 :( )= 1:2
思考:12g 金刚石含有___个C原子含有__ 个C-C键。
NA
2NA
思考与讨论
1.根据金刚石的结构特点,你能分析其硬度大的原因是什么?
在金刚石晶体内部,每个碳原子都与周围的4个碳原子紧密结合,形成一种致密的三维结构,破坏这种三维结构中的C-C共价键需要很高的能量,所以金刚石的硬度很大。
2.以金刚石为例,说明共价晶体的微观结构与分子晶体有哪些不同?
①构成粒子不同,共价晶体中只存在原子,没有小分子。
②相互作用不同,共价晶体中的微粒间的作用力是共价键。
认识SiO2的结构和性质
二氧化硅晶体结构与金刚石晶体结构有什么相同点和不同点?
认识SiO2的结构和性质
109 28
Si
O
共价键
1.相同点:
①键角109.28°
②形成四面体结构
2.不同点:
①共价键键能不同
②金刚石是向空间伸展形成空间网状结构,而二氧化硅形成螺旋上升的长链
③原子之间以共价键结合
③最小环不同
认识SiO2的结构和性质
二氧化硅的结构二氧化硅是自然界含量最高的固态二元氧化物,有多种结构,最常见的是低温石英(α SiO2)。低温石英的结构中有顶角相连的硅氧四面体形成螺旋上升的长链,没有封闭的环状结构,这一结构决定了它具有手性。
1个Si原子和4个O原子形成4个共价键,每个Si原子周围结合4个O原子;同时,每个O原子跟2个Si原子相结合。实际上,SiO2晶体是由Si原子和O原子按1:2的比例所组成的立体网状的晶体。
最小环是由6个Si原子和6个O原子组成,有12个原子。每个最小的环实际拥有的硅原子为6×1/12=1/2,氧原子数为6×1/6=1。
1mol SiO2中含4mol Si—O键,在SiO2晶体中Si、O原子均采取sp3杂化。
正四面体内O—Si—O键角为109°28′。
思考与讨论
1.SiO2是二氧化硅的分子式吗?
二氧化硅为共价晶体,晶体中不存在单个分子,其化学式SiO2为Si与O的最简个数比,而不是分子式。
2.分析金刚石、二氧化硅的晶体结构模型,判断共价晶体的化学式是否可以代表其分子式。
不能,因为共价晶体是一个三维的网状结构,无小分子存在。
3.分析二氧化硅的晶体结构模型,判断晶体中最小的环有
多少个原子,1molSiO2中含有多少摩尔Si-O键。
SiO2晶体中最小环上有12个原子,1molSiO2中含有4molSi-O键。
1.我们可以将SiO2的晶体结构想象为在晶体硅的Si-Si键之间插入O原子。根据SiO2晶体结构图,下列说法不正确的是( )
A.SiO2晶体中每个Si原子通过Si-O极性键与4个O原子作用
B.每个O原子通过Si-O极性键与2个Si原子作用
C.SiO2晶体中Si原子与O原子的原子个数之比为1:2,可用“SiO2”来表示石英的组成
D.在晶体中存在石英分子,故SiO2能叫分子式
2.有以下几种晶体:A.干冰 B.冰 C.水晶 D.金刚石
(1) 属于共价晶体的是 (填序号,下同)。
(2) 属于分子晶体的是 。
(3) 含化学键且受热熔化时化学键不发生变化的晶体是 ,受热熔化时需克服共价键的晶体是 。
(4) 晶体中存在氢键的是 。
D
当堂训练
A、B
C、D
A、B
C、D
B
拓展延伸
耐高温 强度高 耐雨蚀 透波性好
导弹天线罩材料要求
Si3N4晶体结构
Si3N4材料的导弹天线罩制品
小结
晶体类型 共价晶体 分子晶体
组成微粒
作用力
熔沸点
硬度
溶解性
导电性
原子
分子
共价键
分子间作用力
很大
较小
很大
较小
不溶于任何溶剂
部分溶于水
不导电,个别为半导体
固体和熔化状态都不导电,部分溶于水导电
新课导入
物质 熔点/℃ 沸点/℃
CO2 -56.2 (在527 kPa下测得) -78.5
SiO2 1 723 2 230
二氧化硅的熔沸点远高于二氧化碳的熔沸点,说明什么?
说明形成二氧化硅晶体的作用力是远强于分子间作用力的力。
第2节 分子晶体与共价晶体
第三章 晶体结构与性质
第2课时 共价晶体
单晶硅
金刚石
学习目标
1.借助共价晶体模型认识共价晶体的结构特点
2.能够从化学键的特征,分子理解共价晶体的物理特性
预习检测
1.什么是共价晶体?
2.共价晶体有哪些结构特点?
相邻原子间以共价键结合而形成具有空间立体网状结构的晶体。
1.由于共价键的方向性和饱和性,使每个中心原子周围排列的原子数目是固定的。
2.由于所有原子间均以共价键相结合,因此晶体中不存在单个分子。
2.典型的共价晶体有哪些?有什么特点?
金刚石和二氧化硅。
在金刚石晶体中,碳原子以sp3杂化轨道与周围4个碳原子以共价键相结合,C-C键间的夹角109°28′
在二氧化硅晶体中,每个硅原子周围结合4个氧原子,每个氧原子周围结合2个硅原子。
共价晶体的结构与性质
金刚石的晶胞
构成粒子
共价晶体
原子
粒子间的作用力
共价键
如硼(B)、硅(Si)、锗(Ge)和锡(Sn)等
如碳化硅(SiC)、二氧化硅(SiO2)及氮化硅(Si3N4)等
③极少数金属氧化物,
①某些单质
②某些非金属氧化物
如刚玉(ɑ-Al2O3)
思考与讨论
1.分子晶体和共价晶体受热熔化时客服的粒子间作用力相同吗?
不同,前者为分子间作用力,后者为共价键。
2.怎样从原子结构的角度理解金刚石、硅和锗的熔点和硬度依次下降?
共价晶体 金刚石 硅 锗
熔点/℃ >3500 1410 1211
硬度 10 6.5 6.0
在金刚石、硅和锗中,每个原子均以sp3杂化轨道与相邻的4个原子形成σ键,整体上形成三维骨架结构,同属于共价晶体,熔点和硬度都较高。但金刚石、硅和锗的结构差别在于C、Si、Ge原子半径依次递增,C-C、Si-Si、Ge-Ge的键长依次递增,键长越大,键能越小,所以熔点和硬度依次降低。
1.下列有关共价晶体的叙述错误的是( )
A.共价晶体中存在共价键
B.共价晶体具有空间网状结构
C.共价晶体中不存在独立的分子
D.共价晶体熔化时不破坏共价键
2.分析下列各物质的物理性质,判断其固态属于共价晶体的是( )
A.碳化铝,黄色晶体,熔点2200℃,熔融态不导电
B.溴化铝,无色晶体,熔点98℃,熔融态不导电
C.五氧化二钒,无色晶体,熔点19.5℃,易溶于乙醇、氯仿、丙酮中
D.溴化钾,无色晶体,熔融时或溶于水中都能导电
课堂练习
A
D
认识金刚石的结构和性质
2.金刚石中,每个碳原子与多少个碳原子成键?碳原子采取什么杂化方式?
1.一个金刚石晶胞中,含有几个碳原子?
8×1/8+6×1/2+4=8
在金刚石晶体中每个碳原子周围紧邻的碳原子有4个
sp3杂化
3.根据金刚石的结构特点,你能分析其硬度大的原因是什么吗?
在金刚石晶体内部,每个碳原子都与周围的4个碳原子紧密结合,形成一种致密的三维结构,破坏这种三维结构中的C-C共价键需要很高的能量,所以金刚石的硬度很大。
正四面体
最小环为六元环
认识金刚石的结构和性质
1.所有C-C键键长相等,键角相等,键角为109.28°
2.晶体中最小的碳环由6个碳原子构成,且不再同一个平面上。
3.每个碳原子可以形成12个六元环,每个碳碳键可形成6个六元环。
4.晶体中每个C参与了4条C-C键的形成,而每条键中的贡献只有一半。
故C原子与C-C键数之比为:
1 :( )= 1:2
思考:12g 金刚石含有___个C原子含有__ 个C-C键。
NA
2NA
思考与讨论
1.根据金刚石的结构特点,你能分析其硬度大的原因是什么?
在金刚石晶体内部,每个碳原子都与周围的4个碳原子紧密结合,形成一种致密的三维结构,破坏这种三维结构中的C-C共价键需要很高的能量,所以金刚石的硬度很大。
2.以金刚石为例,说明共价晶体的微观结构与分子晶体有哪些不同?
①构成粒子不同,共价晶体中只存在原子,没有小分子。
②相互作用不同,共价晶体中的微粒间的作用力是共价键。
认识SiO2的结构和性质
二氧化硅晶体结构与金刚石晶体结构有什么相同点和不同点?
认识SiO2的结构和性质
109 28
Si
O
共价键
1.相同点:
①键角109.28°
②形成四面体结构
2.不同点:
①共价键键能不同
②金刚石是向空间伸展形成空间网状结构,而二氧化硅形成螺旋上升的长链
③原子之间以共价键结合
③最小环不同
认识SiO2的结构和性质
二氧化硅的结构二氧化硅是自然界含量最高的固态二元氧化物,有多种结构,最常见的是低温石英(α SiO2)。低温石英的结构中有顶角相连的硅氧四面体形成螺旋上升的长链,没有封闭的环状结构,这一结构决定了它具有手性。
1个Si原子和4个O原子形成4个共价键,每个Si原子周围结合4个O原子;同时,每个O原子跟2个Si原子相结合。实际上,SiO2晶体是由Si原子和O原子按1:2的比例所组成的立体网状的晶体。
最小环是由6个Si原子和6个O原子组成,有12个原子。每个最小的环实际拥有的硅原子为6×1/12=1/2,氧原子数为6×1/6=1。
1mol SiO2中含4mol Si—O键,在SiO2晶体中Si、O原子均采取sp3杂化。
正四面体内O—Si—O键角为109°28′。
思考与讨论
1.SiO2是二氧化硅的分子式吗?
二氧化硅为共价晶体,晶体中不存在单个分子,其化学式SiO2为Si与O的最简个数比,而不是分子式。
2.分析金刚石、二氧化硅的晶体结构模型,判断共价晶体的化学式是否可以代表其分子式。
不能,因为共价晶体是一个三维的网状结构,无小分子存在。
3.分析二氧化硅的晶体结构模型,判断晶体中最小的环有
多少个原子,1molSiO2中含有多少摩尔Si-O键。
SiO2晶体中最小环上有12个原子,1molSiO2中含有4molSi-O键。
1.我们可以将SiO2的晶体结构想象为在晶体硅的Si-Si键之间插入O原子。根据SiO2晶体结构图,下列说法不正确的是( )
A.SiO2晶体中每个Si原子通过Si-O极性键与4个O原子作用
B.每个O原子通过Si-O极性键与2个Si原子作用
C.SiO2晶体中Si原子与O原子的原子个数之比为1:2,可用“SiO2”来表示石英的组成
D.在晶体中存在石英分子,故SiO2能叫分子式
2.有以下几种晶体:A.干冰 B.冰 C.水晶 D.金刚石
(1) 属于共价晶体的是 (填序号,下同)。
(2) 属于分子晶体的是 。
(3) 含化学键且受热熔化时化学键不发生变化的晶体是 ,受热熔化时需克服共价键的晶体是 。
(4) 晶体中存在氢键的是 。
D
当堂训练
A、B
C、D
A、B
C、D
B
拓展延伸
耐高温 强度高 耐雨蚀 透波性好
导弹天线罩材料要求
Si3N4晶体结构
Si3N4材料的导弹天线罩制品
小结
晶体类型 共价晶体 分子晶体
组成微粒
作用力
熔沸点
硬度
溶解性
导电性
原子
分子
共价键
分子间作用力
很大
较小
很大
较小
不溶于任何溶剂
部分溶于水
不导电,个别为半导体
固体和熔化状态都不导电,部分溶于水导电
