人教版九年级化学 第十单元 课题2 酸和碱的中和反应 课时1 中和反应课件(共19张PPT)
文档属性
| 名称 | 人教版九年级化学 第十单元 课题2 酸和碱的中和反应 课时1 中和反应课件(共19张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 355.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-27 07:23:17 | ||
图片预览





文档简介
(共19张PPT)
课题2 酸和碱的中和反应
第十单元 酸和碱
课时1 中和反应
目录
01
课程要求
02
课前预习
03
知识点精讲
04
课堂检测
课程要求
了解盐的定义;知道中和反应,认识中和反应在实际中的应用。
课前预习
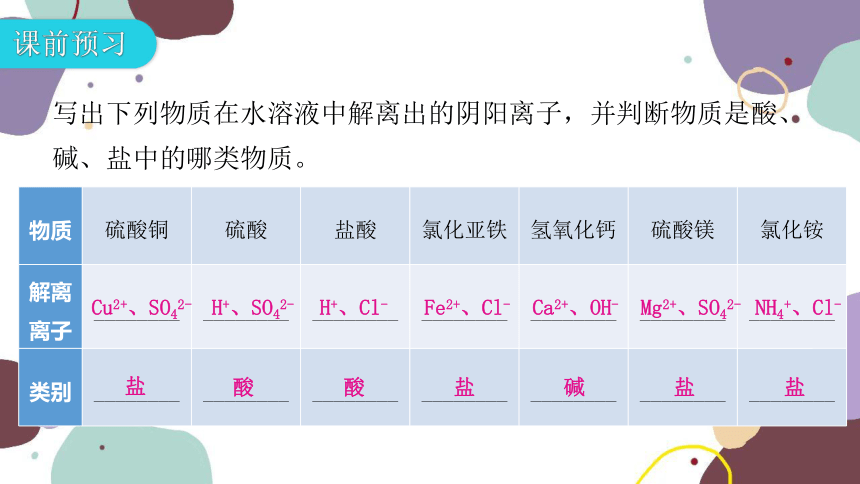
写出下列物质在水溶液中解离出的阴阳离子,并判断物质是酸、碱、盐中的哪类物质。
物质 硫酸铜 硫酸 盐酸 氯化亚铁 氢氧化钙 硫酸镁 氯化铵
解离离子 ________ ________ ________ ________ ________ ________ ________
类别 ________ ________ ________ ________ ________ ________ ________
Cu2+、SO42-
盐
H+、SO42-
酸
H+、Cl-
酸
Fe2+、Cl-
盐
Ca2+、OH-
碱
Mg2+、SO42-
盐
NH4+、Cl-
盐
知识点精讲
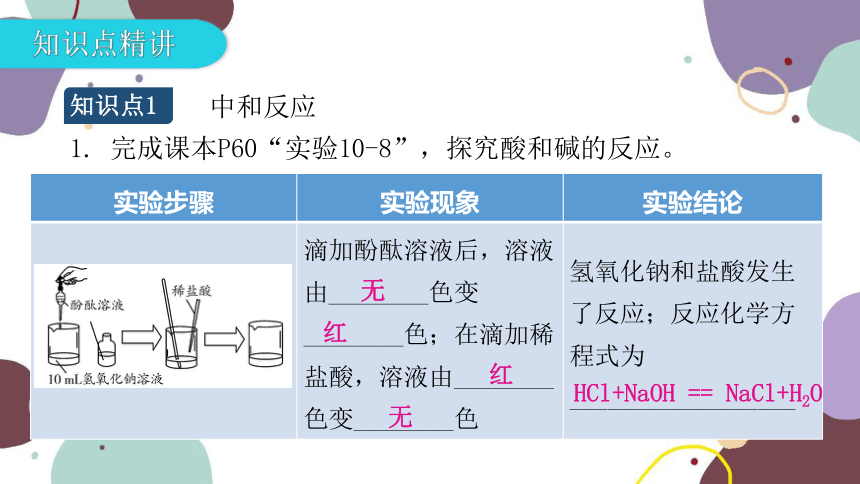
知识点1
中和反应
实验步骤 实验现象 实验结论
滴加酚酞溶液后,溶液由________色变________色;在滴加稀盐酸,溶液由________色变________色 氢氧化钠和盐酸发生了反应;反应化学方程式为__________________
1. 完成课本P60“实验10-8”,探究酸和碱的反应。
无
红
红
无
HCl+NaOH == NaCl+H2O
2. 观察课本P60“图10-14氢氧化钠和盐酸反应示意图”,由图可知,氢氧化钠和盐酸反应的实质是酸中的________与碱中的________结合生成________的过程。(填化学符号)
3. 阅读课本P60、P61,可以发现酸和碱反应生成的的物质(水除外)都是由___________和_____________构成的,我们把这类化合物叫做________。
H+
OH-
H2O
金属离子
酸根离子
盐
【拓展】由铵根离子(NH4+)与酸根离子构成的化合物也是盐,如NH4Cl、NH4NO3等。
【小结】________和________作用生成________和_______的反应,叫做中和反应。
酸
碱
盐
水
课堂练习
1. 下列物质属于盐的是( )
A. CuO B. Ba(OH)2 C. FeSO4 D. HCl
2. 下列反应属于中和反应的是( )
A. Zn+2HCl == ZnCl2+2H2↑
B. Cu(OH)2+H2SO4 == CuSO4+2H2O
C. CuSO4+Fe == FeSO4+Cu
D. CO2+Ca(OH)2 == CaCO3↓+H2O
C
B
3. 下列化学反应属于中和反应的是( )
A. 盐酸与氧化镁
B. 硫酸与锌
C. 氢氧化钠与二氧化碳
D. 氢氧化钡与稀硫酸
D
知识点2
中和反应的应用
1. 调节土壤的酸碱性:如通常利用________改良酸性土壤。
2. 处理工厂的废水:工厂生产过程中的污水,需进行一系列的处理。例如:硫酸厂的污水中含有硫酸等物质,可以用________进行中和处理。
3. 用于医药:人的胃液里含有适量________,可以帮助消化。胃酸过多的病人可以遵医嘱服用某些含氢氧化铝的药物中和过多胃酸,反应的化学方程式为_____________________________。
熟石灰
熟石灰
盐酸
Al(OH)3+3HCl == AlCl3+3H2O
课堂练习
4. 山药中含有碱性皂角素,有的人沾到皮肤上可能会奇痒,可用厨房中________来止痒。
5. 饮食过量,胃酸会大量分泌,以致消化不良。为缓解该症状,下列药剂不适宜的是( )
A. 氢氧化铝 B.氯化钠
C.氢氧化镁 D.碳酸氢钠
食醋
B
思路点拨
医疗上用难溶性的碱来中和胃酸过多。
课堂检测
1. 下列反应属于中和反应的是( )
A. Na2CO3+2HCl == 2NaCl+H2O+CO2↑
B. 2NaOH+H2SO4 == Na2SO4+2H2O
C. CO2+2NaOH == Na2CO3+H2O
D. 2HCl+CuO == CuCl2+H2O
B
2. 下列实际应用中,利用了中和反应的是( )
①用稀硫酸除铁锈②用熟石灰改良酸性土壤③用碳酸氢钠治疗胃酸过多④用氢氧化钠溶液洗去石油产品中的残余硫酸⑤用稀氨水涂抹在蚊子叮咬处(分泌出蚁酸)止痒
A. ②④⑤
B. ②③⑤
C. ①②④
D. ②③④⑤
A
3. 物质X可发生“X + 酸 → 盐 + H2O”的反应,则X可能是 ( )
A. Fe B. CO2 C. H2SO4 D. NaOH
4. 下列反应没有明显现象的是( )
A. 氧化铁与稀盐酸反应
B. 稀盐酸与澄清石灰水反应
C. 氧化钙与水反应
D. 铝丝与硝酸银溶液反应
D
B
5. 将一定量的氢氧化钠溶液与稀盐酸混合,二者恰好完全反应的微观示意图如图10-2-1所示。下列说法不正确的是( )
A. 反应前后阴、阳离子的总数目不变
B. 反应前后溶液的总质量不变
C. 反应后溶液呈中性
D. 反应前后元素种类不变
A
6. 下列物质在生产、生活中有广泛用途,请按以下要求填空(填序号):
①氢氧化铝②稀盐酸③熟石灰④浓硫酸⑤烧碱
(1)可用于治疗胃酸过多的是________。
(2)可用作氨气干燥剂的物质是________。
(3)可用于干燥CO2的物质是________。
(4)炉具清洗剂中含有的物质是________。
(5)农业上用来降低土壤酸性,改良土壤结构的是________。
①
⑤
④
⑤
③
7. 根据图10-2-2回答下列问题:
(1)在烧杯中加入5 mL的氢氧化钠溶液,滴入几滴酚酞溶液,此时溶液呈________色。
(2)加入稀盐酸至过量能观察到的现象是__________________,写出该反应的化学方程式:____________________________。
红
溶液由红色变为无色
NaOH+HCl == H2O+NaCl
(3)反应中,数目减少的离子是___________(填离子符号)。
(4)验证反应后溶液中稀盐酸有剩余,下列操作可行的是________(多选)。
A. 取样,加入CuO粉末
B. 取样,滴加Fe铁粉
C. 取样,加入CaCO3粉末
H+、OH-
ABC
课题2 酸和碱的中和反应
第十单元 酸和碱
课时1 中和反应
目录
01
课程要求
02
课前预习
03
知识点精讲
04
课堂检测
课程要求
了解盐的定义;知道中和反应,认识中和反应在实际中的应用。
课前预习
写出下列物质在水溶液中解离出的阴阳离子,并判断物质是酸、碱、盐中的哪类物质。
物质 硫酸铜 硫酸 盐酸 氯化亚铁 氢氧化钙 硫酸镁 氯化铵
解离离子 ________ ________ ________ ________ ________ ________ ________
类别 ________ ________ ________ ________ ________ ________ ________
Cu2+、SO42-
盐
H+、SO42-
酸
H+、Cl-
酸
Fe2+、Cl-
盐
Ca2+、OH-
碱
Mg2+、SO42-
盐
NH4+、Cl-
盐
知识点精讲
知识点1
中和反应
实验步骤 实验现象 实验结论
滴加酚酞溶液后,溶液由________色变________色;在滴加稀盐酸,溶液由________色变________色 氢氧化钠和盐酸发生了反应;反应化学方程式为__________________
1. 完成课本P60“实验10-8”,探究酸和碱的反应。
无
红
红
无
HCl+NaOH == NaCl+H2O
2. 观察课本P60“图10-14氢氧化钠和盐酸反应示意图”,由图可知,氢氧化钠和盐酸反应的实质是酸中的________与碱中的________结合生成________的过程。(填化学符号)
3. 阅读课本P60、P61,可以发现酸和碱反应生成的的物质(水除外)都是由___________和_____________构成的,我们把这类化合物叫做________。
H+
OH-
H2O
金属离子
酸根离子
盐
【拓展】由铵根离子(NH4+)与酸根离子构成的化合物也是盐,如NH4Cl、NH4NO3等。
【小结】________和________作用生成________和_______的反应,叫做中和反应。
酸
碱
盐
水
课堂练习
1. 下列物质属于盐的是( )
A. CuO B. Ba(OH)2 C. FeSO4 D. HCl
2. 下列反应属于中和反应的是( )
A. Zn+2HCl == ZnCl2+2H2↑
B. Cu(OH)2+H2SO4 == CuSO4+2H2O
C. CuSO4+Fe == FeSO4+Cu
D. CO2+Ca(OH)2 == CaCO3↓+H2O
C
B
3. 下列化学反应属于中和反应的是( )
A. 盐酸与氧化镁
B. 硫酸与锌
C. 氢氧化钠与二氧化碳
D. 氢氧化钡与稀硫酸
D
知识点2
中和反应的应用
1. 调节土壤的酸碱性:如通常利用________改良酸性土壤。
2. 处理工厂的废水:工厂生产过程中的污水,需进行一系列的处理。例如:硫酸厂的污水中含有硫酸等物质,可以用________进行中和处理。
3. 用于医药:人的胃液里含有适量________,可以帮助消化。胃酸过多的病人可以遵医嘱服用某些含氢氧化铝的药物中和过多胃酸,反应的化学方程式为_____________________________。
熟石灰
熟石灰
盐酸
Al(OH)3+3HCl == AlCl3+3H2O
课堂练习
4. 山药中含有碱性皂角素,有的人沾到皮肤上可能会奇痒,可用厨房中________来止痒。
5. 饮食过量,胃酸会大量分泌,以致消化不良。为缓解该症状,下列药剂不适宜的是( )
A. 氢氧化铝 B.氯化钠
C.氢氧化镁 D.碳酸氢钠
食醋
B
思路点拨
医疗上用难溶性的碱来中和胃酸过多。
课堂检测
1. 下列反应属于中和反应的是( )
A. Na2CO3+2HCl == 2NaCl+H2O+CO2↑
B. 2NaOH+H2SO4 == Na2SO4+2H2O
C. CO2+2NaOH == Na2CO3+H2O
D. 2HCl+CuO == CuCl2+H2O
B
2. 下列实际应用中,利用了中和反应的是( )
①用稀硫酸除铁锈②用熟石灰改良酸性土壤③用碳酸氢钠治疗胃酸过多④用氢氧化钠溶液洗去石油产品中的残余硫酸⑤用稀氨水涂抹在蚊子叮咬处(分泌出蚁酸)止痒
A. ②④⑤
B. ②③⑤
C. ①②④
D. ②③④⑤
A
3. 物质X可发生“X + 酸 → 盐 + H2O”的反应,则X可能是 ( )
A. Fe B. CO2 C. H2SO4 D. NaOH
4. 下列反应没有明显现象的是( )
A. 氧化铁与稀盐酸反应
B. 稀盐酸与澄清石灰水反应
C. 氧化钙与水反应
D. 铝丝与硝酸银溶液反应
D
B
5. 将一定量的氢氧化钠溶液与稀盐酸混合,二者恰好完全反应的微观示意图如图10-2-1所示。下列说法不正确的是( )
A. 反应前后阴、阳离子的总数目不变
B. 反应前后溶液的总质量不变
C. 反应后溶液呈中性
D. 反应前后元素种类不变
A
6. 下列物质在生产、生活中有广泛用途,请按以下要求填空(填序号):
①氢氧化铝②稀盐酸③熟石灰④浓硫酸⑤烧碱
(1)可用于治疗胃酸过多的是________。
(2)可用作氨气干燥剂的物质是________。
(3)可用于干燥CO2的物质是________。
(4)炉具清洗剂中含有的物质是________。
(5)农业上用来降低土壤酸性,改良土壤结构的是________。
①
⑤
④
⑤
③
7. 根据图10-2-2回答下列问题:
(1)在烧杯中加入5 mL的氢氧化钠溶液,滴入几滴酚酞溶液,此时溶液呈________色。
(2)加入稀盐酸至过量能观察到的现象是__________________,写出该反应的化学方程式:____________________________。
红
溶液由红色变为无色
NaOH+HCl == H2O+NaCl
(3)反应中,数目减少的离子是___________(填离子符号)。
(4)验证反应后溶液中稀盐酸有剩余,下列操作可行的是________(多选)。
A. 取样,加入CuO粉末
B. 取样,滴加Fe铁粉
C. 取样,加入CaCO3粉末
H+、OH-
ABC
同课章节目录
