物理人教版(2019)选择性必修第三册4.4氢原子光谱和波尔的原子模型(共26张ppt)
文档属性
| 名称 | 物理人教版(2019)选择性必修第三册4.4氢原子光谱和波尔的原子模型(共26张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 物理 | ||
| 更新时间 | 2022-05-26 19:52:57 | ||
图片预览






文档简介
(共26张PPT)
横县百合完全中学
韦衍虎
18276143537
4.4 氢原子光谱和波尔的原子模型
问题导入
把食盐放在火中灼烧,会发出黄色的光。食盐为什么发黄光而不发其他颜色的光呢
α粒子散射的实验使我们知道原子具有核式结构,但电子在原子核的周围怎样运动 这些还要通过其他事实才能认识。
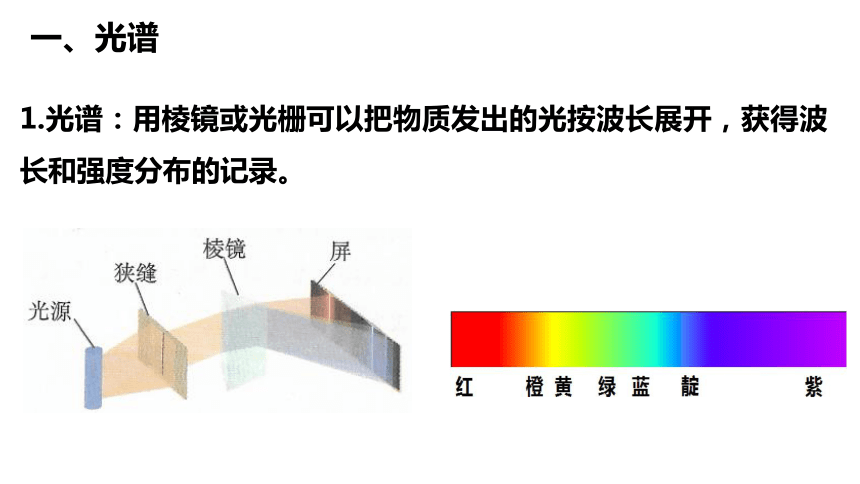
一、光谱
1.光谱:用棱镜或光栅可以把物质发出的光按波长展开,获得波长和强度分布的记录。
2.光谱的分类
②线状谱:光谱是一条条分立的亮线。
①连续谱:光谱是连在一起的光带。
(气体)
3.特征谱线:
每种原子只能发出具有本身特征的某些频率的光
4.光谱分析:
鉴别物质和确定物质的组成成分,发现新元素
含量达到10-13kg就可以检测
越王剑
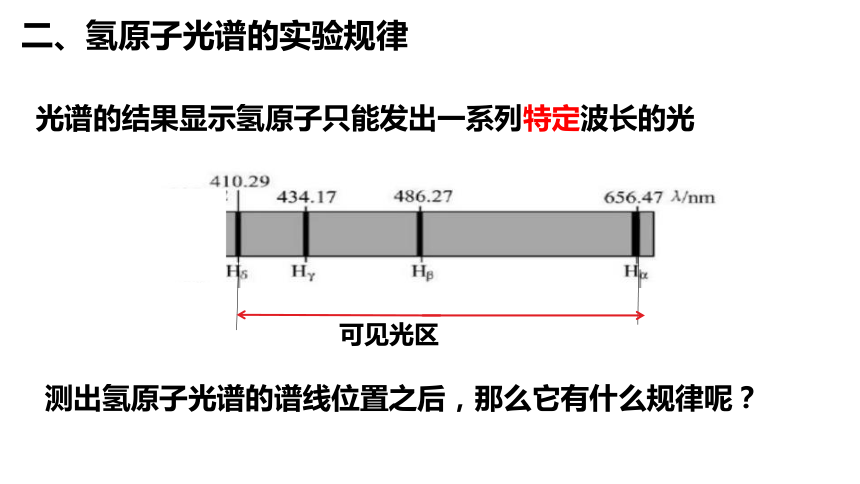
二、氢原子光谱的实验规律
光谱的结果显示氢原子只能发出一系列特定波长的光
可见光区
测出氢原子光谱的谱线位置之后,那么它有什么规律呢?
巴尔末
可见光区谱线规律——巴尔末公式
n=3、4、5...
里德伯常量:
②n只能取正整数3,4,5…,不能取连续值,反映了氢原子光谱波长的分立特征(线状谱)。
n的两层含义:
①每一个n值分别对应一条谱线。
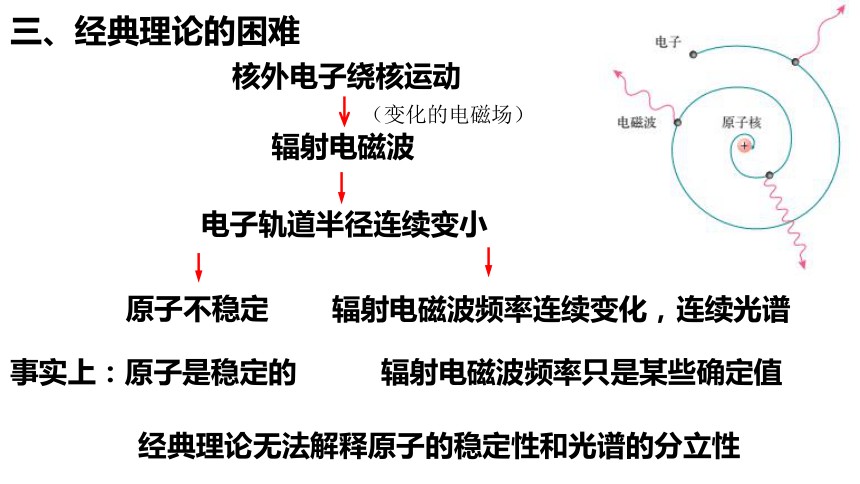
三、经典理论的困难
核外电子绕核运动
辐射电磁波
电子轨道半径连续变小
原子不稳定
辐射电磁波频率连续变化,连续光谱
事实上:原子是稳定的
辐射电磁波频率只是某些确定值
经典理论无法解释原子的稳定性和光谱的分立性
(变化的电磁场)
四、波尔原子理论的基本假设
1.轨道量子化
②电子在轨道绕核转动是稳定的,不产生电磁辐射
轨道量子化:
+
rn
v
n=1
n=2
n=3
-
①绕核运动的电子轨道半径只能是某些分立的数值
氢原子:
rn=n2r1,n=1、2、3
r1=0.053nm
2.定态(能量量子化)
当电子在不同的轨道上运动时,原子处于不同的状态,于是就具有不同的能量。
①能级:各轨道上量子化的能量
②定态:原子中具有确定能量的稳定状态
基态:能量最低的状态(离核最近)
激发态:其他的能量状态
氢原子:E1=-13.6eV
n=1、2、3
n=1
n=2
n=3
E3
E1
E2
基
激
激
3.频率条件
原子系统的变化只能是从一个稳定态,完全跃迁到另一个稳定态。
低能级(Em)
电子吸收光子克服库仑引力做功,原子能量增加
高能级(En)
电子辐射光子,原子能量减少
hv=En-Em
(n>m)
1.验证巴尔末公式
五、玻尔理论对氢光谱的解释
根据波尔理论,氢原子核外只有一个电子,它绕原子核做圆周运动,轨道半径和能量都是分立的。
+
v
-
hv=E3-E2
因此,巴耳末公式代表的应该是电子从量子数分别为 n= 3,4,5,…的能级向量子数为2的能级跃迁时发出的光谱线。
2.用图表示氢原子各能极
-----------------
1
2
3
4
5
-13.6
-3.4
-1.51
-0.85
-0.54
0
n
E/eV
∞
n ∞:电子脱离核束缚
赖曼系
巴尔末系
帕邢系
布喇开系
波尔理论也能很好地解释甚至语言氢原子的其他谱系线。
3.解释气体导电发光与特征谱线
气体放电管中的原子受到高速运动的电子的撞击,发生跃迁到激发态,放出光子,最终回到基态。
能级分立
→能量分立
→分立的亮线
各种气体原子的能级不同,跃迁时发射光子的能量各异。
→特征谱线
六、波尔理论的局限性
玻尔理论成功的解释并预言了氢原子辐射的电磁波的问题,但是也有它的局限性。
②无法解释谱线的强度
①复杂一点的原子,就无法解释它的光谱现象
波尔
原因:
保留了静电粒子的观念,仍然把电子的运动看做经典力学描述小的轨道运动。
修正波尔理论
必须彻底放弃经典概念,用电子云概念取代经典的轨道概念
→建立量子力学
汤姆孙发现电子
汤姆孙的西瓜模型
α 粒子散射实验
卢瑟福的核式结构模型
原子不可割
汤姆孙的西瓜模型
原子稳定性事实氢光谱实验
卢瑟福的核式结构模型
矛盾
玻尔模型
复杂(氦)原子光谱
量子力学理论
矛盾
矛盾
否 定
建 立
否 定
建 立
否 定
建 立
玻尔模型
否 定
建 立
修正
修正
科学漫步
光谱分析
由基尔霍夫开创的光谱分析方法对鉴别化学元素有着巨大的意义。许多化学元素,像艳、物、铊、铜、镓,都是在实验室里通过光语分析发现的。
光谱分析还为深入原子世界打开了道路。近代原子物理学正是从原子光谱的研究中开始的。
课堂练习
例1:关于原子光谱,下列说法正确的是( )
A.原子光谱是不连续的
B.由于原子都是由原子核和电子组成的,所以各种原子的原子光谱是相同的
C.各种原子的原子结构不同,所以各种原子的原子光谱也不相同
D.分析物质发光的光谱,可以鉴别物质中含有那些元素
ACD
课堂练习
例2:关于波尔理论,下列说法正确的是( )
A.原子的不同定态对应于电子沿不同的圆形轨道绕核运动
B.当原子处于激发态时,原子向外辐射能量
C.只有当原子处于基态时,原子才不向外辐射能量
D.不论当原子处于何种定态,原子都不向外辐射能量
AD
课堂练习
例3:如图所示为氢原子能级图。大量处于n=4能级的氢原子向低能级跃迁时发出不同频率的光。用这些光照射金属钙。已知金属钙的逸出功为3.20 eV。能够从金属钙的表面照射出光电子的光共有( )
A.2种 B.3种 C.4种 D.5种
B
课堂练习
例4:如果大量氢原子处在n=3的能级,会辐射出几种频率的光 其中波长最短的光是在哪两个能之间跃迁时发出的
能辐射3种频率的光。波长最短的光是从n=3的能级跃迁到n=1的能级时发出的光。
解:
课堂小结
一、光谱
1.光谱:用棱镜或光栅可以把物质发出的光按波长展开,获得波长和强度分布的记录。
2.光谱的分类
②线状谱:光谱是一条条分立的亮线。
①连续谱:光谱是连在一起的光带。
3.特征谱线:
每种原子只能发出具有本身特征的某些频率的光
4.光谱分析:
鉴别物质和确定物质的组成成分,发现新元素
二、氢原子光谱的实验规律
可见光区谱线规律——巴尔末公式
n=3、4、5...
三、经典理论的困难
经典理论无法解释原子的稳定性和光谱的分立性
四、波尔原子理论的基本假设
1.轨道量子化
②电子在轨道绕核转动是稳定的,不产生电磁辐射
①绕核运动的电子轨道半径只能是某些分立的数值
rn=n2r1,n=1、2、3
2.定态(能量量子化)
基态:能量最低的状态(离核最近)
激发态:其他的能量状态
E1=-13.6eV
n=1、2、3
3.频率条件
hv=En-Em
(n>m)
五、玻尔理论对氢光谱的解释
1.验证巴尔末公式
2.用图表示氢原子各能极
3.解释气体导电发光与特征谱线
六、波尔理论的局限性
无法解释复杂原子的光谱,原因是没有抛弃经典理论
横县百合完全中学
韦衍虎
18276143537
4.4 氢原子光谱和波尔的原子模型
问题导入
把食盐放在火中灼烧,会发出黄色的光。食盐为什么发黄光而不发其他颜色的光呢
α粒子散射的实验使我们知道原子具有核式结构,但电子在原子核的周围怎样运动 这些还要通过其他事实才能认识。
一、光谱
1.光谱:用棱镜或光栅可以把物质发出的光按波长展开,获得波长和强度分布的记录。
2.光谱的分类
②线状谱:光谱是一条条分立的亮线。
①连续谱:光谱是连在一起的光带。
(气体)
3.特征谱线:
每种原子只能发出具有本身特征的某些频率的光
4.光谱分析:
鉴别物质和确定物质的组成成分,发现新元素
含量达到10-13kg就可以检测
越王剑
二、氢原子光谱的实验规律
光谱的结果显示氢原子只能发出一系列特定波长的光
可见光区
测出氢原子光谱的谱线位置之后,那么它有什么规律呢?
巴尔末
可见光区谱线规律——巴尔末公式
n=3、4、5...
里德伯常量:
②n只能取正整数3,4,5…,不能取连续值,反映了氢原子光谱波长的分立特征(线状谱)。
n的两层含义:
①每一个n值分别对应一条谱线。
三、经典理论的困难
核外电子绕核运动
辐射电磁波
电子轨道半径连续变小
原子不稳定
辐射电磁波频率连续变化,连续光谱
事实上:原子是稳定的
辐射电磁波频率只是某些确定值
经典理论无法解释原子的稳定性和光谱的分立性
(变化的电磁场)
四、波尔原子理论的基本假设
1.轨道量子化
②电子在轨道绕核转动是稳定的,不产生电磁辐射
轨道量子化:
+
rn
v
n=1
n=2
n=3
-
①绕核运动的电子轨道半径只能是某些分立的数值
氢原子:
rn=n2r1,n=1、2、3
r1=0.053nm
2.定态(能量量子化)
当电子在不同的轨道上运动时,原子处于不同的状态,于是就具有不同的能量。
①能级:各轨道上量子化的能量
②定态:原子中具有确定能量的稳定状态
基态:能量最低的状态(离核最近)
激发态:其他的能量状态
氢原子:E1=-13.6eV
n=1、2、3
n=1
n=2
n=3
E3
E1
E2
基
激
激
3.频率条件
原子系统的变化只能是从一个稳定态,完全跃迁到另一个稳定态。
低能级(Em)
电子吸收光子克服库仑引力做功,原子能量增加
高能级(En)
电子辐射光子,原子能量减少
hv=En-Em
(n>m)
1.验证巴尔末公式
五、玻尔理论对氢光谱的解释
根据波尔理论,氢原子核外只有一个电子,它绕原子核做圆周运动,轨道半径和能量都是分立的。
+
v
-
hv=E3-E2
因此,巴耳末公式代表的应该是电子从量子数分别为 n= 3,4,5,…的能级向量子数为2的能级跃迁时发出的光谱线。
2.用图表示氢原子各能极
-----------------
1
2
3
4
5
-13.6
-3.4
-1.51
-0.85
-0.54
0
n
E/eV
∞
n ∞:电子脱离核束缚
赖曼系
巴尔末系
帕邢系
布喇开系
波尔理论也能很好地解释甚至语言氢原子的其他谱系线。
3.解释气体导电发光与特征谱线
气体放电管中的原子受到高速运动的电子的撞击,发生跃迁到激发态,放出光子,最终回到基态。
能级分立
→能量分立
→分立的亮线
各种气体原子的能级不同,跃迁时发射光子的能量各异。
→特征谱线
六、波尔理论的局限性
玻尔理论成功的解释并预言了氢原子辐射的电磁波的问题,但是也有它的局限性。
②无法解释谱线的强度
①复杂一点的原子,就无法解释它的光谱现象
波尔
原因:
保留了静电粒子的观念,仍然把电子的运动看做经典力学描述小的轨道运动。
修正波尔理论
必须彻底放弃经典概念,用电子云概念取代经典的轨道概念
→建立量子力学
汤姆孙发现电子
汤姆孙的西瓜模型
α 粒子散射实验
卢瑟福的核式结构模型
原子不可割
汤姆孙的西瓜模型
原子稳定性事实氢光谱实验
卢瑟福的核式结构模型
矛盾
玻尔模型
复杂(氦)原子光谱
量子力学理论
矛盾
矛盾
否 定
建 立
否 定
建 立
否 定
建 立
玻尔模型
否 定
建 立
修正
修正
科学漫步
光谱分析
由基尔霍夫开创的光谱分析方法对鉴别化学元素有着巨大的意义。许多化学元素,像艳、物、铊、铜、镓,都是在实验室里通过光语分析发现的。
光谱分析还为深入原子世界打开了道路。近代原子物理学正是从原子光谱的研究中开始的。
课堂练习
例1:关于原子光谱,下列说法正确的是( )
A.原子光谱是不连续的
B.由于原子都是由原子核和电子组成的,所以各种原子的原子光谱是相同的
C.各种原子的原子结构不同,所以各种原子的原子光谱也不相同
D.分析物质发光的光谱,可以鉴别物质中含有那些元素
ACD
课堂练习
例2:关于波尔理论,下列说法正确的是( )
A.原子的不同定态对应于电子沿不同的圆形轨道绕核运动
B.当原子处于激发态时,原子向外辐射能量
C.只有当原子处于基态时,原子才不向外辐射能量
D.不论当原子处于何种定态,原子都不向外辐射能量
AD
课堂练习
例3:如图所示为氢原子能级图。大量处于n=4能级的氢原子向低能级跃迁时发出不同频率的光。用这些光照射金属钙。已知金属钙的逸出功为3.20 eV。能够从金属钙的表面照射出光电子的光共有( )
A.2种 B.3种 C.4种 D.5种
B
课堂练习
例4:如果大量氢原子处在n=3的能级,会辐射出几种频率的光 其中波长最短的光是在哪两个能之间跃迁时发出的
能辐射3种频率的光。波长最短的光是从n=3的能级跃迁到n=1的能级时发出的光。
解:
课堂小结
一、光谱
1.光谱:用棱镜或光栅可以把物质发出的光按波长展开,获得波长和强度分布的记录。
2.光谱的分类
②线状谱:光谱是一条条分立的亮线。
①连续谱:光谱是连在一起的光带。
3.特征谱线:
每种原子只能发出具有本身特征的某些频率的光
4.光谱分析:
鉴别物质和确定物质的组成成分,发现新元素
二、氢原子光谱的实验规律
可见光区谱线规律——巴尔末公式
n=3、4、5...
三、经典理论的困难
经典理论无法解释原子的稳定性和光谱的分立性
四、波尔原子理论的基本假设
1.轨道量子化
②电子在轨道绕核转动是稳定的,不产生电磁辐射
①绕核运动的电子轨道半径只能是某些分立的数值
rn=n2r1,n=1、2、3
2.定态(能量量子化)
基态:能量最低的状态(离核最近)
激发态:其他的能量状态
E1=-13.6eV
n=1、2、3
3.频率条件
hv=En-Em
(n>m)
五、玻尔理论对氢光谱的解释
1.验证巴尔末公式
2.用图表示氢原子各能极
3.解释气体导电发光与特征谱线
六、波尔理论的局限性
无法解释复杂原子的光谱,原因是没有抛弃经典理论
同课章节目录
- 第一章 分子动理论
- 1 分子动理论的基本内容
- 2 实验:用油膜法估测油酸分子的大小
- 3 分子运动速率分布规律
- 4 分子动能和分子势能
- 第二章 气体、固体和液体
- 1 温度和温标
- 2 气体的等温变化
- 3 气体的等压变化和等容变化
- 4 固体
- 5 液体
- 第三章 热力学定律
- 1 功、热和内能的改变
- 2 热力学第一定律
- 3 能量守恒定律
- 4 热力学第二定律
- 第四章 原子结构和波粒二象性
- 1 普朗克黑体辐射理论
- 2 光电效应
- 3 原子的核式结构模型
- 4 氢原子光谱和玻尔的原子模型
- 5 粒子的波动性和量子力学的建立
- 第五章 原子核
- 1 原子核的组成
- 2 放射性元素的衰变
- 3 核力与结合能
- 4 核裂变与核聚变
- 5 “基本”粒子
