第六章实验活动7:化学反应速率的影响因素课件2021-2022学年高一下学期化学人教版(2019)必修第二册(26张ppt)
文档属性
| 名称 | 第六章实验活动7:化学反应速率的影响因素课件2021-2022学年高一下学期化学人教版(2019)必修第二册(26张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 415.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-29 11:00:25 | ||
图片预览







文档简介
(共26张PPT)
高一—人教版—化学—必修第二册—第六章
整理与提升 实验活动7
——化学反应速率的影响因素
基础知识回顾
一、学习目标
二、学习重点
1.理解控制变量进行对比实验设计
2.处理实验数据并分析实验结果
1.理解浓度、温度、催化剂对化学反应速率的影响
2.理解改变反应条件可以调控化学反应速率
基础知识回顾
一、两个重要的化学反应
二、影响化学反应速率的因素
内因:反应物的化学性质
外因:反应温度、反应物浓度、催化剂......
+ 2H+ = SO2↑+ S↓+H2O
2H2O2 O2↑+2H2O
催化剂
实验活动的目的
探究浓度、温度、催化剂对化学反应速率的影响
研究对象 浓度 温度 催化剂
实验用品
烧杯、量筒、试管、恒温槽、胶头滴管、温度计、秒表。
0.1mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液、3%H2O2溶液、1mol/LFeCl3溶液、MnO2粉末、蒸馏水。
+2H+= SO2↑+S↓+H2O √ √
2H2O2 O2↑+2H2O √
催化剂
实验原理
原理2.
氧气不溶于水,在溶液中产生气泡;
催化剂能影响反应速率;
比较溶液中氧气产生的快慢分析反应速率。
原理1. +2H+= SO2↑+S↓+H2O
硫不溶于水,使溶液出现乳白色浑浊;
的浓度及反应温度都影响反应速率;
比较溶液中出现浑浊现象的时间,判断反应速率。
2H2O2 O2↑+2H2O
催化剂
实验设计
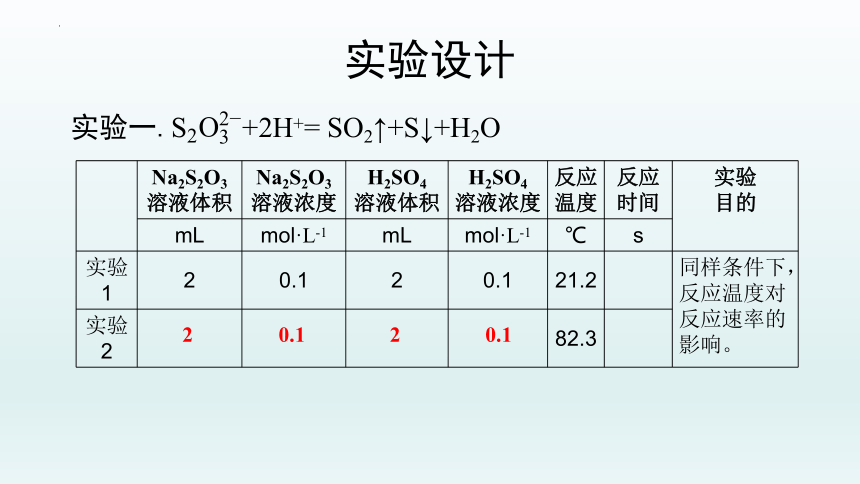
实验一. +2H+= SO2↑+S↓+H2O
实验的目的:反应温度对硫生成速率的影响
实验自变量: ;
实验因变量: ;
实验固定量:
;
实验观测量: 。
反应温度
反应速率
Na2S2O3溶液的浓度和溶液体积;
硫酸的浓度和硫酸溶液的体积
溶液中出现乳白色浑浊所需要的时间
实验设计
实验一.+2H+= SO2↑+S↓+H2O
Na2S2O3 溶液体积 Na2S2O3 溶液浓度 H2SO4 溶液体积 H2SO4 溶液浓度 反应温度 反应 时间 实验
目的
mL mol·L-1 mL mol·L-1 ℃ s
实验 1 2 0.1 2 0.1 21.2 同样条件下,反应温度对反应速率的影响。
实验 2 82.3
2 0.1 2 0.1
实验结论
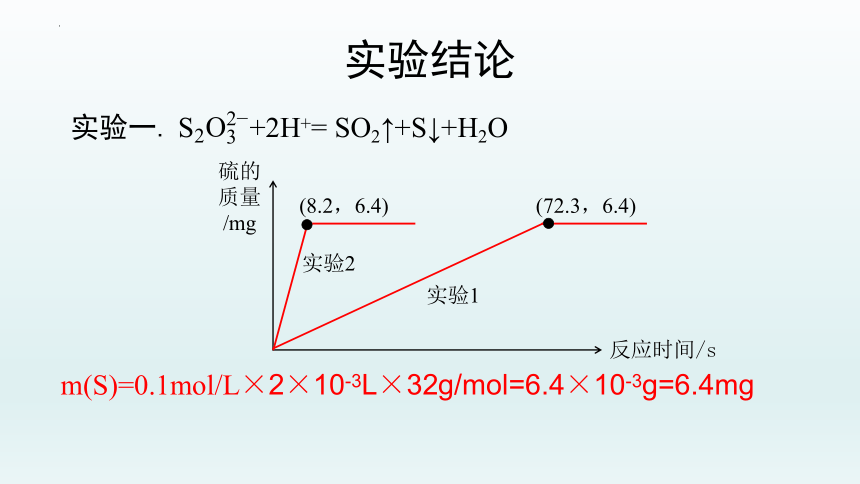
实验一. +2H+= SO2↑+S↓+H2O
反应时间/s
硫的
质量
/mg
m(S)=0.1mol/L×2×10-3L×32g/mol=6.4×10-3g=6.4mg
(8.2,6.4)
(72.3,6.4)
实验1
实验2
实验设计
实验二.+2H+= SO2↑+S↓+H2O
实验的目的:的浓度对硫生成速率的影响
实验自变量:的反应浓度(改变用量实现)
实验因变量:反应速率
实验固定量: ;
;
。
实验观测量: 。
Na2S2O3的浓度(试剂浓度:0.1mol/L)
反应温度(25℃)
硫酸的浓度和硫酸溶液的体积
溶液中出现乳白色浑浊所需要的时间
实验设计
实验二.+2H+= SO2↑+S↓+H2O
实验编号 Na2S2O3 溶液体积 Na2S2O3 溶液浓度 H2SO4 溶液体积 H2SO4 溶液浓度 加水体积 反应温度 反应时间 实验
目的
mL mol·L-1 mL mol·L-1 mL ℃ s 同样条件下,反应物浓度对反应速率的影响。
实验3 2 0.1 2 0.1 0 25
实验4 1 0.1 25
c()实验3==0.05mol·L-1
混合溶液体积≈2+2+0=4mL
c()实验4==0.025mol·L-1
混合溶液体积≈1+2+1=4mL
2 0.1 1
实验结论
实验二.+2H+= SO2↑+S↓+H2O
反应时间/s
硫的
质量
/mg
m(S)实验3=6.4mg m(S)实验4=3.2mg
(58.1,6.4)
(167.2,3.2)
实验4
实验3
实验设计
实验的目的:催化剂对生成氧气速率的影响
实验自变量:催化剂种类
实验因变量:反应速率
实验固定量:
;
实验观测量:
。
H2O2溶液的浓度和溶液体积
反应温度,试管规格等
产生等量的氧气所需要的时间
(本实验定性观察:观察气泡快慢)
实验三.2H2O2 O2↑+2H2O
催化剂
实验设计
H2O2 溶液体积 H2O2 溶液浓度 反应温度 催化 剂 催化剂 用量 定性观察 实验现象 实验
目的
mL 质量百分数 ℃ 种类 用量
实验 5 2 3% 25 无 无 同样条件下,催化剂对反应速率的影响。
实验 6 2 3% 25 MnO2粉末 少量
实验 7 2 3% 25 FeCl3 溶液 2滴
实验三.2H2O2 O2↑+2H2O
催化剂
实验结果
几乎看不到气泡
产生大量
气泡
产生大量
气泡
H2O2 溶液体积 H2O2 溶液浓度 反应温度 催化 剂 催化剂 用量 定性观察 实验现象 实验
目的
mL 质量百分数 ℃ 种类 用量
实验 5 2 3% 25 无 无 同样条件下,催化剂对反应速率的影响。
实验 6 2 3% 25 MnO2粉末 少量
实验 7 2 3% 25 FeCl3 溶液 2滴
实验三.2H2O2 O2↑+2H2O
催化剂
实验思考
实验改进.2H2O2 O2↑+2H2O
催化剂
请思考,计算a、b值
H2O2 溶液体积 H2O2 溶液浓度 反应温度 催化 剂 催化剂 用量 水 反应时间 实验
目的
mL 质量百分数 ℃ 种类 mL mL s
实验 8 2 10% 25 CuCl2 2 mol/L a b 同条件下催化剂对反应速率的影响。
实验 9 2 10% 25 FeCl3 1 mol/L 2 0
试剂混合后溶液总体积相同(mL):2+a+b=2+2=4
催化剂Cu2+和Fe3+浓度相同
a=1
b=1
实验总结
影响化学反应速率的因素分析
影响因素 反应温度 反应物浓度 催化剂 反应物接触面积 气体压强
一般规律
典型案例 将食物置于冰箱保存。 硫在空气和纯氧中加热反应分别是淡蓝色和蓝紫色火焰。 工业上用V2O5做催化剂用SO2和O2合成SO3。 工业上通常将固体物料粉碎后再进行反应。 工业上采用高压用氮气和氢气合成氨气。
升高温度, 速率加快; 降低温度, 速率降低。 增加浓度,速率加快; 减少浓度,速率降低。 使用催化剂, 加快反应速率。 增加反应物接触面积,提高反应速率。 增加气体反应物的气压,速率加快。
例题分析
例题1.【教材P54-7】某同学用相同质量锌粉先后与1mol·L-1盐酸及相同体积浓度为c=a mol·L-1的盐酸(足量)反应,记录相关数据,并做出两个反应过程中放出气体的体积随反应时间的变化图(如右下图)
(1)如何测量反应放出气体的体积
(2)分析实验图,得出a 1
(填“>”,“<”或“=”) 。
(3)若用1mol·L-1的硫酸代替1mol·L-1盐酸,
反应速率如何改变?
V(H2)
/cm3
t/min
0
1mol·L-1
a mol·L-1
例题分析
例题1.【教材P54-7】
(1)如何测量反应放出气体的体积
如右图装置
(2)分析实验图,得出a 1
锌粉质量相同,盐酸过量
(3)若用1mol·L-1的硫酸代替1mol·L-1盐酸,
反应速率加大。
1mol·L-1硫酸,c(H+)=2mol·L-1
1mol·L-1盐酸,c(H+)=1mol·L-1
>
例题分析
例题2.用粉末状CaCO3和稀盐酸反应制取CO2,如图
(1) 段化学反应速率最快,
段收集CO2气体最多。
(2)为减缓上述反应速率,欲向溶液
中加入下列物质,可行的是 。
A.水 B.NaCl固体
C.氯化钠溶液 D.浓盐酸
(3)除(2)外,列举减缓反应速率的方法
。
V(CO2)/cm3
t/min
0
t1
t2
A
B
C
t3
例题分析
例题2.用粉末状CaCO3和稀盐酸反应制取CO2,如图
(1) AB 段化学反应速率最快,
BC 段收集CO2气体最多。
(2)为减缓上述反应速率,欲向溶液
中加入下列物质,可行的是AC 。
A.水 B.NaCl固体
C.氯化钠溶液 D.浓盐酸
(3)除(2)外,列举减缓反应速率的方法
降低反应温度、将粉末状碳酸钙换成块状...... 。
V(CO2)/cm3
t/min
0
t1
t2
A
B
C
t3
难点和问题
(一)难点:控制变量对比实验分析影响化学反应速率的因素
(二)问题:
1.铁和水反应的条件
干燥剂
还原铁粉
水
1.通常条件下,铁和冷水或热水
都不反应。
2.红热的铁和水蒸气可以反应,
生成Fe3O4和H2。
3.说明温度对化学反应的影响比
较显著。
4. 3Fe+4H2O(g) Fe3O4+4H2(g)
高温
把除去氧化膜的镁条投入到盛有稀
盐酸的试管中,发现产生氢气的速率
变化如右图。
(1)t1~t2速率变化的主要原因是
(2)t2~t3速率变化的主要原因是
(H2)/cm3·s-1
t/s
0
t1
t2
t3
1
2
难点和问题
(二)问题:
2.化学反应速率的多因素影响。
(一)难点:控制变量对比实验分析影响化学反应速率的因素
把除去氧化膜的镁条投入到盛有稀
盐酸的试管中,发现产生氢气的速率
变化如右图。
(1)t1~t2速率变化的主要原因是
镁和硫酸反应放热,溶液温度升高。
(2)t2~t3速率变化的主要原因是
氢离子浓度下降,反应速率下降。
(H2)/cm3·s-1
t/s
0
t1
t2
t3
1
2
难点和问题
(二)问题:
2.化学反应速率的多因素影响。
(一)难点:控制变量对比实验分析影响化学反应速率的因素
难点和问题
(二)问题:
3.Na2S2O3溶液和硫酸反应“操作和计时”的关键操作。
恒温槽
恒温槽
1.两支相同试管中加入2mL
硫代硫酸钠溶液和硫酸溶液。
2.置于恒温槽中至温度相同。
3.将硫酸溶液快速倒入硫代硫
酸钠溶液中,并用秒表计时。
4.出现浑浊现象,停止计时。
Na2S2O3
溶液
H2SO4
溶液
混合
(一)难点:控制变量对比实验分析影响化学反应速率的因素
难点和问题
(二)问题:
4.混合溶液出现“浑浊现象”的标志和判断。
恒温槽
恒温槽
1.在盛有硫代硫酸钠溶液
的试管一侧放一个深颜色
的标志物。
2.将等温度的硫酸快速倒入
硫代硫酸钠溶液中。
3.按照如图所示进行观察,
看不到深色标志物时,
停止计时。
4.计算出现浑浊现象的时间。
Na2S2O3
溶液
H2SO4
溶液
混合
眼睛
(一)难点:控制变量对比实验分析影响化学反应速率的因素
难点和问题
(二)问题:
5.过氧化氢溶液分解产生氧气速率测定的关键操作。
10g3%过氧化氢
溶液+少量MnO2
室温恒温槽
1.将反应装置置于恒温水槽中,
使反应及氧气温度等于室温。
2.用带有刻度的注射器收集一定
体积的氧气,氧气压强等于外压。
3.记录收集一定体积的氧气
所用的时间。
4.或者记录一定时间内收集到了
反应条件下氧气的体积。
(一)难点:控制变量对比实验分析影响化学反应速率的因素
高一—人教版—化学—必修第二册—第六章
整理与提升 实验活动7
——化学反应速率的影响因素
基础知识回顾
一、学习目标
二、学习重点
1.理解控制变量进行对比实验设计
2.处理实验数据并分析实验结果
1.理解浓度、温度、催化剂对化学反应速率的影响
2.理解改变反应条件可以调控化学反应速率
基础知识回顾
一、两个重要的化学反应
二、影响化学反应速率的因素
内因:反应物的化学性质
外因:反应温度、反应物浓度、催化剂......
+ 2H+ = SO2↑+ S↓+H2O
2H2O2 O2↑+2H2O
催化剂
实验活动的目的
探究浓度、温度、催化剂对化学反应速率的影响
研究对象 浓度 温度 催化剂
实验用品
烧杯、量筒、试管、恒温槽、胶头滴管、温度计、秒表。
0.1mol/LNa2S2O3溶液、0.1mol/LH2SO4溶液、3%H2O2溶液、1mol/LFeCl3溶液、MnO2粉末、蒸馏水。
+2H+= SO2↑+S↓+H2O √ √
2H2O2 O2↑+2H2O √
催化剂
实验原理
原理2.
氧气不溶于水,在溶液中产生气泡;
催化剂能影响反应速率;
比较溶液中氧气产生的快慢分析反应速率。
原理1. +2H+= SO2↑+S↓+H2O
硫不溶于水,使溶液出现乳白色浑浊;
的浓度及反应温度都影响反应速率;
比较溶液中出现浑浊现象的时间,判断反应速率。
2H2O2 O2↑+2H2O
催化剂
实验设计
实验一. +2H+= SO2↑+S↓+H2O
实验的目的:反应温度对硫生成速率的影响
实验自变量: ;
实验因变量: ;
实验固定量:
;
实验观测量: 。
反应温度
反应速率
Na2S2O3溶液的浓度和溶液体积;
硫酸的浓度和硫酸溶液的体积
溶液中出现乳白色浑浊所需要的时间
实验设计
实验一.+2H+= SO2↑+S↓+H2O
Na2S2O3 溶液体积 Na2S2O3 溶液浓度 H2SO4 溶液体积 H2SO4 溶液浓度 反应温度 反应 时间 实验
目的
mL mol·L-1 mL mol·L-1 ℃ s
实验 1 2 0.1 2 0.1 21.2 同样条件下,反应温度对反应速率的影响。
实验 2 82.3
2 0.1 2 0.1
实验结论
实验一. +2H+= SO2↑+S↓+H2O
反应时间/s
硫的
质量
/mg
m(S)=0.1mol/L×2×10-3L×32g/mol=6.4×10-3g=6.4mg
(8.2,6.4)
(72.3,6.4)
实验1
实验2
实验设计
实验二.+2H+= SO2↑+S↓+H2O
实验的目的:的浓度对硫生成速率的影响
实验自变量:的反应浓度(改变用量实现)
实验因变量:反应速率
实验固定量: ;
;
。
实验观测量: 。
Na2S2O3的浓度(试剂浓度:0.1mol/L)
反应温度(25℃)
硫酸的浓度和硫酸溶液的体积
溶液中出现乳白色浑浊所需要的时间
实验设计
实验二.+2H+= SO2↑+S↓+H2O
实验编号 Na2S2O3 溶液体积 Na2S2O3 溶液浓度 H2SO4 溶液体积 H2SO4 溶液浓度 加水体积 反应温度 反应时间 实验
目的
mL mol·L-1 mL mol·L-1 mL ℃ s 同样条件下,反应物浓度对反应速率的影响。
实验3 2 0.1 2 0.1 0 25
实验4 1 0.1 25
c()实验3==0.05mol·L-1
混合溶液体积≈2+2+0=4mL
c()实验4==0.025mol·L-1
混合溶液体积≈1+2+1=4mL
2 0.1 1
实验结论
实验二.+2H+= SO2↑+S↓+H2O
反应时间/s
硫的
质量
/mg
m(S)实验3=6.4mg m(S)实验4=3.2mg
(58.1,6.4)
(167.2,3.2)
实验4
实验3
实验设计
实验的目的:催化剂对生成氧气速率的影响
实验自变量:催化剂种类
实验因变量:反应速率
实验固定量:
;
实验观测量:
。
H2O2溶液的浓度和溶液体积
反应温度,试管规格等
产生等量的氧气所需要的时间
(本实验定性观察:观察气泡快慢)
实验三.2H2O2 O2↑+2H2O
催化剂
实验设计
H2O2 溶液体积 H2O2 溶液浓度 反应温度 催化 剂 催化剂 用量 定性观察 实验现象 实验
目的
mL 质量百分数 ℃ 种类 用量
实验 5 2 3% 25 无 无 同样条件下,催化剂对反应速率的影响。
实验 6 2 3% 25 MnO2粉末 少量
实验 7 2 3% 25 FeCl3 溶液 2滴
实验三.2H2O2 O2↑+2H2O
催化剂
实验结果
几乎看不到气泡
产生大量
气泡
产生大量
气泡
H2O2 溶液体积 H2O2 溶液浓度 反应温度 催化 剂 催化剂 用量 定性观察 实验现象 实验
目的
mL 质量百分数 ℃ 种类 用量
实验 5 2 3% 25 无 无 同样条件下,催化剂对反应速率的影响。
实验 6 2 3% 25 MnO2粉末 少量
实验 7 2 3% 25 FeCl3 溶液 2滴
实验三.2H2O2 O2↑+2H2O
催化剂
实验思考
实验改进.2H2O2 O2↑+2H2O
催化剂
请思考,计算a、b值
H2O2 溶液体积 H2O2 溶液浓度 反应温度 催化 剂 催化剂 用量 水 反应时间 实验
目的
mL 质量百分数 ℃ 种类 mL mL s
实验 8 2 10% 25 CuCl2 2 mol/L a b 同条件下催化剂对反应速率的影响。
实验 9 2 10% 25 FeCl3 1 mol/L 2 0
试剂混合后溶液总体积相同(mL):2+a+b=2+2=4
催化剂Cu2+和Fe3+浓度相同
a=1
b=1
实验总结
影响化学反应速率的因素分析
影响因素 反应温度 反应物浓度 催化剂 反应物接触面积 气体压强
一般规律
典型案例 将食物置于冰箱保存。 硫在空气和纯氧中加热反应分别是淡蓝色和蓝紫色火焰。 工业上用V2O5做催化剂用SO2和O2合成SO3。 工业上通常将固体物料粉碎后再进行反应。 工业上采用高压用氮气和氢气合成氨气。
升高温度, 速率加快; 降低温度, 速率降低。 增加浓度,速率加快; 减少浓度,速率降低。 使用催化剂, 加快反应速率。 增加反应物接触面积,提高反应速率。 增加气体反应物的气压,速率加快。
例题分析
例题1.【教材P54-7】某同学用相同质量锌粉先后与1mol·L-1盐酸及相同体积浓度为c=a mol·L-1的盐酸(足量)反应,记录相关数据,并做出两个反应过程中放出气体的体积随反应时间的变化图(如右下图)
(1)如何测量反应放出气体的体积
(2)分析实验图,得出a 1
(填“>”,“<”或“=”) 。
(3)若用1mol·L-1的硫酸代替1mol·L-1盐酸,
反应速率如何改变?
V(H2)
/cm3
t/min
0
1mol·L-1
a mol·L-1
例题分析
例题1.【教材P54-7】
(1)如何测量反应放出气体的体积
如右图装置
(2)分析实验图,得出a 1
锌粉质量相同,盐酸过量
(3)若用1mol·L-1的硫酸代替1mol·L-1盐酸,
反应速率加大。
1mol·L-1硫酸,c(H+)=2mol·L-1
1mol·L-1盐酸,c(H+)=1mol·L-1
>
例题分析
例题2.用粉末状CaCO3和稀盐酸反应制取CO2,如图
(1) 段化学反应速率最快,
段收集CO2气体最多。
(2)为减缓上述反应速率,欲向溶液
中加入下列物质,可行的是 。
A.水 B.NaCl固体
C.氯化钠溶液 D.浓盐酸
(3)除(2)外,列举减缓反应速率的方法
。
V(CO2)/cm3
t/min
0
t1
t2
A
B
C
t3
例题分析
例题2.用粉末状CaCO3和稀盐酸反应制取CO2,如图
(1) AB 段化学反应速率最快,
BC 段收集CO2气体最多。
(2)为减缓上述反应速率,欲向溶液
中加入下列物质,可行的是AC 。
A.水 B.NaCl固体
C.氯化钠溶液 D.浓盐酸
(3)除(2)外,列举减缓反应速率的方法
降低反应温度、将粉末状碳酸钙换成块状...... 。
V(CO2)/cm3
t/min
0
t1
t2
A
B
C
t3
难点和问题
(一)难点:控制变量对比实验分析影响化学反应速率的因素
(二)问题:
1.铁和水反应的条件
干燥剂
还原铁粉
水
1.通常条件下,铁和冷水或热水
都不反应。
2.红热的铁和水蒸气可以反应,
生成Fe3O4和H2。
3.说明温度对化学反应的影响比
较显著。
4. 3Fe+4H2O(g) Fe3O4+4H2(g)
高温
把除去氧化膜的镁条投入到盛有稀
盐酸的试管中,发现产生氢气的速率
变化如右图。
(1)t1~t2速率变化的主要原因是
(2)t2~t3速率变化的主要原因是
(H2)/cm3·s-1
t/s
0
t1
t2
t3
1
2
难点和问题
(二)问题:
2.化学反应速率的多因素影响。
(一)难点:控制变量对比实验分析影响化学反应速率的因素
把除去氧化膜的镁条投入到盛有稀
盐酸的试管中,发现产生氢气的速率
变化如右图。
(1)t1~t2速率变化的主要原因是
镁和硫酸反应放热,溶液温度升高。
(2)t2~t3速率变化的主要原因是
氢离子浓度下降,反应速率下降。
(H2)/cm3·s-1
t/s
0
t1
t2
t3
1
2
难点和问题
(二)问题:
2.化学反应速率的多因素影响。
(一)难点:控制变量对比实验分析影响化学反应速率的因素
难点和问题
(二)问题:
3.Na2S2O3溶液和硫酸反应“操作和计时”的关键操作。
恒温槽
恒温槽
1.两支相同试管中加入2mL
硫代硫酸钠溶液和硫酸溶液。
2.置于恒温槽中至温度相同。
3.将硫酸溶液快速倒入硫代硫
酸钠溶液中,并用秒表计时。
4.出现浑浊现象,停止计时。
Na2S2O3
溶液
H2SO4
溶液
混合
(一)难点:控制变量对比实验分析影响化学反应速率的因素
难点和问题
(二)问题:
4.混合溶液出现“浑浊现象”的标志和判断。
恒温槽
恒温槽
1.在盛有硫代硫酸钠溶液
的试管一侧放一个深颜色
的标志物。
2.将等温度的硫酸快速倒入
硫代硫酸钠溶液中。
3.按照如图所示进行观察,
看不到深色标志物时,
停止计时。
4.计算出现浑浊现象的时间。
Na2S2O3
溶液
H2SO4
溶液
混合
眼睛
(一)难点:控制变量对比实验分析影响化学反应速率的因素
难点和问题
(二)问题:
5.过氧化氢溶液分解产生氧气速率测定的关键操作。
10g3%过氧化氢
溶液+少量MnO2
室温恒温槽
1.将反应装置置于恒温水槽中,
使反应及氧气温度等于室温。
2.用带有刻度的注射器收集一定
体积的氧气,氧气压强等于外压。
3.记录收集一定体积的氧气
所用的时间。
4.或者记录一定时间内收集到了
反应条件下氧气的体积。
(一)难点:控制变量对比实验分析影响化学反应速率的因素
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
