第二专题 化学反应与能量转化
图片预览











文档简介
课件40张PPT。第二专题 化学反应与能量转化
复习一、化学反应速率(1)概念
化学反应的快慢用化学反应速率来表示。由于反应过程中反应物不断减少,生成物不断增多,所以化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示。
⑵表达式: v(B)= =
⑶单位为:mol·L-1·S-1或mol·L-1·min-1⑷化学反应速率表达式应用的几点注意
①同一反应,可以选用不同物质的浓度变化表示化学反应速率,所以必须加括号标明是何种物质。
② 同一反应,用不同物质表示的速率虽然数值不同,但其意义相同,都表示化学反应速率的快慢。
③ 在同一时刻或同一时间段内,不同物质的速率的比值一定等于化学方程式中相应的化学计量数之比。
④ 化学反应速率表示一段时间内的平均速率。 比较反应的快慢,应取同一参照物重要规律:(i)速率比=方程式系数比
(ii)变化量比=方程式系数比⑸影响化学反应速率的因素:
①内因:由反应物的结构、性质决定。
②外因:外界条件对化学反应速成率的影响。
1、浓度:对气体参加的反应或溶液中发生的反应速率产生影响,在其他条件不变时,增大反应物的浓度,可以增大反应速率,反之减小。对于纯液体或固体可视其浓度不变。2、温度:其他条件不变时,反应所处的温度越高,反应的速率越快。3、催化剂:使用催化剂可以改变化学反应速率。4、压强:只影响有气体参加的化学反应速率。当其他条件不变时,增大压强,反应速率增大,反之减小。若参加反应的是固态或液态反应物而无气体时,由于压强变化对它们的浓度几乎无影响,可认为速率不变。
若加入的是与反应无关的气体使压强增大,由于反应物的浓度没有改变,所以速率不变。5、其他外因:
增大一定量固体的表面积(如粉碎),可增大反应速率;
光照一般也可增大某些反应的速率;
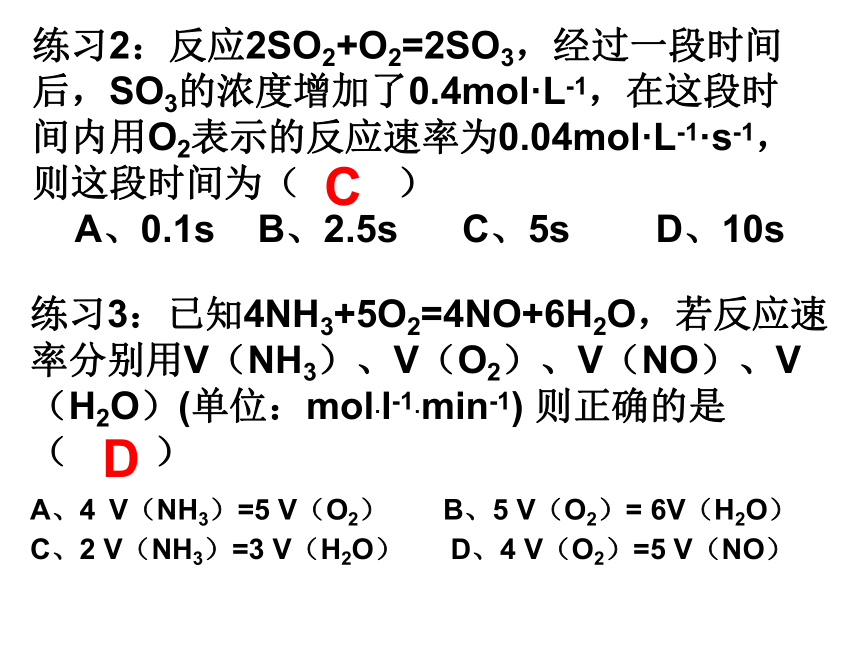
此外,超声波、电磁波、溶剂、原电池等对反应速率也有影响。练习1:反应N2+3H2 ? 2NH3,在2 L的密闭容器中发生,5 min内NH3的质量增加了1.7 g,求υ(NH3)、υ(H2)和υ(N2)。练习2:反应2SO2+O2=2SO3,经过一段时间后,SO3的浓度增加了0.4mol·L-1,在这段时间内用O2表示的反应速率为0.04mol·L-1·s-1,则这段时间为( )
A、0.1s B、2.5s C、5s D、10sC练习3:已知4NH3+5O2=4NO+6H2O,若反应速率分别用V(NH3)、V(O2)、V(NO)、V(H2O)(单位:mol·l-1·min-1) 则正确的是( )
A、4 V(NH3)=5 V(O2) B、5 V(O2)= 6V(H2O)
C、2 V(NH3)=3 V(H2O) D、4 V(O2)=5 V(NO)D练习4:在密闭容器里,通入XmolH2和Ymol I2(g),改变下列条件,反应速率将如何改变?(选填增大、减小、不变)
⑴升高温度
⑵加入催化剂
⑶充入更多的H2
⑷扩大容器的体积
⑸容器容积不变,通入氖气 增大增大增大减小不变二、化学反应限度 当可逆反应的正向反应速率与逆向反应速率相等时,反应物与生成物的浓度就不再改变,我们就说这一反应达到了“限度”。
这种化学反应状态常被称为化学平衡状态,简称“化学平衡”。化学平衡是一种动态平衡。在相同的条件下同时向正、逆两个反应方向进行的反应叫做可逆反应。
通常把由反应物向生成物进行的反应叫做正反应。
而由生成物向反应物进行的反应叫做逆反应。可逆反应的特征:①可逆反应有一定的限度
②可逆反应的平衡是一个动态的平衡
(2)化学平衡状态的特征:逆、动、等、定、变。①“逆”:化学平衡只存在于可逆反应中;
②“动”:化学平衡是一个动态平衡;
③“等”:平衡时正反应和逆反应的速率相等且大于0;
④“定”:平衡时反应物和生成物的浓度保持不变;
⑤“变”:改变外界条件时,平衡会发生移动。(旧的平衡将被破坏,并在新的条件下建立新的平衡。) (3)判断化学平衡状态的标志:
① V正=V逆
n(消耗)=n(生成)(不同方向同一物质比较)
②各组分浓度保持不变或百分含量不变练习1:某温度下,在一固定容积的容器中进行如下反应:H2(g)+I2(g) ?2HI(g),下列情况一定能说明反应已达到限度的是 ( )
A.压强不再随时间而改变时
B.气体的总质量不再改变时
C.混合气体中各组成成分的含量不再改变时
D.单位时间内每消耗1 mol I2,同时有2 mol HI生成时C练习2:100 mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是 ( )
A.加入适量的6 mol·L-1的盐酸
B.加入数滴氯化铜溶液
C.加入适量蒸馏水 D.加入适量的氯化钠溶液
练习3:化工生产中,为加快反应速率应优先考虑的措施是 ( )
A.选用适宜的催化剂 B.采用高压
C.采用高温 D.增大反应物浓度
练习4:在一定温度下,可逆反应x(g)+3Y(g)?2Z(g)达到限度的标志是 ( )
A.Z的生成速率和Z的分解速率相等
B.单位时间内生成n mol X,同时生成3nmol Y
C.X、Y、Z的浓度不再变化
D.X、Y、Z的分子个数之比为1:3:2BAAC2、下列四种X溶液,均能跟盐酸反应,其中反应最快的是( )
A.10℃ 20 mL 3mol/L的X溶液 B.20℃ 30 mL 2molL的X溶液 C.20℃ 10 mL 4mol/L的X溶液 D.10℃ 10 mL 2mol/L的X溶液1、用铁片与稀硫酸反应制取氢气时,下列措施不能使反应速率加快的是( )A.不用稀硫酸,改用98%浓硫酸 B.加热
C.滴加少量CuSO4溶液 D.不用铁片,改用铁粉AC3、对于可逆反应2SO2+O2 2SO3,在混合气体中充入一定量的18O2,足够长的时间后,18O原子( )
A.只存在于O2中 B.只存在于O2和SO3中
C. 只存在于O2和SO2中 D. 存在于O2、SO2和SO3中
DV (H 2) =V (I2 )
混合气体的平均相对分子质量一定
生成n mol H2同时生成2n mol HI
压强不随时间的变化而变化
6、对于一定温度下的密闭容器中,可逆反应H2+I2 2HI,达到平衡的标志是( )C 三、化学反应中的热量变化1、化学反应中总有能量变化2、许多化学反应伴随热量的变化(1)放热反应:有热量放出的化学反应。
(2)吸热反应:有热量吸收的化学反应。 化学反应中的能量变化——化学反应的过程中伴随着能量变化,通常表现为热量的变化一、热量变化放热反应吸热反应“释放”能量:本身所具有的能量:反应物 > 生成物“贮存”能量:本身所具有的能量:
反应物 < 生成物断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量。化学键的断裂和形成是化学反应中能量变化的主要原因。 例题3:拆开1mol H—H键,1mol N—H键,1mol N≡N键分别需要吸收的能量436kJ,391kJ,946kJ,
求:①1molN2气生成NH3需 热量 ,
②1molH2气生成NH3需 热量 。(不考虑可逆反应) 放出92KJ30.67kJ 放出1、放热反应: ⑴大多数化合反应
⑵燃烧反应
⑶酸碱中和反应
⑷金属与酸反应三、常见的放热反应与吸热反应2、吸热反应:⑴大多数分解反应.
⑵持续加热才能进行的反应, 如
以C、H2、CO为还原剂的氧化还原反应,如 C+CO2=2CO H2+CuO=Cu+H2O
铵盐和碱的反应如Ca(OH)2+2NH4Cl=CaCl2+2NH3+2H2O
△△△2、已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的是( )1、下列反应中,即属于氧化还原反应同时又是吸热反应的是( )
A.Ba(OH)2.8H2O与NH4Cl反应 B.灼热的炭与CO2反应
C.铝与稀盐酸 D.H2与O2的燃烧反应A. X的能量一定高于M
B. Y的能量一定高于N
C. X和Y的总能量一定高于M和N的总能量
D. 因该反应为放热反应,故不必加热就可发生1、下列说法中正确的是( )
A.物质发生化学反应都伴随着能量变化.
B.伴有能量变化的物质变化都是化学变化.
C.在一个确定的化学关系中,反应物的总能量与生成物的总能量一定不同.
D.在一个确定的化学关系中,反应物的总能量总是高于生成物的总能量.
2、下列变化中属于吸热反应的是( )
(1)液态水汽化 (2)高温锻烧石灰石
(3)浓H2SO4稀释(4)KClO3分解制O2
(5)生石灰与水反应生成熟石灰
A、C (2) (4)四、热化学反应方程式1、表示化学反应放出或吸收的热量
2、使用热化学方程式注意的几点:
①要标明各物质的聚集状态:S(固)、l(液)、g(气)
②在恒压条件下,△H<0表示放热
△H>0表示吸热
③单位:KJ·mol-1
④化学方程式中各物质的化学计量数不表示分子个数,只表示物质的量,可用整数或分数表示练习已知在25℃、101kpa下,1gC8H18燃烧生成二氧化碳和液态水时放出热量,表示上述反应的热化学方程式正确的是( )
A、C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(g);
△H=-48.40KJ/mol
B、C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l);
△H=-5518KJ/mol
C、C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l);
△H=+5518KJ/mol
D、C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l);
△H=-48.40KJ/mol
B①定义:能把化学能转变为电能的装 置,叫做原电池。四、化学能与电能②构成原电池的条件★有两种活动性不同的金属(或非金属单质)
作电极
★电极材料均插入电解质溶液中
★两极相连形成闭合电路③原电池化学反应本质:
较活泼的金属发生氧化反应,电子从较活泼
的金属(负极)通过外电路流向较不活泼
的金属(正极)正极:较不活泼的金属或石墨作正极,正极发生还原反应,
电极反应式:溶液中阳离子+ne-=单质
正极的现象:一般有气体放出或正极质量增加。负极:较活泼的金属作负极,负极发生氧化反应,
电极反应式:较活泼金属-ne-=金属阳离子
负极现象:负极溶解,负极质量减少。 Zn CuH2SO4原电池燃料电池练习1:把A、B、C、D4块金属片浸入稀硫酸
中,用导线两两相连组成原电池。
若A、B相连时,A为负极;C、D相连时,
D上产生大量气泡;A、C相连时,
电流由C经导线流向A;B、D相连时,
电子由D经导线流向B,则此4种金属的活
动性由强到弱的顺序为 ( )
①A>B>C > D ②A > C > D > B
③C > A > B > D ④ B > A > C > D2锂电池是一代新型高能电池,它以质量轻、能量高而受
到了普遍重视,目前已研制成功多种锂电池,某种锂电池
的总反应为Li + MnO2=LiMnO2,下列说法正确的是( )
A、 Li是正极,电极反应为Li - e- = Li+
B、 Li是负极,电极反应为Li - e- = Li+
C、 Li是负极,电极反应为MnO2 + e- = MnO2 –
D、 Li是负极,电极反应为Li -2e- = Li2+
B练习2:某原电池的总反应是Zn+Cu2+= Zn2+ + Cu,该原电池的正确组成是 ( )
A B C D
正极 Zn Cu Zn Cu
负极 Cu Zn Cu Zn
电解质溶液 CuCl2 CuCl2 ZnCl2 ZnCl2B练习3:4、微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应式为:
Zn+2OH-_e-=ZnO+H2O
Ag2O+H2O+2e-=2Ag+2OH-
根据上述反应式,判断下列叙述正确的
A.在使用过程中,电池负极区溶液的pH减小
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C. Zn是负极, Ag2O是正极
D. Zn电极发生还原反应,Ag2O电极发生氧化反应AC电解池:装置特点:电能转化为化学能
形成条件:(1)与电源相连的两个电极
(2)电解质溶液(或熔化的电解质)
(3)形成闭合回路反应原理电解结果:阴离子移向阳离子移向电子流向电解质溶液e-e-氧化反应还原反应2Cl- — 2e-= Cl2↑Cu2++ 2e-= Cu(氯化铜溶液)阳极阴极石墨石墨1、电解熔融氯化钠电极反应阳极:2Cl-- 2e- = Cl2↑阴极:总的方程式:2NaCl === 2Na + Cl2↑通电Na+ + e- = Na熔融NaCl电解原理应用NaCl溶液电极反应阳极:2Cl-- 2e- = Cl2↑阴极:总的方程式:2H+ + 2e- = H2↑2、电解氯化钠水溶液3、铜的电解精炼⑴、粗铜所含的杂质Zn、Fe、Ni、Ag、Au等⑵、粗铜的精炼 以粗铜为阳极,以纯铜为阴极, 以CuSO4溶液为电解液进行电解阳极: Zn -2e-=Zn2+ Fe-2e-=Fe2+
Ni -2e-=Ni2+ Cu-2e-=Cu2+ 阴极: Cu2+ +2e-=Cu长时间电解后必须补充电解液1.a今有2H2+O2===2H2O反应,构成燃料电池,则负极应通入___气,正极通入___气,电极反应为:负极_______________正极_____________
b如把KOH改为H2SO4作导电物质则电极反应:负极____________正极____________
a和b的电池液不同,反应进行后溶液的PH值各有何变化_________________
c.如把H2改CH4.KOH作导电物质则电极反应为:负极_____________________正极____________总反应式______________氢氧2H2+4OH- -4e-=4H2OO2+2H2O+4e-=4OH-2H2-4e-=4H+O2+4H++4e-=2H2Oa变小 b变大CH4+10OH- -8e-=CO32-+7H2O2O2+4H2O+8e-=8OH-CH4+2O2+2KOH=K2CO3 +3H2O
复习一、化学反应速率(1)概念
化学反应的快慢用化学反应速率来表示。由于反应过程中反应物不断减少,生成物不断增多,所以化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示。
⑵表达式: v(B)= =
⑶单位为:mol·L-1·S-1或mol·L-1·min-1⑷化学反应速率表达式应用的几点注意
①同一反应,可以选用不同物质的浓度变化表示化学反应速率,所以必须加括号标明是何种物质。
② 同一反应,用不同物质表示的速率虽然数值不同,但其意义相同,都表示化学反应速率的快慢。
③ 在同一时刻或同一时间段内,不同物质的速率的比值一定等于化学方程式中相应的化学计量数之比。
④ 化学反应速率表示一段时间内的平均速率。 比较反应的快慢,应取同一参照物重要规律:(i)速率比=方程式系数比
(ii)变化量比=方程式系数比⑸影响化学反应速率的因素:
①内因:由反应物的结构、性质决定。
②外因:外界条件对化学反应速成率的影响。
1、浓度:对气体参加的反应或溶液中发生的反应速率产生影响,在其他条件不变时,增大反应物的浓度,可以增大反应速率,反之减小。对于纯液体或固体可视其浓度不变。2、温度:其他条件不变时,反应所处的温度越高,反应的速率越快。3、催化剂:使用催化剂可以改变化学反应速率。4、压强:只影响有气体参加的化学反应速率。当其他条件不变时,增大压强,反应速率增大,反之减小。若参加反应的是固态或液态反应物而无气体时,由于压强变化对它们的浓度几乎无影响,可认为速率不变。
若加入的是与反应无关的气体使压强增大,由于反应物的浓度没有改变,所以速率不变。5、其他外因:
增大一定量固体的表面积(如粉碎),可增大反应速率;
光照一般也可增大某些反应的速率;
此外,超声波、电磁波、溶剂、原电池等对反应速率也有影响。练习1:反应N2+3H2 ? 2NH3,在2 L的密闭容器中发生,5 min内NH3的质量增加了1.7 g,求υ(NH3)、υ(H2)和υ(N2)。练习2:反应2SO2+O2=2SO3,经过一段时间后,SO3的浓度增加了0.4mol·L-1,在这段时间内用O2表示的反应速率为0.04mol·L-1·s-1,则这段时间为( )
A、0.1s B、2.5s C、5s D、10sC练习3:已知4NH3+5O2=4NO+6H2O,若反应速率分别用V(NH3)、V(O2)、V(NO)、V(H2O)(单位:mol·l-1·min-1) 则正确的是( )
A、4 V(NH3)=5 V(O2) B、5 V(O2)= 6V(H2O)
C、2 V(NH3)=3 V(H2O) D、4 V(O2)=5 V(NO)D练习4:在密闭容器里,通入XmolH2和Ymol I2(g),改变下列条件,反应速率将如何改变?(选填增大、减小、不变)
⑴升高温度
⑵加入催化剂
⑶充入更多的H2
⑷扩大容器的体积
⑸容器容积不变,通入氖气 增大增大增大减小不变二、化学反应限度 当可逆反应的正向反应速率与逆向反应速率相等时,反应物与生成物的浓度就不再改变,我们就说这一反应达到了“限度”。
这种化学反应状态常被称为化学平衡状态,简称“化学平衡”。化学平衡是一种动态平衡。在相同的条件下同时向正、逆两个反应方向进行的反应叫做可逆反应。
通常把由反应物向生成物进行的反应叫做正反应。
而由生成物向反应物进行的反应叫做逆反应。可逆反应的特征:①可逆反应有一定的限度
②可逆反应的平衡是一个动态的平衡
(2)化学平衡状态的特征:逆、动、等、定、变。①“逆”:化学平衡只存在于可逆反应中;
②“动”:化学平衡是一个动态平衡;
③“等”:平衡时正反应和逆反应的速率相等且大于0;
④“定”:平衡时反应物和生成物的浓度保持不变;
⑤“变”:改变外界条件时,平衡会发生移动。(旧的平衡将被破坏,并在新的条件下建立新的平衡。) (3)判断化学平衡状态的标志:
① V正=V逆
n(消耗)=n(生成)(不同方向同一物质比较)
②各组分浓度保持不变或百分含量不变练习1:某温度下,在一固定容积的容器中进行如下反应:H2(g)+I2(g) ?2HI(g),下列情况一定能说明反应已达到限度的是 ( )
A.压强不再随时间而改变时
B.气体的总质量不再改变时
C.混合气体中各组成成分的含量不再改变时
D.单位时间内每消耗1 mol I2,同时有2 mol HI生成时C练习2:100 mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是 ( )
A.加入适量的6 mol·L-1的盐酸
B.加入数滴氯化铜溶液
C.加入适量蒸馏水 D.加入适量的氯化钠溶液
练习3:化工生产中,为加快反应速率应优先考虑的措施是 ( )
A.选用适宜的催化剂 B.采用高压
C.采用高温 D.增大反应物浓度
练习4:在一定温度下,可逆反应x(g)+3Y(g)?2Z(g)达到限度的标志是 ( )
A.Z的生成速率和Z的分解速率相等
B.单位时间内生成n mol X,同时生成3nmol Y
C.X、Y、Z的浓度不再变化
D.X、Y、Z的分子个数之比为1:3:2BAAC2、下列四种X溶液,均能跟盐酸反应,其中反应最快的是( )
A.10℃ 20 mL 3mol/L的X溶液 B.20℃ 30 mL 2molL的X溶液 C.20℃ 10 mL 4mol/L的X溶液 D.10℃ 10 mL 2mol/L的X溶液1、用铁片与稀硫酸反应制取氢气时,下列措施不能使反应速率加快的是( )A.不用稀硫酸,改用98%浓硫酸 B.加热
C.滴加少量CuSO4溶液 D.不用铁片,改用铁粉AC3、对于可逆反应2SO2+O2 2SO3,在混合气体中充入一定量的18O2,足够长的时间后,18O原子( )
A.只存在于O2中 B.只存在于O2和SO3中
C. 只存在于O2和SO2中 D. 存在于O2、SO2和SO3中
DV (H 2) =V (I2 )
混合气体的平均相对分子质量一定
生成n mol H2同时生成2n mol HI
压强不随时间的变化而变化
6、对于一定温度下的密闭容器中,可逆反应H2+I2 2HI,达到平衡的标志是( )C 三、化学反应中的热量变化1、化学反应中总有能量变化2、许多化学反应伴随热量的变化(1)放热反应:有热量放出的化学反应。
(2)吸热反应:有热量吸收的化学反应。 化学反应中的能量变化——化学反应的过程中伴随着能量变化,通常表现为热量的变化一、热量变化放热反应吸热反应“释放”能量:本身所具有的能量:反应物 > 生成物“贮存”能量:本身所具有的能量:
反应物 < 生成物断开反应物中的化学键要吸收能量,而形成生成物中的化学键要放出能量。化学键的断裂和形成是化学反应中能量变化的主要原因。 例题3:拆开1mol H—H键,1mol N—H键,1mol N≡N键分别需要吸收的能量436kJ,391kJ,946kJ,
求:①1molN2气生成NH3需 热量 ,
②1molH2气生成NH3需 热量 。(不考虑可逆反应) 放出92KJ30.67kJ 放出1、放热反应: ⑴大多数化合反应
⑵燃烧反应
⑶酸碱中和反应
⑷金属与酸反应三、常见的放热反应与吸热反应2、吸热反应:⑴大多数分解反应.
⑵持续加热才能进行的反应, 如
以C、H2、CO为还原剂的氧化还原反应,如 C+CO2=2CO H2+CuO=Cu+H2O
铵盐和碱的反应如Ca(OH)2+2NH4Cl=CaCl2+2NH3+2H2O
△△△2、已知反应X+Y=M+N为放热反应,对该反应的下列说法中正确的是( )1、下列反应中,即属于氧化还原反应同时又是吸热反应的是( )
A.Ba(OH)2.8H2O与NH4Cl反应 B.灼热的炭与CO2反应
C.铝与稀盐酸 D.H2与O2的燃烧反应A. X的能量一定高于M
B. Y的能量一定高于N
C. X和Y的总能量一定高于M和N的总能量
D. 因该反应为放热反应,故不必加热就可发生1、下列说法中正确的是( )
A.物质发生化学反应都伴随着能量变化.
B.伴有能量变化的物质变化都是化学变化.
C.在一个确定的化学关系中,反应物的总能量与生成物的总能量一定不同.
D.在一个确定的化学关系中,反应物的总能量总是高于生成物的总能量.
2、下列变化中属于吸热反应的是( )
(1)液态水汽化 (2)高温锻烧石灰石
(3)浓H2SO4稀释(4)KClO3分解制O2
(5)生石灰与水反应生成熟石灰
A、C (2) (4)四、热化学反应方程式1、表示化学反应放出或吸收的热量
2、使用热化学方程式注意的几点:
①要标明各物质的聚集状态:S(固)、l(液)、g(气)
②在恒压条件下,△H<0表示放热
△H>0表示吸热
③单位:KJ·mol-1
④化学方程式中各物质的化学计量数不表示分子个数,只表示物质的量,可用整数或分数表示练习已知在25℃、101kpa下,1gC8H18燃烧生成二氧化碳和液态水时放出热量,表示上述反应的热化学方程式正确的是( )
A、C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(g);
△H=-48.40KJ/mol
B、C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l);
△H=-5518KJ/mol
C、C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l);
△H=+5518KJ/mol
D、C8H18(l)+25/2O2(g)=8CO2(g)+9H2O(l);
△H=-48.40KJ/mol
B①定义:能把化学能转变为电能的装 置,叫做原电池。四、化学能与电能②构成原电池的条件★有两种活动性不同的金属(或非金属单质)
作电极
★电极材料均插入电解质溶液中
★两极相连形成闭合电路③原电池化学反应本质:
较活泼的金属发生氧化反应,电子从较活泼
的金属(负极)通过外电路流向较不活泼
的金属(正极)正极:较不活泼的金属或石墨作正极,正极发生还原反应,
电极反应式:溶液中阳离子+ne-=单质
正极的现象:一般有气体放出或正极质量增加。负极:较活泼的金属作负极,负极发生氧化反应,
电极反应式:较活泼金属-ne-=金属阳离子
负极现象:负极溶解,负极质量减少。 Zn CuH2SO4原电池燃料电池练习1:把A、B、C、D4块金属片浸入稀硫酸
中,用导线两两相连组成原电池。
若A、B相连时,A为负极;C、D相连时,
D上产生大量气泡;A、C相连时,
电流由C经导线流向A;B、D相连时,
电子由D经导线流向B,则此4种金属的活
动性由强到弱的顺序为 ( )
①A>B>C > D ②A > C > D > B
③C > A > B > D ④ B > A > C > D2锂电池是一代新型高能电池,它以质量轻、能量高而受
到了普遍重视,目前已研制成功多种锂电池,某种锂电池
的总反应为Li + MnO2=LiMnO2,下列说法正确的是( )
A、 Li是正极,电极反应为Li - e- = Li+
B、 Li是负极,电极反应为Li - e- = Li+
C、 Li是负极,电极反应为MnO2 + e- = MnO2 –
D、 Li是负极,电极反应为Li -2e- = Li2+
B练习2:某原电池的总反应是Zn+Cu2+= Zn2+ + Cu,该原电池的正确组成是 ( )
A B C D
正极 Zn Cu Zn Cu
负极 Cu Zn Cu Zn
电解质溶液 CuCl2 CuCl2 ZnCl2 ZnCl2B练习3:4、微型纽扣电池在现代生活中有广泛应用。有一种银锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH,电极反应式为:
Zn+2OH-_e-=ZnO+H2O
Ag2O+H2O+2e-=2Ag+2OH-
根据上述反应式,判断下列叙述正确的
A.在使用过程中,电池负极区溶液的pH减小
B.使用过程中,电子由Ag2O极经外电路流向Zn极
C. Zn是负极, Ag2O是正极
D. Zn电极发生还原反应,Ag2O电极发生氧化反应AC电解池:装置特点:电能转化为化学能
形成条件:(1)与电源相连的两个电极
(2)电解质溶液(或熔化的电解质)
(3)形成闭合回路反应原理电解结果:阴离子移向阳离子移向电子流向电解质溶液e-e-氧化反应还原反应2Cl- — 2e-= Cl2↑Cu2++ 2e-= Cu(氯化铜溶液)阳极阴极石墨石墨1、电解熔融氯化钠电极反应阳极:2Cl-- 2e- = Cl2↑阴极:总的方程式:2NaCl === 2Na + Cl2↑通电Na+ + e- = Na熔融NaCl电解原理应用NaCl溶液电极反应阳极:2Cl-- 2e- = Cl2↑阴极:总的方程式:2H+ + 2e- = H2↑2、电解氯化钠水溶液3、铜的电解精炼⑴、粗铜所含的杂质Zn、Fe、Ni、Ag、Au等⑵、粗铜的精炼 以粗铜为阳极,以纯铜为阴极, 以CuSO4溶液为电解液进行电解阳极: Zn -2e-=Zn2+ Fe-2e-=Fe2+
Ni -2e-=Ni2+ Cu-2e-=Cu2+ 阴极: Cu2+ +2e-=Cu长时间电解后必须补充电解液1.a今有2H2+O2===2H2O反应,构成燃料电池,则负极应通入___气,正极通入___气,电极反应为:负极_______________正极_____________
b如把KOH改为H2SO4作导电物质则电极反应:负极____________正极____________
a和b的电池液不同,反应进行后溶液的PH值各有何变化_________________
c.如把H2改CH4.KOH作导电物质则电极反应为:负极_____________________正极____________总反应式______________氢氧2H2+4OH- -4e-=4H2OO2+2H2O+4e-=4OH-2H2-4e-=4H+O2+4H++4e-=2H2Oa变小 b变大CH4+10OH- -8e-=CO32-+7H2O2O2+4H2O+8e-=8OH-CH4+2O2+2KOH=K2CO3 +3H2O
