化学反应的速率和限度
图片预览





文档简介
课件18张PPT。1.化学反应的速率和限度化学反应速率意义:衡量________________的物理量表示方法:v=________,单位:________________________简单计算:同一化学反应中各物质的____________等于各物质的化学计量数之比,也等于各物质的变化浓度之比影响
因素内因:__________________外因浓度:_______________可以加快反应速率,
____________可以加快反应速率
温度:升高温度,可以______________
降低温度,可以_____________
催化剂:使用_______可以加快化学反应速率
其他因素:____________________________
________________化学反应进行快慢Δc/Δtmol·L-1·min-1或mol·L-1·s-1反应速率比反应物的结构、性质增大反应物浓度增大产物浓度加快反应速率减慢反应速率催化剂光、溶剂、固体表面积、电磁波、超声波、原电池等 化学反应限度:大多数化学反应都具有_____________,故化学反应都有
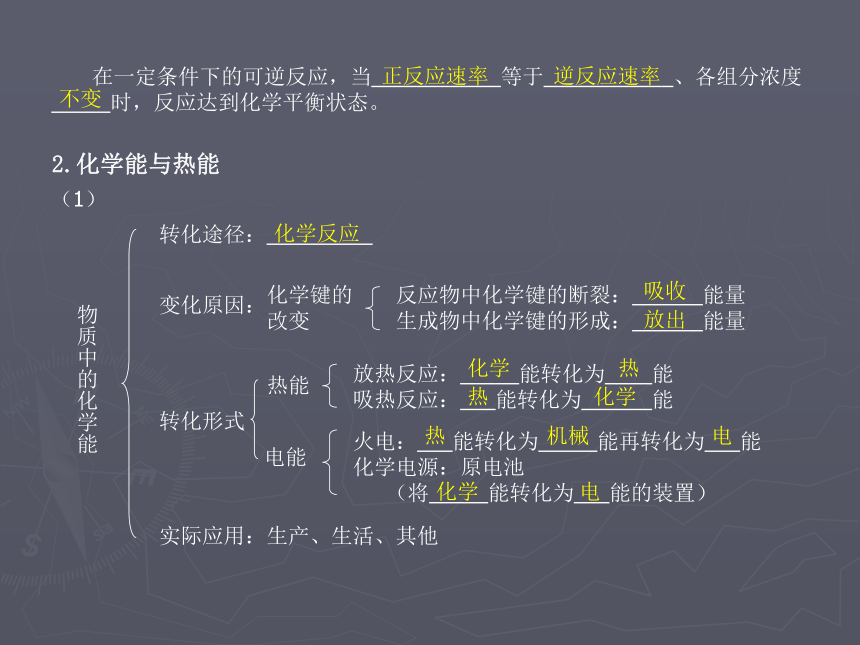
一定的限度;可逆反应的限度以到达_____________为止。一定的可逆性最大反应程度不变 在一定条件下的可逆反应,当___________等于___________、各组分浓度
_____时,反应达到化学平衡状态。正反应速率逆反应速率2.化学能与热能(1)物质中的化学能转化途径:_________变化原因:化学键的
改变反应物中化学键的断裂:______能量
生成物中化学键的形成:______能量转化形式热能放热反应:_____能转化为____能
吸热反应:___能转化为______能电能火电:___能转化为_____能再转化为___能
化学电源:原电池
(将_____能转化为___能的装置)实际应用:生产、生活、其他化学反应吸收放出化学热热化学热机械电化学电(2)了解常见的吸热反应和放热反应
常见的放热反应:
A.所有燃烧反应;B.中和反应;C.大多数化合反应;D.活泼金属跟水或酸反应;E.物质的缓慢氧化常见的吸热反应:
A. 大多数分解反应; B. C+CO2 2CO H2+CuO Cu+H2O
C+H2O CO+H2氯化铵与八水合氢氧化钡的反应,Ca(OH)2与NH4Cl的反应为放热反应。(3)判断反应放热或吸热的方法
①当断开反应物中化学键所_____的能量_____形成生成物中化学键所_____的能量时,反应放热,反之则反应吸热;
②当_______的总能量大于_______的总能量时,反应放热,反之则反应吸热。生成物吸收小于放出反应物3.化学能与电能
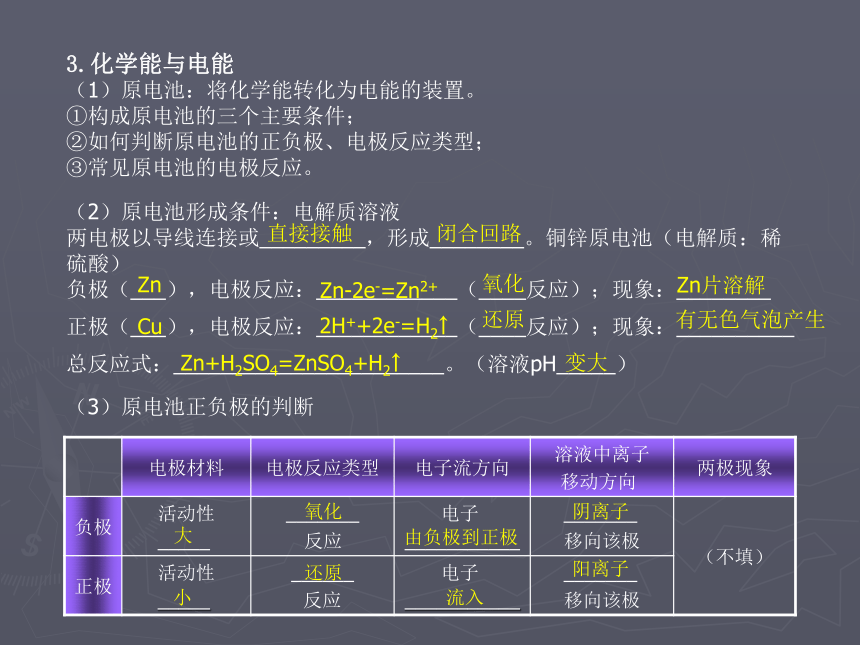
(1)原电池:将化学能转化为电能的装置。
①构成原电池的三个主要条件;
②如何判断原电池的正负极、电极反应类型;
③常见原电池的电极反应。(2)原电池形成条件:电解质溶液
两电极以导线连接或_________,形成________。铜锌原电池(电解质:稀硫酸)
负极(___),电极反应:____________(____反应);现象:________
正极(___),电极反应:____________(____反应);现象:__________
总反应式:_______________________。(溶液pH_____)变大直接接触闭合回路ZnZn-2e-=Zn2+氧化Zn片溶解Cu2H++2e-=H2↑还原有无色气泡产生Zn+H2SO4=ZnSO4+H2↑(3)原电池正负极的判断大氧化由负极到正极阴离子小还原流入阳离子(4)原电池的应用用作电源
判断金属的活泼性
加快某些反应的反应速率(5)电解池:电能转化为化学能
①电解池的阴阳极判断、电极反应类型
②电解CuCl2、饱和NaCl溶液、熔融NaCl、H2O的电极反应。题型一 有关化学反应速率的简单计算
【例1】在mA+nB pC的反应中,m、n、p为各物质的计量数。现测得C每分钟增加1 mol·L-1,B每分钟减少1.5a mol·L-1,A每分钟减少0.5a mol·L-1,则m:n:p为 ( )
A.2:3:2 B.2:3:3 C.1:3:2 D.3:1:2C【解析】由反应速率比等于各物质的计量数比,得m:n:p=1:3:2。【例2】在铝与稀硫酸的反应中,已知10 s末硫酸的浓度减少了0.6 mol·L-1,若不考虑反应过程中溶液体积的变化,则10 s内生成硫酸铝的平均反应速率是 ( )
A.0.02 mol·L-1·s-1 B.1.8 mol·L-1·s-1
C.1.2 mol·L-1·s-1 D.0.18 mol·L-1·s-1A【解析】v(H2SO4)=0.6 mol·L-1/10 s=0.06 mol·L-1·s-1,则v[Al2(SO4)3]
=0.02 mol·L-1·s-1。题型二 有关化学反应速率大小比较
【例3】下列四种X溶液,均能跟盐酸反应,其中反应最快的是 ( )
A.10 ℃ 20 mL 3 mol·L-1的X溶液
B.20 ℃ 30 mL 2 mol·L-1的X溶液
C.20 ℃ 10 mL 4 mol·L-1的X溶液
D.10 ℃ 10 mL 2 mol·L-1的X溶液C【解析】温度高,浓度大,反应速率快。【例4】分析下列实例,根据已有知识和经验,填写下表。压强大反应速率大温度温度升高反应速率变大浓度浓度大反应速率快固体表面积表面积大反应速率快催化剂催化剂加快反应速率压强题型三 有关化学平衡状态
【例5】一定条件下,可逆反应2A ? B+3C,在四种状态中处于平衡状态的是
( )D【解析】同一物质正逆反应速率相等反应达平衡,对于不同物质正逆向反应速率
比等于物质的计量数比,反应达平衡状态。【例6】一定温度下,反应N2(g)+3H2(g) ? 2NH3(g)达到化学平衡状态的标志是 ( )
A.N2、H2和NH3的物质质量分数不再改变
B.c(N2):c(H2):c(NH3)=1:3:2
C.N2与H2的物质的量之和是NH3的物质的量的2倍
D.单位时间里每增加1 mol N2,同时增加3 mol H2A【解析】c(N2):c(H2):c(NH3)=1:3:2是特殊状态,并不说明反应达平衡状态,
同理C项也是如此,而D项不管反应是否达平衡均成立。题型四 吸热反应、放热反应
【例7】下列反应中,反应物总能量低于生成物总能量的是 ( )
A.C+CO2=2CO B.C+O2=CO2
C.C+H2O=CO+H2 D.H2+Cl2 2HClA、C【解析】反应物总能量低于生成物总能量,反应吸热,大部分分解反应和个别
反应如C+CO2 2CO,C+H2O(g) CO+H2;Ca(OH)2+2NH4Cl=
CaCl2+2NH3·H2O,是吸热反应。题型五 反应热大小比较
【例8】(1)S(g)+O2(g)=SO2(g) ΔH1, S(s)+O2(g)=SO2(g) ΔH2
ΔH1____ΔH2(“=”、“>”或“<”表示)。
(2)C(s)+O2(g)=CO2(g) 放出热量Q1,C(s)+12O2(g)=CO(g) 放出热量
Q2, Q1____Q2(用“=”、“>”或“<”表示)。<>【解析】S(g)能量高于S(s),因此燃烧放出能量数值比S(s)燃烧放出的多,
但ΔH1<ΔH2,注意△H<0,C(s)完全燃烧生成CO2时放出的热量多于不完
全燃烧放出的热量。题型六 反应热综合利用
【例9】(1)实验测得1 mol H2与1 mol Cl2反应生成2 mol HCl时,放出184.6 kJ的热量,其理论分析数据与实验数据略有差异,图1表示上述反应能量变化的理论分析示意图:图 ①化学键断裂需要______(填“释放”或“吸收”)能量;
②图中共释放能量____kJ ·mol- 1;
③该反应的反应物的总能量_____(填“大于”、“等于”或“小于”)反应产物的能量,所以该反应是_____反应;
④用图示数据计算其反应热,写出该反应的热化学方程式
___________________________________________________。吸收862大于放热H2(g)+Cl2(g)= 2HCl(g) ΔH=-183 kJ ·mol- 1(2)已知一个化学方程式可由另外几个化学方程式加减而得到,则该化学反应的能量变化即为这几个化学反应能量变化的代数和。
现有:298 K时:
C(s,石墨)+O2(g)= CO2(g) ΔH1=-393.5 kJ ·mol- 1
CO(g)+1/2O2(g) = CO2(g) ΔH2=-283.0 kJ ·mol- 1
写出石墨在氧气中反应生成一氧化碳的热化学方程式
______________________________________________________C(s,石墨)+1/2O2(g)= CO(g) ΔH=-110.5 kJ ·mol- 1题型七 原电池、电解池组成结构
【例10】图2各装置中,不能构成原电池的是 ( )D【解析】活性不同电极浸在电解质溶液中,形成闭合回路构成原电池。【例11】人造地球卫星用到的一种高能电池——银锌蓄电池,其电池的电极反应式为Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-。据此判断氧化
银是 ( )
A.负极,并被氧化 B.正极,并被还原
C.负极,并被还原 D.正极,并被氧化B【解析】由电极反应,Zn失去电子被氧化,Ag2O得到电子被还原。【例12】利用反应Zn+2FeCl3=ZnCl2+2FeCl2设计一个原电池。在图中方格内画出
实验装置图,并指出正极为_____,电极反应式为____________;负极为_____,
电极反应式为______________。C棒Fe3++e-=Fe2+ZnZn-2e-=Zn2+题型八 电极反应书写
【例13】某蓄电池放电、充电时的反应为:Fe+Ni2O3+3H2O Fe(OH)2
+2Ni(OH)2,下列推断中正确的是 ( )
①放电时,Fe为正极,Ni2O3为负极;
②充电时,阴极上的电极反应式是:Fe(OH)2+2e- = Fe+2OH-;
③充电时,Ni(OH)2为阳极;
④蓄电池的电极必须是浸在某种碱性电解质溶液中。
A.①②③ B.①②④ C.①③④ D.②③④D【解析】蓄电池在放电时发生原电池反应,把化学能转变为电能。在充电时发生
电解反应,将电能转变为化学能。反应方程式的左右各物质互为反应物和生成物。此蓄电池在放电时的反应:
Fe + Ni2O3 + 3H2O Fe(OH)2 + 2Ni(OH)2
生成物为Fe(OH)2、Ni(OH)2,电解质溶液应为碱性溶液。0+3+2+2Fe为负极,其电极反应为:
Fe - 2e- +2OH- = Fe(OH)2
Ni2O3为正极,其电极反应为:
Ni2O3+2e- +3H2O = 2Ni(OH)2+2OH-蓄电池在充电时的反应:
Fe(OH)2 + 2Ni(OH)2 Fe+Ni2O3+3H2O
阳极:2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
阴极:Fe(OH)2+2e-=Fe+2OH-。题型九 电化学综合运用
【例14】铅蓄电池工作时(原电池),总反应为:
PbO2+Pb+2H2SO4=2PbSO4+2H2O
由此可判断:
(1)原电池的电极材料:①正极为______;②负极为____。
(2)两极的电极反应为_________________________________________
_________________________。
(3)工作后,蓄电池里电解质溶液的pH_____(填“变大”、“变小”或“不变”),
其理由是_________________________________________________。PbO2Pb正极:PbO2+SO42-+4H++2e-=PbSO4+2H2O负极:Pb+SO42--2e-=PbSO4变大蓄电池工作时,正极反应要消耗H+【解析】书写步骤如下:
(1)负极:Pb-2e-=PbSO4
正极:PbO2+2e-=PbSO4+H2O
(2)负极:Pb+SO42--2e-=PbSO4
正极:PbO2+2e-+SO42-+4H+=PbSO4+2H2O,两式相加,得总式。【例15】20 ℃时用铂电极电解340 g Na2SO4饱和溶液,当阳极析出标准状
况下的气体11.2 L时,剩余溶液恰好完全变成硫酸钠晶体(Na2SO4·10H2O),
试求20 ℃时Na2SO4的溶解度。【解析】n(O2)=11.2 L/22.4 L·mol-1=0.500 mol
2H2O 2H2↑+O2↑
n(H2O)=2n(O2)=1.00 mol
m(H2O)=1.00 mol×18 g·mol-1=18.0 g
m(Na2SO4·10H2O)=340 g-18.0 g=322 g
Na2SO4·10H2O中Na2SO4和H2O的质量分别为:
m(Na2SO4)=322 g×142/322=142 g , m(H2O)=322 g×180/322=180 g。设20 ℃时Na2SO4的溶解度为S,则100 g/S=(180 g+18 g)/142 g,S=71.7 g。【例16】用图3所示的装置进行电解。通电一会儿,发现湿润的KI淀粉试纸的C端
变为蓝色。则:(1) A中发生反应的化学方程式为__________________________________。
(2)在B中观察到的现象是________________、_______________、
_____________________。
(3)室温下,若从电解开始到时间t s,A、B装置中共收集到标准状况下的气体0.168 L,若电解过程中无其他副反应发生,经测定,电解后A中溶液体积为1000 mL,则A溶液的pH为_____。石墨极有气泡产生Cu极周围变蓝色溶液中有蓝色沉淀生成2【解析】可以认为线路中串联了3个电解池,当选定一个为研究对象时,另外的2个可看作是线路或是电阻。
先选定湿润的碘化钾淀粉试纸为研究对象。由于C端变为蓝色,可知C端有I2生成:2I--2e- = I2
I2使淀粉变蓝色。该反应是在电解池的阳极发生的反应,由此可以断定外接电源的E端为负极,F端为正极。
(1)、(2)选A(或B)为研究对象,可忽略B(或A)和碘化钾淀粉试纸的存在。
(3)由题意可知如下关系式: 4H+~O2~2H2
根据气体的体积可求出n(H+)、c(H+)及pH。
因素内因:__________________外因浓度:_______________可以加快反应速率,
____________可以加快反应速率
温度:升高温度,可以______________
降低温度,可以_____________
催化剂:使用_______可以加快化学反应速率
其他因素:____________________________
________________化学反应进行快慢Δc/Δtmol·L-1·min-1或mol·L-1·s-1反应速率比反应物的结构、性质增大反应物浓度增大产物浓度加快反应速率减慢反应速率催化剂光、溶剂、固体表面积、电磁波、超声波、原电池等 化学反应限度:大多数化学反应都具有_____________,故化学反应都有
一定的限度;可逆反应的限度以到达_____________为止。一定的可逆性最大反应程度不变 在一定条件下的可逆反应,当___________等于___________、各组分浓度
_____时,反应达到化学平衡状态。正反应速率逆反应速率2.化学能与热能(1)物质中的化学能转化途径:_________变化原因:化学键的
改变反应物中化学键的断裂:______能量
生成物中化学键的形成:______能量转化形式热能放热反应:_____能转化为____能
吸热反应:___能转化为______能电能火电:___能转化为_____能再转化为___能
化学电源:原电池
(将_____能转化为___能的装置)实际应用:生产、生活、其他化学反应吸收放出化学热热化学热机械电化学电(2)了解常见的吸热反应和放热反应
常见的放热反应:
A.所有燃烧反应;B.中和反应;C.大多数化合反应;D.活泼金属跟水或酸反应;E.物质的缓慢氧化常见的吸热反应:
A. 大多数分解反应; B. C+CO2 2CO H2+CuO Cu+H2O
C+H2O CO+H2氯化铵与八水合氢氧化钡的反应,Ca(OH)2与NH4Cl的反应为放热反应。(3)判断反应放热或吸热的方法
①当断开反应物中化学键所_____的能量_____形成生成物中化学键所_____的能量时,反应放热,反之则反应吸热;
②当_______的总能量大于_______的总能量时,反应放热,反之则反应吸热。生成物吸收小于放出反应物3.化学能与电能
(1)原电池:将化学能转化为电能的装置。
①构成原电池的三个主要条件;
②如何判断原电池的正负极、电极反应类型;
③常见原电池的电极反应。(2)原电池形成条件:电解质溶液
两电极以导线连接或_________,形成________。铜锌原电池(电解质:稀硫酸)
负极(___),电极反应:____________(____反应);现象:________
正极(___),电极反应:____________(____反应);现象:__________
总反应式:_______________________。(溶液pH_____)变大直接接触闭合回路ZnZn-2e-=Zn2+氧化Zn片溶解Cu2H++2e-=H2↑还原有无色气泡产生Zn+H2SO4=ZnSO4+H2↑(3)原电池正负极的判断大氧化由负极到正极阴离子小还原流入阳离子(4)原电池的应用用作电源
判断金属的活泼性
加快某些反应的反应速率(5)电解池:电能转化为化学能
①电解池的阴阳极判断、电极反应类型
②电解CuCl2、饱和NaCl溶液、熔融NaCl、H2O的电极反应。题型一 有关化学反应速率的简单计算
【例1】在mA+nB pC的反应中,m、n、p为各物质的计量数。现测得C每分钟增加1 mol·L-1,B每分钟减少1.5a mol·L-1,A每分钟减少0.5a mol·L-1,则m:n:p为 ( )
A.2:3:2 B.2:3:3 C.1:3:2 D.3:1:2C【解析】由反应速率比等于各物质的计量数比,得m:n:p=1:3:2。【例2】在铝与稀硫酸的反应中,已知10 s末硫酸的浓度减少了0.6 mol·L-1,若不考虑反应过程中溶液体积的变化,则10 s内生成硫酸铝的平均反应速率是 ( )
A.0.02 mol·L-1·s-1 B.1.8 mol·L-1·s-1
C.1.2 mol·L-1·s-1 D.0.18 mol·L-1·s-1A【解析】v(H2SO4)=0.6 mol·L-1/10 s=0.06 mol·L-1·s-1,则v[Al2(SO4)3]
=0.02 mol·L-1·s-1。题型二 有关化学反应速率大小比较
【例3】下列四种X溶液,均能跟盐酸反应,其中反应最快的是 ( )
A.10 ℃ 20 mL 3 mol·L-1的X溶液
B.20 ℃ 30 mL 2 mol·L-1的X溶液
C.20 ℃ 10 mL 4 mol·L-1的X溶液
D.10 ℃ 10 mL 2 mol·L-1的X溶液C【解析】温度高,浓度大,反应速率快。【例4】分析下列实例,根据已有知识和经验,填写下表。压强大反应速率大温度温度升高反应速率变大浓度浓度大反应速率快固体表面积表面积大反应速率快催化剂催化剂加快反应速率压强题型三 有关化学平衡状态
【例5】一定条件下,可逆反应2A ? B+3C,在四种状态中处于平衡状态的是
( )D【解析】同一物质正逆反应速率相等反应达平衡,对于不同物质正逆向反应速率
比等于物质的计量数比,反应达平衡状态。【例6】一定温度下,反应N2(g)+3H2(g) ? 2NH3(g)达到化学平衡状态的标志是 ( )
A.N2、H2和NH3的物质质量分数不再改变
B.c(N2):c(H2):c(NH3)=1:3:2
C.N2与H2的物质的量之和是NH3的物质的量的2倍
D.单位时间里每增加1 mol N2,同时增加3 mol H2A【解析】c(N2):c(H2):c(NH3)=1:3:2是特殊状态,并不说明反应达平衡状态,
同理C项也是如此,而D项不管反应是否达平衡均成立。题型四 吸热反应、放热反应
【例7】下列反应中,反应物总能量低于生成物总能量的是 ( )
A.C+CO2=2CO B.C+O2=CO2
C.C+H2O=CO+H2 D.H2+Cl2 2HClA、C【解析】反应物总能量低于生成物总能量,反应吸热,大部分分解反应和个别
反应如C+CO2 2CO,C+H2O(g) CO+H2;Ca(OH)2+2NH4Cl=
CaCl2+2NH3·H2O,是吸热反应。题型五 反应热大小比较
【例8】(1)S(g)+O2(g)=SO2(g) ΔH1, S(s)+O2(g)=SO2(g) ΔH2
ΔH1____ΔH2(“=”、“>”或“<”表示)。
(2)C(s)+O2(g)=CO2(g) 放出热量Q1,C(s)+12O2(g)=CO(g) 放出热量
Q2, Q1____Q2(用“=”、“>”或“<”表示)。<>【解析】S(g)能量高于S(s),因此燃烧放出能量数值比S(s)燃烧放出的多,
但ΔH1<ΔH2,注意△H<0,C(s)完全燃烧生成CO2时放出的热量多于不完
全燃烧放出的热量。题型六 反应热综合利用
【例9】(1)实验测得1 mol H2与1 mol Cl2反应生成2 mol HCl时,放出184.6 kJ的热量,其理论分析数据与实验数据略有差异,图1表示上述反应能量变化的理论分析示意图:图 ①化学键断裂需要______(填“释放”或“吸收”)能量;
②图中共释放能量____kJ ·mol- 1;
③该反应的反应物的总能量_____(填“大于”、“等于”或“小于”)反应产物的能量,所以该反应是_____反应;
④用图示数据计算其反应热,写出该反应的热化学方程式
___________________________________________________。吸收862大于放热H2(g)+Cl2(g)= 2HCl(g) ΔH=-183 kJ ·mol- 1(2)已知一个化学方程式可由另外几个化学方程式加减而得到,则该化学反应的能量变化即为这几个化学反应能量变化的代数和。
现有:298 K时:
C(s,石墨)+O2(g)= CO2(g) ΔH1=-393.5 kJ ·mol- 1
CO(g)+1/2O2(g) = CO2(g) ΔH2=-283.0 kJ ·mol- 1
写出石墨在氧气中反应生成一氧化碳的热化学方程式
______________________________________________________C(s,石墨)+1/2O2(g)= CO(g) ΔH=-110.5 kJ ·mol- 1题型七 原电池、电解池组成结构
【例10】图2各装置中,不能构成原电池的是 ( )D【解析】活性不同电极浸在电解质溶液中,形成闭合回路构成原电池。【例11】人造地球卫星用到的一种高能电池——银锌蓄电池,其电池的电极反应式为Zn+2OH--2e-=ZnO+H2O,Ag2O+H2O+2e-=2Ag+2OH-。据此判断氧化
银是 ( )
A.负极,并被氧化 B.正极,并被还原
C.负极,并被还原 D.正极,并被氧化B【解析】由电极反应,Zn失去电子被氧化,Ag2O得到电子被还原。【例12】利用反应Zn+2FeCl3=ZnCl2+2FeCl2设计一个原电池。在图中方格内画出
实验装置图,并指出正极为_____,电极反应式为____________;负极为_____,
电极反应式为______________。C棒Fe3++e-=Fe2+ZnZn-2e-=Zn2+题型八 电极反应书写
【例13】某蓄电池放电、充电时的反应为:Fe+Ni2O3+3H2O Fe(OH)2
+2Ni(OH)2,下列推断中正确的是 ( )
①放电时,Fe为正极,Ni2O3为负极;
②充电时,阴极上的电极反应式是:Fe(OH)2+2e- = Fe+2OH-;
③充电时,Ni(OH)2为阳极;
④蓄电池的电极必须是浸在某种碱性电解质溶液中。
A.①②③ B.①②④ C.①③④ D.②③④D【解析】蓄电池在放电时发生原电池反应,把化学能转变为电能。在充电时发生
电解反应,将电能转变为化学能。反应方程式的左右各物质互为反应物和生成物。此蓄电池在放电时的反应:
Fe + Ni2O3 + 3H2O Fe(OH)2 + 2Ni(OH)2
生成物为Fe(OH)2、Ni(OH)2,电解质溶液应为碱性溶液。0+3+2+2Fe为负极,其电极反应为:
Fe - 2e- +2OH- = Fe(OH)2
Ni2O3为正极,其电极反应为:
Ni2O3+2e- +3H2O = 2Ni(OH)2+2OH-蓄电池在充电时的反应:
Fe(OH)2 + 2Ni(OH)2 Fe+Ni2O3+3H2O
阳极:2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
阴极:Fe(OH)2+2e-=Fe+2OH-。题型九 电化学综合运用
【例14】铅蓄电池工作时(原电池),总反应为:
PbO2+Pb+2H2SO4=2PbSO4+2H2O
由此可判断:
(1)原电池的电极材料:①正极为______;②负极为____。
(2)两极的电极反应为_________________________________________
_________________________。
(3)工作后,蓄电池里电解质溶液的pH_____(填“变大”、“变小”或“不变”),
其理由是_________________________________________________。PbO2Pb正极:PbO2+SO42-+4H++2e-=PbSO4+2H2O负极:Pb+SO42--2e-=PbSO4变大蓄电池工作时,正极反应要消耗H+【解析】书写步骤如下:
(1)负极:Pb-2e-=PbSO4
正极:PbO2+2e-=PbSO4+H2O
(2)负极:Pb+SO42--2e-=PbSO4
正极:PbO2+2e-+SO42-+4H+=PbSO4+2H2O,两式相加,得总式。【例15】20 ℃时用铂电极电解340 g Na2SO4饱和溶液,当阳极析出标准状
况下的气体11.2 L时,剩余溶液恰好完全变成硫酸钠晶体(Na2SO4·10H2O),
试求20 ℃时Na2SO4的溶解度。【解析】n(O2)=11.2 L/22.4 L·mol-1=0.500 mol
2H2O 2H2↑+O2↑
n(H2O)=2n(O2)=1.00 mol
m(H2O)=1.00 mol×18 g·mol-1=18.0 g
m(Na2SO4·10H2O)=340 g-18.0 g=322 g
Na2SO4·10H2O中Na2SO4和H2O的质量分别为:
m(Na2SO4)=322 g×142/322=142 g , m(H2O)=322 g×180/322=180 g。设20 ℃时Na2SO4的溶解度为S,则100 g/S=(180 g+18 g)/142 g,S=71.7 g。【例16】用图3所示的装置进行电解。通电一会儿,发现湿润的KI淀粉试纸的C端
变为蓝色。则:(1) A中发生反应的化学方程式为__________________________________。
(2)在B中观察到的现象是________________、_______________、
_____________________。
(3)室温下,若从电解开始到时间t s,A、B装置中共收集到标准状况下的气体0.168 L,若电解过程中无其他副反应发生,经测定,电解后A中溶液体积为1000 mL,则A溶液的pH为_____。石墨极有气泡产生Cu极周围变蓝色溶液中有蓝色沉淀生成2【解析】可以认为线路中串联了3个电解池,当选定一个为研究对象时,另外的2个可看作是线路或是电阻。
先选定湿润的碘化钾淀粉试纸为研究对象。由于C端变为蓝色,可知C端有I2生成:2I--2e- = I2
I2使淀粉变蓝色。该反应是在电解池的阳极发生的反应,由此可以断定外接电源的E端为负极,F端为正极。
(1)、(2)选A(或B)为研究对象,可忽略B(或A)和碘化钾淀粉试纸的存在。
(3)由题意可知如下关系式: 4H+~O2~2H2
根据气体的体积可求出n(H+)、c(H+)及pH。
