鲁教版九年级化学下册 7.3溶液的酸碱性课件(共38张PPT)
文档属性
| 名称 | 鲁教版九年级化学下册 7.3溶液的酸碱性课件(共38张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-28 15:27:46 | ||
图片预览









文档简介
(共39张PPT)
柠檬
山楂
酸桔子
“尝起来酸酸的”
“摸起来滑滑的”
1.生活中的酸有哪些?
“酸”一词从有酸味的酒而来。最早,在制酒的时候,有时把比较珍贵的酒放在窖中保存,在微生物的作用下,产生了酸。
2.生活中的碱有哪些?
“碱”一词在阿拉伯语中表示灰。人们将草木灰放到水中,利用灰汁洗浴、印染等。
生活中的酸有:食醋有酸味、食醋中的醋酸(CH3COOH);水果有酸味、水果中有果酸,如杨梅很酸——望梅止渴、苹果中有苹果酸、柠檬、柑桔等水果中有柠檬酸等。
生活中的碱有:石灰水中有氢氧化钙,炉具清洁剂中含有氢氧化钠,它们都是碱。吃的皮蛋中也有碱。
3.常见的酸有盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)、还有磷酸(H3PO4)、碳酸(H2CO3)、醋酸(CH3COOH)等。
4.常见的碱有氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]、氢氧化钾(KOH)、氢氧化铜[Cu(OH)2]、氨水(NH3·H2O)等。
从名称上看它们最后一个字都是“酸”,从结构上看都含有氢元素。
从名称上看都叫“氢氧化某”;从结构上看都含有氢氧根(OH)
实验探究
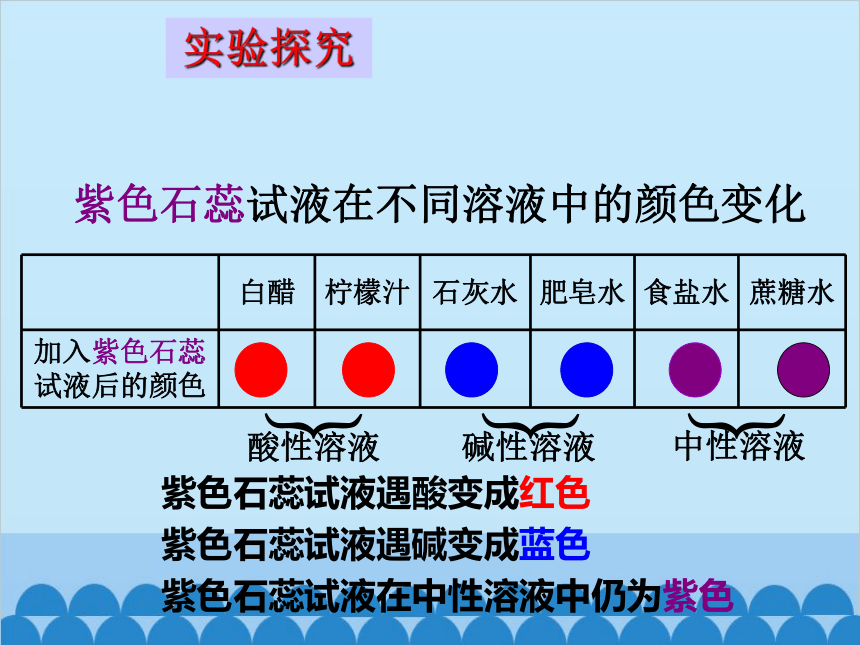
紫色石蕊试液在不同溶液中的颜色变化
白醋 柠檬汁 石灰水 肥皂水 食盐水 蔗糖水
加入紫色石蕊试液后的颜色
︸
︸
︸
酸性溶液
中性溶液
碱性溶液
紫色石蕊试液遇酸变成红色
紫色石蕊试液遇碱变成蓝色
紫色石蕊试液在中性溶液中仍为紫色
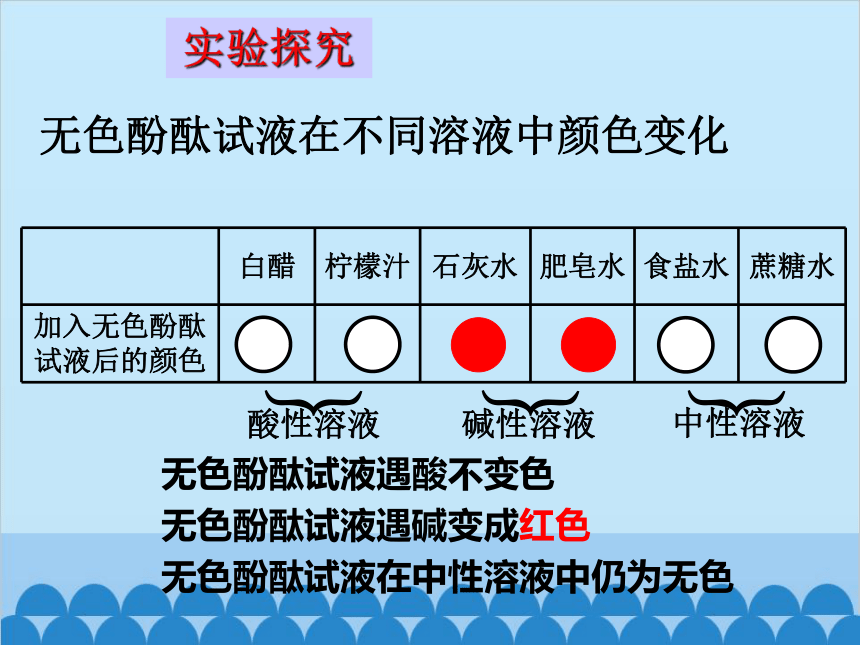
无色酚酞试液在不同溶液中颜色变化
白醋 柠檬汁 石灰水 肥皂水 食盐水 蔗糖水
加入无色酚酞试液后的颜色
︸
︸
︸
酸性溶液
中性溶液
碱性溶液
无色酚酞试液遇酸不变色
无色酚酞试液遇碱变成红色
无色酚酞试液在中性溶液中仍为无色
实验探究
一、如何检验溶液的酸碱性
1.酸碱指示剂:
遇到酸或碱时能发生特定的颜色变化的物质
2.常见的酸碱指示剂:
紫色的石蕊试液 无色的酚酞试液
3.酸碱指示剂的作用:
区分或检验 酸性溶液和碱性溶液
酸性溶液 中性溶液 碱性溶液
石蕊试液 紫色
酚酞试液 无色
变为红色
变为蓝色
不变色
变为红色
4.石蕊试纸:
蓝色石蕊试纸
红色石蕊试纸
检验酸
检验碱
蓝色石蕊试纸遇酸变为红色
红色石蕊试纸遇碱变为蓝色
如何用酸碱指示剂检验溶液的酸碱性?
检验溶液是酸性的方法:取少量该溶液,滴入几滴石蕊试液,若溶液呈现红色,则说明该溶液为酸性溶液。
检验溶液为碱性的方法:取少量该溶液,滴入几滴石蕊试液,若溶液呈现蓝色;
或者滴入几滴无色的酚酞试液,若溶液呈现红色,则说明该溶液为碱性溶液。
巩固练习:
1.盐酸是酸溶液,它使紫色石蕊溶液变______,
遇无色酚酞溶液_______。
2.氢氧化钠溶液是碱溶液,它使石蕊溶液变____,使酚酞溶液变______。
红色
仍无色
蓝色
红色
3.紫色石蕊溶液滴入碱溶液(如石灰水)变_____,
在紫色石蕊溶液滴入酸溶液(如稀硫酸)变______。
4.无色酚酞溶液滴入碱溶液(如石灰水)变____,
在无色酚酞溶液滴入酸溶液(如稀硫酸)显_____。
蓝色
红色
红色
无色
注意:是指示剂在变色,不是酸溶液和碱溶液在变色。如说石蕊溶液使盐酸变红色的说法是错误的。
指示剂的发现
自制指示剂原料
月季花
牵牛花
紫萝卜
美人焦
胡萝卜
紫包菜
活动与探究:自制酸碱指示剂。
⑴取几种植物的花瓣或果实(如牵牛花、月季花、紫卷心菜、胡萝卜等),分别在研钵中捣烂,加入酒精(乙醇与水的体积比为1:1)浸泡;
⑵用纱布将浸泡出的汁液过滤或挤出,得到指示剂;
⑶试验指示剂在上述4种溶液中的颜色变化。
指示剂
(溶液) 在不同溶液中的颜色变化
食醋 石灰水 盐酸 氢氧化钠溶液
红菜苔
胡萝卜
土豆
指示剂
(溶液) 在不同溶液中的颜色变化
食醋 石灰水 盐酸 氢氧化钠溶液
紫色菊花瓣汁 红色 绿色 红色 绿色
金盈菊花瓣汁 黄色 黄色 黄色 黄色
三角梅花瓣汁 红色 黄色 红色 黄色
紫色包菜叶汁 红色 绿色 红色 绿色
讨论:上述实验结果,哪些不可以作酸碱指示剂?
讨论:上述实验结果,哪些可以作酸碱指示剂?
金盈菊花瓣汁,因为在酸、碱溶液中没有变色。
紫色菊花瓣汁,三角梅花瓣汁、紫色包菜叶汁。
巩固练习:
5.下表是四种花的提取液实验的(酒精用于提取花中的色素)
⑴上表中能做酸碱指示剂的花汁是;____________
⑵将厨房中的少量白醋滴入大红花的花汁中,可以看到的现象是_________;
⑶若将紫罗兰提取液滴入氯化钠溶液中,则可看到的现象是____________。
酒精中 酸溶液中 碱溶液中
大红花 粉红色 橙色 绿色
紫罗兰 紫色 红色 蓝色
万寿菊 黄色 黄色 黄色
大红花、紫罗兰
橙色
紫色
与同学合作,课外收集一些花卉、水果和蔬菜,提取其汁液,制作酸碱指示剂,用其检验家中的白醋、果汁、石灰水、肥皂水、自来水、淋浴液等物质的酸碱性。
课外活动
巩固练习:
6.能使紫色石蕊溶液变蓝的溶液,它能使无色酚酞溶液 ( )
A.变红色 B.变蓝色 C.呈无色 D.变紫色
A
7.下列物质的水溶液能使紫色石蕊溶液变红色的是 ( )
A.NaCl B.NH3 C.HCl D.NaOH
C
盐类、中性
变成氨水
后是碱类
盐酸是酸类
是碱类
巩固练习:
8.化学兴趣学习小组的同学采集了三种植物的花瓣,将它们分别放在研钵中研磨,加入酒精充分浸泡后过滤,得到了三种溶液。将三种溶液分别滴加到下列液体中,得到以下信息:
试回答: ⑴如果用所制得的溶液检验花盆中土壤的酸碱性,你会建议选择__________花的酒精溶液来作酸碱指示剂;在上述三种酒精溶液中,酒精属于_________。(填“溶质”或“溶剂”)
⑵如果得知花盆中的土壤显酸性,某种花卉适合微碱性条件下生长,你会建议选择上表中的__________来进行改良。
玫瑰
溶剂
花的种类 所制成溶液的颜色 有关试剂呈现的颜色
白醋 蒸馏水 石灰水
玫瑰 粉红色 红色 粉红色 绿色
黄菊 黄色 黄色 黄色 黄色
雏菊 无色 无色 无色 黄色
石灰水
巩固练习:9.著名化学家罗伯特·波意耳在一次实验中,不小心将盐酸溅到紫罗兰花瓣上,过了一会儿,他惊奇的发现,紫色的花瓣上出现了红点点。波意耳对这意外的发现,作出了各种假设,经过多次实验验证,探究普遍规律,终于获得了成功。对紫罗兰花瓣遇盐酸变红的现象,你有哪些假设 请将你的各种假设以及验证假设的实验方案填写在下表中。
你对紫罗兰花瓣遇酸变红现象的各种假设 你验证假没的实验方案
⑴其他酸也能使花瓣变红色吗
⑴将稀硫酸、稀硝酸等酸分别滴到花瓣上,观察现象
⑵盐酸能使其他种类的花瓣变色吗
⑵将盐酸分别滴到其他种类的花瓣上,观察现象
⑶碱溶液也能使花瓣变色吗
⑶将氢氧化钠、氢氧化钙等碱溶液分别滴到花瓣上,观察现象
1.说出你所知道的酸性物质和碱性物质
2.如何知道某工厂排出的废液是酸性的还是碱性的?(可用多种方法)
达标练习
(1)用酸碱指示剂
(1)用石蕊试纸
间接观察法
电离
电离:物质溶解于水产生自由移动的离子
氯化钠 NaCl
知识回顾
注意:化合物电离时原子团不变
碳酸钠 Na2CO3
= 2Na+ + CO32-
= Na+ + Cl-
硫酸 H2SO4
= 2H+ + SO42-
氢氧化钠 NaOH
= Na+ + OH-
电离时生成的阴离子全部是氢氧根离子(OH-)的化合物叫做碱。
第一站:识别酸和碱
氢氧化钾KOH
[快乐参与]
氢氧化钠NaOH
Na+ 、OH- K+ 、OH-
Na+ 、OH- K+ 、OH-
金属离子和OH-
第一站:识别酸和碱
选出所列物质中的酸和碱(填序号)
酸:
碱:
①HNO3 ④NH4Cl
②Na2SO4 ⑤H2CO3
③Ca(OH)2 ⑥Ba(OH)2
①⑤
③⑥
原子团
氢氧根 OH
硫酸根 SO4
硝酸根 NO3
碳酸根 CO3
铵根 NH4
H+
OH-
酸溶液
碱溶液
酸性
碱性
二、怎样判断溶液酸碱性的强弱
1、溶液的酸碱性
(1)酸性:
酸溶液: H+
酸性
(2)碱性:
碱溶液: OH-
碱性
溶液酸碱性的强弱程度
1.溶液酸碱性强弱程度用pH表示
溶液酸碱性的强弱程度跟什么有关?
pH的范围如何规定?
pH的大小与溶液酸碱性有什么关系?
pH如何测定?
阅读提纲
一定量的水溶液中H+的数量越多,酸性越强。
一定量的水溶液中OH-的数量越多,碱性越强。
pH的范围通常在0~14之间
中性
酸性逐渐增强
碱性逐渐增强
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
pH
pH<7 溶液显酸性pH=7 溶液显中性pH>7 溶液显碱性
溶液酸碱性的强弱程度
1.溶液酸碱性强弱程度用pH表示
(pH的范围通常在0~14之间)
中性
酸性逐渐增强
碱性逐渐增强
2.pH的测定——
pH试纸
在玻璃片或白瓷板上放一片pH 试纸,用玻璃棒蘸取被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH 。
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
pH
取不同的溶液,用pH试纸测定它们的pH
2、溶液酸碱性的强弱
(1)酸碱性的强弱
(2)酸碱性强弱的表示:
pH
(3)酸碱性强弱与pH的关系:
一定量溶液 H+ 数量越多酸性越强;
OH- 数量越多碱性越强
pH的范围:0~14之间
(1)pH=7 溶液显中性
(2)pH<7 溶液显酸性
(3)pH>7 溶液显碱性
pH越小,酸性越强
pH越大,碱性越强
酸性逐渐增强
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
pH
中性
碱性逐渐增强
(4)pH的测定:
pH试纸
在玻璃片或白瓷板上放一片pH 试纸,用玻璃棒蘸取被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,得出被测液的pH 。
(4)pH的测定:
pH试纸
在玻璃片或白瓷板上放一片pH 试纸,用玻璃棒蘸取被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH 。
注意: 1.不能直接把试纸浸入试液,否则会污染试液。
2.不能先用蒸馏水湿润PH试纸,否则会稀释试液的浓度,测出来的PH值就不准确。
测定生活中一些物质的pH,说明它们的酸碱性:
pH 酸碱性 pH 酸碱性
橘汁 3~4 弱酸性 汽水 3~4 弱酸性
糖水 7 中性 自来水 6~7 弱酸性
牛奶 6~7 弱酸性 唾液 6~7 弱酸性
番茄汁 4~6 弱酸性 草木灰水 8~11 弱碱性
肥皂水 8~10 弱碱性 洗洁精 6~7 弱酸性
溶液酸碱度对头发的影响
pH=1 pH=7 pH=13
观察头发光泽
拉断的难易程度
光泽好
难
正常
正常
很不好
很易
讨论:溶液的酸碱度对头发有什么影响?对你选择洗发液有什么启示?
答:碱性物质对头发有损坏作用。所以洗发液应选接近中性的,不要选碱性大的洗发液。然后再用微酸性的护发素来保护头发。
调查与研究
简单测定土壤酸碱性的方法:取样,溶解,测定。
三、物质的酸碱性对生命活动的意义
1、酸和碱与人的生理活动密切相关
2、土壤的酸碱性对植物的生长非常重要
人体某些体液的正常pH范围
血液 唾液 胃液 乳汁 尿液
pH 7.35~7.45 6.6~7.1 0.8~1.5 6.4~6.7 5.0~7.0
大多数植物适宜在接近中性的土壤生长
西瓜6.0~7.0
苹果树6.0~8.0
小麦6.0~7.0
谈一谈,在今天的探究之旅中,你有哪些收获?
生活中的酸和碱
1.你能行:在线测试
2.试试看:见知识领航
3.
查阅网站:酸碱世界http://chemedu.pu.edu.tw/acidbase/acidbaseleft.htm了解更多的有关酸和碱的知识。
稀盐酸可以使紫色石蕊试液变红。已知,在稀盐酸中存在H2O分子、H+ 、Cl- 三种微粒。 请设计实验探究是哪一种微粒使紫色石蕊试液变红?(相关信息:氯化钠溶液中含有Cl- )
提出问题:
建立假设:
设计实验:
动手实验:
交流共享:
获得结论:
稀盐酸中哪一种微粒能使紫色石蕊试液变红?
稀盐酸中的氢离子使紫色石蕊试液变红。
可能是氢离子使紫色石蕊试液变红。
柠檬
山楂
酸桔子
“尝起来酸酸的”
“摸起来滑滑的”
1.生活中的酸有哪些?
“酸”一词从有酸味的酒而来。最早,在制酒的时候,有时把比较珍贵的酒放在窖中保存,在微生物的作用下,产生了酸。
2.生活中的碱有哪些?
“碱”一词在阿拉伯语中表示灰。人们将草木灰放到水中,利用灰汁洗浴、印染等。
生活中的酸有:食醋有酸味、食醋中的醋酸(CH3COOH);水果有酸味、水果中有果酸,如杨梅很酸——望梅止渴、苹果中有苹果酸、柠檬、柑桔等水果中有柠檬酸等。
生活中的碱有:石灰水中有氢氧化钙,炉具清洁剂中含有氢氧化钠,它们都是碱。吃的皮蛋中也有碱。
3.常见的酸有盐酸(HCl)、硫酸(H2SO4)、硝酸(HNO3)、还有磷酸(H3PO4)、碳酸(H2CO3)、醋酸(CH3COOH)等。
4.常见的碱有氢氧化钠(NaOH)、氢氧化钙[Ca(OH)2]、氢氧化钾(KOH)、氢氧化铜[Cu(OH)2]、氨水(NH3·H2O)等。
从名称上看它们最后一个字都是“酸”,从结构上看都含有氢元素。
从名称上看都叫“氢氧化某”;从结构上看都含有氢氧根(OH)
实验探究
紫色石蕊试液在不同溶液中的颜色变化
白醋 柠檬汁 石灰水 肥皂水 食盐水 蔗糖水
加入紫色石蕊试液后的颜色
︸
︸
︸
酸性溶液
中性溶液
碱性溶液
紫色石蕊试液遇酸变成红色
紫色石蕊试液遇碱变成蓝色
紫色石蕊试液在中性溶液中仍为紫色
无色酚酞试液在不同溶液中颜色变化
白醋 柠檬汁 石灰水 肥皂水 食盐水 蔗糖水
加入无色酚酞试液后的颜色
︸
︸
︸
酸性溶液
中性溶液
碱性溶液
无色酚酞试液遇酸不变色
无色酚酞试液遇碱变成红色
无色酚酞试液在中性溶液中仍为无色
实验探究
一、如何检验溶液的酸碱性
1.酸碱指示剂:
遇到酸或碱时能发生特定的颜色变化的物质
2.常见的酸碱指示剂:
紫色的石蕊试液 无色的酚酞试液
3.酸碱指示剂的作用:
区分或检验 酸性溶液和碱性溶液
酸性溶液 中性溶液 碱性溶液
石蕊试液 紫色
酚酞试液 无色
变为红色
变为蓝色
不变色
变为红色
4.石蕊试纸:
蓝色石蕊试纸
红色石蕊试纸
检验酸
检验碱
蓝色石蕊试纸遇酸变为红色
红色石蕊试纸遇碱变为蓝色
如何用酸碱指示剂检验溶液的酸碱性?
检验溶液是酸性的方法:取少量该溶液,滴入几滴石蕊试液,若溶液呈现红色,则说明该溶液为酸性溶液。
检验溶液为碱性的方法:取少量该溶液,滴入几滴石蕊试液,若溶液呈现蓝色;
或者滴入几滴无色的酚酞试液,若溶液呈现红色,则说明该溶液为碱性溶液。
巩固练习:
1.盐酸是酸溶液,它使紫色石蕊溶液变______,
遇无色酚酞溶液_______。
2.氢氧化钠溶液是碱溶液,它使石蕊溶液变____,使酚酞溶液变______。
红色
仍无色
蓝色
红色
3.紫色石蕊溶液滴入碱溶液(如石灰水)变_____,
在紫色石蕊溶液滴入酸溶液(如稀硫酸)变______。
4.无色酚酞溶液滴入碱溶液(如石灰水)变____,
在无色酚酞溶液滴入酸溶液(如稀硫酸)显_____。
蓝色
红色
红色
无色
注意:是指示剂在变色,不是酸溶液和碱溶液在变色。如说石蕊溶液使盐酸变红色的说法是错误的。
指示剂的发现
自制指示剂原料
月季花
牵牛花
紫萝卜
美人焦
胡萝卜
紫包菜
活动与探究:自制酸碱指示剂。
⑴取几种植物的花瓣或果实(如牵牛花、月季花、紫卷心菜、胡萝卜等),分别在研钵中捣烂,加入酒精(乙醇与水的体积比为1:1)浸泡;
⑵用纱布将浸泡出的汁液过滤或挤出,得到指示剂;
⑶试验指示剂在上述4种溶液中的颜色变化。
指示剂
(溶液) 在不同溶液中的颜色变化
食醋 石灰水 盐酸 氢氧化钠溶液
红菜苔
胡萝卜
土豆
指示剂
(溶液) 在不同溶液中的颜色变化
食醋 石灰水 盐酸 氢氧化钠溶液
紫色菊花瓣汁 红色 绿色 红色 绿色
金盈菊花瓣汁 黄色 黄色 黄色 黄色
三角梅花瓣汁 红色 黄色 红色 黄色
紫色包菜叶汁 红色 绿色 红色 绿色
讨论:上述实验结果,哪些不可以作酸碱指示剂?
讨论:上述实验结果,哪些可以作酸碱指示剂?
金盈菊花瓣汁,因为在酸、碱溶液中没有变色。
紫色菊花瓣汁,三角梅花瓣汁、紫色包菜叶汁。
巩固练习:
5.下表是四种花的提取液实验的(酒精用于提取花中的色素)
⑴上表中能做酸碱指示剂的花汁是;____________
⑵将厨房中的少量白醋滴入大红花的花汁中,可以看到的现象是_________;
⑶若将紫罗兰提取液滴入氯化钠溶液中,则可看到的现象是____________。
酒精中 酸溶液中 碱溶液中
大红花 粉红色 橙色 绿色
紫罗兰 紫色 红色 蓝色
万寿菊 黄色 黄色 黄色
大红花、紫罗兰
橙色
紫色
与同学合作,课外收集一些花卉、水果和蔬菜,提取其汁液,制作酸碱指示剂,用其检验家中的白醋、果汁、石灰水、肥皂水、自来水、淋浴液等物质的酸碱性。
课外活动
巩固练习:
6.能使紫色石蕊溶液变蓝的溶液,它能使无色酚酞溶液 ( )
A.变红色 B.变蓝色 C.呈无色 D.变紫色
A
7.下列物质的水溶液能使紫色石蕊溶液变红色的是 ( )
A.NaCl B.NH3 C.HCl D.NaOH
C
盐类、中性
变成氨水
后是碱类
盐酸是酸类
是碱类
巩固练习:
8.化学兴趣学习小组的同学采集了三种植物的花瓣,将它们分别放在研钵中研磨,加入酒精充分浸泡后过滤,得到了三种溶液。将三种溶液分别滴加到下列液体中,得到以下信息:
试回答: ⑴如果用所制得的溶液检验花盆中土壤的酸碱性,你会建议选择__________花的酒精溶液来作酸碱指示剂;在上述三种酒精溶液中,酒精属于_________。(填“溶质”或“溶剂”)
⑵如果得知花盆中的土壤显酸性,某种花卉适合微碱性条件下生长,你会建议选择上表中的__________来进行改良。
玫瑰
溶剂
花的种类 所制成溶液的颜色 有关试剂呈现的颜色
白醋 蒸馏水 石灰水
玫瑰 粉红色 红色 粉红色 绿色
黄菊 黄色 黄色 黄色 黄色
雏菊 无色 无色 无色 黄色
石灰水
巩固练习:9.著名化学家罗伯特·波意耳在一次实验中,不小心将盐酸溅到紫罗兰花瓣上,过了一会儿,他惊奇的发现,紫色的花瓣上出现了红点点。波意耳对这意外的发现,作出了各种假设,经过多次实验验证,探究普遍规律,终于获得了成功。对紫罗兰花瓣遇盐酸变红的现象,你有哪些假设 请将你的各种假设以及验证假设的实验方案填写在下表中。
你对紫罗兰花瓣遇酸变红现象的各种假设 你验证假没的实验方案
⑴其他酸也能使花瓣变红色吗
⑴将稀硫酸、稀硝酸等酸分别滴到花瓣上,观察现象
⑵盐酸能使其他种类的花瓣变色吗
⑵将盐酸分别滴到其他种类的花瓣上,观察现象
⑶碱溶液也能使花瓣变色吗
⑶将氢氧化钠、氢氧化钙等碱溶液分别滴到花瓣上,观察现象
1.说出你所知道的酸性物质和碱性物质
2.如何知道某工厂排出的废液是酸性的还是碱性的?(可用多种方法)
达标练习
(1)用酸碱指示剂
(1)用石蕊试纸
间接观察法
电离
电离:物质溶解于水产生自由移动的离子
氯化钠 NaCl
知识回顾
注意:化合物电离时原子团不变
碳酸钠 Na2CO3
= 2Na+ + CO32-
= Na+ + Cl-
硫酸 H2SO4
= 2H+ + SO42-
氢氧化钠 NaOH
= Na+ + OH-
电离时生成的阴离子全部是氢氧根离子(OH-)的化合物叫做碱。
第一站:识别酸和碱
氢氧化钾KOH
[快乐参与]
氢氧化钠NaOH
Na+ 、OH- K+ 、OH-
Na+ 、OH- K+ 、OH-
金属离子和OH-
第一站:识别酸和碱
选出所列物质中的酸和碱(填序号)
酸:
碱:
①HNO3 ④NH4Cl
②Na2SO4 ⑤H2CO3
③Ca(OH)2 ⑥Ba(OH)2
①⑤
③⑥
原子团
氢氧根 OH
硫酸根 SO4
硝酸根 NO3
碳酸根 CO3
铵根 NH4
H+
OH-
酸溶液
碱溶液
酸性
碱性
二、怎样判断溶液酸碱性的强弱
1、溶液的酸碱性
(1)酸性:
酸溶液: H+
酸性
(2)碱性:
碱溶液: OH-
碱性
溶液酸碱性的强弱程度
1.溶液酸碱性强弱程度用pH表示
溶液酸碱性的强弱程度跟什么有关?
pH的范围如何规定?
pH的大小与溶液酸碱性有什么关系?
pH如何测定?
阅读提纲
一定量的水溶液中H+的数量越多,酸性越强。
一定量的水溶液中OH-的数量越多,碱性越强。
pH的范围通常在0~14之间
中性
酸性逐渐增强
碱性逐渐增强
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
pH
pH<7 溶液显酸性pH=7 溶液显中性pH>7 溶液显碱性
溶液酸碱性的强弱程度
1.溶液酸碱性强弱程度用pH表示
(pH的范围通常在0~14之间)
中性
酸性逐渐增强
碱性逐渐增强
2.pH的测定——
pH试纸
在玻璃片或白瓷板上放一片pH 试纸,用玻璃棒蘸取被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH 。
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
pH
取不同的溶液,用pH试纸测定它们的pH
2、溶液酸碱性的强弱
(1)酸碱性的强弱
(2)酸碱性强弱的表示:
pH
(3)酸碱性强弱与pH的关系:
一定量溶液 H+ 数量越多酸性越强;
OH- 数量越多碱性越强
pH的范围:0~14之间
(1)pH=7 溶液显中性
(2)pH<7 溶液显酸性
(3)pH>7 溶液显碱性
pH越小,酸性越强
pH越大,碱性越强
酸性逐渐增强
0 1 2 3 4 5 6 7 8 9 10 11 12 13 14
pH
中性
碱性逐渐增强
(4)pH的测定:
pH试纸
在玻璃片或白瓷板上放一片pH 试纸,用玻璃棒蘸取被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,得出被测液的pH 。
(4)pH的测定:
pH试纸
在玻璃片或白瓷板上放一片pH 试纸,用玻璃棒蘸取被测液滴到试纸上,把试纸显示的颜色与标准比色卡比较,即可得出被测液的pH 。
注意: 1.不能直接把试纸浸入试液,否则会污染试液。
2.不能先用蒸馏水湿润PH试纸,否则会稀释试液的浓度,测出来的PH值就不准确。
测定生活中一些物质的pH,说明它们的酸碱性:
pH 酸碱性 pH 酸碱性
橘汁 3~4 弱酸性 汽水 3~4 弱酸性
糖水 7 中性 自来水 6~7 弱酸性
牛奶 6~7 弱酸性 唾液 6~7 弱酸性
番茄汁 4~6 弱酸性 草木灰水 8~11 弱碱性
肥皂水 8~10 弱碱性 洗洁精 6~7 弱酸性
溶液酸碱度对头发的影响
pH=1 pH=7 pH=13
观察头发光泽
拉断的难易程度
光泽好
难
正常
正常
很不好
很易
讨论:溶液的酸碱度对头发有什么影响?对你选择洗发液有什么启示?
答:碱性物质对头发有损坏作用。所以洗发液应选接近中性的,不要选碱性大的洗发液。然后再用微酸性的护发素来保护头发。
调查与研究
简单测定土壤酸碱性的方法:取样,溶解,测定。
三、物质的酸碱性对生命活动的意义
1、酸和碱与人的生理活动密切相关
2、土壤的酸碱性对植物的生长非常重要
人体某些体液的正常pH范围
血液 唾液 胃液 乳汁 尿液
pH 7.35~7.45 6.6~7.1 0.8~1.5 6.4~6.7 5.0~7.0
大多数植物适宜在接近中性的土壤生长
西瓜6.0~7.0
苹果树6.0~8.0
小麦6.0~7.0
谈一谈,在今天的探究之旅中,你有哪些收获?
生活中的酸和碱
1.你能行:在线测试
2.试试看:见知识领航
3.
查阅网站:酸碱世界http://chemedu.pu.edu.tw/acidbase/acidbaseleft.htm了解更多的有关酸和碱的知识。
稀盐酸可以使紫色石蕊试液变红。已知,在稀盐酸中存在H2O分子、H+ 、Cl- 三种微粒。 请设计实验探究是哪一种微粒使紫色石蕊试液变红?(相关信息:氯化钠溶液中含有Cl- )
提出问题:
建立假设:
设计实验:
动手实验:
交流共享:
获得结论:
稀盐酸中哪一种微粒能使紫色石蕊试液变红?
稀盐酸中的氢离子使紫色石蕊试液变红。
可能是氢离子使紫色石蕊试液变红。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
