鲁教版九年级化学下册 7.4酸碱中和反应说课稿课件(共32张PPT)
文档属性
| 名称 | 鲁教版九年级化学下册 7.4酸碱中和反应说课稿课件(共32张PPT) |
|
|
| 格式 | ppt | ||
| 文件大小 | 12.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-30 08:44:02 | ||
图片预览







文档简介
(共33张PPT)
教学模式
学情分析
课程资源
开发
教材分析
板书设计
教学设计
课堂评价
说课流程
设计愿景
本课题为了说明中和反应的产物,简单介绍了盐的概念。为下一章盐的学习做了铺垫。
中和反应是酸和碱的重要性质,是贯穿酸、碱、盐知识体系的一个重要纽带
酸碱中和反应往往无现象是需要解决的难点
中和反应在《生活中常见的化合物》和《物质的化学变化》两个一级主题中有重要体现
酸和碱之间发生的中和反应在实际生活中有广泛的应用,所以,教材没有简单将它作为酸或碱的性质来介绍,而是专门编成一个课题来说明。
教材分析——教材的地位及作用
掌握中和反应的实质,为高中学习“离子反应”,打下良好基础
了解酸雨、水污染,认识酸和碱能够使酸碱指示剂变色为中和反应的应用做铺垫
酸碱中和反应往往无现象是需要解决的难点
具备了一定的问题探究能力,小组合作经验,为合作探究奠定基础。
学情分析
通过合作探究、
讨论交流,培养
学生发现问题,
动手实践和团结协作
的能力。
体会化学与
社会的密切
关系,增强
学生对社会
的责任感。
通过实验探究领会
中和反应、盐的概念,
了解中和反应在实际
生活中的应用。
知识与技能
过程与方法
三维目标
情感态度与价值观
通过学生自主的
实验探究,初步
学会判断化学反应
是否发生的
某些方法。
教材分析
中和反应的定义、
实质及其应用。
教学重难点
中和反应的
探究过程和
原理的理解。
教材分析
难点
重点
基 本 理 念
教学模式——设计理念
坚持“学生发展为本”的核心理念
重视教师在课堂教学中的主导作用
体现“六环节互动式”教学与化学教学的融合
让学生主动
体验探究中
和反应滴定
让学生了解
中和反应在
生活中的应用
为每个学生的发展提供多样化的学习评价方式
教学模式
形成
教学模式—“六环节互动式”教学模式
激疑
探究
预习检测,问题生成
合作学习,交流展示
精讲点拨,梳理归纳
达标测评,反馈矫正
反思总结,拓展延伸
自主学习,预习新知
教
学
原
则
促进学生发展
实验为
基础、
理论为
线索
关注生活化学
教师为
主导、学生为
主体
教学模式——教学原则
2
3
1
情境教学法
实验探究法
传统与多媒体演示有效结合法
教学策略
教学模式——教学策略
实验探究法
自主学习法
学生学习方法
合作学习法
学科模式——学习方法
教
学
流
程
教学流程
学生自主设计
实验,指示剂
“多中选优”。
(8分钟)
自主学习,预习新知
课前完成学案“知识回顾”
学生感受没有现象的反应,
探究借用指示剂(2分钟)
深入探究中和
反应生成物,
掌握中和反应
和盐的概念(8分钟)
播放中和反应的
微观过程示图,直观地感受中和反应 (4分钟)
自学并观看多媒体相关图片及问题,了解中和反应在实际中的应用
(6分钟)
典型例题训练法
实际应用题与现实生活相联系
预习检测,问题生成
合作学习,交流展示(18分钟)
精讲点拨,梳理归纳
达标测评,反馈矫正
反思总结,拓展延伸
腌制过程中生成了碱
吃起来有涩味
蘸少量的食醋
涩味消失
醋酸
发生化学反应了?
教学过程——〈一〉自主学习,预习新知
知识回顾
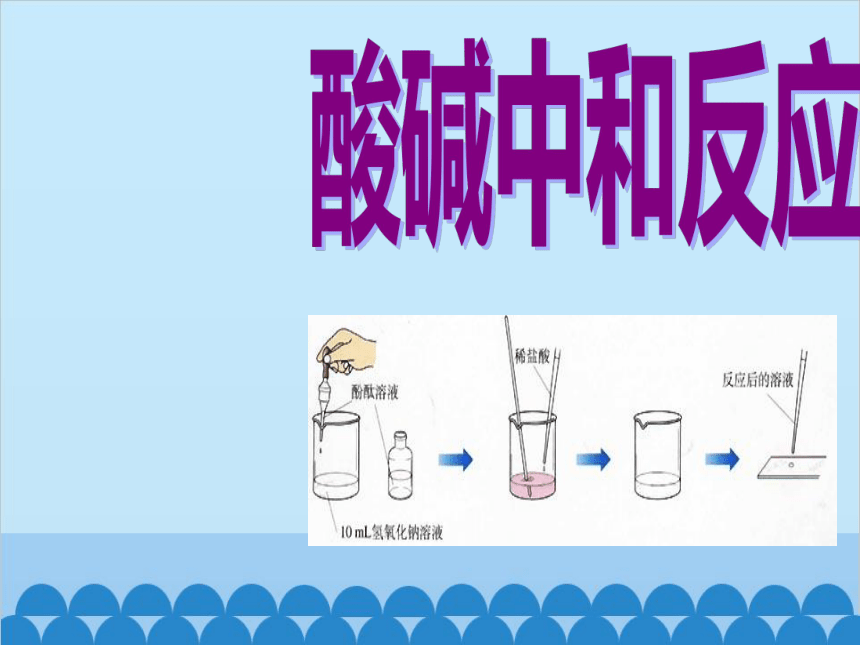
【学生实验】往氢氧化钠溶液中逐滴滴加稀盐酸。
观 察:无现象
问题生成:无现象说明什么问题呢?(反应了、没反应)
教学过程——〈二〉预习检测,问题生成
1.学生感受没有现象的反应,探究借用指示剂。
【提出假设】酸碱之间可以发生反应。
【实验验证】
2、学生自主设计实验,指示剂“多中选优”
教学过程——〈三〉合作学习,交流展示
2、学生自主设计实验,指示剂“多中选优”
方案一:
滴酚酞溶液 滴加稀盐酸
稀NaOH溶液(无色) →→→→ →→ 溶液变红 →→→→→→ 溶液红色变无色,
振荡 振荡
方案二:
滴酚酞溶液 滴加稀NaOH溶液
稀盐酸(无色) →→→→ →→ →→ 溶液无色 →→→→→→ 溶液无色变红色
振荡 振荡
方案三:
滴石蕊溶液 滴加稀盐酸
稀NaOH溶液(无色)→→→→ →→ 溶液变蓝色→→→→→→ 溶液变紫色
振荡 振荡
方案四:
滴石蕊溶液 滴加稀NaOH溶液
稀盐酸(无色) →→→→→→ →→ 溶液变红色 →→→→→→ 溶液变紫色
振荡 振荡
教学过程——〈三〉合作学习,交流展示
2、学生根据设计方案进行实验。
教学过程——〈三〉合作学习,交流展示
取适量方案1反应后的溶液滴在玻璃片上,放在石棉网上微热,使液体蒸发,观察玻璃片上的现象。
观察讨论
3、深入探究中和反应生成物,掌握中和反应和盐的概念
教学过程——〈三〉合作学习,交流展示
板书: HCl﹢NaOH = NaCl ﹢H2O
问题探究
碱
酸
盐
水
+
+
由金属离子和酸根离子构成的化合物。
盐
中和反应定义:酸与碱作用生成盐和水的反应。
教学过程——〈三〉合作学习,交流展示
以下的反应均生成盐和水,它们是不是中和反应呢?
CO2+2NaOH=Na2CO3+H2O
不是中和反应。
Fe2O3+6HCl=2FeCl3+3H2O
不是中和反应。
【及时练习】
教学过程——〈三〉合作学习,交流展示
HCl+NaOH=NaCl+H2O的微观解释图:
4、播放中和反应的微观过程示意图,使学生直观地感受中和反应。
教学过程——〈四〉精讲点拨,梳理归纳
HCl+NaOH=NaCl+H2O的微观解释:
HCl=H++Cl-,NaOH=Na++OH-
盐酸与NaOH溶液混合:盐酸中的H+与NaOH溶液中的OH-结合生成了H2O分子。
盐酸中的Cl-与NaOH溶液中的Na+在反应前后不变。
中和反应的实质: H+ + OH- = H2O
总结归纳
教学过程——〈四〉精讲点拨,梳理归纳
腌制过程中生成了碱
吃起来有涩味
蘸少量的食醋
涩味消失
醋酸
发生了中和反应
教学过程——〈五〉达标测评,反馈矫正
教学过程——〈五〉达标测评,反馈矫正
二、中和反应的应用
学生带着问题阅读相关内容自学,讨论交流,了解中和反应在实际中的应用
教学过程——〈六〉反思总结,拓展延伸
酸碱中和反应
一、中和反应
1.中和反应:
酸 + 碱 ==== 盐 + 水
2.中和反应实质:
H++OH-==== H2O
板书设计
二、中和反应的应用
1.改变土壤酸碱性
2.处理工厂废水
3.用于医疗
4.用于日常生活
评价方法
知识与技能
过程与方法
情感态度与价值观
纸笔测验
实验考试
探究报告
自我评价
小组评价
老师家长评价
责任意识
课堂表现
活动表现
评价建议
小组
分工
评价方面 评价等级 总评等级
化学课程评价 组长
记录员
仪器保管员
卫生管理员 自我评价
平时作业
活动探究
课外探究
小组评价
单元测验
教师、家长对其学习情况的观察评语
主要记录、收集学生的活动记录、活动的收获、化学调查报告、化学小论文等。
化学平日资料收集袋
生活
课本
实验
网络
课程资源的开发与利用
生活
课本
实验
网络
自然
人
课程资源的开发与利用
设计愿景
充分利用多媒体
“滴定顺序”设计“反向对比”
“滴定试剂”设计“多中选优”
家庭小实验拓展学生视野
“实验现象”设计“从无到有”
充分发挥学生的主体地位
教师的主导作用充分体现
作为一名教师,精心设计每一堂课,真诚对待每一位学生,快乐地度过每个40分钟,是我们的责任,更是我们的幸福。
教学感悟
教学模式
学情分析
课程资源
开发
教材分析
板书设计
教学设计
课堂评价
说课流程
设计愿景
本课题为了说明中和反应的产物,简单介绍了盐的概念。为下一章盐的学习做了铺垫。
中和反应是酸和碱的重要性质,是贯穿酸、碱、盐知识体系的一个重要纽带
酸碱中和反应往往无现象是需要解决的难点
中和反应在《生活中常见的化合物》和《物质的化学变化》两个一级主题中有重要体现
酸和碱之间发生的中和反应在实际生活中有广泛的应用,所以,教材没有简单将它作为酸或碱的性质来介绍,而是专门编成一个课题来说明。
教材分析——教材的地位及作用
掌握中和反应的实质,为高中学习“离子反应”,打下良好基础
了解酸雨、水污染,认识酸和碱能够使酸碱指示剂变色为中和反应的应用做铺垫
酸碱中和反应往往无现象是需要解决的难点
具备了一定的问题探究能力,小组合作经验,为合作探究奠定基础。
学情分析
通过合作探究、
讨论交流,培养
学生发现问题,
动手实践和团结协作
的能力。
体会化学与
社会的密切
关系,增强
学生对社会
的责任感。
通过实验探究领会
中和反应、盐的概念,
了解中和反应在实际
生活中的应用。
知识与技能
过程与方法
三维目标
情感态度与价值观
通过学生自主的
实验探究,初步
学会判断化学反应
是否发生的
某些方法。
教材分析
中和反应的定义、
实质及其应用。
教学重难点
中和反应的
探究过程和
原理的理解。
教材分析
难点
重点
基 本 理 念
教学模式——设计理念
坚持“学生发展为本”的核心理念
重视教师在课堂教学中的主导作用
体现“六环节互动式”教学与化学教学的融合
让学生主动
体验探究中
和反应滴定
让学生了解
中和反应在
生活中的应用
为每个学生的发展提供多样化的学习评价方式
教学模式
形成
教学模式—“六环节互动式”教学模式
激疑
探究
预习检测,问题生成
合作学习,交流展示
精讲点拨,梳理归纳
达标测评,反馈矫正
反思总结,拓展延伸
自主学习,预习新知
教
学
原
则
促进学生发展
实验为
基础、
理论为
线索
关注生活化学
教师为
主导、学生为
主体
教学模式——教学原则
2
3
1
情境教学法
实验探究法
传统与多媒体演示有效结合法
教学策略
教学模式——教学策略
实验探究法
自主学习法
学生学习方法
合作学习法
学科模式——学习方法
教
学
流
程
教学流程
学生自主设计
实验,指示剂
“多中选优”。
(8分钟)
自主学习,预习新知
课前完成学案“知识回顾”
学生感受没有现象的反应,
探究借用指示剂(2分钟)
深入探究中和
反应生成物,
掌握中和反应
和盐的概念(8分钟)
播放中和反应的
微观过程示图,直观地感受中和反应 (4分钟)
自学并观看多媒体相关图片及问题,了解中和反应在实际中的应用
(6分钟)
典型例题训练法
实际应用题与现实生活相联系
预习检测,问题生成
合作学习,交流展示(18分钟)
精讲点拨,梳理归纳
达标测评,反馈矫正
反思总结,拓展延伸
腌制过程中生成了碱
吃起来有涩味
蘸少量的食醋
涩味消失
醋酸
发生化学反应了?
教学过程——〈一〉自主学习,预习新知
知识回顾
【学生实验】往氢氧化钠溶液中逐滴滴加稀盐酸。
观 察:无现象
问题生成:无现象说明什么问题呢?(反应了、没反应)
教学过程——〈二〉预习检测,问题生成
1.学生感受没有现象的反应,探究借用指示剂。
【提出假设】酸碱之间可以发生反应。
【实验验证】
2、学生自主设计实验,指示剂“多中选优”
教学过程——〈三〉合作学习,交流展示
2、学生自主设计实验,指示剂“多中选优”
方案一:
滴酚酞溶液 滴加稀盐酸
稀NaOH溶液(无色) →→→→ →→ 溶液变红 →→→→→→ 溶液红色变无色,
振荡 振荡
方案二:
滴酚酞溶液 滴加稀NaOH溶液
稀盐酸(无色) →→→→ →→ →→ 溶液无色 →→→→→→ 溶液无色变红色
振荡 振荡
方案三:
滴石蕊溶液 滴加稀盐酸
稀NaOH溶液(无色)→→→→ →→ 溶液变蓝色→→→→→→ 溶液变紫色
振荡 振荡
方案四:
滴石蕊溶液 滴加稀NaOH溶液
稀盐酸(无色) →→→→→→ →→ 溶液变红色 →→→→→→ 溶液变紫色
振荡 振荡
教学过程——〈三〉合作学习,交流展示
2、学生根据设计方案进行实验。
教学过程——〈三〉合作学习,交流展示
取适量方案1反应后的溶液滴在玻璃片上,放在石棉网上微热,使液体蒸发,观察玻璃片上的现象。
观察讨论
3、深入探究中和反应生成物,掌握中和反应和盐的概念
教学过程——〈三〉合作学习,交流展示
板书: HCl﹢NaOH = NaCl ﹢H2O
问题探究
碱
酸
盐
水
+
+
由金属离子和酸根离子构成的化合物。
盐
中和反应定义:酸与碱作用生成盐和水的反应。
教学过程——〈三〉合作学习,交流展示
以下的反应均生成盐和水,它们是不是中和反应呢?
CO2+2NaOH=Na2CO3+H2O
不是中和反应。
Fe2O3+6HCl=2FeCl3+3H2O
不是中和反应。
【及时练习】
教学过程——〈三〉合作学习,交流展示
HCl+NaOH=NaCl+H2O的微观解释图:
4、播放中和反应的微观过程示意图,使学生直观地感受中和反应。
教学过程——〈四〉精讲点拨,梳理归纳
HCl+NaOH=NaCl+H2O的微观解释:
HCl=H++Cl-,NaOH=Na++OH-
盐酸与NaOH溶液混合:盐酸中的H+与NaOH溶液中的OH-结合生成了H2O分子。
盐酸中的Cl-与NaOH溶液中的Na+在反应前后不变。
中和反应的实质: H+ + OH- = H2O
总结归纳
教学过程——〈四〉精讲点拨,梳理归纳
腌制过程中生成了碱
吃起来有涩味
蘸少量的食醋
涩味消失
醋酸
发生了中和反应
教学过程——〈五〉达标测评,反馈矫正
教学过程——〈五〉达标测评,反馈矫正
二、中和反应的应用
学生带着问题阅读相关内容自学,讨论交流,了解中和反应在实际中的应用
教学过程——〈六〉反思总结,拓展延伸
酸碱中和反应
一、中和反应
1.中和反应:
酸 + 碱 ==== 盐 + 水
2.中和反应实质:
H++OH-==== H2O
板书设计
二、中和反应的应用
1.改变土壤酸碱性
2.处理工厂废水
3.用于医疗
4.用于日常生活
评价方法
知识与技能
过程与方法
情感态度与价值观
纸笔测验
实验考试
探究报告
自我评价
小组评价
老师家长评价
责任意识
课堂表现
活动表现
评价建议
小组
分工
评价方面 评价等级 总评等级
化学课程评价 组长
记录员
仪器保管员
卫生管理员 自我评价
平时作业
活动探究
课外探究
小组评价
单元测验
教师、家长对其学习情况的观察评语
主要记录、收集学生的活动记录、活动的收获、化学调查报告、化学小论文等。
化学平日资料收集袋
生活
课本
实验
网络
课程资源的开发与利用
生活
课本
实验
网络
自然
人
课程资源的开发与利用
设计愿景
充分利用多媒体
“滴定顺序”设计“反向对比”
“滴定试剂”设计“多中选优”
家庭小实验拓展学生视野
“实验现象”设计“从无到有”
充分发挥学生的主体地位
教师的主导作用充分体现
作为一名教师,精心设计每一堂课,真诚对待每一位学生,快乐地度过每个40分钟,是我们的责任,更是我们的幸福。
教学感悟
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
