2021-2022学年人教版九年级下册化学第11单元 盐 化肥(word版 含答案)
文档属性
| 名称 | 2021-2022学年人教版九年级下册化学第11单元 盐 化肥(word版 含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 199.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-30 11:13:04 | ||
图片预览



文档简介
2021—2022学年人教九下化学第11单元 盐 化肥含答案
一、选择题。
1、要除去氯化钠溶液中少量的碳酸钠,可加入适量的 ( )
①石灰水 ②氯化钾溶液 ③盐酸 ④氯化钙溶液
A.①② B.③④ C.①③ D.②④
2、下列物质的化学式书写、俗名都正确的是( )
选项 名称 化学式 俗称
A 乙醇 CH3CH2OH 酒精
B 氧化钙 CaO 熟石灰
C 碳酸氢钠 Na2CO3 苏打
D 氯化钠 NaCl2 食盐
3、根据你的经验,下列家庭小实验不能成功的是( )
A. 用自制净水器把浑浊的河水变为澄清的水
B. 用加热的方法修补电木插座
C. 用电池上的“锌皮”与食醋反应制氢气
D. 用小苏打和柠檬酸自制汽水
4、某同学用pH试纸测定溶液的酸碱度,下列操作或结论正确的是 ( )
A.用pH试纸直接蘸取待测溶液
B.先用水润湿pH试纸再测定溶液的酸碱度
C.用普通pH试纸测得石灰水的pH=9.5
D.用pH试纸测得盐酸的pH=1
5、在粗盐提纯的实验操作中,下列说法正确的是( )
A.过滤时用到的仪器有烧杯、玻璃棒、铁架台、滤纸
B.蒸发操作结束后,将蒸发皿放在石棉网上
C.用药匙将蒸发皿中的白色固体直接转移到纸上
D.实验结束后所得到的白色固体为氯化钠
6、某果农发现其种植的桔树生长迟缓,叶色淡黄。经技术人员诊断,必须追加相应的复合肥料。你认为应选用的复合肥料是( )
A.NH4H2PO4 B.NH4NO3 C.CO(NH2)2 D.K2SO4
7、某同学就测定Na2CO3和NaCl固体混合物中NaCl的质量分数,分别取mg样品,按下列方案进行试验,合理的是( )
A. 与足量稀盐酸充分反应,用排水法收集到VmL气体
B. 与足量BaCl2溶液充分反应,将沉淀过滤、洗涤、干燥,得到m1g固体
C. 与足量AgNO3溶液充分反应,将沉淀过滤、洗涤、干燥,得到m2g固体
D. 与足量浓盐酸充分反应,逸出的气体用 NaOH固体充分吸收,固体质量增加m3g
8、、现有4种试剂:①紫色石蕊试液;②稀硫酸;③碳酸钾溶液;④氯化钡溶液。能用来一次性鉴别稀盐酸、氢氧化钡溶液、碳酸钠溶液的试剂有( )
A.② B.②③ C.①②③ D.②③④
9、下列关于酸、碱、盐的用途不合理的是( )
A. 盐酸除铁锈 B. 氢氧化钠改良酸性土壤
C. 硫酸铜与氢氧化钙混合配制农药波尔多液 D. 纯碱除油污
10、下列化肥不能与碱性物质混合施用的是( )
A.NH4Cl B.Ca3(PO4)2 C.K2SO4 D.CO(NH2)2
11、食盐是重要的调味品,精盐是由粗盐提纯而来,在提纯过程中通常不需要的操作是( )
A. 蒸发 B. 吸附 C. 过滤 D. 溶解
12、下列各组物质分别加入足量的水中,能得到无色透明溶液的是( )
A.FeCl3、NaOH、NaCl B.Na2SO4、HCl、BaCl2
C.CuSO4、KCl、HCl D.Na2CO3、NaCl、Na2SO4
二、填空题。
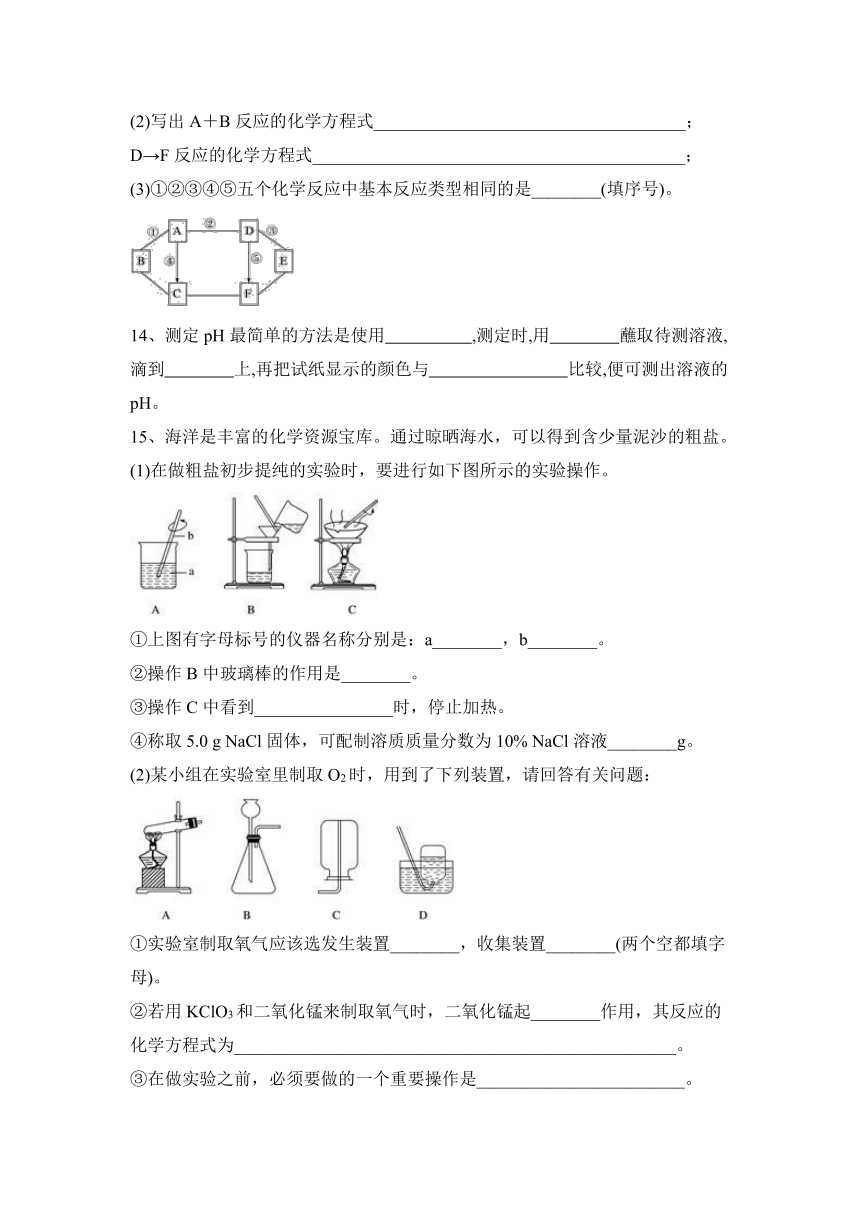
13、如图中A、B、C、D、E、F是初中化学常见的物质,且A、B、C、D、E是五种不同类别的物质,已知B是世界上产量最高的金属,图中“——”表示相连的物质之间可以在溶液中发生化学反应,“―→”表示由某种物质可以转化为另一种物质(部分反应物、生成物及反应条件已略去,所涉及的化学反应均为初中化学学习中常见的反应)。
请回答下列问题:
(1)写出B物质的化学式________,E物质的一种用途________;
(2)写出A+B反应的化学方程式____________________________________;
D→F反应的化学方程式___________________________________________;
(3)①②③④⑤五个化学反应中基本反应类型相同的是________(填序号)。
14、测定pH最简单的方法是使用 ,测定时,用 蘸取待测溶液,滴到 上,再把试纸显示的颜色与 比较,便可测出溶液的pH。
15、海洋是丰富的化学资源宝库。通过晾晒海水,可以得到含少量泥沙的粗盐。
(1)在做粗盐初步提纯的实验时,要进行如下图所示的实验操作。
①上图有字母标号的仪器名称分别是:a________,b________。
②操作B中玻璃棒的作用是________。
③操作C中看到________________时,停止加热。
④称取5.0 g NaCl固体,可配制溶质质量分数为10% NaCl溶液________g。
(2)某小组在实验室里制取O2时,用到了下列装置,请回答有关问题:
①实验室制取氧气应该选发生装置________,收集装置________(两个空都填字母)。
②若用KClO3和二氧化锰来制取氧气时,二氧化锰起________作用,其反应的化学方程式为___________________________________________________。
③在做实验之前,必须要做的一个重要操作是________________________。
16、酸、碱、盐是我们身边重要的化合物。
(1)碱溶液有许多共同性质,是因为不同的碱溶液中都有 (填离子符号)。
(2)常用小苏打治疗胃酸过多,有关反应的化学方程式是 。
(3)将一定量的硫酸铜溶液与氢氧化钠溶液混合,充分反应后过滤,得到无色溶液。该无色溶液中一定含有溶质硫酸钠,可能含有溶质 。若要验证这种可能含有的溶质,不宜使用 (填字母)。
A.酚酞试液 B.pH试纸 C.硫酸铵 D.氯化钠
17、医用氯化钙常用于合成药物。以工业碳酸钙(含少量Fe3+等杂质)为原料生产二水合氯化钙(CaCl2·2H2O)的流程图如下所示。
(1)写出第①步中碳酸钙与盐酸反应的化学方程式:
________________________________________________________________。
(2)第②步中是否发生化学变化?________(填“是”或“否”)。
(3)操作a的名称是________,实验室进行该操作时玻璃棒的作用是
________________________________________________________________。
(4)青少年正处于生长发育阶段,需要摄入足够的钙,写出一种合理的补钙方法:
_________________________________________________________________。
18、(1)洗发时,使用洗发剂后再用护发素,对头发有保护作用。小明同学用pH试纸测得洗发剂的pH略大于7,则洗发剂显 性;测得护发素的pH略小于7,则护发素显 性。
(2)厕所清洁剂能使石蕊变红,则其pH (填“小于”或“大于”,下同)7,厨房清洁剂能使石蕊变蓝,则其pH 7。将两种清洁剂混合在一起,则失去了清洁能力,这是因为 。
(3)小明同学测得家乡雨水的pH=6.2,则该雨水显 性,那么这个雨水是酸雨吗 ,你的理由是 。
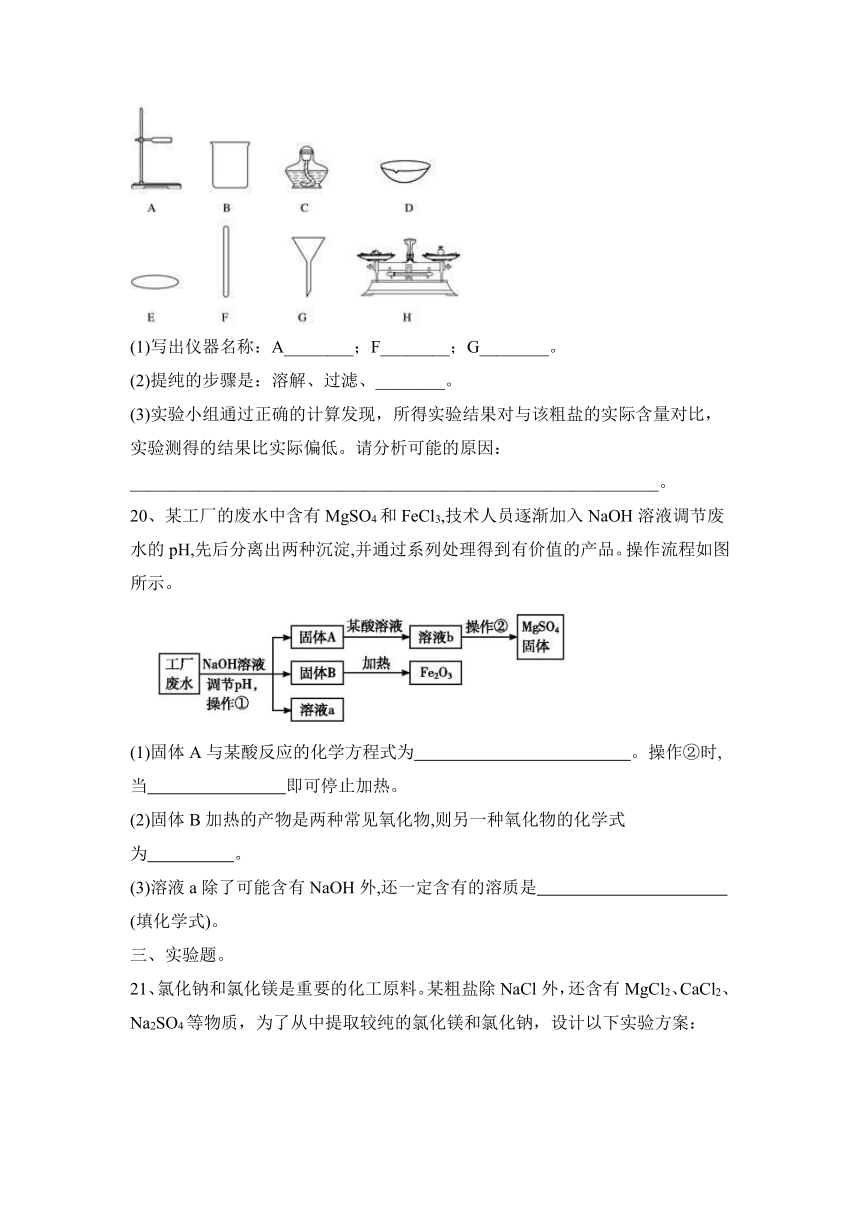
19、实验小组的同学欲对一粗盐样品进行初步提纯。所用实验仪器或用品如下:
(1)写出仪器名称:A________;F________;G________。
(2)提纯的步骤是:溶解、过滤、________。
(3)实验小组通过正确的计算发现,所得实验结果对与该粗盐的实际含量对比,实验测得的结果比实际偏低。请分析可能的原因: _____________________________________________________________。
20、某工厂的废水中含有MgSO4和FeCl3,技术人员逐渐加入NaOH溶液调节废水的pH,先后分离出两种沉淀,并通过系列处理得到有价值的产品。操作流程如图所示。
(1)固体A与某酸反应的化学方程式为 。操作②时,当 即可停止加热。
(2)固体B加热的产物是两种常见氧化物,则另一种氧化物的化学式为 。
(3)溶液a除了可能含有NaOH外,还一定含有的溶质是 (填化学式)。
三、实验题。
21、氯化钠和氯化镁是重要的化工原料。某粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4等物质,为了从中提取较纯的氯化镁和氯化钠,设计以下实验方案:
请回答下列问题:
Ⅰ.步骤①溶解过程中用玻璃棒搅拌的目的是____________________________。
Ⅱ.步骤④⑤的顺序颠倒会引发的后果是_______________________________。
Ⅲ.滤液乙中所含的溶质除氯化钠外还含有________;沉淀B中除含碳酸钙、碳酸钡外还含有________;在步骤⑦中若加入的盐酸略过量是否对实验结果有影响?原因是______________________________________________________。
Ⅳ.写出步骤⑨中反应的化学方程式 ________________________________。
Ⅴ.实验最终所得的精盐的质量大于粗盐中氯化钠的质量,整个过程中产生新的NaCl的反应共有________个。
四、计算题。
22、某纯碱样品中含有少量NaCl,小丽同学取该样品23 g全部溶解于150 g水中,再逐滴加入160 g稀盐酸,反应中产生的气体的质量与盐酸的用量关系如图所示。(提示:相关反应为Na2CO3+2HCl===2NaCl+H2O+CO2↑)
计算当恰好完全反应时:
(1)产生的二氧化碳的质量是多少克。
(2)此时所得到的溶液中溶质的质量分数是多少?(写出必要的计算过程,结果保留到0.1%)。
2021—2022学年人教九下化学第11单元 盐 化肥含答案
一、选择题。
1、要除去氯化钠溶液中少量的碳酸钠,可加入适量的 ( )
①石灰水 ②氯化钾溶液 ③盐酸 ④氯化钙溶液
A.①② B.③④ C.①③ D.②④
【答案】B
2、下列物质的化学式书写、俗名都正确的是( )
选项 名称 化学式 俗称
A 乙醇 CH3CH2OH 酒精
B 氧化钙 CaO 熟石灰
C 碳酸氢钠 Na2CO3 苏打
D 氯化钠 NaCl2 食盐
【答案】A
3、根据你的经验,下列家庭小实验不能成功的是( )
A. 用自制净水器把浑浊的河水变为澄清的水
B. 用加热的方法修补电木插座
C. 用电池上的“锌皮”与食醋反应制氢气
D. 用小苏打和柠檬酸自制汽水
【答案】B
4、某同学用pH试纸测定溶液的酸碱度,下列操作或结论正确的是 ( )
A.用pH试纸直接蘸取待测溶液
B.先用水润湿pH试纸再测定溶液的酸碱度
C.用普通pH试纸测得石灰水的pH=9.5
D.用pH试纸测得盐酸的pH=1
【答案】D
5、在粗盐提纯的实验操作中,下列说法正确的是( )
A.过滤时用到的仪器有烧杯、玻璃棒、铁架台、滤纸
B.蒸发操作结束后,将蒸发皿放在石棉网上
C.用药匙将蒸发皿中的白色固体直接转移到纸上
D.实验结束后所得到的白色固体为氯化钠
【答案】B
6、某果农发现其种植的桔树生长迟缓,叶色淡黄。经技术人员诊断,必须追加相应的复合肥料。你认为应选用的复合肥料是( )
A.NH4H2PO4 B.NH4NO3 C.CO(NH2)2 D.K2SO4
【答案】A
7、某同学就测定Na2CO3和NaCl固体混合物中NaCl的质量分数,分别取mg样品,按下列方案进行试验,合理的是( )
A. 与足量稀盐酸充分反应,用排水法收集到VmL气体
B. 与足量BaCl2溶液充分反应,将沉淀过滤、洗涤、干燥,得到m1g固体
C. 与足量AgNO3溶液充分反应,将沉淀过滤、洗涤、干燥,得到m2g固体
D. 与足量浓盐酸充分反应,逸出的气体用 NaOH固体充分吸收,固体质量增加m3g
【答案】B
8、、现有4种试剂:①紫色石蕊试液;②稀硫酸;③碳酸钾溶液;④氯化钡溶液。能用来一次性鉴别稀盐酸、氢氧化钡溶液、碳酸钠溶液的试剂有( )
A.② B.②③ C.①②③ D.②③④
【答案】C
9、下列关于酸、碱、盐的用途不合理的是( )
A. 盐酸除铁锈 B. 氢氧化钠改良酸性土壤
C. 硫酸铜与氢氧化钙混合配制农药波尔多液 D. 纯碱除油污
【答案】B
10、下列化肥不能与碱性物质混合施用的是( )
A.NH4Cl B.Ca3(PO4)2 C.K2SO4 D.CO(NH2)2
【答案】A。
11、食盐是重要的调味品,精盐是由粗盐提纯而来,在提纯过程中通常不需要的操作是( )
A. 蒸发 B. 吸附 C. 过滤 D. 溶解
【答案】B
12、下列各组物质分别加入足量的水中,能得到无色透明溶液的是( )
A.FeCl3、NaOH、NaCl B.Na2SO4、HCl、BaCl2
C.CuSO4、KCl、HCl D.Na2CO3、NaCl、Na2SO4
【答案】D
二、填空题。
13、如图中A、B、C、D、E、F是初中化学常见的物质,且A、B、C、D、E是五种不同类别的物质,已知B是世界上产量最高的金属,图中“——”表示相连的物质之间可以在溶液中发生化学反应,“―→”表示由某种物质可以转化为另一种物质(部分反应物、生成物及反应条件已略去,所涉及的化学反应均为初中化学学习中常见的反应)。
请回答下列问题:
(1)写出B物质的化学式________,E物质的一种用途________;
(2)写出A+B反应的化学方程式________________________________________________;
D→F反应的化学方程式_______________________________________________________;
(3)①②③④⑤五个化学反应中基本反应类型相同的是________(填序号)。
【答案】
(1)Fe 灭火 (2)Fe+H2SO4===FeSO4+H2↑ Ba(OH)2+2HCl===BaCl2+2H2O (3)②④⑤
14、测定pH最简单的方法是使用 ,测定时,用 蘸取待测溶液,滴到 上,再把试纸显示的颜色与 比较,便可测出溶液的pH。
【答案】pH试纸 玻璃棒 pH试纸 标准比色卡
15、海洋是丰富的化学资源宝库。通过晾晒海水,可以得到含少量泥沙的粗盐。
(1)在做粗盐初步提纯的实验时,要进行如下图所示的实验操作。
①上图有字母标号的仪器名称分别是:a________,b________。
②操作B中玻璃棒的作用是________。
③操作C中看到________________时,停止加热。
④称取5.0 g NaCl固体,可配制溶质质量分数为10% NaCl溶液________g。
(2)某小组在实验室里制取O2时,用到了下列装置,请回答有关问题:
①实验室制取氧气应该选发生装置________,收集装置________(两个空都填字母)。
②若用KClO3和二氧化锰来制取氧气时,二氧化锰起________作用,其反应的化学方程式为___________________________________________________。
③在做实验之前,必须要做的一个重要操作是________________________。
【答案】(1)①烧杯 玻璃棒 ②引流 ③有大量晶体析出 ④50
(2)①B D ②催化 2KClO32KCl+3O2↑ ③检查装置的气密性
16、酸、碱、盐是我们身边重要的化合物。
(1)碱溶液有许多共同性质,是因为不同的碱溶液中都有 (填离子符号)。
(2)常用小苏打治疗胃酸过多,有关反应的化学方程式是 。
(3)将一定量的硫酸铜溶液与氢氧化钠溶液混合,充分反应后过滤,得到无色溶液。该无色溶液中一定含有溶质硫酸钠,可能含有溶质 。若要验证这种可能含有的溶质,不宜使用 (填字母)。
A.酚酞试液 B.pH试纸 C.硫酸铵 D.氯化钠
【答案】(1)OH- (2) (3)NaOH D
17、医用氯化钙常用于合成药物。以工业碳酸钙(含少量Fe3+等杂质)为原料生产二水合氯化钙(CaCl2·2H2O)的流程图如下所示。
(1)写出第①步中碳酸钙与盐酸反应的化学方程式:
________________________________________________________________________。
(2)第②步中是否发生化学变化?________(填“是”或“否”)。
(3)操作a的名称是________,实验室进行该操作时玻璃棒的作用是
________________________________________________________________________。
(4)青少年正处于生长发育阶段,需要摄入足够的钙,写出一种合理的补钙方法:
________________________________________________________________________。
【答案】 (1)CaCO3+2HCl===CaCl2+CO2↑+H2O
(2)是 (3)过滤 引流 (4)多吃富含钙的食物(其他合理答案均可)
18、(1)洗发时,使用洗发剂后再用护发素,对头发有保护作用。小明同学用pH试纸测得洗发剂的pH略大于7,则洗发剂显 性;测得护发素的pH略小于7,则护发素显 性。
(2)厕所清洁剂能使石蕊变红,则其pH (填“小于”或“大于”,下同)7,厨房清洁剂能使石蕊变蓝,则其pH 7。将两种清洁剂混合在一起,则失去了清洁能力,这是因为 。
(3)小明同学测得家乡雨水的pH=6.2,则该雨水显 性,那么这个雨水是酸雨吗 ,你的理由是 。
【答案】(1)碱 酸 (2)小于 大于 酸和碱发生了中和反应
(3)酸 不是 pH小于5.6的雨水才是酸雨
19、实验小组的同学欲对一粗盐样品进行初步提纯。所用实验仪器或用品如下:
(1)写出仪器名称:A________;F________;G________。
(2)提纯的步骤是:溶解、过滤、________。
(3)实验小组通过正确的计算发现,所得实验结果对与该粗盐的实际含量对比,实验测得的结果比实际偏低。请分析可能的原因: _____________________________________________________________。
【答案】(1)铁架台 玻璃棒 (普通)漏斗 (2)蒸发 (3)指针偏左就开始称量;蒸发时有液体飞溅出 溶解时加水过少,粗盐没有全部溶解;称量时有固体沾到滤纸上,没有转入烧杯中等
20、某工厂的废水中含有MgSO4和FeCl3,技术人员逐渐加入NaOH溶液调节废水的pH,先后分离出两种沉淀,并通过系列处理得到有价值的产品。操作流程如图所示。
(1)固体A与某酸反应的化学方程式为 。操作②时,当 即可停止加热。
(2)固体B加热的产物是两种常见氧化物,则另一种氧化物的化学式为 。
(3)溶液a除了可能含有NaOH外,还一定含有的溶质是 (填化学式)。
【答案】
(1) 大量晶体析出
(2)H2O (3)Na2SO4 NaCl
三、实验题。
21、氯化钠和氯化镁是重要的化工原料。某粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4等物质,为了从中提取较纯的氯化镁和氯化钠,设计以下实验方案:
请回答下列问题:
Ⅰ.步骤①溶解过程中用玻璃棒搅拌的目的是_________________________________。
Ⅱ.步骤④⑤的顺序颠倒会引发的后果是_____________________________________。
Ⅲ.滤液乙中所含的溶质除氯化钠外还含有________;沉淀B中除含碳酸钙、碳酸钡外还含有________;在步骤⑦中若加入的盐酸略过量是否对实验结果有影响?原因是
________________________________________________________________________。
Ⅳ.写出步骤⑨中反应的化学方程式 _________________________________________。
Ⅴ.实验最终所得的精盐的质量大于粗盐中氯化钠的质量,整个过程中产生新的NaCl的反应共有________个。
【答案】
Ⅰ.加快溶解的速度 Ⅱ.精盐中会混有氯化钡或无法除去过量的氯化钡 Ⅲ.氢氧化钠、碳酸钠 硫酸钡 无影响,加热蒸发时氯化氢会挥发 Ⅳ.Mg(OH)2+2HCl===Mg Cl2+2H2O Ⅴ.6
【解析】Ⅰ溶解过程中用玻璃棒搅拌的目的是:加快溶解的速度。Ⅱ步骤⑤,加入过量的碳酸钠,不仅是除去粗盐中的氯化钙,还起到除去步骤④中所加的过量的氯化钡的作用,所以步骤④⑤的顺序颠倒会引发的后果是:精盐中会混有氯化钡或无法除去过量的氯化钡。Ⅲ步骤②④⑤所加的试剂都是过量,但步骤④所加的氯化钡可以被碳酸钠反应掉,所以滤液乙中所含的溶质除氯化钠外还含有:氢氧化钠、碳酸钠,沉淀B中除含碳酸钙、碳酸钡外还含有所加的氯化钡与粗盐中的杂质Na2SO4反应生成的硫酸钡,步骤⑦中若加入的盐酸虽然略过量,但由于它是氯化氢气体的水溶液,所以实验结果没有影响,原因是:加热蒸发时氯化氢会挥发Ⅳ步骤。⑨中反应的化学方程式:Mg(OH)2+2HCl===Mg Cl2+2H2O。
Ⅴ步骤②:MgCl2+2NaOH===Mg(OH)2↓+2NaCl,步骤④:Na2SO4+BaCl2===BaSO4↓+2NaCl,步骤⑤发生2个反应:CaCl2+Na2CO3===CaCO3↓+2NaCl,BaCl2+Na2CO3===BaCO3↓+2NaCl,步骤⑦也发生2个反应:NaOH+HCl===NaCl+H2O,Na2CO3+2HCl===2NaCl+H2O+CO2↑,所以整个过程中产生新的NaCl的反应共有6个。
四、计算题。
22、某纯碱样品中含有少量NaCl,小丽同学取该样品23 g全部溶解于150 g水中,再逐滴加入160 g稀盐酸,反应中产生的气体的质量与盐酸的用量关系如图所示。(提示:相关反应为Na2CO3+2HCl===2NaCl+H2O+CO2↑)
计算当恰好完全反应时:
(1)产生的二氧化碳的质量是多少克。
(2)此时所得到的溶液中溶质的质量分数是多少?(写出必要的计算过程,结果保留到0.1%)。
【答案及解析】(1)8.8
(2)设参加反应的的质量为x,反应生成的NaCl的质量为y
x=21.2 g,y=23.4 g
反应后所得NaCl溶液中溶质的质量分数为:
答:恰好完全反应时所得NaCl溶液中溶质的质量分数为8.4%。
一、选择题。
1、要除去氯化钠溶液中少量的碳酸钠,可加入适量的 ( )
①石灰水 ②氯化钾溶液 ③盐酸 ④氯化钙溶液
A.①② B.③④ C.①③ D.②④
2、下列物质的化学式书写、俗名都正确的是( )
选项 名称 化学式 俗称
A 乙醇 CH3CH2OH 酒精
B 氧化钙 CaO 熟石灰
C 碳酸氢钠 Na2CO3 苏打
D 氯化钠 NaCl2 食盐
3、根据你的经验,下列家庭小实验不能成功的是( )
A. 用自制净水器把浑浊的河水变为澄清的水
B. 用加热的方法修补电木插座
C. 用电池上的“锌皮”与食醋反应制氢气
D. 用小苏打和柠檬酸自制汽水
4、某同学用pH试纸测定溶液的酸碱度,下列操作或结论正确的是 ( )
A.用pH试纸直接蘸取待测溶液
B.先用水润湿pH试纸再测定溶液的酸碱度
C.用普通pH试纸测得石灰水的pH=9.5
D.用pH试纸测得盐酸的pH=1
5、在粗盐提纯的实验操作中,下列说法正确的是( )
A.过滤时用到的仪器有烧杯、玻璃棒、铁架台、滤纸
B.蒸发操作结束后,将蒸发皿放在石棉网上
C.用药匙将蒸发皿中的白色固体直接转移到纸上
D.实验结束后所得到的白色固体为氯化钠
6、某果农发现其种植的桔树生长迟缓,叶色淡黄。经技术人员诊断,必须追加相应的复合肥料。你认为应选用的复合肥料是( )
A.NH4H2PO4 B.NH4NO3 C.CO(NH2)2 D.K2SO4
7、某同学就测定Na2CO3和NaCl固体混合物中NaCl的质量分数,分别取mg样品,按下列方案进行试验,合理的是( )
A. 与足量稀盐酸充分反应,用排水法收集到VmL气体
B. 与足量BaCl2溶液充分反应,将沉淀过滤、洗涤、干燥,得到m1g固体
C. 与足量AgNO3溶液充分反应,将沉淀过滤、洗涤、干燥,得到m2g固体
D. 与足量浓盐酸充分反应,逸出的气体用 NaOH固体充分吸收,固体质量增加m3g
8、、现有4种试剂:①紫色石蕊试液;②稀硫酸;③碳酸钾溶液;④氯化钡溶液。能用来一次性鉴别稀盐酸、氢氧化钡溶液、碳酸钠溶液的试剂有( )
A.② B.②③ C.①②③ D.②③④
9、下列关于酸、碱、盐的用途不合理的是( )
A. 盐酸除铁锈 B. 氢氧化钠改良酸性土壤
C. 硫酸铜与氢氧化钙混合配制农药波尔多液 D. 纯碱除油污
10、下列化肥不能与碱性物质混合施用的是( )
A.NH4Cl B.Ca3(PO4)2 C.K2SO4 D.CO(NH2)2
11、食盐是重要的调味品,精盐是由粗盐提纯而来,在提纯过程中通常不需要的操作是( )
A. 蒸发 B. 吸附 C. 过滤 D. 溶解
12、下列各组物质分别加入足量的水中,能得到无色透明溶液的是( )
A.FeCl3、NaOH、NaCl B.Na2SO4、HCl、BaCl2
C.CuSO4、KCl、HCl D.Na2CO3、NaCl、Na2SO4
二、填空题。
13、如图中A、B、C、D、E、F是初中化学常见的物质,且A、B、C、D、E是五种不同类别的物质,已知B是世界上产量最高的金属,图中“——”表示相连的物质之间可以在溶液中发生化学反应,“―→”表示由某种物质可以转化为另一种物质(部分反应物、生成物及反应条件已略去,所涉及的化学反应均为初中化学学习中常见的反应)。
请回答下列问题:
(1)写出B物质的化学式________,E物质的一种用途________;
(2)写出A+B反应的化学方程式____________________________________;
D→F反应的化学方程式___________________________________________;
(3)①②③④⑤五个化学反应中基本反应类型相同的是________(填序号)。
14、测定pH最简单的方法是使用 ,测定时,用 蘸取待测溶液,滴到 上,再把试纸显示的颜色与 比较,便可测出溶液的pH。
15、海洋是丰富的化学资源宝库。通过晾晒海水,可以得到含少量泥沙的粗盐。
(1)在做粗盐初步提纯的实验时,要进行如下图所示的实验操作。
①上图有字母标号的仪器名称分别是:a________,b________。
②操作B中玻璃棒的作用是________。
③操作C中看到________________时,停止加热。
④称取5.0 g NaCl固体,可配制溶质质量分数为10% NaCl溶液________g。
(2)某小组在实验室里制取O2时,用到了下列装置,请回答有关问题:
①实验室制取氧气应该选发生装置________,收集装置________(两个空都填字母)。
②若用KClO3和二氧化锰来制取氧气时,二氧化锰起________作用,其反应的化学方程式为___________________________________________________。
③在做实验之前,必须要做的一个重要操作是________________________。
16、酸、碱、盐是我们身边重要的化合物。
(1)碱溶液有许多共同性质,是因为不同的碱溶液中都有 (填离子符号)。
(2)常用小苏打治疗胃酸过多,有关反应的化学方程式是 。
(3)将一定量的硫酸铜溶液与氢氧化钠溶液混合,充分反应后过滤,得到无色溶液。该无色溶液中一定含有溶质硫酸钠,可能含有溶质 。若要验证这种可能含有的溶质,不宜使用 (填字母)。
A.酚酞试液 B.pH试纸 C.硫酸铵 D.氯化钠
17、医用氯化钙常用于合成药物。以工业碳酸钙(含少量Fe3+等杂质)为原料生产二水合氯化钙(CaCl2·2H2O)的流程图如下所示。
(1)写出第①步中碳酸钙与盐酸反应的化学方程式:
________________________________________________________________。
(2)第②步中是否发生化学变化?________(填“是”或“否”)。
(3)操作a的名称是________,实验室进行该操作时玻璃棒的作用是
________________________________________________________________。
(4)青少年正处于生长发育阶段,需要摄入足够的钙,写出一种合理的补钙方法:
_________________________________________________________________。
18、(1)洗发时,使用洗发剂后再用护发素,对头发有保护作用。小明同学用pH试纸测得洗发剂的pH略大于7,则洗发剂显 性;测得护发素的pH略小于7,则护发素显 性。
(2)厕所清洁剂能使石蕊变红,则其pH (填“小于”或“大于”,下同)7,厨房清洁剂能使石蕊变蓝,则其pH 7。将两种清洁剂混合在一起,则失去了清洁能力,这是因为 。
(3)小明同学测得家乡雨水的pH=6.2,则该雨水显 性,那么这个雨水是酸雨吗 ,你的理由是 。
19、实验小组的同学欲对一粗盐样品进行初步提纯。所用实验仪器或用品如下:
(1)写出仪器名称:A________;F________;G________。
(2)提纯的步骤是:溶解、过滤、________。
(3)实验小组通过正确的计算发现,所得实验结果对与该粗盐的实际含量对比,实验测得的结果比实际偏低。请分析可能的原因: _____________________________________________________________。
20、某工厂的废水中含有MgSO4和FeCl3,技术人员逐渐加入NaOH溶液调节废水的pH,先后分离出两种沉淀,并通过系列处理得到有价值的产品。操作流程如图所示。
(1)固体A与某酸反应的化学方程式为 。操作②时,当 即可停止加热。
(2)固体B加热的产物是两种常见氧化物,则另一种氧化物的化学式为 。
(3)溶液a除了可能含有NaOH外,还一定含有的溶质是 (填化学式)。
三、实验题。
21、氯化钠和氯化镁是重要的化工原料。某粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4等物质,为了从中提取较纯的氯化镁和氯化钠,设计以下实验方案:
请回答下列问题:
Ⅰ.步骤①溶解过程中用玻璃棒搅拌的目的是____________________________。
Ⅱ.步骤④⑤的顺序颠倒会引发的后果是_______________________________。
Ⅲ.滤液乙中所含的溶质除氯化钠外还含有________;沉淀B中除含碳酸钙、碳酸钡外还含有________;在步骤⑦中若加入的盐酸略过量是否对实验结果有影响?原因是______________________________________________________。
Ⅳ.写出步骤⑨中反应的化学方程式 ________________________________。
Ⅴ.实验最终所得的精盐的质量大于粗盐中氯化钠的质量,整个过程中产生新的NaCl的反应共有________个。
四、计算题。
22、某纯碱样品中含有少量NaCl,小丽同学取该样品23 g全部溶解于150 g水中,再逐滴加入160 g稀盐酸,反应中产生的气体的质量与盐酸的用量关系如图所示。(提示:相关反应为Na2CO3+2HCl===2NaCl+H2O+CO2↑)
计算当恰好完全反应时:
(1)产生的二氧化碳的质量是多少克。
(2)此时所得到的溶液中溶质的质量分数是多少?(写出必要的计算过程,结果保留到0.1%)。
2021—2022学年人教九下化学第11单元 盐 化肥含答案
一、选择题。
1、要除去氯化钠溶液中少量的碳酸钠,可加入适量的 ( )
①石灰水 ②氯化钾溶液 ③盐酸 ④氯化钙溶液
A.①② B.③④ C.①③ D.②④
【答案】B
2、下列物质的化学式书写、俗名都正确的是( )
选项 名称 化学式 俗称
A 乙醇 CH3CH2OH 酒精
B 氧化钙 CaO 熟石灰
C 碳酸氢钠 Na2CO3 苏打
D 氯化钠 NaCl2 食盐
【答案】A
3、根据你的经验,下列家庭小实验不能成功的是( )
A. 用自制净水器把浑浊的河水变为澄清的水
B. 用加热的方法修补电木插座
C. 用电池上的“锌皮”与食醋反应制氢气
D. 用小苏打和柠檬酸自制汽水
【答案】B
4、某同学用pH试纸测定溶液的酸碱度,下列操作或结论正确的是 ( )
A.用pH试纸直接蘸取待测溶液
B.先用水润湿pH试纸再测定溶液的酸碱度
C.用普通pH试纸测得石灰水的pH=9.5
D.用pH试纸测得盐酸的pH=1
【答案】D
5、在粗盐提纯的实验操作中,下列说法正确的是( )
A.过滤时用到的仪器有烧杯、玻璃棒、铁架台、滤纸
B.蒸发操作结束后,将蒸发皿放在石棉网上
C.用药匙将蒸发皿中的白色固体直接转移到纸上
D.实验结束后所得到的白色固体为氯化钠
【答案】B
6、某果农发现其种植的桔树生长迟缓,叶色淡黄。经技术人员诊断,必须追加相应的复合肥料。你认为应选用的复合肥料是( )
A.NH4H2PO4 B.NH4NO3 C.CO(NH2)2 D.K2SO4
【答案】A
7、某同学就测定Na2CO3和NaCl固体混合物中NaCl的质量分数,分别取mg样品,按下列方案进行试验,合理的是( )
A. 与足量稀盐酸充分反应,用排水法收集到VmL气体
B. 与足量BaCl2溶液充分反应,将沉淀过滤、洗涤、干燥,得到m1g固体
C. 与足量AgNO3溶液充分反应,将沉淀过滤、洗涤、干燥,得到m2g固体
D. 与足量浓盐酸充分反应,逸出的气体用 NaOH固体充分吸收,固体质量增加m3g
【答案】B
8、、现有4种试剂:①紫色石蕊试液;②稀硫酸;③碳酸钾溶液;④氯化钡溶液。能用来一次性鉴别稀盐酸、氢氧化钡溶液、碳酸钠溶液的试剂有( )
A.② B.②③ C.①②③ D.②③④
【答案】C
9、下列关于酸、碱、盐的用途不合理的是( )
A. 盐酸除铁锈 B. 氢氧化钠改良酸性土壤
C. 硫酸铜与氢氧化钙混合配制农药波尔多液 D. 纯碱除油污
【答案】B
10、下列化肥不能与碱性物质混合施用的是( )
A.NH4Cl B.Ca3(PO4)2 C.K2SO4 D.CO(NH2)2
【答案】A。
11、食盐是重要的调味品,精盐是由粗盐提纯而来,在提纯过程中通常不需要的操作是( )
A. 蒸发 B. 吸附 C. 过滤 D. 溶解
【答案】B
12、下列各组物质分别加入足量的水中,能得到无色透明溶液的是( )
A.FeCl3、NaOH、NaCl B.Na2SO4、HCl、BaCl2
C.CuSO4、KCl、HCl D.Na2CO3、NaCl、Na2SO4
【答案】D
二、填空题。
13、如图中A、B、C、D、E、F是初中化学常见的物质,且A、B、C、D、E是五种不同类别的物质,已知B是世界上产量最高的金属,图中“——”表示相连的物质之间可以在溶液中发生化学反应,“―→”表示由某种物质可以转化为另一种物质(部分反应物、生成物及反应条件已略去,所涉及的化学反应均为初中化学学习中常见的反应)。
请回答下列问题:
(1)写出B物质的化学式________,E物质的一种用途________;
(2)写出A+B反应的化学方程式________________________________________________;
D→F反应的化学方程式_______________________________________________________;
(3)①②③④⑤五个化学反应中基本反应类型相同的是________(填序号)。
【答案】
(1)Fe 灭火 (2)Fe+H2SO4===FeSO4+H2↑ Ba(OH)2+2HCl===BaCl2+2H2O (3)②④⑤
14、测定pH最简单的方法是使用 ,测定时,用 蘸取待测溶液,滴到 上,再把试纸显示的颜色与 比较,便可测出溶液的pH。
【答案】pH试纸 玻璃棒 pH试纸 标准比色卡
15、海洋是丰富的化学资源宝库。通过晾晒海水,可以得到含少量泥沙的粗盐。
(1)在做粗盐初步提纯的实验时,要进行如下图所示的实验操作。
①上图有字母标号的仪器名称分别是:a________,b________。
②操作B中玻璃棒的作用是________。
③操作C中看到________________时,停止加热。
④称取5.0 g NaCl固体,可配制溶质质量分数为10% NaCl溶液________g。
(2)某小组在实验室里制取O2时,用到了下列装置,请回答有关问题:
①实验室制取氧气应该选发生装置________,收集装置________(两个空都填字母)。
②若用KClO3和二氧化锰来制取氧气时,二氧化锰起________作用,其反应的化学方程式为___________________________________________________。
③在做实验之前,必须要做的一个重要操作是________________________。
【答案】(1)①烧杯 玻璃棒 ②引流 ③有大量晶体析出 ④50
(2)①B D ②催化 2KClO32KCl+3O2↑ ③检查装置的气密性
16、酸、碱、盐是我们身边重要的化合物。
(1)碱溶液有许多共同性质,是因为不同的碱溶液中都有 (填离子符号)。
(2)常用小苏打治疗胃酸过多,有关反应的化学方程式是 。
(3)将一定量的硫酸铜溶液与氢氧化钠溶液混合,充分反应后过滤,得到无色溶液。该无色溶液中一定含有溶质硫酸钠,可能含有溶质 。若要验证这种可能含有的溶质,不宜使用 (填字母)。
A.酚酞试液 B.pH试纸 C.硫酸铵 D.氯化钠
【答案】(1)OH- (2) (3)NaOH D
17、医用氯化钙常用于合成药物。以工业碳酸钙(含少量Fe3+等杂质)为原料生产二水合氯化钙(CaCl2·2H2O)的流程图如下所示。
(1)写出第①步中碳酸钙与盐酸反应的化学方程式:
________________________________________________________________________。
(2)第②步中是否发生化学变化?________(填“是”或“否”)。
(3)操作a的名称是________,实验室进行该操作时玻璃棒的作用是
________________________________________________________________________。
(4)青少年正处于生长发育阶段,需要摄入足够的钙,写出一种合理的补钙方法:
________________________________________________________________________。
【答案】 (1)CaCO3+2HCl===CaCl2+CO2↑+H2O
(2)是 (3)过滤 引流 (4)多吃富含钙的食物(其他合理答案均可)
18、(1)洗发时,使用洗发剂后再用护发素,对头发有保护作用。小明同学用pH试纸测得洗发剂的pH略大于7,则洗发剂显 性;测得护发素的pH略小于7,则护发素显 性。
(2)厕所清洁剂能使石蕊变红,则其pH (填“小于”或“大于”,下同)7,厨房清洁剂能使石蕊变蓝,则其pH 7。将两种清洁剂混合在一起,则失去了清洁能力,这是因为 。
(3)小明同学测得家乡雨水的pH=6.2,则该雨水显 性,那么这个雨水是酸雨吗 ,你的理由是 。
【答案】(1)碱 酸 (2)小于 大于 酸和碱发生了中和反应
(3)酸 不是 pH小于5.6的雨水才是酸雨
19、实验小组的同学欲对一粗盐样品进行初步提纯。所用实验仪器或用品如下:
(1)写出仪器名称:A________;F________;G________。
(2)提纯的步骤是:溶解、过滤、________。
(3)实验小组通过正确的计算发现,所得实验结果对与该粗盐的实际含量对比,实验测得的结果比实际偏低。请分析可能的原因: _____________________________________________________________。
【答案】(1)铁架台 玻璃棒 (普通)漏斗 (2)蒸发 (3)指针偏左就开始称量;蒸发时有液体飞溅出 溶解时加水过少,粗盐没有全部溶解;称量时有固体沾到滤纸上,没有转入烧杯中等
20、某工厂的废水中含有MgSO4和FeCl3,技术人员逐渐加入NaOH溶液调节废水的pH,先后分离出两种沉淀,并通过系列处理得到有价值的产品。操作流程如图所示。
(1)固体A与某酸反应的化学方程式为 。操作②时,当 即可停止加热。
(2)固体B加热的产物是两种常见氧化物,则另一种氧化物的化学式为 。
(3)溶液a除了可能含有NaOH外,还一定含有的溶质是 (填化学式)。
【答案】
(1) 大量晶体析出
(2)H2O (3)Na2SO4 NaCl
三、实验题。
21、氯化钠和氯化镁是重要的化工原料。某粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4等物质,为了从中提取较纯的氯化镁和氯化钠,设计以下实验方案:
请回答下列问题:
Ⅰ.步骤①溶解过程中用玻璃棒搅拌的目的是_________________________________。
Ⅱ.步骤④⑤的顺序颠倒会引发的后果是_____________________________________。
Ⅲ.滤液乙中所含的溶质除氯化钠外还含有________;沉淀B中除含碳酸钙、碳酸钡外还含有________;在步骤⑦中若加入的盐酸略过量是否对实验结果有影响?原因是
________________________________________________________________________。
Ⅳ.写出步骤⑨中反应的化学方程式 _________________________________________。
Ⅴ.实验最终所得的精盐的质量大于粗盐中氯化钠的质量,整个过程中产生新的NaCl的反应共有________个。
【答案】
Ⅰ.加快溶解的速度 Ⅱ.精盐中会混有氯化钡或无法除去过量的氯化钡 Ⅲ.氢氧化钠、碳酸钠 硫酸钡 无影响,加热蒸发时氯化氢会挥发 Ⅳ.Mg(OH)2+2HCl===Mg Cl2+2H2O Ⅴ.6
【解析】Ⅰ溶解过程中用玻璃棒搅拌的目的是:加快溶解的速度。Ⅱ步骤⑤,加入过量的碳酸钠,不仅是除去粗盐中的氯化钙,还起到除去步骤④中所加的过量的氯化钡的作用,所以步骤④⑤的顺序颠倒会引发的后果是:精盐中会混有氯化钡或无法除去过量的氯化钡。Ⅲ步骤②④⑤所加的试剂都是过量,但步骤④所加的氯化钡可以被碳酸钠反应掉,所以滤液乙中所含的溶质除氯化钠外还含有:氢氧化钠、碳酸钠,沉淀B中除含碳酸钙、碳酸钡外还含有所加的氯化钡与粗盐中的杂质Na2SO4反应生成的硫酸钡,步骤⑦中若加入的盐酸虽然略过量,但由于它是氯化氢气体的水溶液,所以实验结果没有影响,原因是:加热蒸发时氯化氢会挥发Ⅳ步骤。⑨中反应的化学方程式:Mg(OH)2+2HCl===Mg Cl2+2H2O。
Ⅴ步骤②:MgCl2+2NaOH===Mg(OH)2↓+2NaCl,步骤④:Na2SO4+BaCl2===BaSO4↓+2NaCl,步骤⑤发生2个反应:CaCl2+Na2CO3===CaCO3↓+2NaCl,BaCl2+Na2CO3===BaCO3↓+2NaCl,步骤⑦也发生2个反应:NaOH+HCl===NaCl+H2O,Na2CO3+2HCl===2NaCl+H2O+CO2↑,所以整个过程中产生新的NaCl的反应共有6个。
四、计算题。
22、某纯碱样品中含有少量NaCl,小丽同学取该样品23 g全部溶解于150 g水中,再逐滴加入160 g稀盐酸,反应中产生的气体的质量与盐酸的用量关系如图所示。(提示:相关反应为Na2CO3+2HCl===2NaCl+H2O+CO2↑)
计算当恰好完全反应时:
(1)产生的二氧化碳的质量是多少克。
(2)此时所得到的溶液中溶质的质量分数是多少?(写出必要的计算过程,结果保留到0.1%)。
【答案及解析】(1)8.8
(2)设参加反应的的质量为x,反应生成的NaCl的质量为y
x=21.2 g,y=23.4 g
反应后所得NaCl溶液中溶质的质量分数为:
答:恰好完全反应时所得NaCl溶液中溶质的质量分数为8.4%。
同课章节目录
