2022年人教版九年级下册化学第11单元:盐 化肥(word版 含答案)
文档属性
| 名称 | 2022年人教版九年级下册化学第11单元:盐 化肥(word版 含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 536.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-30 11:17:35 | ||
图片预览


文档简介
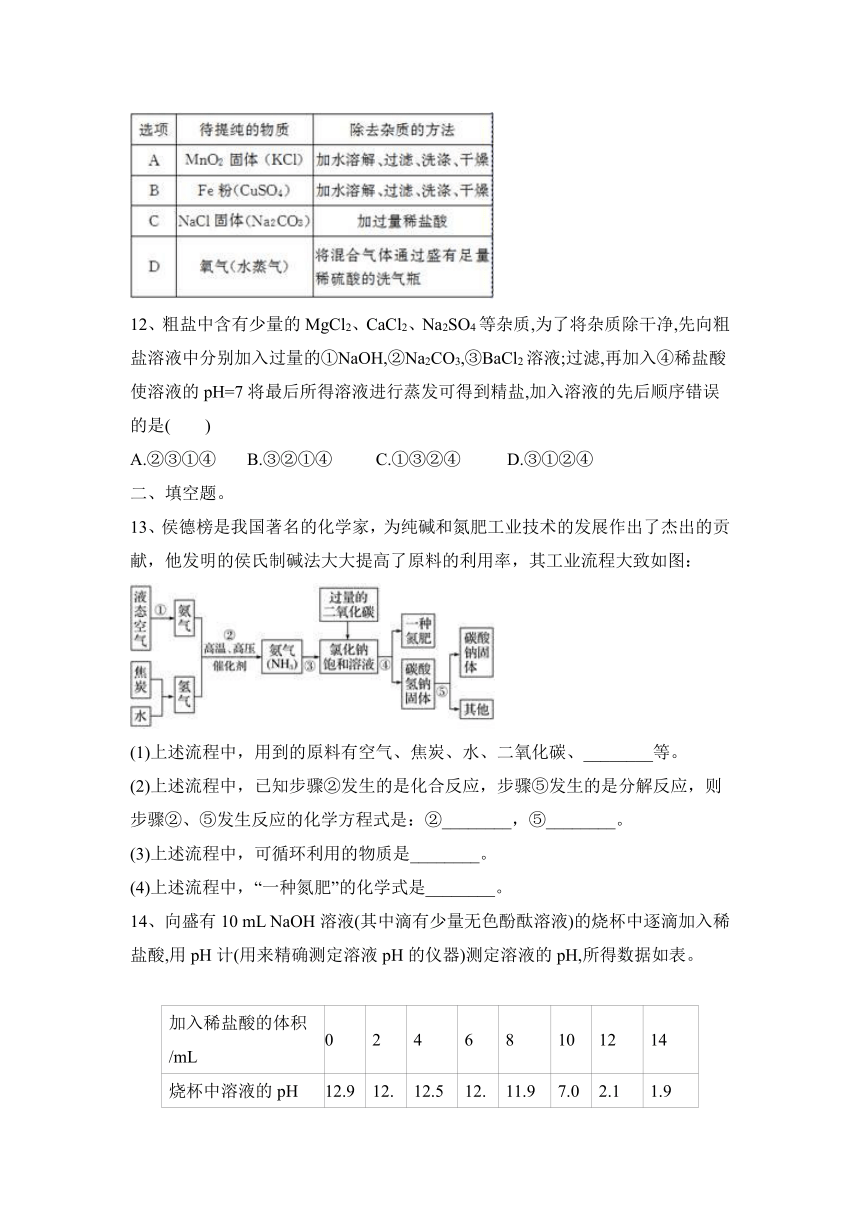
2022(春)人教九下化学第11单元:盐 化肥含答案
一、选择题。
1、根据酸、碱、盐的溶解性判断,下列关于物质的溶解性叙述正确的是 ( )
①硝酸盐都能溶于水 ②碳酸盐都不溶于水
③硫酸盐少数溶于水 ④碱多数难溶于水
A.①② B.①③ C.①④ D.②③
2、下列关于氯化钠的认识,正确的是( )
A.组成:含有钠和氯两种单质
B.性质:与盐酸类似,能与碳酸盐反应
C.用途:可用于生产金属钠
D.生产:常用钠与氯气通过化合反应获得
3、有失去标签的硫酸、氢氧化钙、氢氧化钠三瓶溶液,现有下列试剂,可以一次性予以区分开来的是( )
A. 酚酞试液 B. 石蕊试液 C. 碳酸钠溶液 D. 金属锌
4、下表是一些食物的pH,其中最不适宜胃酸过多的人食用的是 ( )
物质 玉米粥 牛奶 鸡蛋清 番茄
pH 7.0~8.0 6.3~6.6 7.6~8.0 4.0~4.4
A.玉米粥 B.番茄 C.鸡蛋清 D.牛奶
5、下列属于物理变化的是( )
A.海水晒盐 B.海水制“碱”
C.海水制镁 D.除去海水中的氯化镁等可溶性杂质
6、五一国际劳动节,化学兴趣小组来到学校的学农基地,发现原本翠绿的葡萄叶片叶色变黄,为使葡萄叶片转绿,学农基地应为这些葡萄追施的化学肥料是( )
A.CO(NH2)2 B.Ca3(PO4)2 C.KCl D.KH2PO4
7、粗食盐中常含杂质CaCl2,MgCl2和Na2SO4。用粗盐制备精盐时,通常采用溶解、除杂、过滤和蒸发的操作,其中往粗盐溶液中加入NaOH溶液、Na2CO3溶液、BaCl2溶液和盐酸(均可以过量)的目的就是除杂。所加溶液的顺序错误的是( )
A. BaCl2溶液、NaOH溶液、Na2CO3溶液、盐酸
B. NaOH溶液、BaCl2溶液、Na2CO3溶液、盐酸
C. Na2CO3溶液、BaCl2溶液、NaOH溶液、盐酸
D. BaCl2溶液、Na2CO3溶液、NaOH溶液、盐酸
8、下列各组溶液,不另加试剂就无法将它们鉴别出来的是( )
A.BaCl2 NaCl CuSO4 NaOH B.Na2CO3 CaCl2 HCl K2CO3
C.Na2CO3 KCl CaCl2 H2SO4 D.Na2CO3 BaCl2 HCl K2SO4
9、如图所示,通过长颈漏斗向该装置中慢慢加入X,可观察到气球逐渐胀大,再慢慢加入Y,又看到气球逐渐变小,则X、Y分别为( )
A. 盐酸、硫酸铜溶液 B. 盐酸、氯化钙溶液
C. 硫酸、氢氧化钠溶液 D. 硫酸、氯化镁溶液
10、实验室有三瓶化肥标签脱落,只知道它们分别是碳酸氢铵(NH4HCO3)、氯化铵(NH4Cl)和尿素[CO(NH2)2]中的一种,为鉴别三种化肥,某同学分别取少量样品编号为X、Y、Z,并进行如下实验(此处箭头表示得出实验结论)
根据上述实验,下列说法错误的是( )
A.X物质为尿素
B.Y物质为碳酸氢铵
C.常温下如要鉴别Y、Z两种样品,能采取闻气味的方法
D.如果实验Ⅱ中Y、Z两种样品没有另取,则会使检验结果不准确
11、除去下列物质中的少量杂质(括号内为杂质)所用除去杂质的方法正确的是( )
12、粗盐中含有少量的MgCl2、CaCl2、Na2SO4等杂质,为了将杂质除干净,先向粗盐溶液中分别加入过量的①NaOH,②Na2CO3,③BaCl2溶液;过滤,再加入④稀盐酸使溶液的pH=7将最后所得溶液进行蒸发可得到精盐,加入溶液的先后顺序错误的是( )
A.②③①④ B.③②①④ C.①③②④ D.③①②④
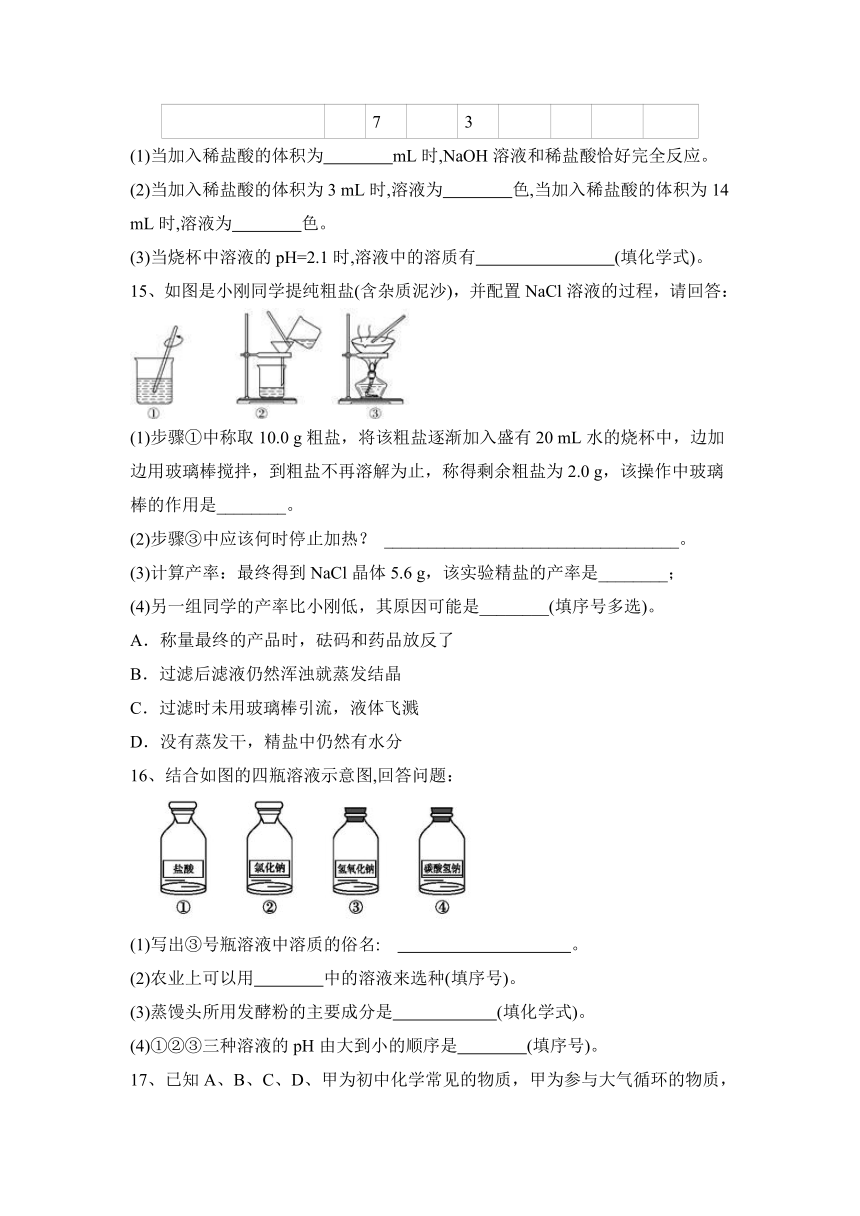
二、填空题。
13、侯德榜是我国著名的化学家,为纯碱和氮肥工业技术的发展作出了杰出的贡献,他发明的侯氏制碱法大大提高了原料的利用率,其工业流程大致如图:
(1)上述流程中,用到的原料有空气、焦炭、水、二氧化碳、________等。
(2)上述流程中,已知步骤②发生的是化合反应,步骤⑤发生的是分解反应,则步骤②、⑤发生反应的化学方程式是:②________,⑤________。
(3)上述流程中,可循环利用的物质是________。
(4)上述流程中,“一种氮肥”的化学式是________。
14、向盛有10 mL NaOH溶液(其中滴有少量无色酚酞溶液)的烧杯中逐滴加入稀盐酸,用pH计(用来精确测定溶液pH的仪器)测定溶液的pH,所得数据如表。
加入稀盐酸的体积/mL 0 2 4 6 8 10 12 14
烧杯中溶液的pH 12.9 12.7 12.5 12.3 11.9 7.0 2.1 1.9
(1)当加入稀盐酸的体积为 mL时,NaOH溶液和稀盐酸恰好完全反应。
(2)当加入稀盐酸的体积为3 mL时,溶液为 色,当加入稀盐酸的体积为14 mL时,溶液为 色。
(3)当烧杯中溶液的pH=2.1时,溶液中的溶质有 (填化学式)。
15、如图是小刚同学提纯粗盐(含杂质泥沙),并配置NaCl溶液的过程,请回答:
(1)步骤①中称取10.0 g粗盐,将该粗盐逐渐加入盛有20 mL水的烧杯中,边加边用玻璃棒搅拌,到粗盐不再溶解为止,称得剩余粗盐为2.0 g,该操作中玻璃棒的作用是________。
(2)步骤③中应该何时停止加热? __________________________________。
(3)计算产率:最终得到NaCl晶体5.6 g,该实验精盐的产率是________;
(4)另一组同学的产率比小刚低,其原因可能是________(填序号多选)。
A.称量最终的产品时,砝码和药品放反了
B.过滤后滤液仍然浑浊就蒸发结晶
C.过滤时未用玻璃棒引流,液体飞溅
D.没有蒸发干,精盐中仍然有水分
16、结合如图的四瓶溶液示意图,回答问题:
(1)写出③号瓶溶液中溶质的俗名: 。
(2)农业上可以用 中的溶液来选种(填序号)。
(3)蒸馒头所用发酵粉的主要成分是 (填化学式)。
(4)①②③三种溶液的pH由大到小的顺序是 (填序号)。
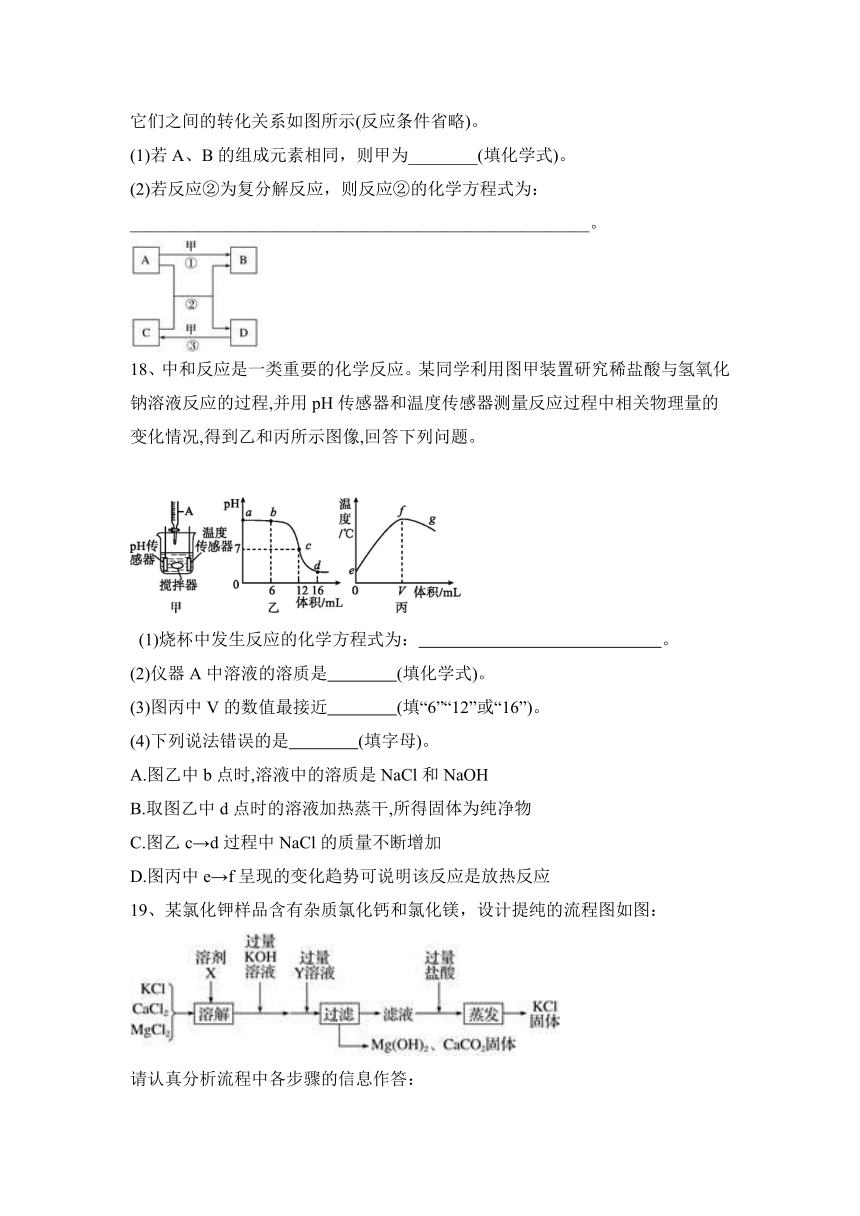
17、已知A、B、C、D、甲为初中化学常见的物质,甲为参与大气循环的物质,它们之间的转化关系如图所示(反应条件省略)。
(1)若A、B的组成元素相同,则甲为________(填化学式)。
(2)若反应②为复分解反应,则反应②的化学方程式为:
_____________________________________________________。
18、中和反应是一类重要的化学反应。某同学利用图甲装置研究稀盐酸与氢氧化钠溶液反应的过程,并用pH传感器和温度传感器测量反应过程中相关物理量的变化情况,得到乙和丙所示图像,回答下列问题。
(1)烧杯中发生反应的化学方程式为: 。
(2)仪器A中溶液的溶质是 (填化学式)。
(3)图丙中V的数值最接近 (填“6”“12”或“16”)。
(4)下列说法错误的是 (填字母)。
A.图乙中b点时,溶液中的溶质是NaCl和NaOH
B.取图乙中d点时的溶液加热蒸干,所得固体为纯净物
C.图乙c→d过程中NaCl的质量不断增加
D.图丙中e→f呈现的变化趋势可说明该反应是放热反应
19、某氯化钾样品含有杂质氯化钙和氯化镁,设计提纯的流程图如图:
请认真分析流程中各步骤的信息作答:
(1)溶剂X是________;Y溶液中溶质的化学式:________。
(2)蒸发操作的目的是除去(填物质的化学式)________。
(3)写出加入过量KOH溶液反应的化学方程式:
____________________________________________________________。
20、A~H是初中化学常见的物质,它们之间的关系如图所示(“→”表示物质间的转化关系,“—”表示两端的物质能发生化学反应)。虚线圈中的两种物质类别相同。A的浓溶液有吸水性,在实验室常用作干燥剂;C可用来改良酸性土壤;D广泛应用于肥皂、石油、造纸、纺织和印染等工业,在生活中可用来去除油污;E的水溶液为浅绿色,F可与生石灰、水配制成具有杀菌作用的波尔多液;A的稀溶液与G发生复分解反应生成F与H。
(1)写出化学式:B ,F 。
(2)写出C转化为D的化学方程式: 。
(3)写出A的稀溶液与G发生反应的化学方程式: ;F转化为E反应的基本类型是 。
(4)分类观是化学的核心观念之一,以上8种物质没有涉及的物质类别是 。
三、实验题。
21、漳州小吃手抓面,制作时要用到大树碱,大树碱的主要成分是K2CO3。为了测定大树碱中K2CO3的质量分数,小文同学进行了如下实验;
(1)用托盘天平称取10 g大树碱样品,在称量过程中发现天平指针如图所示,则此时应进行的操作是______________________________________________。
(2)用量筒量取一定量的水,为了准确量取水的体积,还需要使用的仪器是________。
(3)把大树碱样品和水加入烧杯中,用玻璃棒搅拌,使大树碱完全溶解,玻璃棒的作用是_______________________________________________________。
(4)向配好的溶液中逐渐加入CaCl2溶液,生成1 g沉淀(假设大树碱中其他成分不参与反应,反应的化学方程式为CaCl2+K2CO3===CaCO3↓+2KCl)。计算大树碱中K2CO3的质量分数________。
(5)小文同学在配制好溶液后,发现纸片上还有残留固体,则计算出的大树碱K2CO3的质量分数________(填“偏大”或“偏小”)。
22、硫酸铵和氯化钾是化工生产的副产品,直接作为肥料使用会使土壤酸化或影响作物的生长,工业上往往将氯化钾转化为无氯化肥。下图是硫酸铵等几种盐的溶解度曲线。回答下列问题:
(1)根据溶解度曲线图,归纳硫酸铵等物质溶解度——温度曲线变化规律:
①_____________________________________________________________;
②温度相同时,_________________________________________________。
(2)将氯化钾转化为无氯钾肥的流程如下:
③根据溶解度曲线判断产品(无氯钾肥)的化学式是________。
④操作Ⅰ主要是趁热过滤,过滤后的产品中________(NH4)2SO4晶体析出(填“有”或“没有”)。
(3)苯甲酸(C6H5COOH)通常用作定香剂或防腐剂,也用作果汁饮料的保香剂。合成苯甲酸晶体常伴随有氯化钾等副产品生成,某同学加热分离氯化钾后的白色固体A,并测定其熔点,发现其在115 ℃开始熔化,达到130 ℃时仍有少量不熔。
资料苯甲酸熔点122.4 ℃,纯净固体一般都有固定熔点;在常温时苯甲酸溶解度很小,小于0.4 g。
【提出问题】分离氯化钾后的白色固体A的成分是什么?
【猜想】]猜想1:苯甲酸;猜想2:氯化钾,猜想3:____________________________________。
【实验探究】限选试剂:蒸馏水、AgNO3溶液、稀硝酸
四、计算类综合题。
23、某实验小组用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液,测定Na2CO3溶液中溶质的质量分数。他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示。
(1)在加入Na2CO3溶液的过程中,开始时没有发现沉淀生成,说明滤液中的溶质有________。
(2)计算Na2CO3溶液中溶质的质量分数________。(写出计算过程,计算结果精确到0.1%)(反应的方程式:Na2CO3+CaCl2===CaCO3↓+2NaCl)
2022(春)人教九下化学第11单元:盐 化肥含答案
一、选择题。
1、根据酸、碱、盐的溶解性判断,下列关于物质的溶解性叙述正确的是 ( )
①硝酸盐都能溶于水 ②碳酸盐都不溶于水
③硫酸盐少数溶于水 ④碱多数难溶于水
A.①② B.①③ C.①④ D.②③
【答案】C
2、下列关于氯化钠的认识,正确的是( )
A.组成:含有钠和氯两种单质
B.性质:与盐酸类似,能与碳酸盐反应
C.用途:可用于生产金属钠
D.生产:常用钠与氯气通过化合反应获得
【答案】C
3、有失去标签的硫酸、氢氧化钙、氢氧化钠三瓶溶液,现有下列试剂,可以一次性予以区分开来的是( )
A. 酚酞试液 B. 石蕊试液 C. 碳酸钠溶液 D. 金属锌
【答案】C
4、下表是一些食物的pH,其中最不适宜胃酸过多的人食用的是 ( )
物质 玉米粥 牛奶 鸡蛋清 番茄
pH 7.0~8.0 6.3~6.6 7.6~8.0 4.0~4.4
A.玉米粥 B.番茄 C.鸡蛋清 D.牛奶
【答案】B
5、下列属于物理变化的是( )
A.海水晒盐 B.海水制“碱”
C.海水制镁 D.除去海水中的氯化镁等可溶性杂质
【答案】A
6、五一国际劳动节,化学兴趣小组来到学校的学农基地,发现原本翠绿的葡萄叶片叶色变黄,为使葡萄叶片转绿,学农基地应为这些葡萄追施的化学肥料是( )
A.CO(NH2)2 B.Ca3(PO4)2 C.KCl D.KH2PO4
【答案】A。
7、粗食盐中常含杂质CaCl2,MgCl2和Na2SO4。用粗盐制备精盐时,通常采用溶解、除杂、过滤和蒸发的操作,其中往粗盐溶液中加入NaOH溶液、Na2CO3溶液、BaCl2溶液和盐酸(均可以过量)的目的就是除杂。所加溶液的顺序错误的是( )
A. BaCl2溶液、NaOH溶液、Na2CO3溶液、盐酸
B. NaOH溶液、BaCl2溶液、Na2CO3溶液、盐酸
C. Na2CO3溶液、BaCl2溶液、NaOH溶液、盐酸
D. BaCl2溶液、Na2CO3溶液、NaOH溶液、盐酸
【答案】C
8、下列各组溶液,不另加试剂就无法将它们鉴别出来的是( )
A.BaCl2 NaCl CuSO4 NaOH B.Na2CO3 CaCl2 HCl K2CO3
C.Na2CO3 KCl CaCl2 H2SO4 D.Na2CO3 BaCl2 HCl K2SO4
【答案】B
9、如图所示,通过长颈漏斗向该装置中慢慢加入X,可观察到气球逐渐胀大,再慢慢加入Y,又看到气球逐渐变小,则X、Y分别为( )
A. 盐酸、硫酸铜溶液 B. 盐酸、氯化钙溶液
C. 硫酸、氢氧化钠溶液 D. 硫酸、氯化镁溶液
【答案】C
10、实验室有三瓶化肥标签脱落,只知道它们分别是碳酸氢铵(NH4HCO3)、氯化铵(NH4Cl)和尿素[CO(NH2)2]中的一种,为鉴别三种化肥,某同学分别取少量样品编号为X、Y、Z,并进行如下实验(此处箭头表示得出实验结论)
根据上述实验,下列说法错误的是( )
A.X物质为尿素
B.Y物质为碳酸氢铵
C.常温下如要鉴别Y、Z两种样品,能采取闻气味的方法
D.如果实验Ⅱ中Y、Z两种样品没有另取,则会使检验结果不准确
【答案】D。
11、除去下列物质中的少量杂质(括号内为杂质)所用除去杂质的方法正确的是( )
【答案】A
12、粗盐中含有少量的MgCl2、CaCl2、Na2SO4等杂质,为了将杂质除干净,先向粗盐溶液中分别加入过量的①NaOH,②Na2CO3,③BaCl2溶液;过滤,再加入④稀盐酸使溶液的pH=7将最后所得溶液进行蒸发可得到精盐,加入溶液的先后顺序错误的是( )
A.②③①④ B.③②①④ C.①③②④ D.③①②④
【答案】A
二、填空题。
13、侯德榜是我国著名的化学家,为纯碱和氮肥工业技术的发展作出了杰出的贡献,他发明的侯氏制碱法大大提高了原料的利用率,其工业流程大致如图:
(1)上述流程中,用到的原料有空气、焦炭、水、二氧化碳、________等。
(2)上述流程中,已知步骤②发生的是化合反应,步骤⑤发生的是分解反应,则步骤②、⑤发生反应的化学方程式是:②________,⑤________。
(3)上述流程中,可循环利用的物质是________。
(4)上述流程中,“一种氮肥”的化学式是________。
【答案】(1)氯化钠饱和溶液
(2)N2+3H22NH3 2NaHCO3Na2CO3+H2O+CO2↑
(3)二氧化碳、水 (4)NH4Cl
14、向盛有10 mL NaOH溶液(其中滴有少量无色酚酞溶液)的烧杯中逐滴加入稀盐酸,用pH计(用来精确测定溶液pH的仪器)测定溶液的pH,所得数据如表。
加入稀盐酸的体积/mL 0 2 4 6 8 10 12 14
烧杯中溶液的pH 12.9 12.7 12.5 12.3 11.9 7.0 2.1 1.9
(1)当加入稀盐酸的体积为 mL时,NaOH溶液和稀盐酸恰好完全反应。
(2)当加入稀盐酸的体积为3 mL时,溶液为 色,当加入稀盐酸的体积为14 mL时,溶液为 色。
(3)当烧杯中溶液的pH=2.1时,溶液中的溶质有 (填化学式)。
【答案】(1)10 (2)红 无 (3)NaCl、HCl
15、如图是小刚同学提纯粗盐(含杂质泥沙),并配置NaCl溶液的过程,请回答:
(1)步骤①中称取10.0 g粗盐,将该粗盐逐渐加入盛有20 mL水的烧杯中,边加边用玻璃棒搅拌,到粗盐不再溶解为止,称得剩余粗盐为2.0 g,该操作中玻璃棒的作用是________。
(2)步骤③中应该何时停止加热? __________________________________。
(3)计算产率:最终得到NaCl晶体5.6 g,该实验精盐的产率是________;
(4)另一组同学的产率比小刚低,其原因可能是________(填序号多选)。
A.称量最终的产品时,砝码和药品放反了
B.过滤后滤液仍然浑浊就蒸发结晶
C.过滤时未用玻璃棒引流,液体飞溅
D.没有蒸发干,精盐中仍然有水分
【答案】(1)搅拌 (2)析出大量晶体 (3)70% (4)ABC
16、结合如图的四瓶溶液示意图,回答问题:
(1)写出③号瓶溶液中溶质的俗名: 。
(2)农业上可以用 中的溶液来选种(填序号)。
(3)蒸馒头所用发酵粉的主要成分是 (填化学式)。
(4)①②③三种溶液的pH由大到小的顺序是 (填序号)。
【答案】(1)烧碱 (2)② (3)NaHCO3 (4)③②①
17、已知A、B、C、D、甲为初中化学常见的物质,甲为参与大气循环的物质,它们之间的转化关系如图所示(反应条件省略)。
(1)若A、B的组成元素相同,则甲为________(填化学式)。
(2)若反应②为复分解反应,则反应②的化学方程式为:
_____________________________________________________。
【答案】(1)O2 (2)Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
18、中和反应是一类重要的化学反应。某同学利用图甲装置研究稀盐酸与氢氧化钠溶液反应的过程,并用pH传感器和温度传感器测量反应过程中相关物理量的变化情况,得到乙和丙所示图像,回答下列问题。
(1)烧杯中发生反应的化学方程式为: 。
(2)仪器A中溶液的溶质是 (填化学式)。
(3)图丙中V的数值最接近 (填“6”“12”或“16”)。
(4)下列说法错误的是 (填字母)。
A.图乙中b点时,溶液中的溶质是NaCl和NaOH
B.取图乙中d点时的溶液加热蒸干,所得固体为纯净物
C.图乙c→d过程中NaCl的质量不断增加
D.图丙中e→f呈现的变化趋势可说明该反应是放热反应
【答案】(1)NaOH+HClNaCl+H2O (2)HCl (3)12 (4)C
19、某氯化钾样品含有杂质氯化钙和氯化镁,设计提纯的流程图如图:
请认真分析流程中各步骤的信息作答:
(1)溶剂X是________;Y溶液中溶质的化学式:________。
(2)蒸发操作的目的是除去(填物质的化学式)________。
(3)写出加入过量KOH溶液反应的化学方程式:
____________________________________________________________。
【答案】(1)水(或H2O) K2CO3 (2)HCl、H2O
(3)MgCl2+2KOH===Mg(OH)2↓+2KCl
20、A~H是初中化学常见的物质,它们之间的关系如图所示(“→”表示物质间的转化关系,“—”表示两端的物质能发生化学反应)。虚线圈中的两种物质类别相同。A的浓溶液有吸水性,在实验室常用作干燥剂;C可用来改良酸性土壤;D广泛应用于肥皂、石油、造纸、纺织和印染等工业,在生活中可用来去除油污;E的水溶液为浅绿色,F可与生石灰、水配制成具有杀菌作用的波尔多液;A的稀溶液与G发生复分解反应生成F与H。
(1)写出化学式:B ,F 。
(2)写出C转化为D的化学方程式: 。
(3)写出A的稀溶液与G发生反应的化学方程式: ;F转化为E反应的基本类型是 。
(4)分类观是化学的核心观念之一,以上8种物质没有涉及的物质类别是 。
【答案】(1)HCl CuSO4 (2)
(3) 置换反应 (4)单质
三、实验题。
21、漳州小吃手抓面,制作时要用到大树碱,大树碱的主要成分是K2CO3。为了测定大树碱中K2CO3的质量分数,小文同学进行了如下实验;
(1)用托盘天平称取10 g大树碱样品,在称量过程中发现天平指针如图所示,则此时应进行的操作是______________________________________________。
(2)用量筒量取一定量的水,为了准确量取水的体积,还需要使用的仪器是________。
(3)把大树碱样品和水加入烧杯中,用玻璃棒搅拌,使大树碱完全溶解,玻璃棒的作用是_______________________________________________________。
(4)向配好的溶液中逐渐加入CaCl2溶液,生成1 g沉淀(假设大树碱中其他成分不参与反应,反应的化学方程式为CaCl2+K2CO3===CaCO3↓+2KCl)。计算大树碱中K2CO3的质量分数________。
(5)小文同学在配制好溶液后,发现纸片上还有残留固体,则计算出的大树碱K2CO3的质量分数________(填“偏大”或“偏小”)。
【答案】(1)往左盘加树碱至天平平衡 (2)胶头滴管 (3)搅拌,加速溶解 (4)13.8% (5)偏小
【解析】(1)指针偏右,说明左盘树碱样品小于10 g;
(2)用量筒量取一定量的水,为了准确量取水的体积,还需要使用的仪器是胶头滴管;(3)溶解中玻璃棒的作用是搅拌,加速溶解;(4)根据碳酸钙的质量计算碳酸钾的质量,进而求质量分数;(5)纸片上还有残留固体,则溶液中溶质偏小,质量分数偏小。
22、硫酸铵和氯化钾是化工生产的副产品,直接作为肥料使用会使土壤酸化或影响作物的生长,工业上往往将氯化钾转化为无氯化肥。下图是硫酸铵等几种盐的溶解度曲线。回答下列问题:
(1)根据溶解度曲线图,归纳硫酸铵等物质溶解度——温度曲线变化规律:
①_____________________________________________________________;
②温度相同时,_________________________________________________。
(2)将氯化钾转化为无氯钾肥的流程如下:
③根据溶解度曲线判断产品(无氯钾肥)的化学式是________。
④操作Ⅰ主要是趁热过滤,过滤后的产品中________(NH4)2SO4晶体析出(填“有”或“没有”)。
(3)苯甲酸(C6H5COOH)通常用作定香剂或防腐剂,也用作果汁饮料的保香剂。合成苯甲酸晶体常伴随有氯化钾等副产品生成,某同学加热分离氯化钾后的白色固体A,并测定其熔点,发现其在115 ℃开始熔化,达到130 ℃时仍有少量不熔。
资料苯甲酸熔点122.4 ℃,纯净固体一般都有固定熔点;在常温时苯甲酸溶解度很小,小于0.4 g。
【提出问题】分离氯化钾后的白色固体A的成分是什么?
【猜想】]猜想1:苯甲酸;猜想2:氯化钾,猜想3:____________________________________。
【实验探究】限选试剂:蒸馏水、AgNO3溶液、稀硝酸
【答案】
(1)①大部分物质的溶解度随温度的升高而增大 ②各物质的解度不一定相同
(2)③K2SO4 ④没有
(3)【猜想】苯甲酸、氯化钾
【实验探究】
四、计算类综合题。
23、某实验小组用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液,测定Na2CO3溶液中溶质的质量分数。他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示。
(1)在加入Na2CO3溶液的过程中,开始时没有发现沉淀生成,说明滤液中的溶质有________。
(2)计算Na2CO3溶液中溶质的质量分数________。(写出计算过程,计算结果精确到0.1%)(反应的方程式:Na2CO3+CaCl2===CaCO3↓+2NaCl)
【答案】(1)CaCl2、HCl
(2)设:20 g Na2CO3溶液中溶质的质量为x,
解之得:x=5.3 g,
则该Na2CO3溶液中溶质的质量分数为×100%=26.5%。
【解析】(1)根据已知条件可知,开始时没有发现沉淀生成,说明滤液中除了CaCl2还有其他物质,由第一个实验可以推断,这种物质是稀盐酸;
(2)分析图意可知,有20 g Na2CO3溶液与氯化钙溶液全部反应,生成5 g碳酸钙沉淀,根据反应的化学方程式,得出各物质之间的质量比,列出比例式,就可计算出20 g Na2CO3溶液中溶质的质量,然后根据溶质的质量分数公式计算即可。
一、选择题。
1、根据酸、碱、盐的溶解性判断,下列关于物质的溶解性叙述正确的是 ( )
①硝酸盐都能溶于水 ②碳酸盐都不溶于水
③硫酸盐少数溶于水 ④碱多数难溶于水
A.①② B.①③ C.①④ D.②③
2、下列关于氯化钠的认识,正确的是( )
A.组成:含有钠和氯两种单质
B.性质:与盐酸类似,能与碳酸盐反应
C.用途:可用于生产金属钠
D.生产:常用钠与氯气通过化合反应获得
3、有失去标签的硫酸、氢氧化钙、氢氧化钠三瓶溶液,现有下列试剂,可以一次性予以区分开来的是( )
A. 酚酞试液 B. 石蕊试液 C. 碳酸钠溶液 D. 金属锌
4、下表是一些食物的pH,其中最不适宜胃酸过多的人食用的是 ( )
物质 玉米粥 牛奶 鸡蛋清 番茄
pH 7.0~8.0 6.3~6.6 7.6~8.0 4.0~4.4
A.玉米粥 B.番茄 C.鸡蛋清 D.牛奶
5、下列属于物理变化的是( )
A.海水晒盐 B.海水制“碱”
C.海水制镁 D.除去海水中的氯化镁等可溶性杂质
6、五一国际劳动节,化学兴趣小组来到学校的学农基地,发现原本翠绿的葡萄叶片叶色变黄,为使葡萄叶片转绿,学农基地应为这些葡萄追施的化学肥料是( )
A.CO(NH2)2 B.Ca3(PO4)2 C.KCl D.KH2PO4
7、粗食盐中常含杂质CaCl2,MgCl2和Na2SO4。用粗盐制备精盐时,通常采用溶解、除杂、过滤和蒸发的操作,其中往粗盐溶液中加入NaOH溶液、Na2CO3溶液、BaCl2溶液和盐酸(均可以过量)的目的就是除杂。所加溶液的顺序错误的是( )
A. BaCl2溶液、NaOH溶液、Na2CO3溶液、盐酸
B. NaOH溶液、BaCl2溶液、Na2CO3溶液、盐酸
C. Na2CO3溶液、BaCl2溶液、NaOH溶液、盐酸
D. BaCl2溶液、Na2CO3溶液、NaOH溶液、盐酸
8、下列各组溶液,不另加试剂就无法将它们鉴别出来的是( )
A.BaCl2 NaCl CuSO4 NaOH B.Na2CO3 CaCl2 HCl K2CO3
C.Na2CO3 KCl CaCl2 H2SO4 D.Na2CO3 BaCl2 HCl K2SO4
9、如图所示,通过长颈漏斗向该装置中慢慢加入X,可观察到气球逐渐胀大,再慢慢加入Y,又看到气球逐渐变小,则X、Y分别为( )
A. 盐酸、硫酸铜溶液 B. 盐酸、氯化钙溶液
C. 硫酸、氢氧化钠溶液 D. 硫酸、氯化镁溶液
10、实验室有三瓶化肥标签脱落,只知道它们分别是碳酸氢铵(NH4HCO3)、氯化铵(NH4Cl)和尿素[CO(NH2)2]中的一种,为鉴别三种化肥,某同学分别取少量样品编号为X、Y、Z,并进行如下实验(此处箭头表示得出实验结论)
根据上述实验,下列说法错误的是( )
A.X物质为尿素
B.Y物质为碳酸氢铵
C.常温下如要鉴别Y、Z两种样品,能采取闻气味的方法
D.如果实验Ⅱ中Y、Z两种样品没有另取,则会使检验结果不准确
11、除去下列物质中的少量杂质(括号内为杂质)所用除去杂质的方法正确的是( )
12、粗盐中含有少量的MgCl2、CaCl2、Na2SO4等杂质,为了将杂质除干净,先向粗盐溶液中分别加入过量的①NaOH,②Na2CO3,③BaCl2溶液;过滤,再加入④稀盐酸使溶液的pH=7将最后所得溶液进行蒸发可得到精盐,加入溶液的先后顺序错误的是( )
A.②③①④ B.③②①④ C.①③②④ D.③①②④
二、填空题。
13、侯德榜是我国著名的化学家,为纯碱和氮肥工业技术的发展作出了杰出的贡献,他发明的侯氏制碱法大大提高了原料的利用率,其工业流程大致如图:
(1)上述流程中,用到的原料有空气、焦炭、水、二氧化碳、________等。
(2)上述流程中,已知步骤②发生的是化合反应,步骤⑤发生的是分解反应,则步骤②、⑤发生反应的化学方程式是:②________,⑤________。
(3)上述流程中,可循环利用的物质是________。
(4)上述流程中,“一种氮肥”的化学式是________。
14、向盛有10 mL NaOH溶液(其中滴有少量无色酚酞溶液)的烧杯中逐滴加入稀盐酸,用pH计(用来精确测定溶液pH的仪器)测定溶液的pH,所得数据如表。
加入稀盐酸的体积/mL 0 2 4 6 8 10 12 14
烧杯中溶液的pH 12.9 12.7 12.5 12.3 11.9 7.0 2.1 1.9
(1)当加入稀盐酸的体积为 mL时,NaOH溶液和稀盐酸恰好完全反应。
(2)当加入稀盐酸的体积为3 mL时,溶液为 色,当加入稀盐酸的体积为14 mL时,溶液为 色。
(3)当烧杯中溶液的pH=2.1时,溶液中的溶质有 (填化学式)。
15、如图是小刚同学提纯粗盐(含杂质泥沙),并配置NaCl溶液的过程,请回答:
(1)步骤①中称取10.0 g粗盐,将该粗盐逐渐加入盛有20 mL水的烧杯中,边加边用玻璃棒搅拌,到粗盐不再溶解为止,称得剩余粗盐为2.0 g,该操作中玻璃棒的作用是________。
(2)步骤③中应该何时停止加热? __________________________________。
(3)计算产率:最终得到NaCl晶体5.6 g,该实验精盐的产率是________;
(4)另一组同学的产率比小刚低,其原因可能是________(填序号多选)。
A.称量最终的产品时,砝码和药品放反了
B.过滤后滤液仍然浑浊就蒸发结晶
C.过滤时未用玻璃棒引流,液体飞溅
D.没有蒸发干,精盐中仍然有水分
16、结合如图的四瓶溶液示意图,回答问题:
(1)写出③号瓶溶液中溶质的俗名: 。
(2)农业上可以用 中的溶液来选种(填序号)。
(3)蒸馒头所用发酵粉的主要成分是 (填化学式)。
(4)①②③三种溶液的pH由大到小的顺序是 (填序号)。
17、已知A、B、C、D、甲为初中化学常见的物质,甲为参与大气循环的物质,它们之间的转化关系如图所示(反应条件省略)。
(1)若A、B的组成元素相同,则甲为________(填化学式)。
(2)若反应②为复分解反应,则反应②的化学方程式为:
_____________________________________________________。
18、中和反应是一类重要的化学反应。某同学利用图甲装置研究稀盐酸与氢氧化钠溶液反应的过程,并用pH传感器和温度传感器测量反应过程中相关物理量的变化情况,得到乙和丙所示图像,回答下列问题。
(1)烧杯中发生反应的化学方程式为: 。
(2)仪器A中溶液的溶质是 (填化学式)。
(3)图丙中V的数值最接近 (填“6”“12”或“16”)。
(4)下列说法错误的是 (填字母)。
A.图乙中b点时,溶液中的溶质是NaCl和NaOH
B.取图乙中d点时的溶液加热蒸干,所得固体为纯净物
C.图乙c→d过程中NaCl的质量不断增加
D.图丙中e→f呈现的变化趋势可说明该反应是放热反应
19、某氯化钾样品含有杂质氯化钙和氯化镁,设计提纯的流程图如图:
请认真分析流程中各步骤的信息作答:
(1)溶剂X是________;Y溶液中溶质的化学式:________。
(2)蒸发操作的目的是除去(填物质的化学式)________。
(3)写出加入过量KOH溶液反应的化学方程式:
____________________________________________________________。
20、A~H是初中化学常见的物质,它们之间的关系如图所示(“→”表示物质间的转化关系,“—”表示两端的物质能发生化学反应)。虚线圈中的两种物质类别相同。A的浓溶液有吸水性,在实验室常用作干燥剂;C可用来改良酸性土壤;D广泛应用于肥皂、石油、造纸、纺织和印染等工业,在生活中可用来去除油污;E的水溶液为浅绿色,F可与生石灰、水配制成具有杀菌作用的波尔多液;A的稀溶液与G发生复分解反应生成F与H。
(1)写出化学式:B ,F 。
(2)写出C转化为D的化学方程式: 。
(3)写出A的稀溶液与G发生反应的化学方程式: ;F转化为E反应的基本类型是 。
(4)分类观是化学的核心观念之一,以上8种物质没有涉及的物质类别是 。
三、实验题。
21、漳州小吃手抓面,制作时要用到大树碱,大树碱的主要成分是K2CO3。为了测定大树碱中K2CO3的质量分数,小文同学进行了如下实验;
(1)用托盘天平称取10 g大树碱样品,在称量过程中发现天平指针如图所示,则此时应进行的操作是______________________________________________。
(2)用量筒量取一定量的水,为了准确量取水的体积,还需要使用的仪器是________。
(3)把大树碱样品和水加入烧杯中,用玻璃棒搅拌,使大树碱完全溶解,玻璃棒的作用是_______________________________________________________。
(4)向配好的溶液中逐渐加入CaCl2溶液,生成1 g沉淀(假设大树碱中其他成分不参与反应,反应的化学方程式为CaCl2+K2CO3===CaCO3↓+2KCl)。计算大树碱中K2CO3的质量分数________。
(5)小文同学在配制好溶液后,发现纸片上还有残留固体,则计算出的大树碱K2CO3的质量分数________(填“偏大”或“偏小”)。
22、硫酸铵和氯化钾是化工生产的副产品,直接作为肥料使用会使土壤酸化或影响作物的生长,工业上往往将氯化钾转化为无氯化肥。下图是硫酸铵等几种盐的溶解度曲线。回答下列问题:
(1)根据溶解度曲线图,归纳硫酸铵等物质溶解度——温度曲线变化规律:
①_____________________________________________________________;
②温度相同时,_________________________________________________。
(2)将氯化钾转化为无氯钾肥的流程如下:
③根据溶解度曲线判断产品(无氯钾肥)的化学式是________。
④操作Ⅰ主要是趁热过滤,过滤后的产品中________(NH4)2SO4晶体析出(填“有”或“没有”)。
(3)苯甲酸(C6H5COOH)通常用作定香剂或防腐剂,也用作果汁饮料的保香剂。合成苯甲酸晶体常伴随有氯化钾等副产品生成,某同学加热分离氯化钾后的白色固体A,并测定其熔点,发现其在115 ℃开始熔化,达到130 ℃时仍有少量不熔。
资料苯甲酸熔点122.4 ℃,纯净固体一般都有固定熔点;在常温时苯甲酸溶解度很小,小于0.4 g。
【提出问题】分离氯化钾后的白色固体A的成分是什么?
【猜想】]猜想1:苯甲酸;猜想2:氯化钾,猜想3:____________________________________。
【实验探究】限选试剂:蒸馏水、AgNO3溶液、稀硝酸
四、计算类综合题。
23、某实验小组用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液,测定Na2CO3溶液中溶质的质量分数。他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示。
(1)在加入Na2CO3溶液的过程中,开始时没有发现沉淀生成,说明滤液中的溶质有________。
(2)计算Na2CO3溶液中溶质的质量分数________。(写出计算过程,计算结果精确到0.1%)(反应的方程式:Na2CO3+CaCl2===CaCO3↓+2NaCl)
2022(春)人教九下化学第11单元:盐 化肥含答案
一、选择题。
1、根据酸、碱、盐的溶解性判断,下列关于物质的溶解性叙述正确的是 ( )
①硝酸盐都能溶于水 ②碳酸盐都不溶于水
③硫酸盐少数溶于水 ④碱多数难溶于水
A.①② B.①③ C.①④ D.②③
【答案】C
2、下列关于氯化钠的认识,正确的是( )
A.组成:含有钠和氯两种单质
B.性质:与盐酸类似,能与碳酸盐反应
C.用途:可用于生产金属钠
D.生产:常用钠与氯气通过化合反应获得
【答案】C
3、有失去标签的硫酸、氢氧化钙、氢氧化钠三瓶溶液,现有下列试剂,可以一次性予以区分开来的是( )
A. 酚酞试液 B. 石蕊试液 C. 碳酸钠溶液 D. 金属锌
【答案】C
4、下表是一些食物的pH,其中最不适宜胃酸过多的人食用的是 ( )
物质 玉米粥 牛奶 鸡蛋清 番茄
pH 7.0~8.0 6.3~6.6 7.6~8.0 4.0~4.4
A.玉米粥 B.番茄 C.鸡蛋清 D.牛奶
【答案】B
5、下列属于物理变化的是( )
A.海水晒盐 B.海水制“碱”
C.海水制镁 D.除去海水中的氯化镁等可溶性杂质
【答案】A
6、五一国际劳动节,化学兴趣小组来到学校的学农基地,发现原本翠绿的葡萄叶片叶色变黄,为使葡萄叶片转绿,学农基地应为这些葡萄追施的化学肥料是( )
A.CO(NH2)2 B.Ca3(PO4)2 C.KCl D.KH2PO4
【答案】A。
7、粗食盐中常含杂质CaCl2,MgCl2和Na2SO4。用粗盐制备精盐时,通常采用溶解、除杂、过滤和蒸发的操作,其中往粗盐溶液中加入NaOH溶液、Na2CO3溶液、BaCl2溶液和盐酸(均可以过量)的目的就是除杂。所加溶液的顺序错误的是( )
A. BaCl2溶液、NaOH溶液、Na2CO3溶液、盐酸
B. NaOH溶液、BaCl2溶液、Na2CO3溶液、盐酸
C. Na2CO3溶液、BaCl2溶液、NaOH溶液、盐酸
D. BaCl2溶液、Na2CO3溶液、NaOH溶液、盐酸
【答案】C
8、下列各组溶液,不另加试剂就无法将它们鉴别出来的是( )
A.BaCl2 NaCl CuSO4 NaOH B.Na2CO3 CaCl2 HCl K2CO3
C.Na2CO3 KCl CaCl2 H2SO4 D.Na2CO3 BaCl2 HCl K2SO4
【答案】B
9、如图所示,通过长颈漏斗向该装置中慢慢加入X,可观察到气球逐渐胀大,再慢慢加入Y,又看到气球逐渐变小,则X、Y分别为( )
A. 盐酸、硫酸铜溶液 B. 盐酸、氯化钙溶液
C. 硫酸、氢氧化钠溶液 D. 硫酸、氯化镁溶液
【答案】C
10、实验室有三瓶化肥标签脱落,只知道它们分别是碳酸氢铵(NH4HCO3)、氯化铵(NH4Cl)和尿素[CO(NH2)2]中的一种,为鉴别三种化肥,某同学分别取少量样品编号为X、Y、Z,并进行如下实验(此处箭头表示得出实验结论)
根据上述实验,下列说法错误的是( )
A.X物质为尿素
B.Y物质为碳酸氢铵
C.常温下如要鉴别Y、Z两种样品,能采取闻气味的方法
D.如果实验Ⅱ中Y、Z两种样品没有另取,则会使检验结果不准确
【答案】D。
11、除去下列物质中的少量杂质(括号内为杂质)所用除去杂质的方法正确的是( )
【答案】A
12、粗盐中含有少量的MgCl2、CaCl2、Na2SO4等杂质,为了将杂质除干净,先向粗盐溶液中分别加入过量的①NaOH,②Na2CO3,③BaCl2溶液;过滤,再加入④稀盐酸使溶液的pH=7将最后所得溶液进行蒸发可得到精盐,加入溶液的先后顺序错误的是( )
A.②③①④ B.③②①④ C.①③②④ D.③①②④
【答案】A
二、填空题。
13、侯德榜是我国著名的化学家,为纯碱和氮肥工业技术的发展作出了杰出的贡献,他发明的侯氏制碱法大大提高了原料的利用率,其工业流程大致如图:
(1)上述流程中,用到的原料有空气、焦炭、水、二氧化碳、________等。
(2)上述流程中,已知步骤②发生的是化合反应,步骤⑤发生的是分解反应,则步骤②、⑤发生反应的化学方程式是:②________,⑤________。
(3)上述流程中,可循环利用的物质是________。
(4)上述流程中,“一种氮肥”的化学式是________。
【答案】(1)氯化钠饱和溶液
(2)N2+3H22NH3 2NaHCO3Na2CO3+H2O+CO2↑
(3)二氧化碳、水 (4)NH4Cl
14、向盛有10 mL NaOH溶液(其中滴有少量无色酚酞溶液)的烧杯中逐滴加入稀盐酸,用pH计(用来精确测定溶液pH的仪器)测定溶液的pH,所得数据如表。
加入稀盐酸的体积/mL 0 2 4 6 8 10 12 14
烧杯中溶液的pH 12.9 12.7 12.5 12.3 11.9 7.0 2.1 1.9
(1)当加入稀盐酸的体积为 mL时,NaOH溶液和稀盐酸恰好完全反应。
(2)当加入稀盐酸的体积为3 mL时,溶液为 色,当加入稀盐酸的体积为14 mL时,溶液为 色。
(3)当烧杯中溶液的pH=2.1时,溶液中的溶质有 (填化学式)。
【答案】(1)10 (2)红 无 (3)NaCl、HCl
15、如图是小刚同学提纯粗盐(含杂质泥沙),并配置NaCl溶液的过程,请回答:
(1)步骤①中称取10.0 g粗盐,将该粗盐逐渐加入盛有20 mL水的烧杯中,边加边用玻璃棒搅拌,到粗盐不再溶解为止,称得剩余粗盐为2.0 g,该操作中玻璃棒的作用是________。
(2)步骤③中应该何时停止加热? __________________________________。
(3)计算产率:最终得到NaCl晶体5.6 g,该实验精盐的产率是________;
(4)另一组同学的产率比小刚低,其原因可能是________(填序号多选)。
A.称量最终的产品时,砝码和药品放反了
B.过滤后滤液仍然浑浊就蒸发结晶
C.过滤时未用玻璃棒引流,液体飞溅
D.没有蒸发干,精盐中仍然有水分
【答案】(1)搅拌 (2)析出大量晶体 (3)70% (4)ABC
16、结合如图的四瓶溶液示意图,回答问题:
(1)写出③号瓶溶液中溶质的俗名: 。
(2)农业上可以用 中的溶液来选种(填序号)。
(3)蒸馒头所用发酵粉的主要成分是 (填化学式)。
(4)①②③三种溶液的pH由大到小的顺序是 (填序号)。
【答案】(1)烧碱 (2)② (3)NaHCO3 (4)③②①
17、已知A、B、C、D、甲为初中化学常见的物质,甲为参与大气循环的物质,它们之间的转化关系如图所示(反应条件省略)。
(1)若A、B的组成元素相同,则甲为________(填化学式)。
(2)若反应②为复分解反应,则反应②的化学方程式为:
_____________________________________________________。
【答案】(1)O2 (2)Ca(OH)2+Na2CO3===CaCO3↓+2NaOH
18、中和反应是一类重要的化学反应。某同学利用图甲装置研究稀盐酸与氢氧化钠溶液反应的过程,并用pH传感器和温度传感器测量反应过程中相关物理量的变化情况,得到乙和丙所示图像,回答下列问题。
(1)烧杯中发生反应的化学方程式为: 。
(2)仪器A中溶液的溶质是 (填化学式)。
(3)图丙中V的数值最接近 (填“6”“12”或“16”)。
(4)下列说法错误的是 (填字母)。
A.图乙中b点时,溶液中的溶质是NaCl和NaOH
B.取图乙中d点时的溶液加热蒸干,所得固体为纯净物
C.图乙c→d过程中NaCl的质量不断增加
D.图丙中e→f呈现的变化趋势可说明该反应是放热反应
【答案】(1)NaOH+HClNaCl+H2O (2)HCl (3)12 (4)C
19、某氯化钾样品含有杂质氯化钙和氯化镁,设计提纯的流程图如图:
请认真分析流程中各步骤的信息作答:
(1)溶剂X是________;Y溶液中溶质的化学式:________。
(2)蒸发操作的目的是除去(填物质的化学式)________。
(3)写出加入过量KOH溶液反应的化学方程式:
____________________________________________________________。
【答案】(1)水(或H2O) K2CO3 (2)HCl、H2O
(3)MgCl2+2KOH===Mg(OH)2↓+2KCl
20、A~H是初中化学常见的物质,它们之间的关系如图所示(“→”表示物质间的转化关系,“—”表示两端的物质能发生化学反应)。虚线圈中的两种物质类别相同。A的浓溶液有吸水性,在实验室常用作干燥剂;C可用来改良酸性土壤;D广泛应用于肥皂、石油、造纸、纺织和印染等工业,在生活中可用来去除油污;E的水溶液为浅绿色,F可与生石灰、水配制成具有杀菌作用的波尔多液;A的稀溶液与G发生复分解反应生成F与H。
(1)写出化学式:B ,F 。
(2)写出C转化为D的化学方程式: 。
(3)写出A的稀溶液与G发生反应的化学方程式: ;F转化为E反应的基本类型是 。
(4)分类观是化学的核心观念之一,以上8种物质没有涉及的物质类别是 。
【答案】(1)HCl CuSO4 (2)
(3) 置换反应 (4)单质
三、实验题。
21、漳州小吃手抓面,制作时要用到大树碱,大树碱的主要成分是K2CO3。为了测定大树碱中K2CO3的质量分数,小文同学进行了如下实验;
(1)用托盘天平称取10 g大树碱样品,在称量过程中发现天平指针如图所示,则此时应进行的操作是______________________________________________。
(2)用量筒量取一定量的水,为了准确量取水的体积,还需要使用的仪器是________。
(3)把大树碱样品和水加入烧杯中,用玻璃棒搅拌,使大树碱完全溶解,玻璃棒的作用是_______________________________________________________。
(4)向配好的溶液中逐渐加入CaCl2溶液,生成1 g沉淀(假设大树碱中其他成分不参与反应,反应的化学方程式为CaCl2+K2CO3===CaCO3↓+2KCl)。计算大树碱中K2CO3的质量分数________。
(5)小文同学在配制好溶液后,发现纸片上还有残留固体,则计算出的大树碱K2CO3的质量分数________(填“偏大”或“偏小”)。
【答案】(1)往左盘加树碱至天平平衡 (2)胶头滴管 (3)搅拌,加速溶解 (4)13.8% (5)偏小
【解析】(1)指针偏右,说明左盘树碱样品小于10 g;
(2)用量筒量取一定量的水,为了准确量取水的体积,还需要使用的仪器是胶头滴管;(3)溶解中玻璃棒的作用是搅拌,加速溶解;(4)根据碳酸钙的质量计算碳酸钾的质量,进而求质量分数;(5)纸片上还有残留固体,则溶液中溶质偏小,质量分数偏小。
22、硫酸铵和氯化钾是化工生产的副产品,直接作为肥料使用会使土壤酸化或影响作物的生长,工业上往往将氯化钾转化为无氯化肥。下图是硫酸铵等几种盐的溶解度曲线。回答下列问题:
(1)根据溶解度曲线图,归纳硫酸铵等物质溶解度——温度曲线变化规律:
①_____________________________________________________________;
②温度相同时,_________________________________________________。
(2)将氯化钾转化为无氯钾肥的流程如下:
③根据溶解度曲线判断产品(无氯钾肥)的化学式是________。
④操作Ⅰ主要是趁热过滤,过滤后的产品中________(NH4)2SO4晶体析出(填“有”或“没有”)。
(3)苯甲酸(C6H5COOH)通常用作定香剂或防腐剂,也用作果汁饮料的保香剂。合成苯甲酸晶体常伴随有氯化钾等副产品生成,某同学加热分离氯化钾后的白色固体A,并测定其熔点,发现其在115 ℃开始熔化,达到130 ℃时仍有少量不熔。
资料苯甲酸熔点122.4 ℃,纯净固体一般都有固定熔点;在常温时苯甲酸溶解度很小,小于0.4 g。
【提出问题】分离氯化钾后的白色固体A的成分是什么?
【猜想】]猜想1:苯甲酸;猜想2:氯化钾,猜想3:____________________________________。
【实验探究】限选试剂:蒸馏水、AgNO3溶液、稀硝酸
【答案】
(1)①大部分物质的溶解度随温度的升高而增大 ②各物质的解度不一定相同
(2)③K2SO4 ④没有
(3)【猜想】苯甲酸、氯化钾
【实验探究】
四、计算类综合题。
23、某实验小组用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2CO3溶液,他决定利用该废液,测定Na2CO3溶液中溶质的质量分数。他将废液过滤,然后向废液中慢慢滴加Na2CO3溶液,加入Na2CO3溶液的质量与生成沉淀质量的关系如图所示。
(1)在加入Na2CO3溶液的过程中,开始时没有发现沉淀生成,说明滤液中的溶质有________。
(2)计算Na2CO3溶液中溶质的质量分数________。(写出计算过程,计算结果精确到0.1%)(反应的方程式:Na2CO3+CaCl2===CaCO3↓+2NaCl)
【答案】(1)CaCl2、HCl
(2)设:20 g Na2CO3溶液中溶质的质量为x,
解之得:x=5.3 g,
则该Na2CO3溶液中溶质的质量分数为×100%=26.5%。
【解析】(1)根据已知条件可知,开始时没有发现沉淀生成,说明滤液中除了CaCl2还有其他物质,由第一个实验可以推断,这种物质是稀盐酸;
(2)分析图意可知,有20 g Na2CO3溶液与氯化钙溶液全部反应,生成5 g碳酸钙沉淀,根据反应的化学方程式,得出各物质之间的质量比,列出比例式,就可计算出20 g Na2CO3溶液中溶质的质量,然后根据溶质的质量分数公式计算即可。
同课章节目录
