2022春人教九下化学第九单元 溶液(word版有答案)
文档属性
| 名称 | 2022春人教九下化学第九单元 溶液(word版有答案) |  | |
| 格式 | zip | ||
| 文件大小 | 376.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-31 09:27:12 | ||
图片预览



文档简介
2022春人教九下化学第九单元 溶液含答案
一、选择题。
1、下列厨房用品中,易溶于水形成溶液的是( )
A 花生油 B 面粉 C 白糖 D 辣椒粉
2、下列关于溶液的说法正确的是( )
A.溶液具有均一性、稳定性
B.长期放置后不会分层的液体一定是溶液
C.溶质都是固体
D.医用酒精是乙醇溶液,乙醇作溶剂
3、如图所示分液漏斗中盛有液体甲,锥形瓶内盛有固体乙。打开分液漏斗,气球会逐渐鼓起的组合是( )
选项 A B C D
甲 水 稀盐酸 水 稀盐酸
乙 氢氧化钠固体 锌粒 硝酸铵固体 大理石
4、配制溶液时,下列溶剂中最常用的是( )
A.酒精 B.植物油 C.汽油 D.水
5、0 ℃时,四个实验小组分别取不同质量的NaCl,逐渐加入盛有50 g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表。下列说法错误的是 ( )
实验小组 第一组 第二组 第三组 第四组
水的质量/g 50 50 50 50
所取NaCl的质量/g 15 20 25 30
剩余NaCl的质量/g 0 2 7 12
A.20 ℃时,50 g NaCl饱和溶液中含有18 g NaCl
B.用蒸发的方法可以使不饱和溶液变成饱和溶液
C.第二组所得溶液的溶质与溶剂的质量比为9∶25
D.第一组所得溶液是不饱和溶液
6、室温时,向100 g水中加入硝酸钾至刚好饱和,图所示的四个图像能正确反映对应变化关系的是 ( )
7、下列有关溶液的叙述正确的是 ( )
A.稀溶液一定是不饱和溶液
B.饱和溶液就是不能再溶解如何物质的溶液
C.溶质的溶解度都随温度的升高而增大
D.溶质在溶解的过程中,有的放出热量,有的吸收热量
8、下列关于溶液的说法中错误的是( )
A. 饱和溶液析出晶体后,其溶质的质量分数可能不变
B. 在溶液里进行的化学反应,通常比较快
C. 同种溶质的饱和溶液,一定比它的不饱和溶液的溶质质量分数大
D. 不饱和溶液转化为饱和溶液,溶质质量分数可能不变
9、小朋要配制50 g质量分数为14%的氢氧化钠溶液来制作“叶脉书签”。下列关于配制该溶液的说法不正确的是( )
①若用氢氧化钠固体配制,需称取氢氧化钠固体7.0 g
②用托盘天平称氢氧化钠固体时,在两盘各放一张质量相等的纸
③选用200 mL量筒量取所需的水
④实验中用到的玻璃仪器有烧杯、量筒、胶头滴管、玻璃棒和试剂瓶
⑤用量筒量取水时,仰视读数,配得溶液的溶质质量分数偏大
A.①③ B.②③⑤
C.③⑤ D.②④⑤
10、下列叙述正确的是( )
A 均一、稳定、无色透明的液体一定是溶液
B 泥水中,泥是溶质,水是溶剂
C 溶液一定是由溶质和溶剂组成的
D 冰和水混合在一起,冰是溶质,水是溶剂
11、20℃时,四个实验小组分别取不同质量的NaCl,逐渐加人到各盛有50g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表:
实验小组 第一组 第二组 第三组 第四组
水的质量/g 50 50 50 50
所取NaCl的质量/g 15 20 25 30
剩余NaCl的质量/g 0 2 7 12
下列说法错误的是( )
A.20℃时,50gNaCl饱和溶液中含有18gNaCl
B.用蒸发的方法可以使不饱和溶液变成饱和溶液
C.第二组所得溶液的溶质与溶剂的质量比为9:25
D.相同温度下,NaCl在水里的溶解度与水的质量无关
12、如图是a,b,c三种物质的溶解度曲线,下列分析不正确的是( )
A. t2℃时,a,b,c三种物质的溶解度由大到小的顺序是a>b>c
B. t2℃时,将50g a物质放入100g水中充分溶解得到a的饱和溶液
C. t1℃时 a,b,c三种物质的溶液中溶质质量分数关系是b>a=c
D. 除去a中少量的c,可采用降温结晶的方法
13、实验室用氯化钠固体配制质量分数为6%的氯化钠溶液,不需要用到的仪器是( )
A.烧杯 B.量筒 C.集气瓶 D.托盘天平
二、填空题。
14、写出下列溶液中溶质的化学式.
①锌与稀硫酸恰好完全反应后的溶液 .②铁粉与硫酸铜恰好完全反应后的溶液 .
③碳酸钙与稀盐酸恰好完全反应后的溶液 .
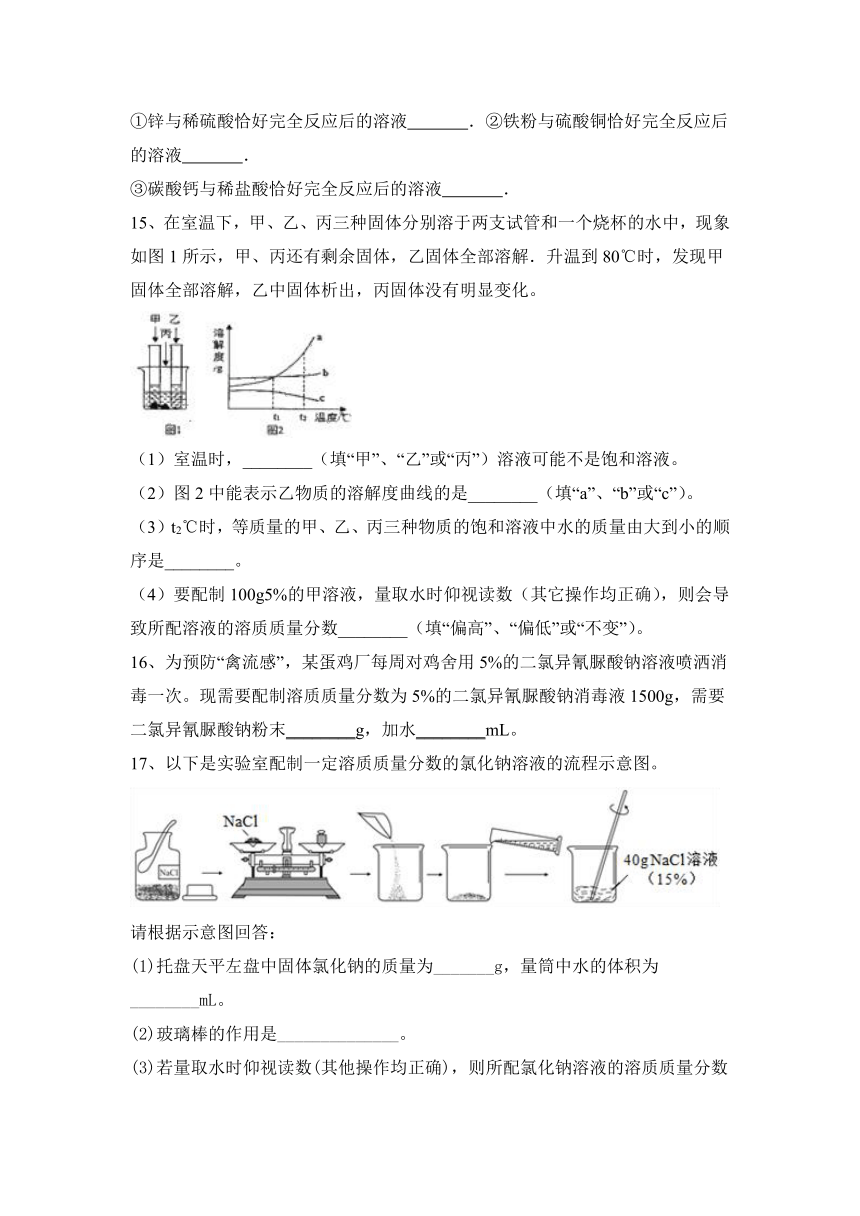
15、在室温下,甲、乙、丙三种固体分别溶于两支试管和一个烧杯的水中,现象如图1所示,甲、丙还有剩余固体,乙固体全部溶解.升温到80℃时,发现甲固体全部溶解,乙中固体析出,丙固体没有明显变化。
(1)室温时,________(填“甲”、“乙”或“丙”)溶液可能不是饱和溶液。
(2)图2中能表示乙物质的溶解度曲线的是________(填“a”、“b”或“c”)。
(3)t2℃时,等质量的甲、乙、丙三种物质的饱和溶液中水的质量由大到小的顺序是________。
(4)要配制100g5%的甲溶液,量取水时仰视读数(其它操作均正确),则会导致所配溶液的溶质质量分数________(填“偏高”、“偏低”或“不变”)。
16、为预防“禽流感”,某蛋鸡厂每周对鸡舍用5%的二氯异氰脲酸钠溶液喷洒消毒一次。现需要配制溶质质量分数为5%的二氯异氰脲酸钠消毒液1500g,需要二氯异氰脲酸钠粉末________g,加水________mL。
17、以下是实验室配制一定溶质质量分数的氯化钠溶液的流程示意图。
请根据示意图回答:
(1)托盘天平左盘中固体氯化钠的质量为_______g,量筒中水的体积为________mL。
(2)玻璃棒的作用是______________。
(3)若量取水时仰视读数(其他操作均正确),则所配氯化钠溶液的溶质质量分数_____15%(填“大于”、“等于”或“小于”)。
18、写出下列溶液中溶质或溶剂的化学式:
(1)澄清石灰水的溶质 ;(2)碘酒中的溶剂 ;
(3)稀盐酸中的溶质 ;(4)铁与稀硫酸恰好反应后所得溶液的溶质 .
19、A、B两种物质的溶解度曲线如图所示,据图回答:
(1)当温度为20℃时,A、B两种物质溶解度大小关系为________。
(2)当温度为30℃时,B的溶解度等于________克。
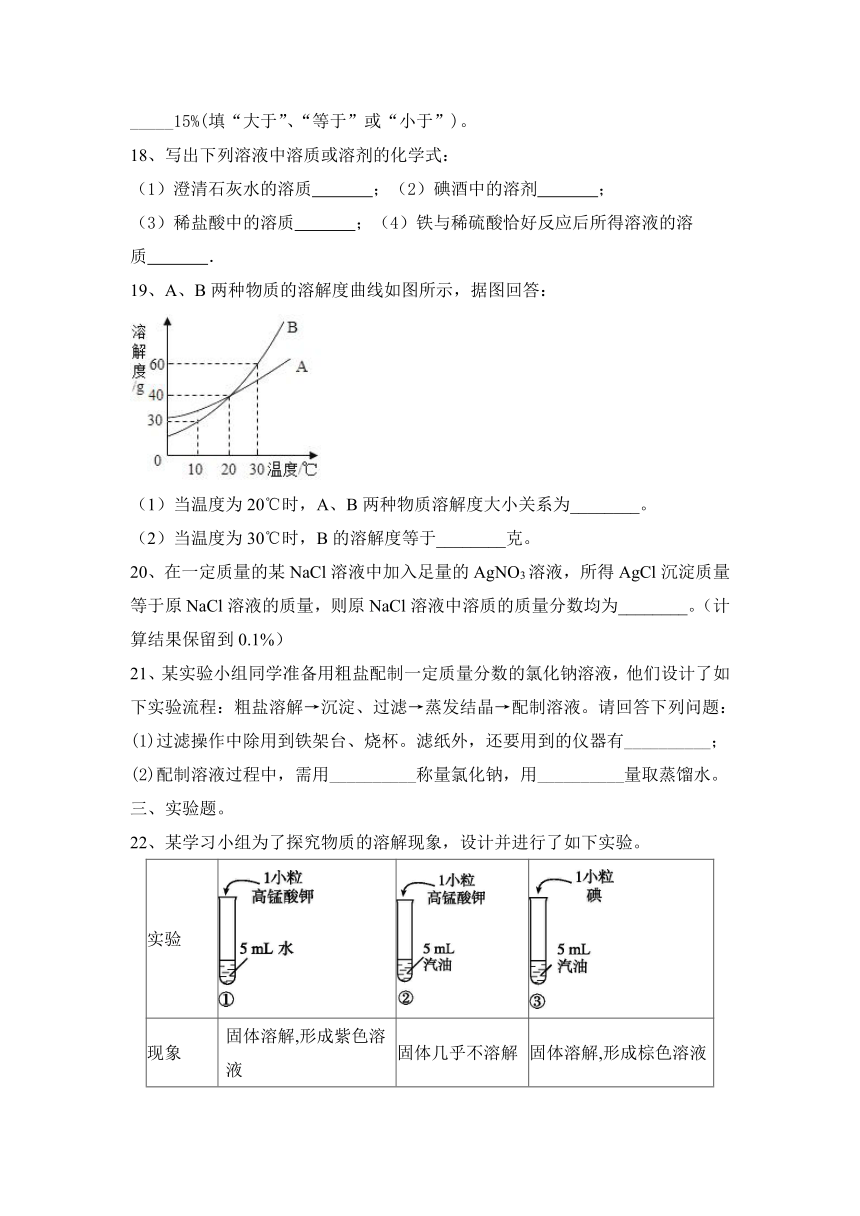
20、在一定质量的某NaCl溶液中加入足量的AgNO3溶液,所得AgCl沉淀质量等于原NaCl溶液的质量,则原NaCl溶液中溶质的质量分数均为________。(计算结果保留到0.1%)
21、某实验小组同学准备用粗盐配制一定质量分数的氯化钠溶液,他们设计了如下实验流程:粗盐溶解→沉淀、过滤→蒸发结晶→配制溶液。请回答下列问题:
(1)过滤操作中除用到铁架台、烧杯。滤纸外,还要用到的仪器有__________;
(2)配制溶液过程中,需用__________称量氯化钠,用__________量取蒸馏水。
三、实验题。
22、某学习小组为了探究物质的溶解现象,设计并进行了如下实验。
实验
现象 固体溶解,形成紫色溶液 固体几乎不溶解 固体溶解,形成棕色溶液
(1)对比实验①②的现象,可得出的结论是 。
(2)设计实验②③的目的是 。
五、计算题。
23、课外活动小组的同学为确定某硫酸钠和氢氧化钠固体混合物中硫酸钠的含量,他们取10g该固体混合物与98g质量分数为10%的稀硫酸恰好完全反应。求:
(1)原混合物中硫酸钠的质量分数;
(2)反应后所得溶液中溶质的质量分数。
2022春人教九下化学第九单元 溶液含答案
一、选择题。
1、下列厨房用品中,易溶于水形成溶液的是( )
A 花生油 B 面粉 C 白糖 D 辣椒粉
【答案】A
2、下列关于溶液的说法正确的是( )
A.溶液具有均一性、稳定性
B.长期放置后不会分层的液体一定是溶液
C.溶质都是固体
D.医用酒精是乙醇溶液,乙醇作溶剂
【答案】A
3、如图所示分液漏斗中盛有液体甲,锥形瓶内盛有固体乙。打开分液漏斗,气球会逐渐鼓起的组合是( )
选项 A B C D
甲 水 稀盐酸 水 稀盐酸
乙 氢氧化钠固体 锌粒 硝酸铵固体 大理石
【答案】C
4、配制溶液时,下列溶剂中最常用的是( )
A.酒精 B.植物油 C.汽油 D.水
【答案】D。
5、0 ℃时,四个实验小组分别取不同质量的NaCl,逐渐加入盛有50 g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表。下列说法错误的是 ( )
实验小组 第一组 第二组 第三组 第四组
水的质量/g 50 50 50 50
所取NaCl的质量/g 15 20 25 30
剩余NaCl的质量/g 0 2 7 12
A.20 ℃时,50 g NaCl饱和溶液中含有18 g NaCl
B.用蒸发的方法可以使不饱和溶液变成饱和溶液
C.第二组所得溶液的溶质与溶剂的质量比为9∶25
D.第一组所得溶液是不饱和溶液
【答案】A
6、室温时,向100 g水中加入硝酸钾至刚好饱和,图所示的四个图像能正确反映对应变化关系的是 ( )
【答案】A
7、下列有关溶液的叙述正确的是 ( )
A.稀溶液一定是不饱和溶液
B.饱和溶液就是不能再溶解如何物质的溶液
C.溶质的溶解度都随温度的升高而增大
D.溶质在溶解的过程中,有的放出热量,有的吸收热量
【答案】D
8、下列关于溶液的说法中错误的是( )
A. 饱和溶液析出晶体后,其溶质的质量分数可能不变
B. 在溶液里进行的化学反应,通常比较快
C. 同种溶质的饱和溶液,一定比它的不饱和溶液的溶质质量分数大
D. 不饱和溶液转化为饱和溶液,溶质质量分数可能不变
【答案】C
9、小朋要配制50 g质量分数为14%的氢氧化钠溶液来制作“叶脉书签”。下列关于配制该溶液的说法不正确的是( )
①若用氢氧化钠固体配制,需称取氢氧化钠固体7.0 g
②用托盘天平称氢氧化钠固体时,在两盘各放一张质量相等的纸
③选用200 mL量筒量取所需的水
④实验中用到的玻璃仪器有烧杯、量筒、胶头滴管、玻璃棒和试剂瓶
⑤用量筒量取水时,仰视读数,配得溶液的溶质质量分数偏大
A.①③ B.②③⑤
C.③⑤ D.②④⑤
【答案】B
10、下列叙述正确的是( )
A 均一、稳定、无色透明的液体一定是溶液
B 泥水中,泥是溶质,水是溶剂
C 溶液一定是由溶质和溶剂组成的
D 冰和水混合在一起,冰是溶质,水是溶剂
【答案】C
11、20℃时,四个实验小组分别取不同质量的NaCl,逐渐加人到各盛有50g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表:
实验小组 第一组 第二组 第三组 第四组
水的质量/g 50 50 50 50
所取NaCl的质量/g 15 20 25 30
剩余NaCl的质量/g 0 2 7 12
下列说法错误的是( )
A.20℃时,50gNaCl饱和溶液中含有18gNaCl
B.用蒸发的方法可以使不饱和溶液变成饱和溶液
C.第二组所得溶液的溶质与溶剂的质量比为9:25
D.相同温度下,NaCl在水里的溶解度与水的质量无关
【答案】A
12、如图是a,b,c三种物质的溶解度曲线,下列分析不正确的是( )
A. t2℃时,a,b,c三种物质的溶解度由大到小的顺序是a>b>c
B. t2℃时,将50g a物质放入100g水中充分溶解得到a的饱和溶液
C. t1℃时 a,b,c三种物质的溶液中溶质质量分数关系是b>a=c
D. 除去a中少量的c,可采用降温结晶的方法
【答案】C
13、实验室用氯化钠固体配制质量分数为6%的氯化钠溶液,不需要用到的仪器是( )
A.烧杯 B.量筒 C.集气瓶 D.托盘天平
【答案】C
二、填空题。
14、写出下列溶液中溶质的化学式.
①锌与稀硫酸恰好完全反应后的溶液 .②铁粉与硫酸铜恰好完全反应后的溶液 .
③碳酸钙与稀盐酸恰好完全反应后的溶液 .
【答案】①ZnSO4;②FeSO4;③CaCl2.
15、在室温下,甲、乙、丙三种固体分别溶于两支试管和一个烧杯的水中,现象如图1所示,甲、丙还有剩余固体,乙固体全部溶解.升温到80℃时,发现甲固体全部溶解,乙中固体析出,丙固体没有明显变化。
(1)室温时,________(填“甲”、“乙”或“丙”)溶液可能不是饱和溶液。
(2)图2中能表示乙物质的溶解度曲线的是________(填“a”、“b”或“c”)。
(3)t2℃时,等质量的甲、乙、丙三种物质的饱和溶液中水的质量由大到小的顺序是________。
(4)要配制100g5%的甲溶液,量取水时仰视读数(其它操作均正确),则会导致所配溶液的溶质质量分数________(填“偏高”、“偏低”或“不变”)。
【答案】(1)乙 (2)c (3)乙>丙>甲 (4)偏低
16、为预防“禽流感”,某蛋鸡厂每周对鸡舍用5%的二氯异氰脲酸钠溶液喷洒消毒一次。现需要配制溶质质量分数为5%的二氯异氰脲酸钠消毒液1500g,需要二氯异氰脲酸钠粉末________g,加水________mL。
【答案】 75;1425
17、以下是实验室配制一定溶质质量分数的氯化钠溶液的流程示意图。
请根据示意图回答:
(1)托盘天平左盘中固体氯化钠的质量为_______g,量筒中水的体积为________mL。
(2)玻璃棒的作用是______________。
(3)若量取水时仰视读数(其他操作均正确),则所配氯化钠溶液的溶质质量分数_____15%(填“大于”、“等于”或“小于”)。
【答案】 6 34 加速氯化钠的溶解 小于
18、写出下列溶液中溶质或溶剂的化学式:
(1)澄清石灰水的溶质 ;(2)碘酒中的溶剂 ;
(3)稀盐酸中的溶质 ;(4)铁与稀硫酸恰好反应后所得溶液的溶质 .
【答案】(1)Ca(OH)2;(2)C2H5OH;(3)HCl;(4)FeSO4.
19、A、B两种物质的溶解度曲线如图所示,据图回答:
(1)当温度为20℃时,A、B两种物质溶解度大小关系为________。
(2)当温度为30℃时,B的溶解度等于________克。
【答案】(1)A=B (2)60
20、在一定质量的某NaCl溶液中加入足量的AgNO3溶液,所得AgCl沉淀质量等于原NaCl溶液的质量,则原NaCl溶液中溶质的质量分数均为________。(计算结果保留到0.1%)
【答案】40.8%
21、某实验小组同学准备用粗盐配制一定质量分数的氯化钠溶液,他们设计了如下实验流程:粗盐溶解→沉淀、过滤→蒸发结晶→配制溶液。请回答下列问题:
(1)过滤操作中除用到铁架台、烧杯。滤纸外,还要用到的仪器有__________;
(2)配制溶液过程中,需用__________称量氯化钠,用__________量取蒸馏水。
【答案】漏斗、玻璃棒 托盘天平 量筒
三、实验题。
22、某学习小组为了探究物质的溶解现象,设计并进行了如下实验。
实验
现象 固体溶解,形成紫色溶液 固体几乎不溶解 固体溶解,形成棕色溶液
(1)对比实验①②的现象,可得出的结论是 。
(2)设计实验②③的目的是 。
【答案】(1)同种溶质在不同溶剂中的溶解性不同
(2)探究不同溶质在同种溶剂中的溶解性情况
【解析】(1)实验①②是将高锰酸钾分别放入等体积的水、汽油中,在水中的现象是固体溶解,形成紫色溶液,在汽油中的现象是固体几乎不溶解,说明同种溶质在不同溶剂中的溶解性不同。(2)实验②③是分别将高锰酸钾、碘放入等体积的汽油中,高锰酸钾在汽油中几乎不溶解,碘在汽油中溶解,形成棕色溶液,说明不同溶质在同种溶剂中的溶解性不同。
五、计算题。
23、课外活动小组的同学为确定某硫酸钠和氢氧化钠固体混合物中硫酸钠的含量,他们取10g该固体混合物与98g质量分数为10%的稀硫酸恰好完全反应。求:
(1)原混合物中硫酸钠的质量分数;
(2)反应后所得溶液中溶质的质量分数。
【答案】(1)原混合物中硫酸钠的质量分数为20%
(2)反应后所得溶液中溶质的质量分数为15%
【解析】(1)设参加反应氢氧化钠质量为x,反应生成硫酸钠的质量为y
2NaOH+ H2SO4═ Na2SO4+2H2O
80 98 142
x 98g×10% y
x=8g y=14.2g
原混合物中硫酸钠的质量分数= ×100%=20%
答:原混合物中硫酸钠的质量分数为20%
(2)反应后所得溶液中溶质的质量=10g﹣8g+14.2g=16.2g,故反应后溶液的质量分数= ×100%=15%
答:反应后所得溶液中溶质的质量分数为15%
一、选择题。
1、下列厨房用品中,易溶于水形成溶液的是( )
A 花生油 B 面粉 C 白糖 D 辣椒粉
2、下列关于溶液的说法正确的是( )
A.溶液具有均一性、稳定性
B.长期放置后不会分层的液体一定是溶液
C.溶质都是固体
D.医用酒精是乙醇溶液,乙醇作溶剂
3、如图所示分液漏斗中盛有液体甲,锥形瓶内盛有固体乙。打开分液漏斗,气球会逐渐鼓起的组合是( )
选项 A B C D
甲 水 稀盐酸 水 稀盐酸
乙 氢氧化钠固体 锌粒 硝酸铵固体 大理石
4、配制溶液时,下列溶剂中最常用的是( )
A.酒精 B.植物油 C.汽油 D.水
5、0 ℃时,四个实验小组分别取不同质量的NaCl,逐渐加入盛有50 g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表。下列说法错误的是 ( )
实验小组 第一组 第二组 第三组 第四组
水的质量/g 50 50 50 50
所取NaCl的质量/g 15 20 25 30
剩余NaCl的质量/g 0 2 7 12
A.20 ℃时,50 g NaCl饱和溶液中含有18 g NaCl
B.用蒸发的方法可以使不饱和溶液变成饱和溶液
C.第二组所得溶液的溶质与溶剂的质量比为9∶25
D.第一组所得溶液是不饱和溶液
6、室温时,向100 g水中加入硝酸钾至刚好饱和,图所示的四个图像能正确反映对应变化关系的是 ( )
7、下列有关溶液的叙述正确的是 ( )
A.稀溶液一定是不饱和溶液
B.饱和溶液就是不能再溶解如何物质的溶液
C.溶质的溶解度都随温度的升高而增大
D.溶质在溶解的过程中,有的放出热量,有的吸收热量
8、下列关于溶液的说法中错误的是( )
A. 饱和溶液析出晶体后,其溶质的质量分数可能不变
B. 在溶液里进行的化学反应,通常比较快
C. 同种溶质的饱和溶液,一定比它的不饱和溶液的溶质质量分数大
D. 不饱和溶液转化为饱和溶液,溶质质量分数可能不变
9、小朋要配制50 g质量分数为14%的氢氧化钠溶液来制作“叶脉书签”。下列关于配制该溶液的说法不正确的是( )
①若用氢氧化钠固体配制,需称取氢氧化钠固体7.0 g
②用托盘天平称氢氧化钠固体时,在两盘各放一张质量相等的纸
③选用200 mL量筒量取所需的水
④实验中用到的玻璃仪器有烧杯、量筒、胶头滴管、玻璃棒和试剂瓶
⑤用量筒量取水时,仰视读数,配得溶液的溶质质量分数偏大
A.①③ B.②③⑤
C.③⑤ D.②④⑤
10、下列叙述正确的是( )
A 均一、稳定、无色透明的液体一定是溶液
B 泥水中,泥是溶质,水是溶剂
C 溶液一定是由溶质和溶剂组成的
D 冰和水混合在一起,冰是溶质,水是溶剂
11、20℃时,四个实验小组分别取不同质量的NaCl,逐渐加人到各盛有50g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表:
实验小组 第一组 第二组 第三组 第四组
水的质量/g 50 50 50 50
所取NaCl的质量/g 15 20 25 30
剩余NaCl的质量/g 0 2 7 12
下列说法错误的是( )
A.20℃时,50gNaCl饱和溶液中含有18gNaCl
B.用蒸发的方法可以使不饱和溶液变成饱和溶液
C.第二组所得溶液的溶质与溶剂的质量比为9:25
D.相同温度下,NaCl在水里的溶解度与水的质量无关
12、如图是a,b,c三种物质的溶解度曲线,下列分析不正确的是( )
A. t2℃时,a,b,c三种物质的溶解度由大到小的顺序是a>b>c
B. t2℃时,将50g a物质放入100g水中充分溶解得到a的饱和溶液
C. t1℃时 a,b,c三种物质的溶液中溶质质量分数关系是b>a=c
D. 除去a中少量的c,可采用降温结晶的方法
13、实验室用氯化钠固体配制质量分数为6%的氯化钠溶液,不需要用到的仪器是( )
A.烧杯 B.量筒 C.集气瓶 D.托盘天平
二、填空题。
14、写出下列溶液中溶质的化学式.
①锌与稀硫酸恰好完全反应后的溶液 .②铁粉与硫酸铜恰好完全反应后的溶液 .
③碳酸钙与稀盐酸恰好完全反应后的溶液 .
15、在室温下,甲、乙、丙三种固体分别溶于两支试管和一个烧杯的水中,现象如图1所示,甲、丙还有剩余固体,乙固体全部溶解.升温到80℃时,发现甲固体全部溶解,乙中固体析出,丙固体没有明显变化。
(1)室温时,________(填“甲”、“乙”或“丙”)溶液可能不是饱和溶液。
(2)图2中能表示乙物质的溶解度曲线的是________(填“a”、“b”或“c”)。
(3)t2℃时,等质量的甲、乙、丙三种物质的饱和溶液中水的质量由大到小的顺序是________。
(4)要配制100g5%的甲溶液,量取水时仰视读数(其它操作均正确),则会导致所配溶液的溶质质量分数________(填“偏高”、“偏低”或“不变”)。
16、为预防“禽流感”,某蛋鸡厂每周对鸡舍用5%的二氯异氰脲酸钠溶液喷洒消毒一次。现需要配制溶质质量分数为5%的二氯异氰脲酸钠消毒液1500g,需要二氯异氰脲酸钠粉末________g,加水________mL。
17、以下是实验室配制一定溶质质量分数的氯化钠溶液的流程示意图。
请根据示意图回答:
(1)托盘天平左盘中固体氯化钠的质量为_______g,量筒中水的体积为________mL。
(2)玻璃棒的作用是______________。
(3)若量取水时仰视读数(其他操作均正确),则所配氯化钠溶液的溶质质量分数_____15%(填“大于”、“等于”或“小于”)。
18、写出下列溶液中溶质或溶剂的化学式:
(1)澄清石灰水的溶质 ;(2)碘酒中的溶剂 ;
(3)稀盐酸中的溶质 ;(4)铁与稀硫酸恰好反应后所得溶液的溶质 .
19、A、B两种物质的溶解度曲线如图所示,据图回答:
(1)当温度为20℃时,A、B两种物质溶解度大小关系为________。
(2)当温度为30℃时,B的溶解度等于________克。
20、在一定质量的某NaCl溶液中加入足量的AgNO3溶液,所得AgCl沉淀质量等于原NaCl溶液的质量,则原NaCl溶液中溶质的质量分数均为________。(计算结果保留到0.1%)
21、某实验小组同学准备用粗盐配制一定质量分数的氯化钠溶液,他们设计了如下实验流程:粗盐溶解→沉淀、过滤→蒸发结晶→配制溶液。请回答下列问题:
(1)过滤操作中除用到铁架台、烧杯。滤纸外,还要用到的仪器有__________;
(2)配制溶液过程中,需用__________称量氯化钠,用__________量取蒸馏水。
三、实验题。
22、某学习小组为了探究物质的溶解现象,设计并进行了如下实验。
实验
现象 固体溶解,形成紫色溶液 固体几乎不溶解 固体溶解,形成棕色溶液
(1)对比实验①②的现象,可得出的结论是 。
(2)设计实验②③的目的是 。
五、计算题。
23、课外活动小组的同学为确定某硫酸钠和氢氧化钠固体混合物中硫酸钠的含量,他们取10g该固体混合物与98g质量分数为10%的稀硫酸恰好完全反应。求:
(1)原混合物中硫酸钠的质量分数;
(2)反应后所得溶液中溶质的质量分数。
2022春人教九下化学第九单元 溶液含答案
一、选择题。
1、下列厨房用品中,易溶于水形成溶液的是( )
A 花生油 B 面粉 C 白糖 D 辣椒粉
【答案】A
2、下列关于溶液的说法正确的是( )
A.溶液具有均一性、稳定性
B.长期放置后不会分层的液体一定是溶液
C.溶质都是固体
D.医用酒精是乙醇溶液,乙醇作溶剂
【答案】A
3、如图所示分液漏斗中盛有液体甲,锥形瓶内盛有固体乙。打开分液漏斗,气球会逐渐鼓起的组合是( )
选项 A B C D
甲 水 稀盐酸 水 稀盐酸
乙 氢氧化钠固体 锌粒 硝酸铵固体 大理石
【答案】C
4、配制溶液时,下列溶剂中最常用的是( )
A.酒精 B.植物油 C.汽油 D.水
【答案】D。
5、0 ℃时,四个实验小组分别取不同质量的NaCl,逐渐加入盛有50 g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表。下列说法错误的是 ( )
实验小组 第一组 第二组 第三组 第四组
水的质量/g 50 50 50 50
所取NaCl的质量/g 15 20 25 30
剩余NaCl的质量/g 0 2 7 12
A.20 ℃时,50 g NaCl饱和溶液中含有18 g NaCl
B.用蒸发的方法可以使不饱和溶液变成饱和溶液
C.第二组所得溶液的溶质与溶剂的质量比为9∶25
D.第一组所得溶液是不饱和溶液
【答案】A
6、室温时,向100 g水中加入硝酸钾至刚好饱和,图所示的四个图像能正确反映对应变化关系的是 ( )
【答案】A
7、下列有关溶液的叙述正确的是 ( )
A.稀溶液一定是不饱和溶液
B.饱和溶液就是不能再溶解如何物质的溶液
C.溶质的溶解度都随温度的升高而增大
D.溶质在溶解的过程中,有的放出热量,有的吸收热量
【答案】D
8、下列关于溶液的说法中错误的是( )
A. 饱和溶液析出晶体后,其溶质的质量分数可能不变
B. 在溶液里进行的化学反应,通常比较快
C. 同种溶质的饱和溶液,一定比它的不饱和溶液的溶质质量分数大
D. 不饱和溶液转化为饱和溶液,溶质质量分数可能不变
【答案】C
9、小朋要配制50 g质量分数为14%的氢氧化钠溶液来制作“叶脉书签”。下列关于配制该溶液的说法不正确的是( )
①若用氢氧化钠固体配制,需称取氢氧化钠固体7.0 g
②用托盘天平称氢氧化钠固体时,在两盘各放一张质量相等的纸
③选用200 mL量筒量取所需的水
④实验中用到的玻璃仪器有烧杯、量筒、胶头滴管、玻璃棒和试剂瓶
⑤用量筒量取水时,仰视读数,配得溶液的溶质质量分数偏大
A.①③ B.②③⑤
C.③⑤ D.②④⑤
【答案】B
10、下列叙述正确的是( )
A 均一、稳定、无色透明的液体一定是溶液
B 泥水中,泥是溶质,水是溶剂
C 溶液一定是由溶质和溶剂组成的
D 冰和水混合在一起,冰是溶质,水是溶剂
【答案】C
11、20℃时,四个实验小组分别取不同质量的NaCl,逐渐加人到各盛有50g水的烧杯中,不断搅拌直到不再溶解为止,然后分别称量剩余NaCl的质量。记录数据如下表:
实验小组 第一组 第二组 第三组 第四组
水的质量/g 50 50 50 50
所取NaCl的质量/g 15 20 25 30
剩余NaCl的质量/g 0 2 7 12
下列说法错误的是( )
A.20℃时,50gNaCl饱和溶液中含有18gNaCl
B.用蒸发的方法可以使不饱和溶液变成饱和溶液
C.第二组所得溶液的溶质与溶剂的质量比为9:25
D.相同温度下,NaCl在水里的溶解度与水的质量无关
【答案】A
12、如图是a,b,c三种物质的溶解度曲线,下列分析不正确的是( )
A. t2℃时,a,b,c三种物质的溶解度由大到小的顺序是a>b>c
B. t2℃时,将50g a物质放入100g水中充分溶解得到a的饱和溶液
C. t1℃时 a,b,c三种物质的溶液中溶质质量分数关系是b>a=c
D. 除去a中少量的c,可采用降温结晶的方法
【答案】C
13、实验室用氯化钠固体配制质量分数为6%的氯化钠溶液,不需要用到的仪器是( )
A.烧杯 B.量筒 C.集气瓶 D.托盘天平
【答案】C
二、填空题。
14、写出下列溶液中溶质的化学式.
①锌与稀硫酸恰好完全反应后的溶液 .②铁粉与硫酸铜恰好完全反应后的溶液 .
③碳酸钙与稀盐酸恰好完全反应后的溶液 .
【答案】①ZnSO4;②FeSO4;③CaCl2.
15、在室温下,甲、乙、丙三种固体分别溶于两支试管和一个烧杯的水中,现象如图1所示,甲、丙还有剩余固体,乙固体全部溶解.升温到80℃时,发现甲固体全部溶解,乙中固体析出,丙固体没有明显变化。
(1)室温时,________(填“甲”、“乙”或“丙”)溶液可能不是饱和溶液。
(2)图2中能表示乙物质的溶解度曲线的是________(填“a”、“b”或“c”)。
(3)t2℃时,等质量的甲、乙、丙三种物质的饱和溶液中水的质量由大到小的顺序是________。
(4)要配制100g5%的甲溶液,量取水时仰视读数(其它操作均正确),则会导致所配溶液的溶质质量分数________(填“偏高”、“偏低”或“不变”)。
【答案】(1)乙 (2)c (3)乙>丙>甲 (4)偏低
16、为预防“禽流感”,某蛋鸡厂每周对鸡舍用5%的二氯异氰脲酸钠溶液喷洒消毒一次。现需要配制溶质质量分数为5%的二氯异氰脲酸钠消毒液1500g,需要二氯异氰脲酸钠粉末________g,加水________mL。
【答案】 75;1425
17、以下是实验室配制一定溶质质量分数的氯化钠溶液的流程示意图。
请根据示意图回答:
(1)托盘天平左盘中固体氯化钠的质量为_______g,量筒中水的体积为________mL。
(2)玻璃棒的作用是______________。
(3)若量取水时仰视读数(其他操作均正确),则所配氯化钠溶液的溶质质量分数_____15%(填“大于”、“等于”或“小于”)。
【答案】 6 34 加速氯化钠的溶解 小于
18、写出下列溶液中溶质或溶剂的化学式:
(1)澄清石灰水的溶质 ;(2)碘酒中的溶剂 ;
(3)稀盐酸中的溶质 ;(4)铁与稀硫酸恰好反应后所得溶液的溶质 .
【答案】(1)Ca(OH)2;(2)C2H5OH;(3)HCl;(4)FeSO4.
19、A、B两种物质的溶解度曲线如图所示,据图回答:
(1)当温度为20℃时,A、B两种物质溶解度大小关系为________。
(2)当温度为30℃时,B的溶解度等于________克。
【答案】(1)A=B (2)60
20、在一定质量的某NaCl溶液中加入足量的AgNO3溶液,所得AgCl沉淀质量等于原NaCl溶液的质量,则原NaCl溶液中溶质的质量分数均为________。(计算结果保留到0.1%)
【答案】40.8%
21、某实验小组同学准备用粗盐配制一定质量分数的氯化钠溶液,他们设计了如下实验流程:粗盐溶解→沉淀、过滤→蒸发结晶→配制溶液。请回答下列问题:
(1)过滤操作中除用到铁架台、烧杯。滤纸外,还要用到的仪器有__________;
(2)配制溶液过程中,需用__________称量氯化钠,用__________量取蒸馏水。
【答案】漏斗、玻璃棒 托盘天平 量筒
三、实验题。
22、某学习小组为了探究物质的溶解现象,设计并进行了如下实验。
实验
现象 固体溶解,形成紫色溶液 固体几乎不溶解 固体溶解,形成棕色溶液
(1)对比实验①②的现象,可得出的结论是 。
(2)设计实验②③的目的是 。
【答案】(1)同种溶质在不同溶剂中的溶解性不同
(2)探究不同溶质在同种溶剂中的溶解性情况
【解析】(1)实验①②是将高锰酸钾分别放入等体积的水、汽油中,在水中的现象是固体溶解,形成紫色溶液,在汽油中的现象是固体几乎不溶解,说明同种溶质在不同溶剂中的溶解性不同。(2)实验②③是分别将高锰酸钾、碘放入等体积的汽油中,高锰酸钾在汽油中几乎不溶解,碘在汽油中溶解,形成棕色溶液,说明不同溶质在同种溶剂中的溶解性不同。
五、计算题。
23、课外活动小组的同学为确定某硫酸钠和氢氧化钠固体混合物中硫酸钠的含量,他们取10g该固体混合物与98g质量分数为10%的稀硫酸恰好完全反应。求:
(1)原混合物中硫酸钠的质量分数;
(2)反应后所得溶液中溶质的质量分数。
【答案】(1)原混合物中硫酸钠的质量分数为20%
(2)反应后所得溶液中溶质的质量分数为15%
【解析】(1)设参加反应氢氧化钠质量为x,反应生成硫酸钠的质量为y
2NaOH+ H2SO4═ Na2SO4+2H2O
80 98 142
x 98g×10% y
x=8g y=14.2g
原混合物中硫酸钠的质量分数= ×100%=20%
答:原混合物中硫酸钠的质量分数为20%
(2)反应后所得溶液中溶质的质量=10g﹣8g+14.2g=16.2g,故反应后溶液的质量分数= ×100%=15%
答:反应后所得溶液中溶质的质量分数为15%
同课章节目录
