第三章第二节第1课时分子晶体课件2021-2022学年高二化学人教版(2019)选择性必修2pptx
文档属性
| 名称 | 第三章第二节第1课时分子晶体课件2021-2022学年高二化学人教版(2019)选择性必修2pptx |  | |
| 格式 | zip | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-01 14:52:14 | ||
图片预览





文档简介
(共21张PPT)
第三章 晶体结构与性质
第二节 分子晶体与共价晶体
第1课时 分子晶体
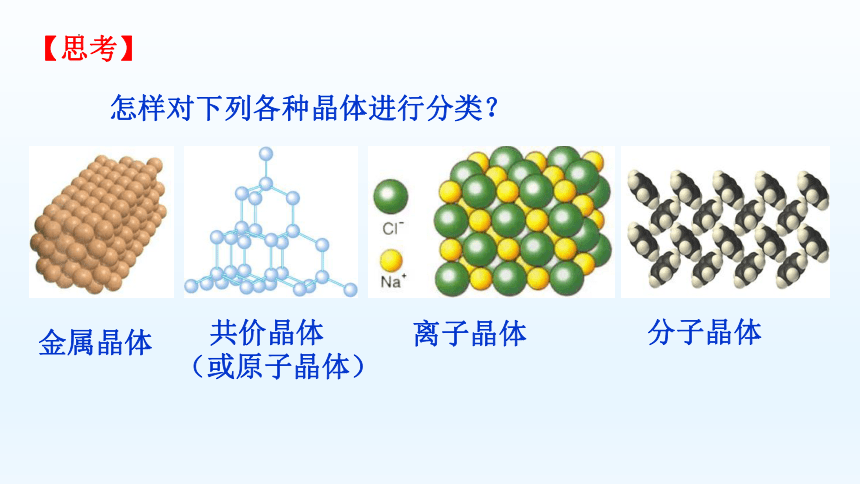
【思考】
怎样对下列各种晶体进行分类?
金属晶体
共价晶体
(或原子晶体)
离子晶体
分子晶体
晶体的类型:
根据组成晶体的粒子种类和粒子之间作用力的不同,可以将晶体分成四种基本类型。
金属晶体
共价晶体
离子晶体
分子晶体
金属原子或离子以金属键结合而成的晶体
原子之间以共价键结合而成的晶体
阴、阳离子之间以离子键结合而成的晶体
分子之间通过分子间作用力凝聚在一起形成的晶体
一、分子晶体
1.概念:分子之间通过分子间作用力凝聚在一起形成的晶体
2.属于分子晶体的物质类别:
⑵非金属单质分子:
卤素单质,O2,N2,C60,P4,S8,稀有气体
⑴所有非金属氢化物:
H2O、H2S、NH3、CH4、HX
(3)非金属氧化物分子:
CO2,P4O10,SO2
(4)几乎所有的酸:
(5)绝大多数有机物
烃、卤代烃、醇、酚、醛、酮、羧酸、酯
3、分子晶体的物理性质
①分子晶体熔、沸点低;
硬度小;
分子晶体中,分子之间是以很弱的分子间作用力(范德华力或氢键)相结合。
②易升华(干冰、碘、红磷、萘)
③固态和熔融状态时都不导电,酸在水溶液中能导电。
④溶解性遵循相似相溶原理
⑤分子晶体熔沸点的比较:
分子间作用力越强,熔沸点越高
⑴若分子间存在氢键,则分子间作用力较大,熔沸点较高。
如H2O>H2Te>H2Se>H2S,HF>HCl,NH3>PH3
⑵组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,熔沸点越高。
I2 > Br2 > Cl2>F2
⑶相对分子质量相近时,分子极性越大,熔沸点越高 CO>N2
⑷有机物的同分异构体中,支链数越多,熔沸点越低。
如沸点:正戊烷>异戊烷>新戊烷;
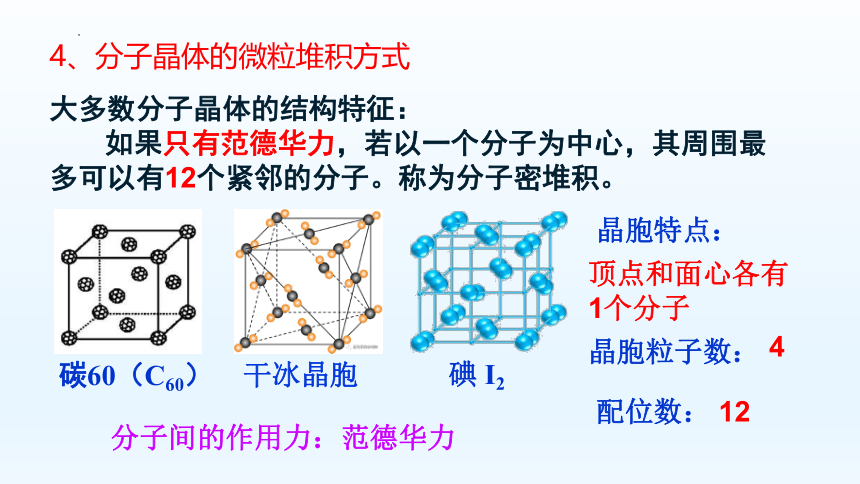
4、分子晶体的微粒堆积方式
大多数分子晶体的结构特征:
如果只有范德华力,若以一个分子为中心,其周围最多可以有12个紧邻的分子。称为分子密堆积。
碳60(C60)
干冰晶胞
碘 I2
顶点和面心各有1个分子
4
晶胞特点:
晶胞粒子数:
配位数:
12
分子间的作用力:范德华力
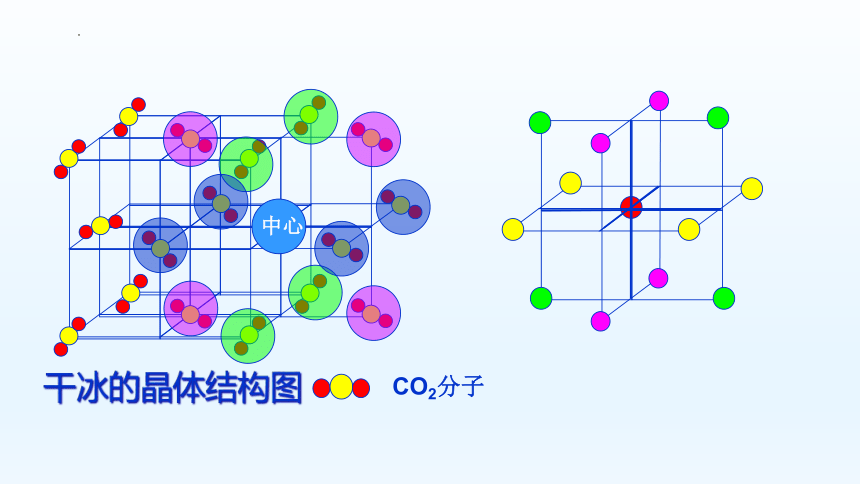
干冰的晶体结构图
中心
CO2分子
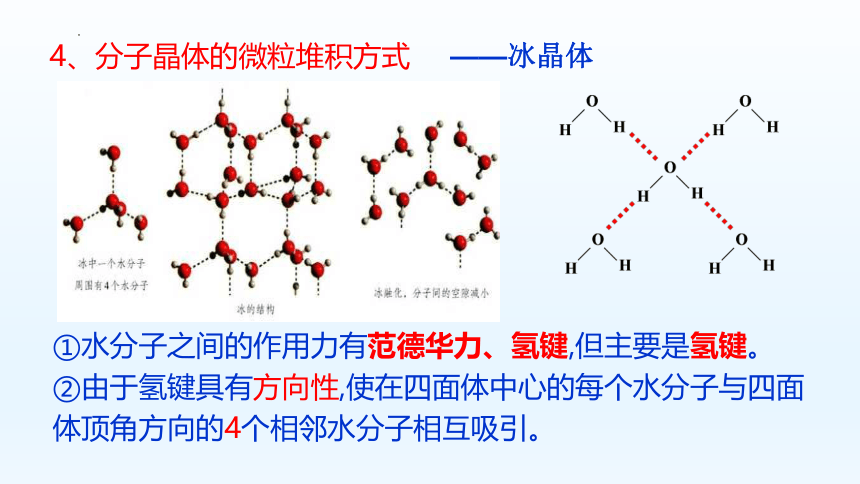
——冰晶体
4、分子晶体的微粒堆积方式
①水分子之间的作用力有范德华力、氢键,但主要是氢键。
②由于氢键具有方向性,使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引。
氢键有方向性
冰的结构
冰晶体中,水分子间的主要作用力是氢键,由于氢键具有方向性,使得晶体中分子的空间利用率降低,留有相当大的空隙,造成冰的密度比水小。这种晶体不具有分子密堆积特征。如HF、NH3
总结:分子晶体的结构特征
堆积方式
微粒间作用力
空间特点
举例
分子密堆积
范德华力
通常每个分子周围有12个紧邻的分子
C60、干冰、I2、O2
分子非密堆积
范德华力和氢键
每个分子周围紧邻的分子小于12个
HF、NH3、冰
【思考】
1.为什么冰的密度比水小呢?
冰晶体中的主要作用力是氢键,由于氢键具有方向性,使冰晶体中每个水分子与四面体顶角的4个水分子相互吸引,使得晶体中的空隙较大,空间利用率不高,造成冰的密度比水小。
2.水的密度随温度变化的曲线如下图所示。0-4℃,水的密度随温度的升高而增大。超过4℃,水的密度随温度的升高而减小。为什么会这样呢
【思考】
0-4℃时,温度升高,冰开始熔化,部分氢键被破坏,水分子间距离减小,密度增大;
超过4℃时,温度升高,水分子热运动速度加快,使得分子的平均距离加大,密度减小。
【思考】
3.为什么干冰的密度比冰大?
干冰中的CO2之间只存在范德华力,一个分子周围有12个紧邻分子,具有分子密堆积特征;
冰中水分子之间的氢键具有方向性,导致冰晶体不具有分子密堆积特征,晶体中有较大空隙;
另外,CO2的摩尔质量比水的大,所以干冰的密度比冰大。
课堂练习
1.比较下列化合物熔、沸点的高低(填“>”或“<”)。
①CO2_______SO2 ②NH3________PH3 ③O3_______O2 ④Ne________Ar ⑤CH3CH2OH________CH3OH ⑥CO________N2
<
<
>
>
>
>
2.AlCl3晶体的类型:
设计实验证明?
3.判断:
①分子晶体中均存在化学键( )
②H2SO4为强电解质,硫酸晶体是能导电的( )
③冰中1个H2O分子可通过氢键与4个水分子相连,所以含
1 mol H2O的冰中,可形成氢键的数目为4NA ( )
④氢键有方向性,所以液态水结成冰时体积会变大 ( )
⑥冰晶体中每个水分子周围只有4个紧邻的水分子( )
⑦SiCl4晶体是分子晶体,熔点高于CCl4( )
√
√
√
×
×
×
4.干冰晶体的晶胞是一种面心立方结构,如图所示,即每8个CO2构成立方体,且在6个面的中心又各占据1个CO2分子,在每个CO2周围距离a(其中a为立方体棱长)的CO2有
A.4个 B.8个
C.12个 D.6个
天然气水合物 — 一种潜在的能源
20世纪末,科学家发现海底存在大量天然气水合物晶体。其主要气体成分是甲烷,称甲烷水合物,外形像冰,在常温常压下会迅速分解释放出甲烷又称“可燃冰”。
不如意的时候不要尽往悲伤里钻,想想有笑声的日子吧!
https://www.21cnjy.com/help/help_extract.php
第三章 晶体结构与性质
第二节 分子晶体与共价晶体
第1课时 分子晶体
【思考】
怎样对下列各种晶体进行分类?
金属晶体
共价晶体
(或原子晶体)
离子晶体
分子晶体
晶体的类型:
根据组成晶体的粒子种类和粒子之间作用力的不同,可以将晶体分成四种基本类型。
金属晶体
共价晶体
离子晶体
分子晶体
金属原子或离子以金属键结合而成的晶体
原子之间以共价键结合而成的晶体
阴、阳离子之间以离子键结合而成的晶体
分子之间通过分子间作用力凝聚在一起形成的晶体
一、分子晶体
1.概念:分子之间通过分子间作用力凝聚在一起形成的晶体
2.属于分子晶体的物质类别:
⑵非金属单质分子:
卤素单质,O2,N2,C60,P4,S8,稀有气体
⑴所有非金属氢化物:
H2O、H2S、NH3、CH4、HX
(3)非金属氧化物分子:
CO2,P4O10,SO2
(4)几乎所有的酸:
(5)绝大多数有机物
烃、卤代烃、醇、酚、醛、酮、羧酸、酯
3、分子晶体的物理性质
①分子晶体熔、沸点低;
硬度小;
分子晶体中,分子之间是以很弱的分子间作用力(范德华力或氢键)相结合。
②易升华(干冰、碘、红磷、萘)
③固态和熔融状态时都不导电,酸在水溶液中能导电。
④溶解性遵循相似相溶原理
⑤分子晶体熔沸点的比较:
分子间作用力越强,熔沸点越高
⑴若分子间存在氢键,则分子间作用力较大,熔沸点较高。
如H2O>H2Te>H2Se>H2S,HF>HCl,NH3>PH3
⑵组成和结构相似的分子晶体,相对分子质量越大,分子间作用力越强,熔沸点越高。
I2 > Br2 > Cl2>F2
⑶相对分子质量相近时,分子极性越大,熔沸点越高 CO>N2
⑷有机物的同分异构体中,支链数越多,熔沸点越低。
如沸点:正戊烷>异戊烷>新戊烷;
4、分子晶体的微粒堆积方式
大多数分子晶体的结构特征:
如果只有范德华力,若以一个分子为中心,其周围最多可以有12个紧邻的分子。称为分子密堆积。
碳60(C60)
干冰晶胞
碘 I2
顶点和面心各有1个分子
4
晶胞特点:
晶胞粒子数:
配位数:
12
分子间的作用力:范德华力
干冰的晶体结构图
中心
CO2分子
——冰晶体
4、分子晶体的微粒堆积方式
①水分子之间的作用力有范德华力、氢键,但主要是氢键。
②由于氢键具有方向性,使在四面体中心的每个水分子与四面体顶角方向的4个相邻水分子相互吸引。
氢键有方向性
冰的结构
冰晶体中,水分子间的主要作用力是氢键,由于氢键具有方向性,使得晶体中分子的空间利用率降低,留有相当大的空隙,造成冰的密度比水小。这种晶体不具有分子密堆积特征。如HF、NH3
总结:分子晶体的结构特征
堆积方式
微粒间作用力
空间特点
举例
分子密堆积
范德华力
通常每个分子周围有12个紧邻的分子
C60、干冰、I2、O2
分子非密堆积
范德华力和氢键
每个分子周围紧邻的分子小于12个
HF、NH3、冰
【思考】
1.为什么冰的密度比水小呢?
冰晶体中的主要作用力是氢键,由于氢键具有方向性,使冰晶体中每个水分子与四面体顶角的4个水分子相互吸引,使得晶体中的空隙较大,空间利用率不高,造成冰的密度比水小。
2.水的密度随温度变化的曲线如下图所示。0-4℃,水的密度随温度的升高而增大。超过4℃,水的密度随温度的升高而减小。为什么会这样呢
【思考】
0-4℃时,温度升高,冰开始熔化,部分氢键被破坏,水分子间距离减小,密度增大;
超过4℃时,温度升高,水分子热运动速度加快,使得分子的平均距离加大,密度减小。
【思考】
3.为什么干冰的密度比冰大?
干冰中的CO2之间只存在范德华力,一个分子周围有12个紧邻分子,具有分子密堆积特征;
冰中水分子之间的氢键具有方向性,导致冰晶体不具有分子密堆积特征,晶体中有较大空隙;
另外,CO2的摩尔质量比水的大,所以干冰的密度比冰大。
课堂练习
1.比较下列化合物熔、沸点的高低(填“>”或“<”)。
①CO2_______SO2 ②NH3________PH3 ③O3_______O2 ④Ne________Ar ⑤CH3CH2OH________CH3OH ⑥CO________N2
<
<
>
>
>
>
2.AlCl3晶体的类型:
设计实验证明?
3.判断:
①分子晶体中均存在化学键( )
②H2SO4为强电解质,硫酸晶体是能导电的( )
③冰中1个H2O分子可通过氢键与4个水分子相连,所以含
1 mol H2O的冰中,可形成氢键的数目为4NA ( )
④氢键有方向性,所以液态水结成冰时体积会变大 ( )
⑥冰晶体中每个水分子周围只有4个紧邻的水分子( )
⑦SiCl4晶体是分子晶体,熔点高于CCl4( )
√
√
√
×
×
×
4.干冰晶体的晶胞是一种面心立方结构,如图所示,即每8个CO2构成立方体,且在6个面的中心又各占据1个CO2分子,在每个CO2周围距离a(其中a为立方体棱长)的CO2有
A.4个 B.8个
C.12个 D.6个
天然气水合物 — 一种潜在的能源
20世纪末,科学家发现海底存在大量天然气水合物晶体。其主要气体成分是甲烷,称甲烷水合物,外形像冰,在常温常压下会迅速分解释放出甲烷又称“可燃冰”。
不如意的时候不要尽往悲伤里钻,想想有笑声的日子吧!
https://www.21cnjy.com/help/help_extract.php
