鲁教版九年级化学下册 第八单元 海水中的化学复习教案(表格式)
文档属性
| 名称 | 鲁教版九年级化学下册 第八单元 海水中的化学复习教案(表格式) |

|
|
| 格式 | doc | ||
| 文件大小 | 457.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-05-31 16:24:31 | ||
图片预览


文档简介
第八单元 海水中的化学
学习目标:
1.运用图示、列表等方式认识海洋中蕴藏着丰富的资源,认识合理开发海洋资源与保护海洋环境的辩证关系。学会蒸馏法分离物质,认识海水淡化的可行性,进一步树立资源意识。
2.进一步了解海水“晒盐”的过程,结晶等概念。认识溶解度的含义,学会绘制溶解度曲线。
3.学会粗盐提纯的实验方法。了解食盐在生产、生活中的重要用途;
4.学习氨碱法制纯碱的简单原理和主要流程,认识纯碱的性质,了解纯碱的主要用途,进一步理解盐的定义及复分解反应的实质。
复习重点、难点
重点:1、结晶等概念,
2、溶解度的含义及应用,盐类的性质
难点:1、溶解度涵义的理解
2、氨碱法制纯碱的反应原理,复分解反应发生的实质
教学过程:
教师活动 学生活动 活动意图
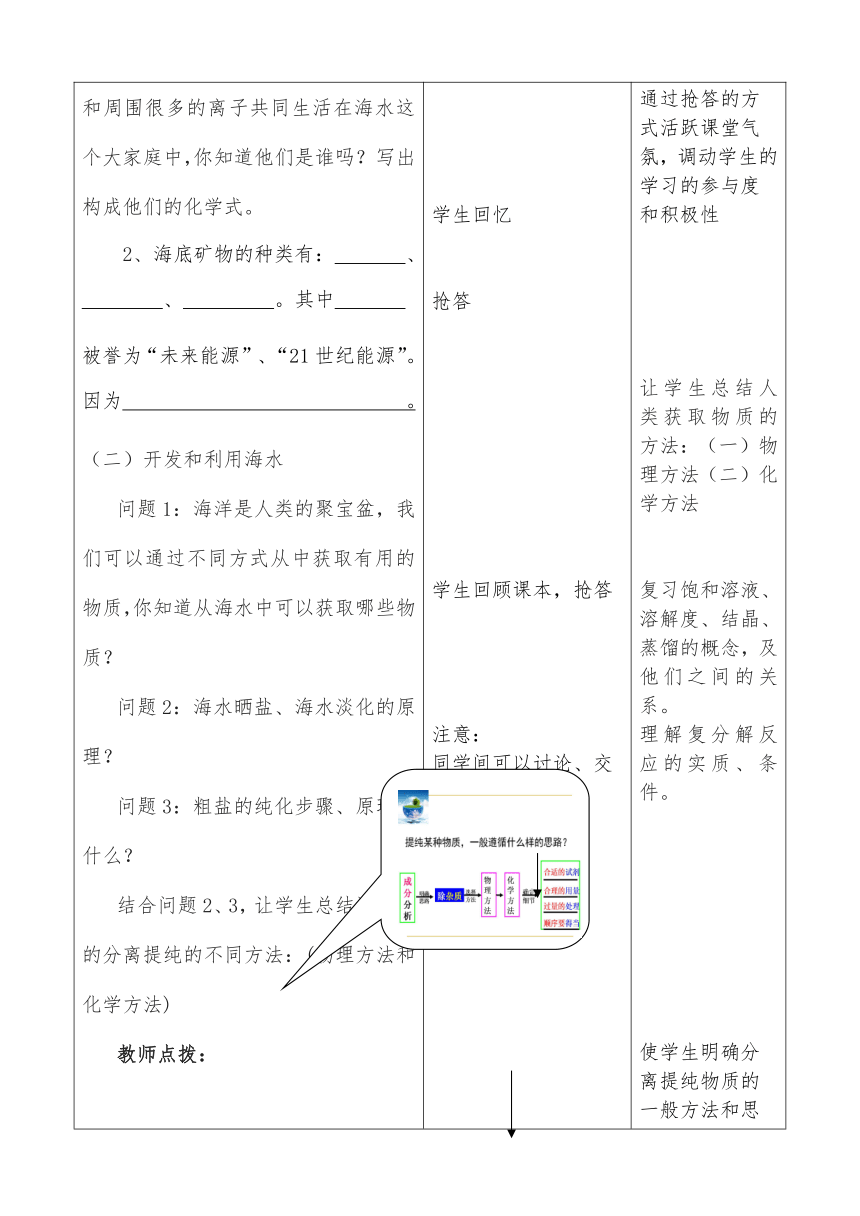
一、单元知识网络化:投影:第九单元知识网络。二、回顾课本,夯实基础(一)认识海水的组成:1、我是海水中的一个水分子,我和周围很多的离子共同生活在海水这个大家庭中,你知道他们是谁吗?写出构成他们的化学式。2、海底矿物的种类有: 、 、 。其中 被誉为“未来能源”、“21世纪能源”。因为 。(二)开发和利用海水问题1:海洋是人类的聚宝盆,我们可以通过不同方式从中获取有用的物质,你知道从海水中可以获取哪些物质?问题2:海水晒盐、海水淡化的原理?问题3:粗盐的纯化步骤、原理是什么?结合问题2、3,让学生总结混合物的分离提纯的不同方法:(物理方法和化学方法) 教师点拨:(三)保护海水从海水中可以获得很多的化学资源,除此以外,“我”这个水分子,还“看到”,1、人类在开发和利用海洋资源是,势必会造成海洋的污染,所以人类现在必须要立即行动起来,保护海洋资源,你能说出哪些海洋保护措施呢?三、走近中考:例1、(12攀枝花)甲、乙两种物质的溶解度曲线如右图。 (1)10℃时,甲物质的溶解度 (选填“大于”、“小于”或“等于”)乙物质的溶解度。 (2) 40℃时,把40g甲物质放入100g水中,所得的是 (选填“饱和”或“不饱和”)溶液。(3) 20℃时,甲物质溶液中溶质的质量分数不可能为 。A.20% B.25% C.26.5% D.30%(4)如右图所示,20℃时,将盛有乙物质饱和溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出。加入的物质可能是________(填字母序号)。A.氢氧化钠 B.氯化钠 C.硝酸铵教师点拨:把握住溶解度的四要素;溶解度曲线的意义;饱和溶液与溶质质量分数关系。例2、(12长春)同学们通过以下在溶液中进行的实验,探究复分解反应发生的条件:①H2SO4 + Ba(NO3)2 ②H2SO4 + NaOH ③H2SO4 + Na2CO3 ④Ba(NO3)2 + NaOH ⑤Ba(NO3)2 + Na2CO3 ⑥NaOH+ Na2CO3 (1)同学们总结归纳出复分解反应发生的条件是生成物中有__________; (2)同学们将实验后的所有物质倒入同一烧杯中,后续实验及现象如下:综合分析可知,无色滤液a中一定含有的溶质包括和__________;(3)下列有关利用无色滤液a和白色沉淀b的设想中,合理的是__________。A.鉴别MgCl2溶液和BaCl2溶液:取样,滴加无色滤液aB.制NaNO3溶液:向无色滤液a中加入适量的稀HNO3C.除去Ba(NO3)2溶液中的HNO3:向其中加入过量的白色沉淀b教师点拨:本题考查的知识点主要有:复分解反应的条件和实质;酸碱盐的性质;盐的溶解性。四、当堂测试、诊断达标1、某温度时,向一定量的饱和石灰水中加入少量的生石灰,恢复到原来的温度。下列说法中正确的是 ( )A.溶液的质量减少 B.溶液的质量不变C.溶液中溶质的质量分数增大 D.溶液中溶质的溶解度增大2、下列对“20.C时。硝酸钾溶解度为31.6克”的理解正确的是()A、20°C时,31.6克硝酸钾溶解在100克水里。B、20°C时,100克溶液中含31.6克硝酸钾C、31.6克硝酸钾溶解在100克水中达到饱和状态。D、20°C时,31.6克硝酸钾溶解在100克水中恰好达到饱和状态。3、向一杯接近饱和的KN03溶液中,逐渐加入KN03晶体,下图符合溶液中溶质的质量变化规律的是( )4、为了证明长期暴露在空气中氢氧化钠溶液已经部分变质,请分别选用两种不同物质类别的试剂完成证明,按要求填写:(1)选用的试剂为 ,实验现象为 。(2)选用的试剂为 ,实验现象为 。五、课堂内容总结:通过今天的复习课,你提升了哪些化学基本观念,学会了哪些有效的复习方法,还有什么疑惑记下来六、综合拓展,能力提升1、要除去氯化钙溶液中的少量盐酸,使溶液变为中性,在没有指示剂的情况下,可加入( )A、氢氧化钙 B、氢氧化钠 C、碳酸钙 D、硝酸银溶液下2、如图所示曲线A、B、C分别表示三种固体物质的溶解度变化,试回答: (1)t3℃,A、B、C三种物质的溶解度由小到大的顺序是 。(2)M点表示t3℃时,A的 (饱和、不饱和)溶液。(3)当A中混有少量B时,可采用法 提纯A。(4)若要将C物质接近饱和的溶液变成饱和,可采用的方法有 、 、 。(5)从该图中,你还能获得的信息有:(写一点即可)__________________。(6)将t3℃时A、B、C三种物质的饱和溶液降温至t2℃,溶液中溶质质量分数由大到小的顺序是 。 3、现有氢氧化钠、碳酸钠、稀硫酸三瓶无色溶液,只提供无色酚酞,如何鉴别? 学生根据知识网络,回顾本单元知识,初步使知识系统化。 学生回忆抢答学生回顾课本,抢答 注意:同学间可以讨论、交流、相互补充学生回顾课本、思考讨论学生在独立思考的基础上完成例1,而后小组内讨论交流学生思考,独立完成后,组内交流讨论。练习反馈,查缺补漏。根据反馈检测情况总结收获,找出疑惑。练习,提升能力。 引导学生回扣课本,将知识系统化,网络化。促使学生对知识系统化,加深理解和记忆。通过抢答的方式活跃课堂气氛,调动学生的学习的参与度和积极性让学生总结人类获取物质的方法:(一)物理方法(二)化学方法复习饱和溶液、溶解度、结晶、蒸馏的概念,及他们之间的关系。理解复分解反应的实质、条件。使学生明确分离提纯物质的一般方法和思路。旨在培养学生的环保意识。走进中考,熟悉本单元考点一:理解溶解度的含义,知道影响固体溶解度的因素,能读懂溶解度曲线并用溶解度曲线解决混合物分离等实际问题自主练习巩固本单元知识走进中考,熟悉本单元考点二:理解复分解反应的条件和实质;初步掌握盐的性质;通过检测,及时反馈、检测。拓展应用、提高能力。提升能力
教学反思:以《新课标》的基本理念为指引,在教学上采用了探究式的教学方法,通过设置问题情景、学生分组讨论练习巩固,使学生在“做中学、学中懂”。学生在小组活动中,经历了自主、探究、合作的学习方式,即发展了学生的个性潜能,又培养了他们的合作精神。教师始终是学生学习的帮助者,学生是以研究者、探究者的角色出现在教学过程中,主体地位得到了充分体现,使教学过程成为一个再发现、再创造的认识过程,同时在教学过程中重视学法渗透,进一步把所学知识转化为解决问题的能力。
海水晒盐
海水中的化学
过 程
固体物质溶解度
海水制碱
氨碱法制纯碱
纯碱的性质
(盐类物质的性质)
复分解反应的实质
海 洋 化 学 资 源
海水中的化学物质
海 底 矿 物 资 源
海 水 淡 化
海水 制镁
粗盐提纯
PAGE
学习目标:
1.运用图示、列表等方式认识海洋中蕴藏着丰富的资源,认识合理开发海洋资源与保护海洋环境的辩证关系。学会蒸馏法分离物质,认识海水淡化的可行性,进一步树立资源意识。
2.进一步了解海水“晒盐”的过程,结晶等概念。认识溶解度的含义,学会绘制溶解度曲线。
3.学会粗盐提纯的实验方法。了解食盐在生产、生活中的重要用途;
4.学习氨碱法制纯碱的简单原理和主要流程,认识纯碱的性质,了解纯碱的主要用途,进一步理解盐的定义及复分解反应的实质。
复习重点、难点
重点:1、结晶等概念,
2、溶解度的含义及应用,盐类的性质
难点:1、溶解度涵义的理解
2、氨碱法制纯碱的反应原理,复分解反应发生的实质
教学过程:
教师活动 学生活动 活动意图
一、单元知识网络化:投影:第九单元知识网络。二、回顾课本,夯实基础(一)认识海水的组成:1、我是海水中的一个水分子,我和周围很多的离子共同生活在海水这个大家庭中,你知道他们是谁吗?写出构成他们的化学式。2、海底矿物的种类有: 、 、 。其中 被誉为“未来能源”、“21世纪能源”。因为 。(二)开发和利用海水问题1:海洋是人类的聚宝盆,我们可以通过不同方式从中获取有用的物质,你知道从海水中可以获取哪些物质?问题2:海水晒盐、海水淡化的原理?问题3:粗盐的纯化步骤、原理是什么?结合问题2、3,让学生总结混合物的分离提纯的不同方法:(物理方法和化学方法) 教师点拨:(三)保护海水从海水中可以获得很多的化学资源,除此以外,“我”这个水分子,还“看到”,1、人类在开发和利用海洋资源是,势必会造成海洋的污染,所以人类现在必须要立即行动起来,保护海洋资源,你能说出哪些海洋保护措施呢?三、走近中考:例1、(12攀枝花)甲、乙两种物质的溶解度曲线如右图。 (1)10℃时,甲物质的溶解度 (选填“大于”、“小于”或“等于”)乙物质的溶解度。 (2) 40℃时,把40g甲物质放入100g水中,所得的是 (选填“饱和”或“不饱和”)溶液。(3) 20℃时,甲物质溶液中溶质的质量分数不可能为 。A.20% B.25% C.26.5% D.30%(4)如右图所示,20℃时,将盛有乙物质饱和溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出。加入的物质可能是________(填字母序号)。A.氢氧化钠 B.氯化钠 C.硝酸铵教师点拨:把握住溶解度的四要素;溶解度曲线的意义;饱和溶液与溶质质量分数关系。例2、(12长春)同学们通过以下在溶液中进行的实验,探究复分解反应发生的条件:①H2SO4 + Ba(NO3)2 ②H2SO4 + NaOH ③H2SO4 + Na2CO3 ④Ba(NO3)2 + NaOH ⑤Ba(NO3)2 + Na2CO3 ⑥NaOH+ Na2CO3 (1)同学们总结归纳出复分解反应发生的条件是生成物中有__________; (2)同学们将实验后的所有物质倒入同一烧杯中,后续实验及现象如下:综合分析可知,无色滤液a中一定含有的溶质包括和__________;(3)下列有关利用无色滤液a和白色沉淀b的设想中,合理的是__________。A.鉴别MgCl2溶液和BaCl2溶液:取样,滴加无色滤液aB.制NaNO3溶液:向无色滤液a中加入适量的稀HNO3C.除去Ba(NO3)2溶液中的HNO3:向其中加入过量的白色沉淀b教师点拨:本题考查的知识点主要有:复分解反应的条件和实质;酸碱盐的性质;盐的溶解性。四、当堂测试、诊断达标1、某温度时,向一定量的饱和石灰水中加入少量的生石灰,恢复到原来的温度。下列说法中正确的是 ( )A.溶液的质量减少 B.溶液的质量不变C.溶液中溶质的质量分数增大 D.溶液中溶质的溶解度增大2、下列对“20.C时。硝酸钾溶解度为31.6克”的理解正确的是()A、20°C时,31.6克硝酸钾溶解在100克水里。B、20°C时,100克溶液中含31.6克硝酸钾C、31.6克硝酸钾溶解在100克水中达到饱和状态。D、20°C时,31.6克硝酸钾溶解在100克水中恰好达到饱和状态。3、向一杯接近饱和的KN03溶液中,逐渐加入KN03晶体,下图符合溶液中溶质的质量变化规律的是( )4、为了证明长期暴露在空气中氢氧化钠溶液已经部分变质,请分别选用两种不同物质类别的试剂完成证明,按要求填写:(1)选用的试剂为 ,实验现象为 。(2)选用的试剂为 ,实验现象为 。五、课堂内容总结:通过今天的复习课,你提升了哪些化学基本观念,学会了哪些有效的复习方法,还有什么疑惑记下来六、综合拓展,能力提升1、要除去氯化钙溶液中的少量盐酸,使溶液变为中性,在没有指示剂的情况下,可加入( )A、氢氧化钙 B、氢氧化钠 C、碳酸钙 D、硝酸银溶液下2、如图所示曲线A、B、C分别表示三种固体物质的溶解度变化,试回答: (1)t3℃,A、B、C三种物质的溶解度由小到大的顺序是 。(2)M点表示t3℃时,A的 (饱和、不饱和)溶液。(3)当A中混有少量B时,可采用法 提纯A。(4)若要将C物质接近饱和的溶液变成饱和,可采用的方法有 、 、 。(5)从该图中,你还能获得的信息有:(写一点即可)__________________。(6)将t3℃时A、B、C三种物质的饱和溶液降温至t2℃,溶液中溶质质量分数由大到小的顺序是 。 3、现有氢氧化钠、碳酸钠、稀硫酸三瓶无色溶液,只提供无色酚酞,如何鉴别? 学生根据知识网络,回顾本单元知识,初步使知识系统化。 学生回忆抢答学生回顾课本,抢答 注意:同学间可以讨论、交流、相互补充学生回顾课本、思考讨论学生在独立思考的基础上完成例1,而后小组内讨论交流学生思考,独立完成后,组内交流讨论。练习反馈,查缺补漏。根据反馈检测情况总结收获,找出疑惑。练习,提升能力。 引导学生回扣课本,将知识系统化,网络化。促使学生对知识系统化,加深理解和记忆。通过抢答的方式活跃课堂气氛,调动学生的学习的参与度和积极性让学生总结人类获取物质的方法:(一)物理方法(二)化学方法复习饱和溶液、溶解度、结晶、蒸馏的概念,及他们之间的关系。理解复分解反应的实质、条件。使学生明确分离提纯物质的一般方法和思路。旨在培养学生的环保意识。走进中考,熟悉本单元考点一:理解溶解度的含义,知道影响固体溶解度的因素,能读懂溶解度曲线并用溶解度曲线解决混合物分离等实际问题自主练习巩固本单元知识走进中考,熟悉本单元考点二:理解复分解反应的条件和实质;初步掌握盐的性质;通过检测,及时反馈、检测。拓展应用、提高能力。提升能力
教学反思:以《新课标》的基本理念为指引,在教学上采用了探究式的教学方法,通过设置问题情景、学生分组讨论练习巩固,使学生在“做中学、学中懂”。学生在小组活动中,经历了自主、探究、合作的学习方式,即发展了学生的个性潜能,又培养了他们的合作精神。教师始终是学生学习的帮助者,学生是以研究者、探究者的角色出现在教学过程中,主体地位得到了充分体现,使教学过程成为一个再发现、再创造的认识过程,同时在教学过程中重视学法渗透,进一步把所学知识转化为解决问题的能力。
海水晒盐
海水中的化学
过 程
固体物质溶解度
海水制碱
氨碱法制纯碱
纯碱的性质
(盐类物质的性质)
复分解反应的实质
海 洋 化 学 资 源
海水中的化学物质
海 底 矿 物 资 源
海 水 淡 化
海水 制镁
粗盐提纯
PAGE
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
