2021-2022学年九年级化学人教版上册3.2.3原子的结构(课件19页)
文档属性
| 名称 | 2021-2022学年九年级化学人教版上册3.2.3原子的结构(课件19页) |  | |
| 格式 | pptx | ||
| 文件大小 | 517.8KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-01 15:51:13 | ||
图片预览




文档简介
(共19张PPT)
课题2 原子的结构
(3课时)
Na
Cl
H
C
+11
2
8
1
+11
2
8
质子数
核外电子数
=
质子数
核外电子数
>
+17
2
8
7
+17
2
8
8
Na
Na
+
Cl
Cl
-
质子数
核外电子数
=
质子数
核外电子数
<
失去一个电子
得到一个电子
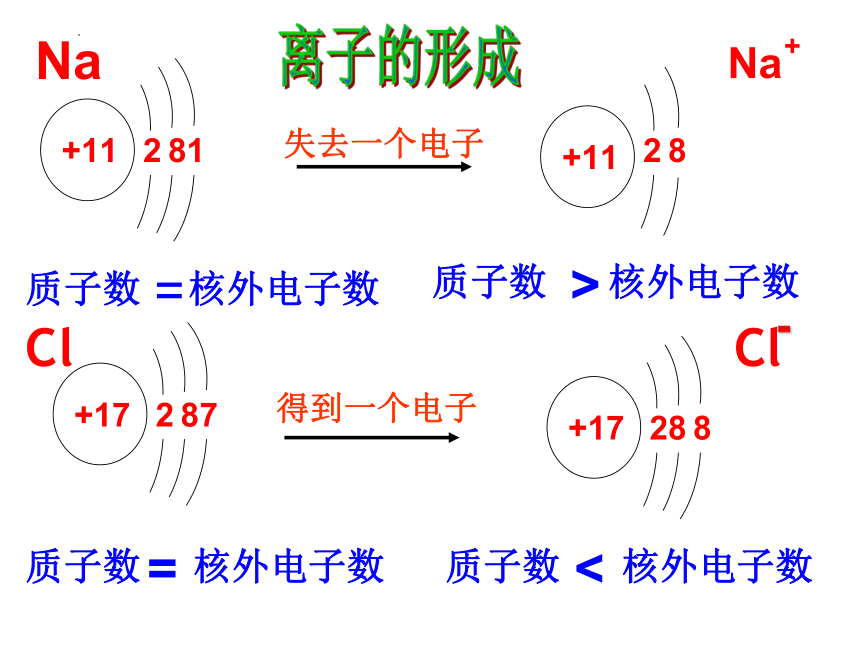
离子的形成
+13
2
8
3
+13
2
8
+17
2
8
7
+17
2
8
8
Al
Al
3+
Cl
Cl
-
练习
+8
2
6
O
+8
2
8
O2-
+11
2
8
1
Na
Ne
+10
2
8
原子中: 核电荷数 质子数 核外电子数
阳离子: 核电荷数 质子数 核外电子数
阴离子: 核电荷数 质子数 核外电子数
=
=
=
=
>
<
离子:带电荷的原子或原子团叫做离子。
(1)离子的定义
阳离子:带正电荷的原子或原子团。
(2)离子的分类
阴离子:带负电荷的原子或原子团。
5.离子的形成
离子符号的书写:先写元素符号,再在元素符号(或原子团)右上角标明所带电荷数及电性,数值在前,正、负号在后。离子带1个单位的正电荷或一个单位的负电荷,“1”省略不写。
离子所带电荷数由该元素原子的最外层电子数决定。
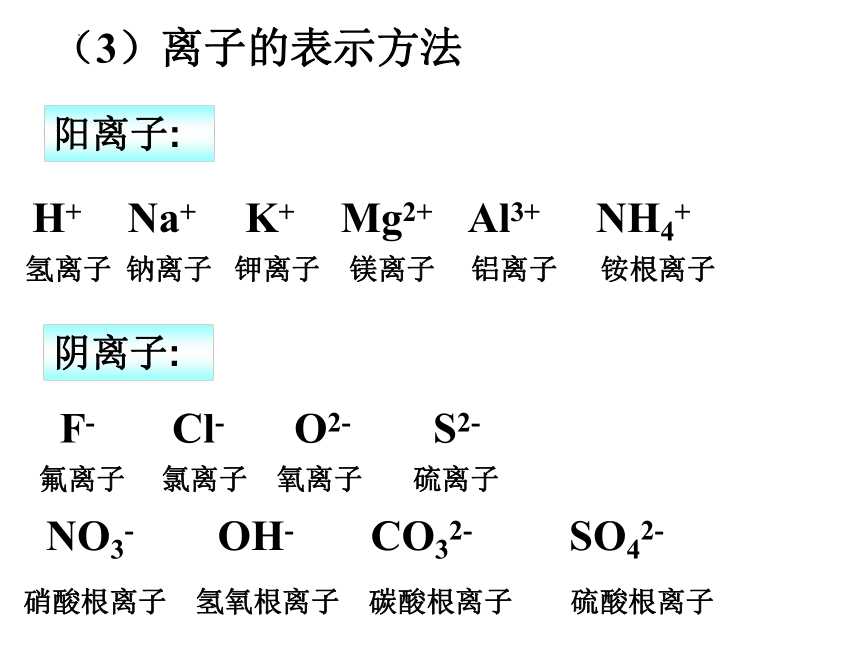
(3)离子的表示方法
氢离子 钠离子 钾离子 镁离子 铝离子 铵根离子
H+ Na+ K+ Mg2+ Al3+ NH4+
阳离子:
阴离子:
F- Cl- O2- S2-
硝酸根离子 氢氧根离子 碳酸根离子 硫酸根离子
NO3- OH- CO32- SO42-
氟离子 氯离子 氧离子 硫离子
表示该离子(或一个离子)
2Mg2+
表示每个镁离子带两个单位的正电荷
Cl-
氯离子或一个氯离子
表示2个镁离子
镁离子: Mg2 +
5个硫酸根离子: 5 SO42-
(4)离子符号的意义
Al
3+
3
每个铝离子带三个单位正电荷
3个铝离子
铝离子或一个铝离子
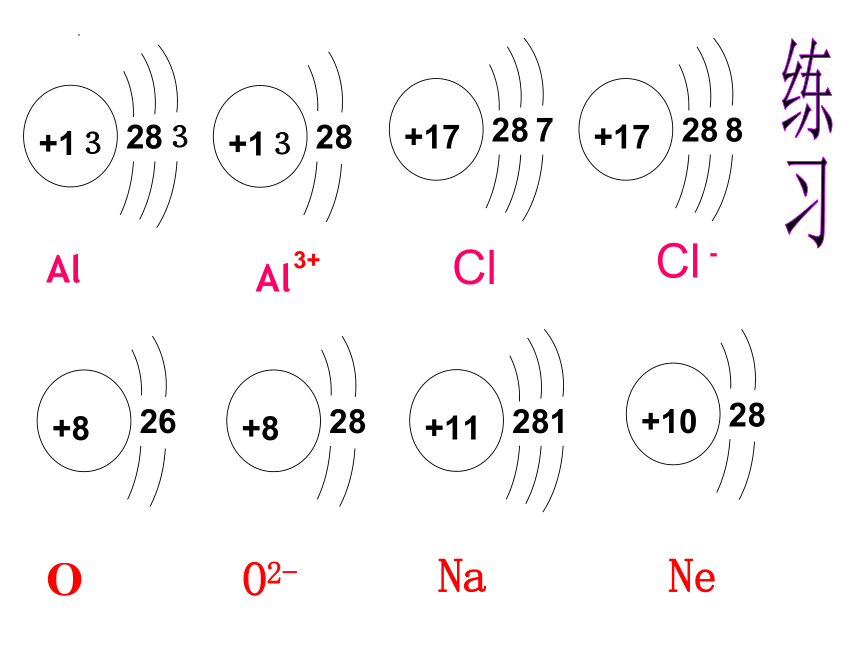
练一练
练习:
写出钠离子、镁离子、氧离子、氯离子的离子 符号并画出它们的结构示意图。
+11
2
8
+12
2
8
2
8
+8
2
8
8
+17
Na+ Mg2+ O2- Cl-
氯化钠的形成过程:
钠与氯气的反应
电子转移
不稳定
稳定
更稳定
氯化钠的形成
失1个电子
得1个电子
钠原子(Na)
氯原子(Cl)
钠离子(Na+)
氯离子(Cl-)
Na+
Cl-
静电作用
不带电的化合物NaCl
6.构成物质的粒子:原子、分子、离子
(1)由原子直接构成的物质:金属(如: Fe 、 Mg、Al)、稀有气体(如:He、Ne)、某些固态非金属(如:C、Si)
(2)由分子构成的物质:(如:H2、O2、HCl、O3、H2O、CO2)
(3)由离子构成的物质:含有金属离子或NH4+的化合物。如:NaCl、MgCl2
讨论与思考:
原子与离子的区别与联系
1、概念上:
2、电性上:
3、结构上:
区别
联系:
原子
阳离子
失电子
得电子
失电子
得电子
原子是化学变化中的最小微粒而离子是带电的原子或原子团
原子不带电而离子带电
原子是不稳定结构而离子是稳定结构
阴离子
原
子
分子
离子
物质
稀有气体、
金属等
氧气、水、
氢气等
氯化钠等
聚集
构成
构成
得到或
失去电子
构成
分解
小结:
原子、离子、分子、物质间的关系图
7
+17
8
2
练习1
氯原子结构示意图为 ,圆圈代 ,
+17代表 ,弧线表示 ,7表示 ,
在化学反应中,易 电子,成为Cl-,其结构
示意图为 ,Cl与Cl-属于同种元素是因为
,Cl与Cl-性质不同,是因为 。
原子核
核电荷数
电子层
最外层电子数
得1个
质子数相同
最外层电子数不同
8
+17
8
2
练习2 根据下列原子或离子结构示意图填空。
1
+11
8
2
8
2
+10
7
2
+9
8
2
+9
A B C D
(1)电子层排布相同的是 。
(2)属于同种元素的是 。
(3)属于金属元素的是 。
(4)属于稀有气体元素的是 。
(5)属于阴离子的是 ,
其离子符号是 。
B、C
A、B
D
C
B
F -
3. 在化学反应里,元素的原子结构发生变化的是 ( )
A 、质子数 B 、最外层电子数
C 、中子数 D、核电荷数
4. 某微粒的结构示意图 下列有关说法中不正确的是 ( )
A、该元素原子的核外有2个电子层
B、该元素是一种金属元素
C、该微粒是阳离子
D、该微粒最外层具有稳定结构
+13
8
2
B
A
5.已知铝元素的原子结构示意图为Al
(1) 表示的意义 ;
(2)铝元素原子核外共有 个电子层,最外层电子数是 ;
(3)铝元素的原子在化学反应中易(填“得”或“失”) 电子,形成 离子(填“阴”或“阳”),带 个单位的 电荷(填“正”或“负”),铝离子的符号表示为 。
(4)由此可以看出:原子在失去最外层电子或在最外层得到电子达到稳定结构后,一般不会发生改变的有 。
①元素的种类 ②元素的化学性质 ③原子核的质量 ④粒子的电性 ⑤原子核 ⑥最外层电子数 ⑦电子层数 ⑧核外电子层数 ⑨质子个数
原子核内有13个质子
3
3
失
阳
3
正
①③⑤⑨
Al3+
( )
+11
2
8
+8
2
6
+12
2
8
+8
2
8
A
B
C
D
D
7、某粒子结构示意图为
+x
2
8
则该粒子是
( )
A.一定是稀有气体原子 B.一定是阳离子
C.一定是阴离子 D.以上三种都有可能
6、下列粒子结构示意图中,表示阴离子的是
D
课题2 原子的结构
(3课时)
Na
Cl
H
C
+11
2
8
1
+11
2
8
质子数
核外电子数
=
质子数
核外电子数
>
+17
2
8
7
+17
2
8
8
Na
Na
+
Cl
Cl
-
质子数
核外电子数
=
质子数
核外电子数
<
失去一个电子
得到一个电子
离子的形成
+13
2
8
3
+13
2
8
+17
2
8
7
+17
2
8
8
Al
Al
3+
Cl
Cl
-
练习
+8
2
6
O
+8
2
8
O2-
+11
2
8
1
Na
Ne
+10
2
8
原子中: 核电荷数 质子数 核外电子数
阳离子: 核电荷数 质子数 核外电子数
阴离子: 核电荷数 质子数 核外电子数
=
=
=
=
>
<
离子:带电荷的原子或原子团叫做离子。
(1)离子的定义
阳离子:带正电荷的原子或原子团。
(2)离子的分类
阴离子:带负电荷的原子或原子团。
5.离子的形成
离子符号的书写:先写元素符号,再在元素符号(或原子团)右上角标明所带电荷数及电性,数值在前,正、负号在后。离子带1个单位的正电荷或一个单位的负电荷,“1”省略不写。
离子所带电荷数由该元素原子的最外层电子数决定。
(3)离子的表示方法
氢离子 钠离子 钾离子 镁离子 铝离子 铵根离子
H+ Na+ K+ Mg2+ Al3+ NH4+
阳离子:
阴离子:
F- Cl- O2- S2-
硝酸根离子 氢氧根离子 碳酸根离子 硫酸根离子
NO3- OH- CO32- SO42-
氟离子 氯离子 氧离子 硫离子
表示该离子(或一个离子)
2Mg2+
表示每个镁离子带两个单位的正电荷
Cl-
氯离子或一个氯离子
表示2个镁离子
镁离子: Mg2 +
5个硫酸根离子: 5 SO42-
(4)离子符号的意义
Al
3+
3
每个铝离子带三个单位正电荷
3个铝离子
铝离子或一个铝离子
练一练
练习:
写出钠离子、镁离子、氧离子、氯离子的离子 符号并画出它们的结构示意图。
+11
2
8
+12
2
8
2
8
+8
2
8
8
+17
Na+ Mg2+ O2- Cl-
氯化钠的形成过程:
钠与氯气的反应
电子转移
不稳定
稳定
更稳定
氯化钠的形成
失1个电子
得1个电子
钠原子(Na)
氯原子(Cl)
钠离子(Na+)
氯离子(Cl-)
Na+
Cl-
静电作用
不带电的化合物NaCl
6.构成物质的粒子:原子、分子、离子
(1)由原子直接构成的物质:金属(如: Fe 、 Mg、Al)、稀有气体(如:He、Ne)、某些固态非金属(如:C、Si)
(2)由分子构成的物质:(如:H2、O2、HCl、O3、H2O、CO2)
(3)由离子构成的物质:含有金属离子或NH4+的化合物。如:NaCl、MgCl2
讨论与思考:
原子与离子的区别与联系
1、概念上:
2、电性上:
3、结构上:
区别
联系:
原子
阳离子
失电子
得电子
失电子
得电子
原子是化学变化中的最小微粒而离子是带电的原子或原子团
原子不带电而离子带电
原子是不稳定结构而离子是稳定结构
阴离子
原
子
分子
离子
物质
稀有气体、
金属等
氧气、水、
氢气等
氯化钠等
聚集
构成
构成
得到或
失去电子
构成
分解
小结:
原子、离子、分子、物质间的关系图
7
+17
8
2
练习1
氯原子结构示意图为 ,圆圈代 ,
+17代表 ,弧线表示 ,7表示 ,
在化学反应中,易 电子,成为Cl-,其结构
示意图为 ,Cl与Cl-属于同种元素是因为
,Cl与Cl-性质不同,是因为 。
原子核
核电荷数
电子层
最外层电子数
得1个
质子数相同
最外层电子数不同
8
+17
8
2
练习2 根据下列原子或离子结构示意图填空。
1
+11
8
2
8
2
+10
7
2
+9
8
2
+9
A B C D
(1)电子层排布相同的是 。
(2)属于同种元素的是 。
(3)属于金属元素的是 。
(4)属于稀有气体元素的是 。
(5)属于阴离子的是 ,
其离子符号是 。
B、C
A、B
D
C
B
F -
3. 在化学反应里,元素的原子结构发生变化的是 ( )
A 、质子数 B 、最外层电子数
C 、中子数 D、核电荷数
4. 某微粒的结构示意图 下列有关说法中不正确的是 ( )
A、该元素原子的核外有2个电子层
B、该元素是一种金属元素
C、该微粒是阳离子
D、该微粒最外层具有稳定结构
+13
8
2
B
A
5.已知铝元素的原子结构示意图为Al
(1) 表示的意义 ;
(2)铝元素原子核外共有 个电子层,最外层电子数是 ;
(3)铝元素的原子在化学反应中易(填“得”或“失”) 电子,形成 离子(填“阴”或“阳”),带 个单位的 电荷(填“正”或“负”),铝离子的符号表示为 。
(4)由此可以看出:原子在失去最外层电子或在最外层得到电子达到稳定结构后,一般不会发生改变的有 。
①元素的种类 ②元素的化学性质 ③原子核的质量 ④粒子的电性 ⑤原子核 ⑥最外层电子数 ⑦电子层数 ⑧核外电子层数 ⑨质子个数
原子核内有13个质子
3
3
失
阳
3
正
①③⑤⑨
Al3+
( )
+11
2
8
+8
2
6
+12
2
8
+8
2
8
A
B
C
D
D
7、某粒子结构示意图为
+x
2
8
则该粒子是
( )
A.一定是稀有气体原子 B.一定是阳离子
C.一定是阴离子 D.以上三种都有可能
6、下列粒子结构示意图中,表示阴离子的是
D
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
