第2021-2022学年九年级化学人教版下册11.1.2生活中常见的盐(课件38页)
文档属性
| 名称 | 第2021-2022学年九年级化学人教版下册11.1.2生活中常见的盐(课件38页) |

|
|
| 格式 | pptx | ||
| 文件大小 | 6.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-01 16:56:03 | ||
图片预览










文档简介
(共38张PPT)
第11单元 盐 化肥
化学课件
编辑时间:2020-12-18
2020年度新制作的课件
课题 1 生活中常见的盐2
【54】
一 成功学习
1 成功目标(学习要高效,目标不可少)
(1) 知道复分解反应发生的条件。
(2) 能运用复分解反应发生的条件判断复分解反应的发生与否
(3) 能够记住部分酸碱盐溶解性表并能够运用分析解决简单问题。
重点:复分解反应发生的条件
难点:运用复分解反应发生的条件,判断复分解反应的发生与否,
能正确书写化学方程式
考点:运用复分解反应发生的条件解决相关的问题
2. 成功自学 (目标已明确,高效来自学)
(预习课本75-76页, 完成下列各题)
一、(温故知新)判断下列反应是否复分解反应?你的判断依据是什么?
(1) 碳酸钙和稀盐酸_____,_____________________________________
(2) 碳酸钠和稀盐酸:_____,___________________________________
(3) 氢氧化钠和硫酸:_____,___________________________________
(4) 氢氧化钙和二氧化碳:_____,_______________________________
(5) 碳酸钠和石灰水:_____,___________________________________
属于复分解反应的是_____________。你的判断依据是_____________
_______________________________
是
2NaOH + H2SO4=Na2SO4 + 2H2O
2HCl + CaCO3=CaCl2 + CO2↑ +H2O
2HCl + Na2CO3=2NaCl + CO2↑ +H2O
是
是
CO2 + Ca(OH)2 =CaCO3↓ + H2O
Na2CO3+ Ca(OH)2 =CaCO3↓+ 2NaOH
是
1 2 3 5
不是
两种化合物相互
交换成分,且有水、气体或沉淀产生
详细讲解
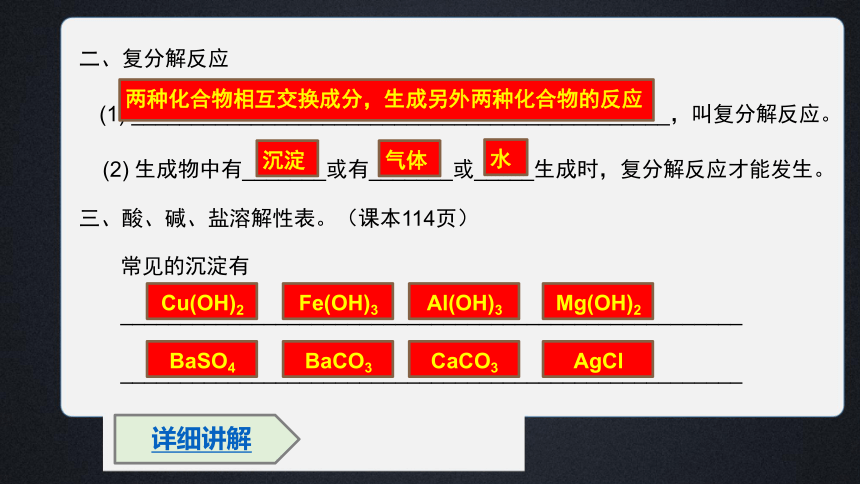
二、复分解反应
(1) _____________________________________________,叫复分解反应。
(2) 生成物中有_______或有_______或_____生成时,复分解反应才能发生。
三、酸、碱、盐溶解性表。(课本114页)
常见的沉淀有
____________________________________________________
____________________________________________________
两种化合物相互交换成分,生成另外两种化合物的反应
沉淀
气体
水
Cu(OH)2
Fe(OH)3
Al(OH)3
Mg(OH)2
BaSO4
BaCO3
CaCO3
AgCl
3.成功合作(小组面对面,交流更方便)
(1) 硫酸铜和氢氧化钠反应,硫酸铜和氢氧化钡反应,两者是否属于复分
解反应?观察到的现象有什么共同之处?
(2) 前面学过的酸碱中和反应是否也属于复分解反应?中和反应的生成物
中,相同的生成物是什么?
(3) 碳酸钠、碳酸钙等含碳酸根的盐与盐酸发生复分解反应时,可观察到的
共同现象是什么?
(4) 完善课本75页实验探究中表格中的内容。
二 成功示学
(各组请同学展示讨论结果,组间互助,补充答案。根据表现选出最活跃
小组及最活跃个人。)
(1) 我来说成功自学的答案
(2) 我来说本节课学习到的内容
(展示大舞台,有我更精彩)
三 成功测学
1 基础题
(1) 关于复分解反应说法一定正确的是 ( )
A.反应物为酸和碱 B.伴随有明显变化
C.生成物为盐和水 D.元素化合价不变
(2) 下列各组物质中不能发生复分解反应的是 ( )
A.HCl和Ca(OH)2 B.Na2CO3 和H2SO4
C.KCl和CuSO4 D.CaCl2和K2CO3
D
C
2 综合题
(3) 可溶性钡盐有毒。用X射线检查胃病时,可服用钡餐(硫酸钡)。若误服碳
酸钡会引起中毒,其反应的化学方程式为:
___________________________________________________________
中毒后可立即服用泻盐(硫酸镁)来解毒,其反应的化学方程式为:
_________________________________________________________
2HCl + BaCO3=BaCl2 + CO2↑ +H2O
BaCl2 + MgSO4= BaSO4↓+ MgCl2
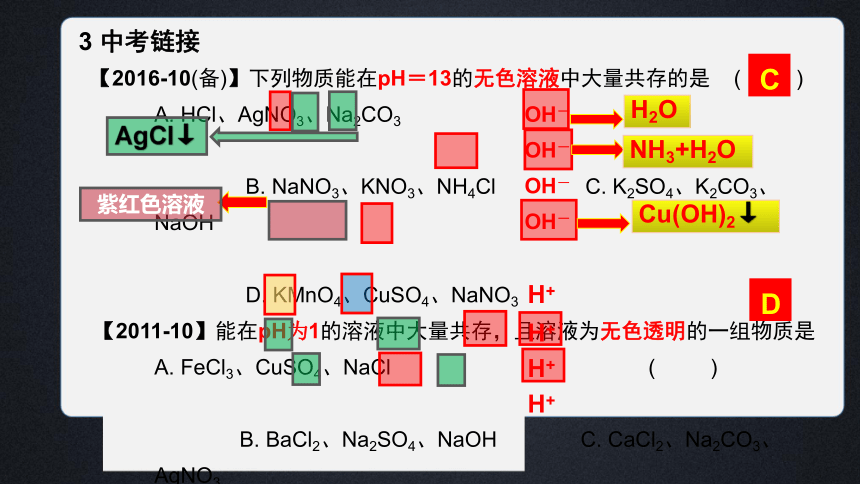
3 中考链接
【2016-10(备)】下列物质能在pH=13的无色溶液中大量共存的是 ( ) A. HCl、AgNO3、Na2CO3
B. NaNO3、KNO3、NH4Cl C. K2SO4、K2CO3、NaOH
D. KMnO4、CuSO4、NaNO3
【2011-10】能在pH为1的溶液中大量共存,且溶液为无色透明的一组物质是 A. FeCl3、CuSO4、NaCl ( )
B. BaCl2、Na2SO4、NaOH C. CaCl2、Na2CO3、AgNO3
D. K2SO4、NaNO3、NH4Cl
C
D
H2O
OH-
OH-
OH-
OH-
NH3+H2O
紫红色溶液
Cu(OH)2↓
AgCl↓
H+
H+
H+
H+
知识提纲
一 复分解反应
二 复分解反应发生的条件
三 复分解反应的应用
生活中常见的盐
【课标要求】
(1) 知道复分解反应发生的条件。
(2) 能运用复分解反应发生的条件判断复分解反应的发生与否
(3) 能够记住部分酸碱盐溶解性表并能够运用分析解决简单问题。
【重、难点】
重点:复分解反应发生的条件
难点:运用复分解反应发生的条件,判断复分解反应的发生与否,
能正确书写化学方程式
考点:运用复分解反应发生的条件解决相关的问题
【引入】
由两种化合物相互交换成分,生成另外两种化合物的反应,这样的反应叫做复分解反应
怎样检验物质中含有碳酸根?
某物质
+稀盐酸
产生气体
变浑浊
CO2
CaCO3
(含碳酸根或碳酸氢根离子)
碳酸根或碳酸氢根离子检验方法:
+澄清石灰水
一 复分解反应发生的条件
【实验11-3 】
向两支各盛有少量硫酸铜溶液的试管中分别滴加氢氧化钠溶液和氯化钡溶液,观察现象并填写下表。
CuSO4溶液+NaOH溶液 CuSO4溶液+BaCl2溶液
现象
化学 方程式
CuSO4+ BaCl2= BaSO4↓+ CuCl2
有蓝色絮状沉淀生成
有白色沉淀生成
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓
【讨论】
1. 上述两个反应是否属于复分解反应
观察到的现象有什么共同之处
2. 前面学过的酸碱中和反应是否也属于复分解反应
中和反应的生成物中,相同的生成物是什么
3. 碳酸钠、碳酸钙等含碳酸根的盐溶液与盐酸发生复分解反应时,可观察
到的共同现象是什么
是
都有沉淀生成
是
都有水生成
都有气体生成
【练习】写出下列反应的化学方程式
1.氯化钠溶液与硝酸银溶液
2.氢氧化钾溶液与盐酸
3.碳酸钙与稀硝酸
NaCl + AgNO3 = NaNO3 + AgCl↓
KOH + HCl = KCl + H2O
CaCO3 + 2HNO3 = Ca(NO3)2 + CO2↑ + H2O
根据复分解反应发生的条件,并利用书后附录1所提供的有关酸、碱、盐溶解性的信息,判断稀硫酸与下表中化合物的溶液之间是否能发生反应。
NaOH溶液 NaCl溶液 K2CO3溶液 Ba(NO3)2溶液
H2SO4
判断依据
否
能
无气体、沉淀、水生成
有水生成
H+、SO4 2-
Na+、OH-
Na+、SO4 2-
有 H2O 生成
H2SO4 + 2NaOH = Na2SO4 + 2H2O
H+、SO4 2-
Na+、Cl-
Na+、SO4 2-
无气体、沉淀、水生成
H2SO4 + 2NaCl = Na2SO4 + 2HCl
H+、Cl-
NaOH溶液 NaCl溶液 K2CO3溶液 Ba(NO3)2溶液
H2SO4
判断依据
能
能
有沉淀生成
有气体生成
H+、SO4 2-
K+、CO32-
K+、SO4 2-
有 CO2 生成
H2SO4 + K2CO3 = K2SO4 + H2O + CO2↑
H+、SO4 2-
Ba2+、NO3-
BaSO4
有沉淀生成
H2SO4 + Ba(NO3)2 = BaSO4↓ + 2HNO3
H+、NO3-
酸、碱、盐之间并不是都能发生复分解反应。只有当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
复分解反应发生的条件:生成物中有沉淀或气体或有水生成
H+ + OH- = H2O
2H+ + CO32- = H2O + CO2↑
Ba2+ + SO42- = BaSO4↓
离子的种类减少
复分解反应的本质:
Na2SO4 + KNO3 —— K2SO4 + NaNO3
H+、Cl-
Na+、CO3 2-
Na+、Cl-
反应前
反应后
溶液中离子种类
发生改变
2HCl + Na2CO3 —— 2NaCl + CO2↑ + H2O
复分解反应发生时的离子变化
×
Na+、SO42-
K+、NO3-
K+、SO42-
Na+、NO3-
溶液中离子种类
没发生改变
反应前
反应后
√
实质
实质
CaSO4 MgCO3
Ca(OH)2 Ag2SO4
AgOH Al2(CO3)3
CuCO3 Fe2(CO3)3
硫酸钙、碳酸镁,
氢氧化钙硫酸银,
四个微溶要记会
氢氧化银碳酸铝,
碳酸铜和碳酸铁,
水溶液中不能存。
红褐色Fe(OH)3
蓝色Cu(OH)2
钾钠铵盐硝酸盐,
易溶于水不沉淀。
盐酸盐不溶银亚汞,
硫酸盐不溶钡和铅。
溶碱有五位,
钾钠铵钙钡。
其余多不溶,
红褐铁蓝铜。
部分酸碱盐的溶解性表记忆顺口溜
OH- NO3- Cl- SO42- CO32-
H+ H2O 溶挥 溶挥 溶 溶挥
NH4+ 溶 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 BaSO4↓ 白↓
Ca2+ 微溶 溶 溶 微溶 白↓
Mg2+ 白↓ 溶 溶 溶 微溶
OH- NO3- Cl- SO42- CO32-
Al3+ 白↓ 溶 溶 溶 不存在
Mn2+ ↓ 溶 溶 溶 ↓
Zn2+ 白↓ 溶 溶 溶 ↓
Fe2+ 白↓ 溶浅绿 溶浅绿 溶浅绿 ↓
Fe3+ 红褐↓ 溶、黄 溶、黄 溶、黄 不存在
Cu2+ 蓝色↓ 溶、蓝 溶、蓝 溶、蓝 不存在
Ag+ 不存在 溶 AgCl↓ 微溶 ↓
钾钠铵盐硝酸盐,
易溶于水不沉淀。
酸碱盐中只要含有
K+Na+NH4+NO3- 就一定是易溶于水的
OH- NO3- Cl- SO42- CO32-
H+ H2O 溶挥 溶挥 溶 溶挥
NH4+ 溶 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 BaSO4↓ 白↓
Ca2+ 微溶 溶 溶 微溶 白↓
Mg2+ 白↓ 溶 溶 溶 微溶
OH- NO3- Cl- SO42- CO32-
Al3+ 白↓ 溶 溶 溶 不存在
Mn2+ ↓ 溶 溶 溶 ↓
Zn2+ 白↓ 溶 溶 溶 ↓
Fe2+ 白↓ 溶浅绿 溶浅绿 溶浅绿 ↓
Fe3+ 红褐↓ 溶、黄 溶、黄 溶、黄 不存在
Cu2+ 蓝色↓ 溶、蓝 溶、蓝 溶、蓝 不存在
Ag+ 不存在 溶 AgCl↓ 微溶 ↓
盐酸盐不溶银亚汞,
硫酸盐不溶钡和铅。
除了AgCl↓ BaSO4↓
这两种既不溶于水也不溶于稀硝酸的白色沉淀,
其余的氯化物和硫酸盐都溶于水
OH- NO3- Cl- SO42- CO32-
H+ H2O 溶挥 溶挥 溶 溶挥
NH4+ 溶 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 BaSO4↓ 白↓
Ca2+ 微溶 溶 溶 微溶 白↓
Mg2+ 白↓ 溶 溶 溶 微溶
OH- NO3- Cl- SO42- CO32-
Al3+ 白↓ 溶 溶 溶 不存在
Mn2+ ↓ 溶 溶 溶 ↓
Zn2+ 白↓ 溶 溶 溶 ↓
Fe2+ 白↓ 溶浅绿 溶浅绿 溶浅绿 ↓
Fe3+ 红褐↓ 溶、黄 溶、黄 溶、黄 不存在
Cu2+ 蓝色↓ 溶、蓝 溶、蓝 溶、蓝 不存在
Ag+ 不存在 溶 AgCl↓ 微溶 ↓
硫酸钙、碳酸镁,
氢氧化钙硫酸银,
四个微溶要记会。
CaSO4
MgCO3
Ca(OH)2
Ag2SO4
OH- NO3- Cl- SO42- CO32-
H+ H2O 溶挥 溶挥 溶 溶挥
NH4+ 溶 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 BaSO4↓ 白↓
Ca2+ 微溶 溶 溶 微溶 白↓
Mg2+ 白↓ 溶 溶 溶 微溶
OH- NO3- Cl- SO42- CO32-
Al3+ 白↓ 溶 溶 溶 不存在
Mn2+ ↓ 溶 溶 溶 ↓
Zn2+ 白↓ 溶 溶 溶 ↓
Fe2+ 白↓ 溶浅绿 溶浅绿 溶浅绿 ↓
Fe3+ 红褐↓ 溶、黄 溶、黄 溶、黄 不存在
Cu2+ 蓝色↓ 溶、蓝 溶、蓝 溶、蓝 不存在
Ag+ 不存在 溶 AgCl↓ 微溶 ↓
氢氧化银碳酸铝,
碳酸铜和碳酸铁,
水溶液中不能存。
AgOH
Al2(CO3)3
CuCO3
Fe2(CO3)3
OH- NO3- Cl- SO42- CO32-
H+ H2O 溶挥 溶挥 溶 溶挥
NH4+ 溶 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 BaSO4↓ 白↓
Ca2+ 微溶 溶 溶 微溶 白↓
Mg2+ 白↓ 溶 溶 溶 微溶
OH- NO3- Cl- SO42- CO32-
Al3+ 白↓ 溶 溶 溶 不存在
Mn2+ ↓ 溶 溶 溶 ↓
Zn2+ 白↓ 溶 溶 溶 ↓
Fe2+ 白↓ 溶浅绿 溶浅绿 溶浅绿 ↓
Fe3+ 红褐↓ 溶、黄 溶、黄 溶、黄 不存在
Cu2+ 蓝色↓ 溶、蓝 溶、蓝 溶、蓝 不存在
Ag+ 不存在 溶 AgCl↓ 微溶 ↓
溶碱有五位,
钾钠铵钙钡。
其余多不溶,
红褐铁蓝铜。
红褐色Fe(OH)3
蓝色Cu(OH)2
OH- NO3- Cl- SO42- CO32-
H+ H2O HNO3 HCl H2SO4 H2CO3
NH4+ NH3 H2O NH4NO3 NH4Cl (NH4)2SO4 (NH4)2CO3
K+ KOH KNO3 KCl K2SO4 K2CO3
Na+ NaOH NaNO3 NaCl Na2SO4 Na2CO3
Ba2+ Ba(OH)2 Ba(NO3)2 BaCl2 BaSO4↓ BaCO3↓
Ca2+ Ca(OH)2微 Ca(NO3)2 CaCl2 CaSO4微 CaCO3↓
Mg2+ Mg(OH)2↓ Mg(NO3)2 MgCl2 MgSO4 MgCO3微
OH- NO3- Cl- SO42- CO32-
Al3+ Al(OH)3↓ Al(NO3)3 AlCl3 Al2(SO4)3 不存在
Mn2+ Mn(OH)2↓ Mn(NO3)2 MnCl2 MnSO4 MnCO3↓
Zn2+ Zn(OH)2↓ Zn(NO3)2 ZnCl2 ZnSO4 ZnCO3↓
Fe2+ Fe(OH)2↓ Fe(NO3)2 FeCl2 FeSO4 FeCO3↓
Fe3+ Fe(OH)3↓ Fe(NO3)3 FeCl3 Fe2(SO4)3 不存在
Cu2+ Cu(OH)2↓ Cu(NO3)2 CuCl2 CuSO4 不存在
Ag+ 不存在 AgNO3 AgCl↓ Ag2SO4微 Ag2CO3↓
根据复分解反应发生的条件,并利用书后附录1所提供的有关酸、碱、盐溶解性的信息,判断下列化合物的溶液两两之间是否能发生反应。
H2SO4 Ba(NO3)2 NaOH K2CO3
H2SO4
Ba(NO3)2
NaOH
K2CO3
否
否
否
否
能
能
能
能
能
能
否
否
能
能
否
否
复分解反应发生的条件:生成物中有沉淀或气体或有水生成
酸、碱、盐之间并不是都能发生复分解反应。只有当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
练习:下列各组物质的溶液,不能发生复分解反应的是 ( )
A. HCl、Ca(OH)2
B. Na2CO3、H2SO4
C. AgNO3、BaCl2
D. KCl、CuSO4
D
H2O
H2O + CO2↑
AgCl↓
二 四种基本反应类型
化合反应 分解反应 置换反应 复分解反应
定 义
类 型
特 征
由两种或两种以上物质生成另一种物质的反应
由一种物质生成两种或两种以上其它物质的反应
由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应
由两种化合物互相交换成分生成另外两种化合物的反应
A+B+ …→AB
AB→A+B+ ….
AB + C→A +CB
AB + CD→ AD+ CB
反应物和生成物都为化合物
反应物为多种而生成物只有一种,即“多变一”
反应物只有一种而生成物有多种,即“一变多”
反应物与生成物都是两种,且都是单质和化合物
下列物质能否发生反应?写出能发生反应的化学方程式,并注明反应类型。
反应 能否反应 化学方程式 反应
类型
(1) 铜与稀盐酸
(2) 银与硫酸锌溶液
(3) 铁与硫酸铜溶液
(4) 硫酸和硝酸钾溶液
(5) 氢氧化钠溶液和硝酸
(6) 氯化钠溶液和硝酸银溶液
(7) 碳酸钾溶液和盐酸
(8) 硫酸铜溶液和氯化钡溶液
(9) 锌与和稀硫酸溶液
能
否
否
否
能
能
能
能
能
Fe + CuSO4 = FeSO4 + Cu
NaOH + HNO3= NaNO3 +H2O
NaCl+ AgNO3 = AgCl↓+NaNO3
2HCl+K2CO3=2KCl+CO2↑+H2O
CuSO4 +BaCl2=BaSO4↓+CuCl2
Zn + H2SO4 = ZnSO4 + H2↑
置换
复分解
复分解
复分解
复分解
置换
三 物质的分类
物质
纯净物
混合物
单质
化合物
金属
非金属
稀有气体
酸
碱
盐
氧化物
Fe、Cu、Al
C、S、H2
He、Ne、Ar
HCl、H2SO4
NaOH、Ca(OH)2
NaCl、CaCO3
Fe2O3、CaO
四 候氏制碱法
我国制碱工业的先驱——侯德榜
1921年,他在哥伦比亚大学获博士学位后,怀着工业救国的远大抱负,回到祖国。
为了实现中国人自己制碱的梦想,侯德榜把全部身心都投入到研究和改进制碱工艺上,经过5年艰苦的摸索,发明了“联合制碱法”(又称“侯氏制碱法”),终于在1926年生产出合格的纯碱。
低温下,将CO2和NH3通入饱和食盐水,因为低温下,小苏打的溶解度较小,所以会有碳酸氢钠固体析出,滤出固体后加热分解即得到纯碱 )
NaCl + H2O + CO2 + NH3 = NaHCO3↓ + NH4Cl
2NaHCO3 Na2CO3 + H2O + CO2↑
Δ
五 石笋和石钟乳的形成
CO2溶于水生成碳酸,当这样的溶液在地下石灰岩层流过时,与石灰岩的主要成份碳酸钙发生化学反应,生成溶于水的碳酸氢钙,其反应式为:H2O + CO2 + CaCO3 = Ca(HCO3)2
当溶有大量碳酸氢钙的水溶液遇热或压强突然减小,碳酸氢钙就会分解生成难溶于水的碳酸钙。其反应式为:Ca(HCO3)2= H2O+CO2↑+CaCO3↓
六 盐的化学性质
1. 盐能与金属发生置换反应,如:Fe + CuSO4 = Cu + FeSO4
2. 盐能与酸反应生成新盐和新酸,如:Na2CO3 + 2HC l = 2NaCl + CO2↑+ H2O
3. 盐能与碱反应生成新盐和新碱,如:Na2CO3 + Ca(OH)2 = CaCO3↓+2NaOH
4. 盐能与盐反应生成新盐和新盐,如:Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
二、盐的化学性质
与某些金属反应
通式:金属+盐→新金属+新盐(置换反应)
举例:Fe+CuSO4=== ____________
FeSO4+Cu
化学性质(必考)
通式:盐+酸―→新盐+新酸
举例
Na2CO3+2HCl ===____________________
BaCl2+H2SO4 ===_______________
与酸反应
与碱反应
通式:盐+碱―→新盐+新碱
举例
______________________________________
(工业上用纯碱制取烧碱)CuSO4+2NaOH=== __________________
与某些盐反应
举例
通式:盐+盐―→新盐+新盐
CuSO4+BaCl2=== ________________AgNO3+NaCl=== _______________
复分解反应
表达式:
AB+CD―→
AD+CB
2NaCl+H2O+CO2↑
BaSO4↓+2HCl
Na2CO3+Ca(OH)2 === CaCO3↓+2NaOH
Cu(OH)2↓+Na2SO4
BaSO4↓+CuCl2
AgCl↓+NaNO3
4. (2014河南3题1分)发明了“联合制碱法”的科学家是 ( )
5. [2012河南18(4)题1分]用化学方程式表示“联合制碱法”中的如下反应:向饱和食盐水中先后通入足量的NH3和CO2,生成小苏打(在该溶液中难溶)和一种氮肥。
A
NaCl + H2O + NH3 + CO2 = NaHCO3↓+NH4Cl
【2016-10(备)】下列物质能在pH=13的无色溶液中大量共存的是 ( ) A. HCl、AgNO3、Na2CO3
B. NaNO3、KNO3、NH4Cl C. K2SO4、K2CO3、NaOH
D. KMnO4、CuSO4、NaNO3
【2011-10】能在pH为1的溶液中大量共存,且溶液为无色透明的一组物质是 A. FeCl3、CuSO4、NaCl ( )
B. BaCl2、Na2SO4、NaOH C. CaCl2、Na2CO3、AgNO3
D. K2SO4、NaNO3、NH4Cl
C
D
第11单元 盐 化肥
化学课件
编辑时间:2020-12-18
2020年度新制作的课件
课题 1 生活中常见的盐2
【54】
一 成功学习
1 成功目标(学习要高效,目标不可少)
(1) 知道复分解反应发生的条件。
(2) 能运用复分解反应发生的条件判断复分解反应的发生与否
(3) 能够记住部分酸碱盐溶解性表并能够运用分析解决简单问题。
重点:复分解反应发生的条件
难点:运用复分解反应发生的条件,判断复分解反应的发生与否,
能正确书写化学方程式
考点:运用复分解反应发生的条件解决相关的问题
2. 成功自学 (目标已明确,高效来自学)
(预习课本75-76页, 完成下列各题)
一、(温故知新)判断下列反应是否复分解反应?你的判断依据是什么?
(1) 碳酸钙和稀盐酸_____,_____________________________________
(2) 碳酸钠和稀盐酸:_____,___________________________________
(3) 氢氧化钠和硫酸:_____,___________________________________
(4) 氢氧化钙和二氧化碳:_____,_______________________________
(5) 碳酸钠和石灰水:_____,___________________________________
属于复分解反应的是_____________。你的判断依据是_____________
_______________________________
是
2NaOH + H2SO4=Na2SO4 + 2H2O
2HCl + CaCO3=CaCl2 + CO2↑ +H2O
2HCl + Na2CO3=2NaCl + CO2↑ +H2O
是
是
CO2 + Ca(OH)2 =CaCO3↓ + H2O
Na2CO3+ Ca(OH)2 =CaCO3↓+ 2NaOH
是
1 2 3 5
不是
两种化合物相互
交换成分,且有水、气体或沉淀产生
详细讲解
二、复分解反应
(1) _____________________________________________,叫复分解反应。
(2) 生成物中有_______或有_______或_____生成时,复分解反应才能发生。
三、酸、碱、盐溶解性表。(课本114页)
常见的沉淀有
____________________________________________________
____________________________________________________
两种化合物相互交换成分,生成另外两种化合物的反应
沉淀
气体
水
Cu(OH)2
Fe(OH)3
Al(OH)3
Mg(OH)2
BaSO4
BaCO3
CaCO3
AgCl
3.成功合作(小组面对面,交流更方便)
(1) 硫酸铜和氢氧化钠反应,硫酸铜和氢氧化钡反应,两者是否属于复分
解反应?观察到的现象有什么共同之处?
(2) 前面学过的酸碱中和反应是否也属于复分解反应?中和反应的生成物
中,相同的生成物是什么?
(3) 碳酸钠、碳酸钙等含碳酸根的盐与盐酸发生复分解反应时,可观察到的
共同现象是什么?
(4) 完善课本75页实验探究中表格中的内容。
二 成功示学
(各组请同学展示讨论结果,组间互助,补充答案。根据表现选出最活跃
小组及最活跃个人。)
(1) 我来说成功自学的答案
(2) 我来说本节课学习到的内容
(展示大舞台,有我更精彩)
三 成功测学
1 基础题
(1) 关于复分解反应说法一定正确的是 ( )
A.反应物为酸和碱 B.伴随有明显变化
C.生成物为盐和水 D.元素化合价不变
(2) 下列各组物质中不能发生复分解反应的是 ( )
A.HCl和Ca(OH)2 B.Na2CO3 和H2SO4
C.KCl和CuSO4 D.CaCl2和K2CO3
D
C
2 综合题
(3) 可溶性钡盐有毒。用X射线检查胃病时,可服用钡餐(硫酸钡)。若误服碳
酸钡会引起中毒,其反应的化学方程式为:
___________________________________________________________
中毒后可立即服用泻盐(硫酸镁)来解毒,其反应的化学方程式为:
_________________________________________________________
2HCl + BaCO3=BaCl2 + CO2↑ +H2O
BaCl2 + MgSO4= BaSO4↓+ MgCl2
3 中考链接
【2016-10(备)】下列物质能在pH=13的无色溶液中大量共存的是 ( ) A. HCl、AgNO3、Na2CO3
B. NaNO3、KNO3、NH4Cl C. K2SO4、K2CO3、NaOH
D. KMnO4、CuSO4、NaNO3
【2011-10】能在pH为1的溶液中大量共存,且溶液为无色透明的一组物质是 A. FeCl3、CuSO4、NaCl ( )
B. BaCl2、Na2SO4、NaOH C. CaCl2、Na2CO3、AgNO3
D. K2SO4、NaNO3、NH4Cl
C
D
H2O
OH-
OH-
OH-
OH-
NH3+H2O
紫红色溶液
Cu(OH)2↓
AgCl↓
H+
H+
H+
H+
知识提纲
一 复分解反应
二 复分解反应发生的条件
三 复分解反应的应用
生活中常见的盐
【课标要求】
(1) 知道复分解反应发生的条件。
(2) 能运用复分解反应发生的条件判断复分解反应的发生与否
(3) 能够记住部分酸碱盐溶解性表并能够运用分析解决简单问题。
【重、难点】
重点:复分解反应发生的条件
难点:运用复分解反应发生的条件,判断复分解反应的发生与否,
能正确书写化学方程式
考点:运用复分解反应发生的条件解决相关的问题
【引入】
由两种化合物相互交换成分,生成另外两种化合物的反应,这样的反应叫做复分解反应
怎样检验物质中含有碳酸根?
某物质
+稀盐酸
产生气体
变浑浊
CO2
CaCO3
(含碳酸根或碳酸氢根离子)
碳酸根或碳酸氢根离子检验方法:
+澄清石灰水
一 复分解反应发生的条件
【实验11-3 】
向两支各盛有少量硫酸铜溶液的试管中分别滴加氢氧化钠溶液和氯化钡溶液,观察现象并填写下表。
CuSO4溶液+NaOH溶液 CuSO4溶液+BaCl2溶液
现象
化学 方程式
CuSO4+ BaCl2= BaSO4↓+ CuCl2
有蓝色絮状沉淀生成
有白色沉淀生成
CuSO4 + 2NaOH = Na2SO4 + Cu(OH)2↓
【讨论】
1. 上述两个反应是否属于复分解反应
观察到的现象有什么共同之处
2. 前面学过的酸碱中和反应是否也属于复分解反应
中和反应的生成物中,相同的生成物是什么
3. 碳酸钠、碳酸钙等含碳酸根的盐溶液与盐酸发生复分解反应时,可观察
到的共同现象是什么
是
都有沉淀生成
是
都有水生成
都有气体生成
【练习】写出下列反应的化学方程式
1.氯化钠溶液与硝酸银溶液
2.氢氧化钾溶液与盐酸
3.碳酸钙与稀硝酸
NaCl + AgNO3 = NaNO3 + AgCl↓
KOH + HCl = KCl + H2O
CaCO3 + 2HNO3 = Ca(NO3)2 + CO2↑ + H2O
根据复分解反应发生的条件,并利用书后附录1所提供的有关酸、碱、盐溶解性的信息,判断稀硫酸与下表中化合物的溶液之间是否能发生反应。
NaOH溶液 NaCl溶液 K2CO3溶液 Ba(NO3)2溶液
H2SO4
判断依据
否
能
无气体、沉淀、水生成
有水生成
H+、SO4 2-
Na+、OH-
Na+、SO4 2-
有 H2O 生成
H2SO4 + 2NaOH = Na2SO4 + 2H2O
H+、SO4 2-
Na+、Cl-
Na+、SO4 2-
无气体、沉淀、水生成
H2SO4 + 2NaCl = Na2SO4 + 2HCl
H+、Cl-
NaOH溶液 NaCl溶液 K2CO3溶液 Ba(NO3)2溶液
H2SO4
判断依据
能
能
有沉淀生成
有气体生成
H+、SO4 2-
K+、CO32-
K+、SO4 2-
有 CO2 生成
H2SO4 + K2CO3 = K2SO4 + H2O + CO2↑
H+、SO4 2-
Ba2+、NO3-
BaSO4
有沉淀生成
H2SO4 + Ba(NO3)2 = BaSO4↓ + 2HNO3
H+、NO3-
酸、碱、盐之间并不是都能发生复分解反应。只有当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
复分解反应发生的条件:生成物中有沉淀或气体或有水生成
H+ + OH- = H2O
2H+ + CO32- = H2O + CO2↑
Ba2+ + SO42- = BaSO4↓
离子的种类减少
复分解反应的本质:
Na2SO4 + KNO3 —— K2SO4 + NaNO3
H+、Cl-
Na+、CO3 2-
Na+、Cl-
反应前
反应后
溶液中离子种类
发生改变
2HCl + Na2CO3 —— 2NaCl + CO2↑ + H2O
复分解反应发生时的离子变化
×
Na+、SO42-
K+、NO3-
K+、SO42-
Na+、NO3-
溶液中离子种类
没发生改变
反应前
反应后
√
实质
实质
CaSO4 MgCO3
Ca(OH)2 Ag2SO4
AgOH Al2(CO3)3
CuCO3 Fe2(CO3)3
硫酸钙、碳酸镁,
氢氧化钙硫酸银,
四个微溶要记会
氢氧化银碳酸铝,
碳酸铜和碳酸铁,
水溶液中不能存。
红褐色Fe(OH)3
蓝色Cu(OH)2
钾钠铵盐硝酸盐,
易溶于水不沉淀。
盐酸盐不溶银亚汞,
硫酸盐不溶钡和铅。
溶碱有五位,
钾钠铵钙钡。
其余多不溶,
红褐铁蓝铜。
部分酸碱盐的溶解性表记忆顺口溜
OH- NO3- Cl- SO42- CO32-
H+ H2O 溶挥 溶挥 溶 溶挥
NH4+ 溶 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 BaSO4↓ 白↓
Ca2+ 微溶 溶 溶 微溶 白↓
Mg2+ 白↓ 溶 溶 溶 微溶
OH- NO3- Cl- SO42- CO32-
Al3+ 白↓ 溶 溶 溶 不存在
Mn2+ ↓ 溶 溶 溶 ↓
Zn2+ 白↓ 溶 溶 溶 ↓
Fe2+ 白↓ 溶浅绿 溶浅绿 溶浅绿 ↓
Fe3+ 红褐↓ 溶、黄 溶、黄 溶、黄 不存在
Cu2+ 蓝色↓ 溶、蓝 溶、蓝 溶、蓝 不存在
Ag+ 不存在 溶 AgCl↓ 微溶 ↓
钾钠铵盐硝酸盐,
易溶于水不沉淀。
酸碱盐中只要含有
K+Na+NH4+NO3- 就一定是易溶于水的
OH- NO3- Cl- SO42- CO32-
H+ H2O 溶挥 溶挥 溶 溶挥
NH4+ 溶 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 BaSO4↓ 白↓
Ca2+ 微溶 溶 溶 微溶 白↓
Mg2+ 白↓ 溶 溶 溶 微溶
OH- NO3- Cl- SO42- CO32-
Al3+ 白↓ 溶 溶 溶 不存在
Mn2+ ↓ 溶 溶 溶 ↓
Zn2+ 白↓ 溶 溶 溶 ↓
Fe2+ 白↓ 溶浅绿 溶浅绿 溶浅绿 ↓
Fe3+ 红褐↓ 溶、黄 溶、黄 溶、黄 不存在
Cu2+ 蓝色↓ 溶、蓝 溶、蓝 溶、蓝 不存在
Ag+ 不存在 溶 AgCl↓ 微溶 ↓
盐酸盐不溶银亚汞,
硫酸盐不溶钡和铅。
除了AgCl↓ BaSO4↓
这两种既不溶于水也不溶于稀硝酸的白色沉淀,
其余的氯化物和硫酸盐都溶于水
OH- NO3- Cl- SO42- CO32-
H+ H2O 溶挥 溶挥 溶 溶挥
NH4+ 溶 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 BaSO4↓ 白↓
Ca2+ 微溶 溶 溶 微溶 白↓
Mg2+ 白↓ 溶 溶 溶 微溶
OH- NO3- Cl- SO42- CO32-
Al3+ 白↓ 溶 溶 溶 不存在
Mn2+ ↓ 溶 溶 溶 ↓
Zn2+ 白↓ 溶 溶 溶 ↓
Fe2+ 白↓ 溶浅绿 溶浅绿 溶浅绿 ↓
Fe3+ 红褐↓ 溶、黄 溶、黄 溶、黄 不存在
Cu2+ 蓝色↓ 溶、蓝 溶、蓝 溶、蓝 不存在
Ag+ 不存在 溶 AgCl↓ 微溶 ↓
硫酸钙、碳酸镁,
氢氧化钙硫酸银,
四个微溶要记会。
CaSO4
MgCO3
Ca(OH)2
Ag2SO4
OH- NO3- Cl- SO42- CO32-
H+ H2O 溶挥 溶挥 溶 溶挥
NH4+ 溶 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 BaSO4↓ 白↓
Ca2+ 微溶 溶 溶 微溶 白↓
Mg2+ 白↓ 溶 溶 溶 微溶
OH- NO3- Cl- SO42- CO32-
Al3+ 白↓ 溶 溶 溶 不存在
Mn2+ ↓ 溶 溶 溶 ↓
Zn2+ 白↓ 溶 溶 溶 ↓
Fe2+ 白↓ 溶浅绿 溶浅绿 溶浅绿 ↓
Fe3+ 红褐↓ 溶、黄 溶、黄 溶、黄 不存在
Cu2+ 蓝色↓ 溶、蓝 溶、蓝 溶、蓝 不存在
Ag+ 不存在 溶 AgCl↓ 微溶 ↓
氢氧化银碳酸铝,
碳酸铜和碳酸铁,
水溶液中不能存。
AgOH
Al2(CO3)3
CuCO3
Fe2(CO3)3
OH- NO3- Cl- SO42- CO32-
H+ H2O 溶挥 溶挥 溶 溶挥
NH4+ 溶 溶 溶 溶 溶
K+ 溶 溶 溶 溶 溶
Na+ 溶 溶 溶 溶 溶
Ba2+ 溶 溶 溶 BaSO4↓ 白↓
Ca2+ 微溶 溶 溶 微溶 白↓
Mg2+ 白↓ 溶 溶 溶 微溶
OH- NO3- Cl- SO42- CO32-
Al3+ 白↓ 溶 溶 溶 不存在
Mn2+ ↓ 溶 溶 溶 ↓
Zn2+ 白↓ 溶 溶 溶 ↓
Fe2+ 白↓ 溶浅绿 溶浅绿 溶浅绿 ↓
Fe3+ 红褐↓ 溶、黄 溶、黄 溶、黄 不存在
Cu2+ 蓝色↓ 溶、蓝 溶、蓝 溶、蓝 不存在
Ag+ 不存在 溶 AgCl↓ 微溶 ↓
溶碱有五位,
钾钠铵钙钡。
其余多不溶,
红褐铁蓝铜。
红褐色Fe(OH)3
蓝色Cu(OH)2
OH- NO3- Cl- SO42- CO32-
H+ H2O HNO3 HCl H2SO4 H2CO3
NH4+ NH3 H2O NH4NO3 NH4Cl (NH4)2SO4 (NH4)2CO3
K+ KOH KNO3 KCl K2SO4 K2CO3
Na+ NaOH NaNO3 NaCl Na2SO4 Na2CO3
Ba2+ Ba(OH)2 Ba(NO3)2 BaCl2 BaSO4↓ BaCO3↓
Ca2+ Ca(OH)2微 Ca(NO3)2 CaCl2 CaSO4微 CaCO3↓
Mg2+ Mg(OH)2↓ Mg(NO3)2 MgCl2 MgSO4 MgCO3微
OH- NO3- Cl- SO42- CO32-
Al3+ Al(OH)3↓ Al(NO3)3 AlCl3 Al2(SO4)3 不存在
Mn2+ Mn(OH)2↓ Mn(NO3)2 MnCl2 MnSO4 MnCO3↓
Zn2+ Zn(OH)2↓ Zn(NO3)2 ZnCl2 ZnSO4 ZnCO3↓
Fe2+ Fe(OH)2↓ Fe(NO3)2 FeCl2 FeSO4 FeCO3↓
Fe3+ Fe(OH)3↓ Fe(NO3)3 FeCl3 Fe2(SO4)3 不存在
Cu2+ Cu(OH)2↓ Cu(NO3)2 CuCl2 CuSO4 不存在
Ag+ 不存在 AgNO3 AgCl↓ Ag2SO4微 Ag2CO3↓
根据复分解反应发生的条件,并利用书后附录1所提供的有关酸、碱、盐溶解性的信息,判断下列化合物的溶液两两之间是否能发生反应。
H2SO4 Ba(NO3)2 NaOH K2CO3
H2SO4
Ba(NO3)2
NaOH
K2CO3
否
否
否
否
能
能
能
能
能
能
否
否
能
能
否
否
复分解反应发生的条件:生成物中有沉淀或气体或有水生成
酸、碱、盐之间并不是都能发生复分解反应。只有当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。
练习:下列各组物质的溶液,不能发生复分解反应的是 ( )
A. HCl、Ca(OH)2
B. Na2CO3、H2SO4
C. AgNO3、BaCl2
D. KCl、CuSO4
D
H2O
H2O + CO2↑
AgCl↓
二 四种基本反应类型
化合反应 分解反应 置换反应 复分解反应
定 义
类 型
特 征
由两种或两种以上物质生成另一种物质的反应
由一种物质生成两种或两种以上其它物质的反应
由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应
由两种化合物互相交换成分生成另外两种化合物的反应
A+B+ …→AB
AB→A+B+ ….
AB + C→A +CB
AB + CD→ AD+ CB
反应物和生成物都为化合物
反应物为多种而生成物只有一种,即“多变一”
反应物只有一种而生成物有多种,即“一变多”
反应物与生成物都是两种,且都是单质和化合物
下列物质能否发生反应?写出能发生反应的化学方程式,并注明反应类型。
反应 能否反应 化学方程式 反应
类型
(1) 铜与稀盐酸
(2) 银与硫酸锌溶液
(3) 铁与硫酸铜溶液
(4) 硫酸和硝酸钾溶液
(5) 氢氧化钠溶液和硝酸
(6) 氯化钠溶液和硝酸银溶液
(7) 碳酸钾溶液和盐酸
(8) 硫酸铜溶液和氯化钡溶液
(9) 锌与和稀硫酸溶液
能
否
否
否
能
能
能
能
能
Fe + CuSO4 = FeSO4 + Cu
NaOH + HNO3= NaNO3 +H2O
NaCl+ AgNO3 = AgCl↓+NaNO3
2HCl+K2CO3=2KCl+CO2↑+H2O
CuSO4 +BaCl2=BaSO4↓+CuCl2
Zn + H2SO4 = ZnSO4 + H2↑
置换
复分解
复分解
复分解
复分解
置换
三 物质的分类
物质
纯净物
混合物
单质
化合物
金属
非金属
稀有气体
酸
碱
盐
氧化物
Fe、Cu、Al
C、S、H2
He、Ne、Ar
HCl、H2SO4
NaOH、Ca(OH)2
NaCl、CaCO3
Fe2O3、CaO
四 候氏制碱法
我国制碱工业的先驱——侯德榜
1921年,他在哥伦比亚大学获博士学位后,怀着工业救国的远大抱负,回到祖国。
为了实现中国人自己制碱的梦想,侯德榜把全部身心都投入到研究和改进制碱工艺上,经过5年艰苦的摸索,发明了“联合制碱法”(又称“侯氏制碱法”),终于在1926年生产出合格的纯碱。
低温下,将CO2和NH3通入饱和食盐水,因为低温下,小苏打的溶解度较小,所以会有碳酸氢钠固体析出,滤出固体后加热分解即得到纯碱 )
NaCl + H2O + CO2 + NH3 = NaHCO3↓ + NH4Cl
2NaHCO3 Na2CO3 + H2O + CO2↑
Δ
五 石笋和石钟乳的形成
CO2溶于水生成碳酸,当这样的溶液在地下石灰岩层流过时,与石灰岩的主要成份碳酸钙发生化学反应,生成溶于水的碳酸氢钙,其反应式为:H2O + CO2 + CaCO3 = Ca(HCO3)2
当溶有大量碳酸氢钙的水溶液遇热或压强突然减小,碳酸氢钙就会分解生成难溶于水的碳酸钙。其反应式为:Ca(HCO3)2= H2O+CO2↑+CaCO3↓
六 盐的化学性质
1. 盐能与金属发生置换反应,如:Fe + CuSO4 = Cu + FeSO4
2. 盐能与酸反应生成新盐和新酸,如:Na2CO3 + 2HC l = 2NaCl + CO2↑+ H2O
3. 盐能与碱反应生成新盐和新碱,如:Na2CO3 + Ca(OH)2 = CaCO3↓+2NaOH
4. 盐能与盐反应生成新盐和新盐,如:Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
二、盐的化学性质
与某些金属反应
通式:金属+盐→新金属+新盐(置换反应)
举例:Fe+CuSO4=== ____________
FeSO4+Cu
化学性质(必考)
通式:盐+酸―→新盐+新酸
举例
Na2CO3+2HCl ===____________________
BaCl2+H2SO4 ===_______________
与酸反应
与碱反应
通式:盐+碱―→新盐+新碱
举例
______________________________________
(工业上用纯碱制取烧碱)CuSO4+2NaOH=== __________________
与某些盐反应
举例
通式:盐+盐―→新盐+新盐
CuSO4+BaCl2=== ________________AgNO3+NaCl=== _______________
复分解反应
表达式:
AB+CD―→
AD+CB
2NaCl+H2O+CO2↑
BaSO4↓+2HCl
Na2CO3+Ca(OH)2 === CaCO3↓+2NaOH
Cu(OH)2↓+Na2SO4
BaSO4↓+CuCl2
AgCl↓+NaNO3
4. (2014河南3题1分)发明了“联合制碱法”的科学家是 ( )
5. [2012河南18(4)题1分]用化学方程式表示“联合制碱法”中的如下反应:向饱和食盐水中先后通入足量的NH3和CO2,生成小苏打(在该溶液中难溶)和一种氮肥。
A
NaCl + H2O + NH3 + CO2 = NaHCO3↓+NH4Cl
【2016-10(备)】下列物质能在pH=13的无色溶液中大量共存的是 ( ) A. HCl、AgNO3、Na2CO3
B. NaNO3、KNO3、NH4Cl C. K2SO4、K2CO3、NaOH
D. KMnO4、CuSO4、NaNO3
【2011-10】能在pH为1的溶液中大量共存,且溶液为无色透明的一组物质是 A. FeCl3、CuSO4、NaCl ( )
B. BaCl2、Na2SO4、NaOH C. CaCl2、Na2CO3、AgNO3
D. K2SO4、NaNO3、NH4Cl
C
D
同课章节目录
