2021-2022学年九年级化学人教版下册11.1.1生活中常见的盐(课件34页)
文档属性
| 名称 | 2021-2022学年九年级化学人教版下册11.1.1生活中常见的盐(课件34页) |

|
|
| 格式 | pptx | ||
| 文件大小 | 12.0MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-01 17:00:47 | ||
图片预览










文档简介
(共34张PPT)
第11单元 盐 化肥
化学课件
编辑时间:2020-12-16
2020年度新制作的课件
课题 1 生活中常见的盐
【53】
一 成功学习
1 成功目标(学习要高效,目标不可少)
(1) 了解氯化钠、碳酸钠、碳酸氢钠、碳酸钙的组成、性质及主要用途,
学会碳酸根离子的检验方法。
(2) 记住常见盐的化学性质,会写有关反应的化学方程式。
重点:复分解反应的概念,常见盐的化学性质
难点:碳酸根离子的检验方法
考点:常见盐的化学性质
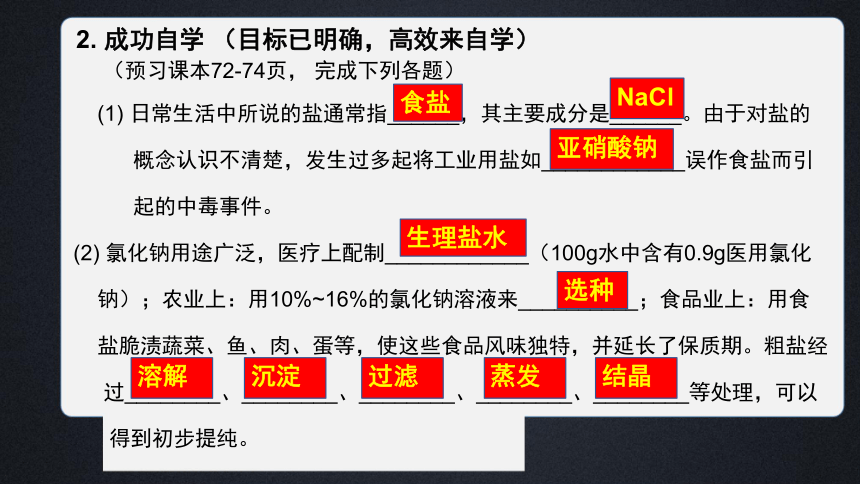
2. 成功自学 (目标已明确,高效来自学)
(预习课本72-74页, 完成下列各题)
(1) 日常生活中所说的盐通常指______,其主要成分是______。由于对盐的
概念认识不清楚,发生过多起将工业用盐如____________误作食盐而引
起的中毒事件。
(2) 氯化钠用途广泛,医疗上配制____________(100g水中含有0.9g医用氯化
钠);农业上:用10%~16%的氯化钠溶液来__________;食品业上:用食
盐脆渍蔬菜、鱼、肉、蛋等,使这些食品风味独特,并延长了保质期。粗盐经
过________、________、________、________、________等处理,可以
得到初步提纯。
食盐
生理盐水
NaCl
亚硝酸钠
选种
溶解
沉淀
过滤
蒸发
结晶
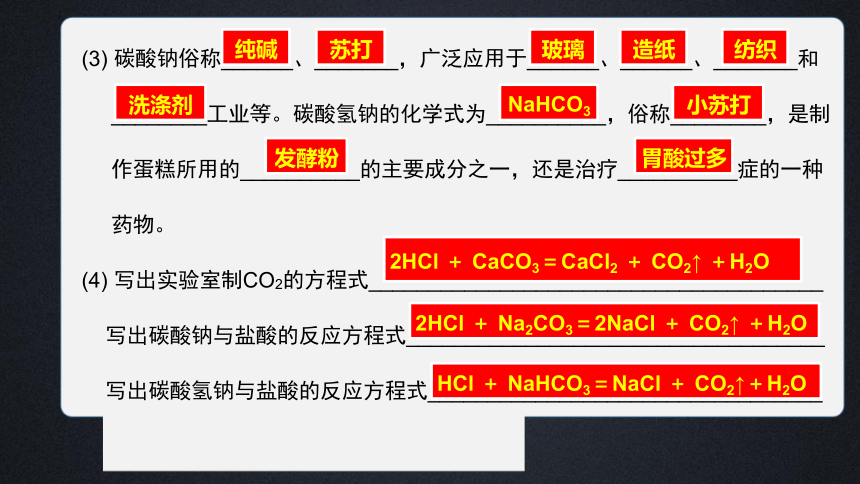
(3) 碳酸钠俗称______、_______,广泛应用于______、______、_______和
________工业等。碳酸氢钠的化学式为__________,俗称________,是制
作蛋糕所用的__________的主要成分之一,还是治疗__________症的一种
药物。
(4) 写出实验室制CO2的方程式______________________________________
写出碳酸钠与盐酸的反应方程式___________________________________
写出碳酸氢钠与盐酸的反应方程式_________________________________
2HCl + CaCO3=CaCl2 + CO2↑ +H2O
纯碱
苏打
玻璃
造纸
纺织
洗涤剂
NaHCO3
小苏打
发酵粉
胃酸过多
2HCl + Na2CO3=2NaCl + CO2↑ +H2O
HCl + NaHCO3=NaCl + CO2↑+H2O
(5) 分别写出在澄清石灰水中通入CO2与加入碳酸钠溶液的方程式,比较不同
之处______________________________________、
_______________________________________
(6) 由_______________相互交换成分,生成另外两种__________的反应叫做
____________反应
CO2 + Ca(OH)2 =CaCO3↓ + H2O
Na2CO3+ Ca(OH)2 =CaCO3↓+ 2NaOH
两种化合物
化合物
复分解
详细讲解
3.成功合作(小组面对面,交流更方便)
(1) 讨论课本74页实验11-1的现象并分析原因。
(2) 讨论课本74页实验11-2的实验现象并分析原因
二 成功示学
(各组请同学展示讨论结果,组间互助,补充答案。根据表现选出最活跃
小组及最活跃个人。)
(1) 我来说成功自学的答案
(2) 我来说本节课学习到的内容
(展示大舞台,有我更精彩)
三 成功测学
1 基础题
(1) 下列物质中不属于盐的一组是 ( )
A.纯碱、氯化钠 B.碳酸钙、高铀酸钾
C.小苏打、硝酸钾 D.氨水、生石灰
(2) 下列盐的用途中,错误的是 ( )
A.用含亚硝酸钠的工业用盐制香肠
B.用碳酸钙作补钙剂
C.用氯化钠配制生理盐水
D.用碳酸氢钠作焙制糕点的发酵粉
D
A
(3) 下列有关NaCl的叙述,错误的是 ( )
A.不溶于水 B.溶液呈中性
C.是食盐的主要成分 D.可用于配制生理盐水
2 综合题
(4) 滴有酚酞溶液的石灰水分别和下列各物质恰好完全反应后,溶液仍显红色
的是 ( )
A.二氧化碳 B.硫酸溶液
C.稀盐酸 D.碳酸钠溶液
A
D
3 中考链接
【2018-25(1)】焙制糕点所用发酵粉中含有碳酸氢钠,其俗名为___(填字母代号)。
a. 纯碱 b. 烧碱 c. 苏打 d. 小苏打
【2017-16】在医疗上可用小苏打治疗胃酸(HCl)过多症,其原理是
______________________________________(用化学方程式表示)。
【2016-23(1)】复分解反应发生后,生成物肯定不会是______(填“单质”或“化合
物”)。
【2013-21(1)】复分解反应发生的条件是有沉淀析出,或有气体放出,或有_____
生成。
单质
d
HCl + NaHCO3= NaCl + CO2↑ + H2O
水
知识提纲
一 常见盐的性质和用途
二 碳酸根离子的检验方法
三 复分解反应
生活中常见的盐
【课标要求】
(1) 了解氯化钠、碳酸钠、碳酸氢钠、碳酸钙的组成、性质及主要用途,
学会碳酸根离子的检验方法。
(2) 记住常见盐的化学性质,会写有关反应的化学方程式。
【重、难点】
重点:复分解反应的概念,常见盐的化学性质
难点:碳酸根离子的检验方法
考点:常见盐的化学性质
【引入】
原从水中来,
不敢水中行。
人人都要我,
无我食不成。
打一物质
食盐
日常生活中所说的盐,通常指食盐(主要成分是NaCl);而化学中的盐,不仅仅是指食盐,而是指一类组成里含有金属离子和酸根离子的化合物,如氯化钠、硫酸铜、碳酸钙等。我国曾发生过多次将工业用盐如亚硝酸钠 (NaNO2)误作食盐用于烹调而引起的中毒事件。
除食盐外,生活中常见的碳酸钠(Na2CO3,俗称纯碱、苏打)、碳酸氢钠(NaHCO3,俗称小苏打)、高锰酸钾(KMnO4)等都属于盐;石灰石和大理石的主要成分碳酸钙(CaCO3)也属于盐。
厨师放错盐工人进医院石家庄37人中毒
亚硝酸钠
亚硝酸钠是工业用盐,它是一种白色不透明晶体,形状很像食盐。亚硝酸盐不仅是致癌物质,而且摄入0.2~0.5 g即可引起食物中毒,3 g可致死。而亚硝酸盐是食品添加剂的一种,起着色、防腐作用,广泛用于熟肉类、灌肠类和罐头等动物性食品。现在世界各国仍允许用它来腌制肉类,但用量严加限制。
农户误用某工业盐
造成8人食物中毒
盐
生活中的食盐
指由金属离子和酸根离子构成的化合物,如NaCl、K2SO4等。
金属离子或
铵根离子NH4+,
盐的定义
NH4+和金属离子
的性质相似
一 氯化钠
氯化钠的用途很多。例如,医疗上的生理盐水①是用氯化钠配制的;农业上可以用氯化钠溶液来选种;工业上可以氯化钠为原料来制取碳酸钠、氢氧化钠、氯气和盐酸等。此外,还可用食盐腌渍蔬菜、鱼、肉、蛋等,腌制成的食品不仅风味独特,还可延长保存时间。公路上的积雪也可以用氯化钠来消除,等等。
氯化钠在自然界中分布很广,除海水里含有大量氯化钠外,盐湖、盐井和盐矿也是氯化钠的来源。
氯化钠是重要的调味品,炒菜时如果不放食盐,菜将食之无味。氯化钠也是人的正常生理活动所必不可少的。人体内所含的氯化钠大部分以离子形式存在于体液中。钠离子对维持细胞内外正常的水分分布和促进细胞内外物质交换起主要作用;氯离子是胃液中的主要成分,具有促生盐酸、帮助消化和增进食欲的作用。人们每天都要摄入一些食盐来补充由于出汗、排尿等而排出的氯化钠,以满足人体的正常需要(每人每天约需3~5g食盐)。但长期食用过多食盐不利于人体健康。
① 100 mL生理盐水中含0.9 g医用氯化钠。
1. 常见的盐—— 氯化钠
(1)俗称:食盐;
(2)化学式:NaCl;
(3)性状:白色晶体,易溶于水,有咸味,溶液呈中性;
(4)主要来源:海水、盐湖、盐井、盐矿。
2. 氯化钠的用途
(1)氯化钠是重要的调味品
(2)氯化钠具有广泛的用途
生理盐水
工业原料
选种
融雪剂
1)分布 : 氯化钠在自然界中的分布很广,除海水里含有大量的氯化钠外,盐湖、盐井和盐矿中也蕴藏着氯化钠。
3.氯化钠在自然界中的分布与获取
2)获取:通过晾晒海水或煮盐井水,盐湖水等,可以蒸发除去其水分,得到含有较多杂质的氯化钠晶体——粗盐。当有大量粗盐从海水、盐湖水等析出时,就会形成美丽的盐景。
蒸发池
结晶池
“海水晒盐” 过程
水分蒸发
粗盐
母液
海水“晒盐”等方法得到的是粗盐,
含有可溶性和不溶性杂质。
粗盐
精盐
?
粗盐提纯—去除粗盐中不溶性杂质
①溶解
②过滤
③蒸发
思考:上述过程中玻璃棒的用途分别是什么?
④转移
搅拌
引流
搅拌
二 碳酸钠、碳酸氢钠和碳酸钙
(1)俗名:纯碱、苏打;
(2)化学式: Na2CO3;
(3)纯碱不是碱,而是盐;
(4)性状:白色晶体,风化成粉末,
易溶于水,
水溶液显碱性。
1.碳酸钠
洗涤剂
造纸
碳酸钠用途
纺织印染
玻璃
(1)俗名:小苏打;
(2)化学式: NaHCO3;
(3)性状:白色粉末,能溶于水,
水溶液呈弱碱性,
加热易分解。
2.碳酸氢钠
面点发酵剂
治疗胃酸过多
碳酸氢钠用途
灭火剂原料
饮料原料
1 2NaOH + CO2 =Na2CO3 + H2O
2 Na2CO3 + CO2 +H2O = 2NaHCO3
3 NaHCO3 + HCl = NaCl + CO2↑ +H2O
4 2NaCl+ 2H2O 2NaOH + Cl2↑ + H2↑(电解饱和食盐水)
通电
5 Na2CO3+ Ca(OH)2 =CaCO3↓+ 2NaOH
6 NaOH + HCl = NaCl +H2O
7 NaCl+H2O+CO2+NH3=NaHCO3↓+NH4Cl(侯氏制碱法)
8 2NaHCO3 Na2CO3 +H2O +CO2↑
Δ
知识网络: 有关Na2CO3的相互转化
NaOH
Na2CO3
NaHCO3
NaCl
1
2
3
4
5
6
7
8
9 Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
9
3.碳酸钙
(1)大理石、石灰石主要成分;
(2)化学式: CaCO3;
(3)性状:多为灰白色矿物,
纯净物为白色粉末;
不溶于水,能溶于酸。
珍珠首饰
建筑材料
碳酸钙的用途
补钙剂
水泥原料
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
在实验室制取二氧化碳时,用大理石或石灰石与盐酸反应
盐酸腐蚀含有碳酸钙的建材
氯化钠 碳酸钠 碳酸氢钠 碳酸钙
化学式
相对分子质量
俗称
颜色状态
溶解性
用途
NaCl
食盐
白色固体
易溶
调味品、
生理盐水
Na2CO3
纯碱、苏打
白色固体
易溶
玻璃、造纸
NaHCO3
小苏打
白色固体
易溶
发酵粉、
治疗胃酸过多
CaCO3
白色固体
难溶
建筑材料、补钙剂
几种常见的盐
58.5
106
84
100
成功测学
【实验11-1】
向盛有0.5 g碳酸钠的试管里加入 2mL盐酸,迅速用带导管的橡胶塞塞紧试管口,并将导管另一端通入盛有澄清石灰水的试管中(如图 11-4),观察现象
用碳酸氢钠代替碳酸钠进行上述实验,并分析现象。
碳酸钠十盐酸 碳酸氢钠十盐酸
现象
分析
NaHCO3 + HCl = NaCl + CO2↑ +H2O
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
大试管内出现大量气泡,小试管内澄清石灰水变浑浊
两者反应产生CO2气体
两者反应产生CO2气体
︶
︶
【实验11-2】
向盛有少量碳酸钠溶液的试管里滴入澄清石灰水,观察并分析现象。
现象
分析
Na2CO3+ Ca(OH)2 =CaCO3↓+ 2NaOH
有白色沉淀产生
发生反应,有不溶于水的物质生成
知识网络:有关CaCO3的相互转化
1 CaCO3 CaO + CO2↑
高温
2 CaO +H2O = Ca(OH)2
3 Ca(OH)2 + CO2 = CaCO3↓ + H2O
Ca(OH)2 + Na2CO3= CaCO3↓+ 2NaOH
4 CaCO3 +CO2 +H2O = Ca(HCO3)2
5 Ca(HCO3)2 CaCO3↓ + H2O +CO2↑
△
6 Ca(HCO3)2 + 2HCl = CaCl2 + 2H2O + 2CO2↑
7 CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
8 Ca(OH) 2 + 2HCl = CaCl2 + 2H2O
9 CaO + 2HCl = CaCl2 + H2O
CaCO3
1
3
2
CaO
Ca(OH)2
Ca(HCO3)2
CaCl2
4
5
7
8
6
9
10 CaCl2 + Na2CO3 = CaCO3 ↓+ 2NaCl
10
酸和碱作用生成盐和水的反应是否是复分解反应,为什么?
如:NaOH + HCl = NaCl + H2O
分析上述反应,它们都发生在溶液中,都是由两种化合物互相交换成分,生成另外两种化合物的反应,这样的反应叫做复分解反应。
一、盐
概念:组成里含有金属离子(或铵根离子)和酸根离子的化合物【易错警示】盐的组成元素中不一定都含有金属元素,如NH4Cl等铵盐
常见的盐及其用途(10年8考)
氯化钠(NaCl)
食盐的主要成分,白色晶体,易溶于水,有咸味,水溶液呈中性用途:可作________、防腐剂、融雪剂,配制生理盐水、农业选种等
碳酸钠(Na2CO3)
俗名______或_____,白色粉末,易溶于水,水溶液显碱性
工业制法
制碱科学家:侯德榜,发明了“联合制碱法”(又称“侯氏制碱法”)
反应原理
NaCl+NH3+CO2+H2O=== NaHCO3↓+NH4Cl 2NaHCO3 Na2CO3+CO2↑+H2O
用途:可用于生产玻璃、洗涤剂、造纸、纺织等工业
调味品
纯碱
苏打
一、盐
常见的盐及其用途(10年8考)
碳酸钙(CaCO3)
碳酸氢钠(NaHCO3)
俗名________白色固体,能溶于水,水溶液显碱性
用途
焙制糕点所用发酵粉的主要成分之一
治疗胃酸过多,化学方程式:________________________________
石灰石、大理石的主要成分,白色固体,____溶于水用途:可用作__________、补钙剂,实验室和工业上都用来制取CO2,
工业上制取CO2的化学方程式为__________________________
小苏打
不
建筑材料
CaCO3 CaO+CO2↑
NaHCO3+HCl= NaCl+CO2↑+H2O
3. (2016河南备用卷19题2分)如图是某胃药标签说明书。
(1)若用碳酸镁代替碳酸氢钠,则每次用量需减少。请解释其中的道理。
(2)此胃药不适用于胃溃疡患者,其原因是什么?
相同质量的碳酸镁和碳酸氢钠比较,碳酸镁消耗的盐酸多。
碳酸氢钠与胃酸反应生成二氧化碳气体,会加重胃溃疡病情。
第11单元 盐 化肥
化学课件
编辑时间:2020-12-16
2020年度新制作的课件
课题 1 生活中常见的盐
【53】
一 成功学习
1 成功目标(学习要高效,目标不可少)
(1) 了解氯化钠、碳酸钠、碳酸氢钠、碳酸钙的组成、性质及主要用途,
学会碳酸根离子的检验方法。
(2) 记住常见盐的化学性质,会写有关反应的化学方程式。
重点:复分解反应的概念,常见盐的化学性质
难点:碳酸根离子的检验方法
考点:常见盐的化学性质
2. 成功自学 (目标已明确,高效来自学)
(预习课本72-74页, 完成下列各题)
(1) 日常生活中所说的盐通常指______,其主要成分是______。由于对盐的
概念认识不清楚,发生过多起将工业用盐如____________误作食盐而引
起的中毒事件。
(2) 氯化钠用途广泛,医疗上配制____________(100g水中含有0.9g医用氯化
钠);农业上:用10%~16%的氯化钠溶液来__________;食品业上:用食
盐脆渍蔬菜、鱼、肉、蛋等,使这些食品风味独特,并延长了保质期。粗盐经
过________、________、________、________、________等处理,可以
得到初步提纯。
食盐
生理盐水
NaCl
亚硝酸钠
选种
溶解
沉淀
过滤
蒸发
结晶
(3) 碳酸钠俗称______、_______,广泛应用于______、______、_______和
________工业等。碳酸氢钠的化学式为__________,俗称________,是制
作蛋糕所用的__________的主要成分之一,还是治疗__________症的一种
药物。
(4) 写出实验室制CO2的方程式______________________________________
写出碳酸钠与盐酸的反应方程式___________________________________
写出碳酸氢钠与盐酸的反应方程式_________________________________
2HCl + CaCO3=CaCl2 + CO2↑ +H2O
纯碱
苏打
玻璃
造纸
纺织
洗涤剂
NaHCO3
小苏打
发酵粉
胃酸过多
2HCl + Na2CO3=2NaCl + CO2↑ +H2O
HCl + NaHCO3=NaCl + CO2↑+H2O
(5) 分别写出在澄清石灰水中通入CO2与加入碳酸钠溶液的方程式,比较不同
之处______________________________________、
_______________________________________
(6) 由_______________相互交换成分,生成另外两种__________的反应叫做
____________反应
CO2 + Ca(OH)2 =CaCO3↓ + H2O
Na2CO3+ Ca(OH)2 =CaCO3↓+ 2NaOH
两种化合物
化合物
复分解
详细讲解
3.成功合作(小组面对面,交流更方便)
(1) 讨论课本74页实验11-1的现象并分析原因。
(2) 讨论课本74页实验11-2的实验现象并分析原因
二 成功示学
(各组请同学展示讨论结果,组间互助,补充答案。根据表现选出最活跃
小组及最活跃个人。)
(1) 我来说成功自学的答案
(2) 我来说本节课学习到的内容
(展示大舞台,有我更精彩)
三 成功测学
1 基础题
(1) 下列物质中不属于盐的一组是 ( )
A.纯碱、氯化钠 B.碳酸钙、高铀酸钾
C.小苏打、硝酸钾 D.氨水、生石灰
(2) 下列盐的用途中,错误的是 ( )
A.用含亚硝酸钠的工业用盐制香肠
B.用碳酸钙作补钙剂
C.用氯化钠配制生理盐水
D.用碳酸氢钠作焙制糕点的发酵粉
D
A
(3) 下列有关NaCl的叙述,错误的是 ( )
A.不溶于水 B.溶液呈中性
C.是食盐的主要成分 D.可用于配制生理盐水
2 综合题
(4) 滴有酚酞溶液的石灰水分别和下列各物质恰好完全反应后,溶液仍显红色
的是 ( )
A.二氧化碳 B.硫酸溶液
C.稀盐酸 D.碳酸钠溶液
A
D
3 中考链接
【2018-25(1)】焙制糕点所用发酵粉中含有碳酸氢钠,其俗名为___(填字母代号)。
a. 纯碱 b. 烧碱 c. 苏打 d. 小苏打
【2017-16】在医疗上可用小苏打治疗胃酸(HCl)过多症,其原理是
______________________________________(用化学方程式表示)。
【2016-23(1)】复分解反应发生后,生成物肯定不会是______(填“单质”或“化合
物”)。
【2013-21(1)】复分解反应发生的条件是有沉淀析出,或有气体放出,或有_____
生成。
单质
d
HCl + NaHCO3= NaCl + CO2↑ + H2O
水
知识提纲
一 常见盐的性质和用途
二 碳酸根离子的检验方法
三 复分解反应
生活中常见的盐
【课标要求】
(1) 了解氯化钠、碳酸钠、碳酸氢钠、碳酸钙的组成、性质及主要用途,
学会碳酸根离子的检验方法。
(2) 记住常见盐的化学性质,会写有关反应的化学方程式。
【重、难点】
重点:复分解反应的概念,常见盐的化学性质
难点:碳酸根离子的检验方法
考点:常见盐的化学性质
【引入】
原从水中来,
不敢水中行。
人人都要我,
无我食不成。
打一物质
食盐
日常生活中所说的盐,通常指食盐(主要成分是NaCl);而化学中的盐,不仅仅是指食盐,而是指一类组成里含有金属离子和酸根离子的化合物,如氯化钠、硫酸铜、碳酸钙等。我国曾发生过多次将工业用盐如亚硝酸钠 (NaNO2)误作食盐用于烹调而引起的中毒事件。
除食盐外,生活中常见的碳酸钠(Na2CO3,俗称纯碱、苏打)、碳酸氢钠(NaHCO3,俗称小苏打)、高锰酸钾(KMnO4)等都属于盐;石灰石和大理石的主要成分碳酸钙(CaCO3)也属于盐。
厨师放错盐工人进医院石家庄37人中毒
亚硝酸钠
亚硝酸钠是工业用盐,它是一种白色不透明晶体,形状很像食盐。亚硝酸盐不仅是致癌物质,而且摄入0.2~0.5 g即可引起食物中毒,3 g可致死。而亚硝酸盐是食品添加剂的一种,起着色、防腐作用,广泛用于熟肉类、灌肠类和罐头等动物性食品。现在世界各国仍允许用它来腌制肉类,但用量严加限制。
农户误用某工业盐
造成8人食物中毒
盐
生活中的食盐
指由金属离子和酸根离子构成的化合物,如NaCl、K2SO4等。
金属离子或
铵根离子NH4+,
盐的定义
NH4+和金属离子
的性质相似
一 氯化钠
氯化钠的用途很多。例如,医疗上的生理盐水①是用氯化钠配制的;农业上可以用氯化钠溶液来选种;工业上可以氯化钠为原料来制取碳酸钠、氢氧化钠、氯气和盐酸等。此外,还可用食盐腌渍蔬菜、鱼、肉、蛋等,腌制成的食品不仅风味独特,还可延长保存时间。公路上的积雪也可以用氯化钠来消除,等等。
氯化钠在自然界中分布很广,除海水里含有大量氯化钠外,盐湖、盐井和盐矿也是氯化钠的来源。
氯化钠是重要的调味品,炒菜时如果不放食盐,菜将食之无味。氯化钠也是人的正常生理活动所必不可少的。人体内所含的氯化钠大部分以离子形式存在于体液中。钠离子对维持细胞内外正常的水分分布和促进细胞内外物质交换起主要作用;氯离子是胃液中的主要成分,具有促生盐酸、帮助消化和增进食欲的作用。人们每天都要摄入一些食盐来补充由于出汗、排尿等而排出的氯化钠,以满足人体的正常需要(每人每天约需3~5g食盐)。但长期食用过多食盐不利于人体健康。
① 100 mL生理盐水中含0.9 g医用氯化钠。
1. 常见的盐—— 氯化钠
(1)俗称:食盐;
(2)化学式:NaCl;
(3)性状:白色晶体,易溶于水,有咸味,溶液呈中性;
(4)主要来源:海水、盐湖、盐井、盐矿。
2. 氯化钠的用途
(1)氯化钠是重要的调味品
(2)氯化钠具有广泛的用途
生理盐水
工业原料
选种
融雪剂
1)分布 : 氯化钠在自然界中的分布很广,除海水里含有大量的氯化钠外,盐湖、盐井和盐矿中也蕴藏着氯化钠。
3.氯化钠在自然界中的分布与获取
2)获取:通过晾晒海水或煮盐井水,盐湖水等,可以蒸发除去其水分,得到含有较多杂质的氯化钠晶体——粗盐。当有大量粗盐从海水、盐湖水等析出时,就会形成美丽的盐景。
蒸发池
结晶池
“海水晒盐” 过程
水分蒸发
粗盐
母液
海水“晒盐”等方法得到的是粗盐,
含有可溶性和不溶性杂质。
粗盐
精盐
?
粗盐提纯—去除粗盐中不溶性杂质
①溶解
②过滤
③蒸发
思考:上述过程中玻璃棒的用途分别是什么?
④转移
搅拌
引流
搅拌
二 碳酸钠、碳酸氢钠和碳酸钙
(1)俗名:纯碱、苏打;
(2)化学式: Na2CO3;
(3)纯碱不是碱,而是盐;
(4)性状:白色晶体,风化成粉末,
易溶于水,
水溶液显碱性。
1.碳酸钠
洗涤剂
造纸
碳酸钠用途
纺织印染
玻璃
(1)俗名:小苏打;
(2)化学式: NaHCO3;
(3)性状:白色粉末,能溶于水,
水溶液呈弱碱性,
加热易分解。
2.碳酸氢钠
面点发酵剂
治疗胃酸过多
碳酸氢钠用途
灭火剂原料
饮料原料
1 2NaOH + CO2 =Na2CO3 + H2O
2 Na2CO3 + CO2 +H2O = 2NaHCO3
3 NaHCO3 + HCl = NaCl + CO2↑ +H2O
4 2NaCl+ 2H2O 2NaOH + Cl2↑ + H2↑(电解饱和食盐水)
通电
5 Na2CO3+ Ca(OH)2 =CaCO3↓+ 2NaOH
6 NaOH + HCl = NaCl +H2O
7 NaCl+H2O+CO2+NH3=NaHCO3↓+NH4Cl(侯氏制碱法)
8 2NaHCO3 Na2CO3 +H2O +CO2↑
Δ
知识网络: 有关Na2CO3的相互转化
NaOH
Na2CO3
NaHCO3
NaCl
1
2
3
4
5
6
7
8
9 Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
9
3.碳酸钙
(1)大理石、石灰石主要成分;
(2)化学式: CaCO3;
(3)性状:多为灰白色矿物,
纯净物为白色粉末;
不溶于水,能溶于酸。
珍珠首饰
建筑材料
碳酸钙的用途
补钙剂
水泥原料
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
在实验室制取二氧化碳时,用大理石或石灰石与盐酸反应
盐酸腐蚀含有碳酸钙的建材
氯化钠 碳酸钠 碳酸氢钠 碳酸钙
化学式
相对分子质量
俗称
颜色状态
溶解性
用途
NaCl
食盐
白色固体
易溶
调味品、
生理盐水
Na2CO3
纯碱、苏打
白色固体
易溶
玻璃、造纸
NaHCO3
小苏打
白色固体
易溶
发酵粉、
治疗胃酸过多
CaCO3
白色固体
难溶
建筑材料、补钙剂
几种常见的盐
58.5
106
84
100
成功测学
【实验11-1】
向盛有0.5 g碳酸钠的试管里加入 2mL盐酸,迅速用带导管的橡胶塞塞紧试管口,并将导管另一端通入盛有澄清石灰水的试管中(如图 11-4),观察现象
用碳酸氢钠代替碳酸钠进行上述实验,并分析现象。
碳酸钠十盐酸 碳酸氢钠十盐酸
现象
分析
NaHCO3 + HCl = NaCl + CO2↑ +H2O
Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
大试管内出现大量气泡,小试管内澄清石灰水变浑浊
两者反应产生CO2气体
两者反应产生CO2气体
︶
︶
【实验11-2】
向盛有少量碳酸钠溶液的试管里滴入澄清石灰水,观察并分析现象。
现象
分析
Na2CO3+ Ca(OH)2 =CaCO3↓+ 2NaOH
有白色沉淀产生
发生反应,有不溶于水的物质生成
知识网络:有关CaCO3的相互转化
1 CaCO3 CaO + CO2↑
高温
2 CaO +H2O = Ca(OH)2
3 Ca(OH)2 + CO2 = CaCO3↓ + H2O
Ca(OH)2 + Na2CO3= CaCO3↓+ 2NaOH
4 CaCO3 +CO2 +H2O = Ca(HCO3)2
5 Ca(HCO3)2 CaCO3↓ + H2O +CO2↑
△
6 Ca(HCO3)2 + 2HCl = CaCl2 + 2H2O + 2CO2↑
7 CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
8 Ca(OH) 2 + 2HCl = CaCl2 + 2H2O
9 CaO + 2HCl = CaCl2 + H2O
CaCO3
1
3
2
CaO
Ca(OH)2
Ca(HCO3)2
CaCl2
4
5
7
8
6
9
10 CaCl2 + Na2CO3 = CaCO3 ↓+ 2NaCl
10
酸和碱作用生成盐和水的反应是否是复分解反应,为什么?
如:NaOH + HCl = NaCl + H2O
分析上述反应,它们都发生在溶液中,都是由两种化合物互相交换成分,生成另外两种化合物的反应,这样的反应叫做复分解反应。
一、盐
概念:组成里含有金属离子(或铵根离子)和酸根离子的化合物【易错警示】盐的组成元素中不一定都含有金属元素,如NH4Cl等铵盐
常见的盐及其用途(10年8考)
氯化钠(NaCl)
食盐的主要成分,白色晶体,易溶于水,有咸味,水溶液呈中性用途:可作________、防腐剂、融雪剂,配制生理盐水、农业选种等
碳酸钠(Na2CO3)
俗名______或_____,白色粉末,易溶于水,水溶液显碱性
工业制法
制碱科学家:侯德榜,发明了“联合制碱法”(又称“侯氏制碱法”)
反应原理
NaCl+NH3+CO2+H2O=== NaHCO3↓+NH4Cl 2NaHCO3 Na2CO3+CO2↑+H2O
用途:可用于生产玻璃、洗涤剂、造纸、纺织等工业
调味品
纯碱
苏打
一、盐
常见的盐及其用途(10年8考)
碳酸钙(CaCO3)
碳酸氢钠(NaHCO3)
俗名________白色固体,能溶于水,水溶液显碱性
用途
焙制糕点所用发酵粉的主要成分之一
治疗胃酸过多,化学方程式:________________________________
石灰石、大理石的主要成分,白色固体,____溶于水用途:可用作__________、补钙剂,实验室和工业上都用来制取CO2,
工业上制取CO2的化学方程式为__________________________
小苏打
不
建筑材料
CaCO3 CaO+CO2↑
NaHCO3+HCl= NaCl+CO2↑+H2O
3. (2016河南备用卷19题2分)如图是某胃药标签说明书。
(1)若用碳酸镁代替碳酸氢钠,则每次用量需减少。请解释其中的道理。
(2)此胃药不适用于胃溃疡患者,其原因是什么?
相同质量的碳酸镁和碳酸氢钠比较,碳酸镁消耗的盐酸多。
碳酸氢钠与胃酸反应生成二氧化碳气体,会加重胃溃疡病情。
同课章节目录
