3.3.1乙醇 课件
图片预览




文档简介
(共20张PPT)
必修第二册第3章
第3节 第一课时
饮食中的有机物
乙醇
“酉”字最早见于商代甲骨文,本义是酒器,后引申为“酒”,而酒中主要成分就是乙醇。
乙醇是无色透明、具有特殊香味的液体;比水轻,20℃时密度为0.789g/cm3;熔点为-117.3℃,沸点为78.5℃,易挥发,与水以任意比互溶,能溶解多种无机物和有机化合物,是优良的有机溶剂。
1.增减的是浓度,不变的是贡献
99.5%的酒精是无水酒精,可做溶剂
95%的酒精用于擦拭相机摄像头
75%的酒精消毒效果最好
40%-50%的酒精用于按摩
25%-50%的酒精可用于物理退热
一、乙醇的功与过
2.酒的主要成分
白酒的度数表示酒中含乙醇的体积百分比。
啤酒的度数是指啤酒生产原料麦芽汁的浓度。
3.作为汽车燃料
我国使用乙醇汽油是用90%的普通汽油与
10%的燃料乙醇调和而成。
4 . 酒驾违法
血液中的酒精含量大于或等于20mg/100mL,小于80mg/100mL。
饮用350mL啤酒或20mL白酒后,血液酒精浓度就可达到20mg/100mL
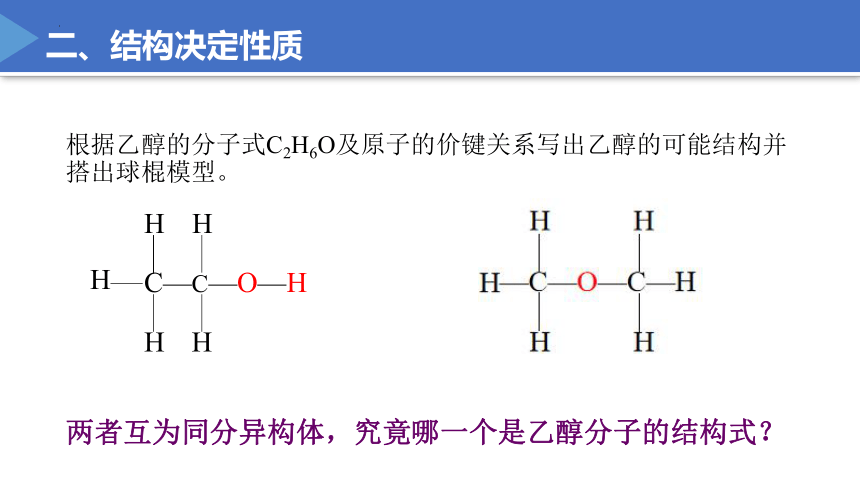
根据乙醇的分子式C2H6O及原子的价键关系写出乙醇的可能结构并搭出球棍模型。
二、结构决定性质
C—C—O—H
H
H
H
H
H
两者互为同分异构体,究竟哪一个是乙醇分子的结构式?
二、结构决定性质
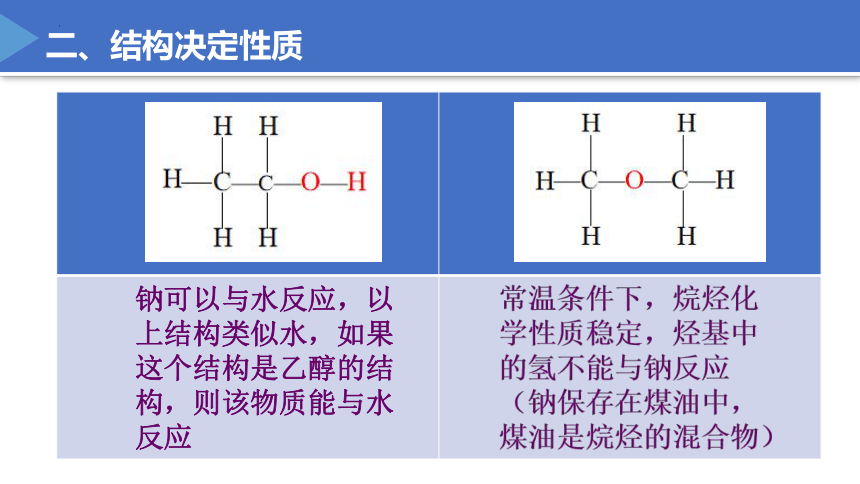
钠可以与水反应,以上结构类似水,如果这个结构是乙醇的结构,则该物质能与水反应
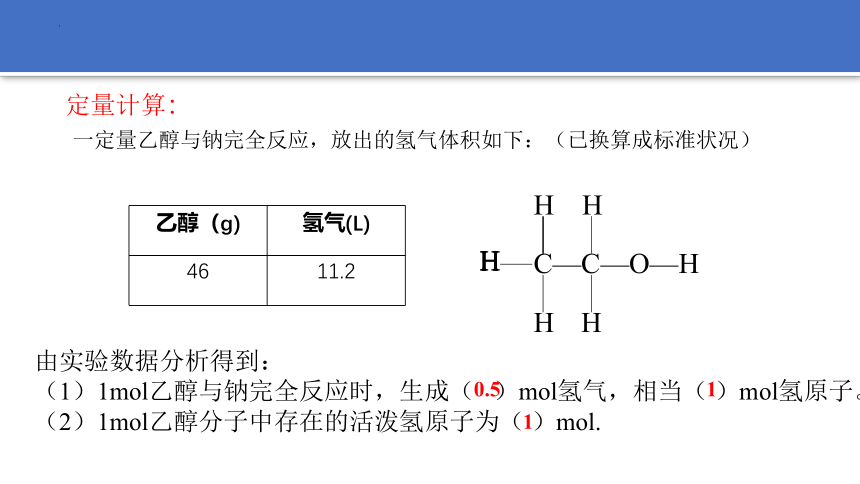
定量计算:
一定量乙醇与钠完全反应,放出的氢气体积如下:(已换算成标准状况)
乙醇(g) 氢气(L)
46 11.2
C—C—O—H
H
H
H
H
H
H
H
由实验数据分析得到:
(1)1mol乙醇与钠完全反应时,生成( )mol氢气,相当( )mol氢原子。
(2)1mol乙醇分子中存在的活泼氢原子为( )mol.
0.5
1
1
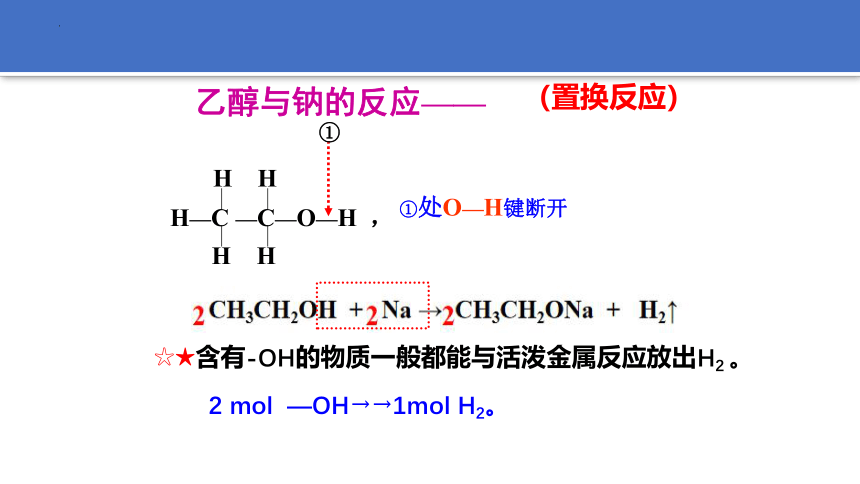
乙醇与钠的反应——
H—C —C—O—H ,
H H
H H
①处O—H键断开
①
☆★含有-OH的物质一般都能与活泼金属反应放出H2 。
(置换反应)
2 mol —OH→→1mol H2。
确定结构:
C—C—O—H
H
H
H
H
H
H
H
醇的官能团--羟基
CH3CH2OH
乙基
烃的衍生物: 烃分子中的氢原子被
其他原子或原子团所取代而生成的一系
列化合物称为烃的衍生物。
醇的官能团--羟基
实验目的:探究乙醇的化学性质
实验用品:无水乙醇,酸性高锰酸钾溶液,金属钠,铜丝;
试管,试管夹,烧杯,量筒,玻璃片,火柴,小刀,滤纸
实验方案实施:
三、活动 探究
实验方案 实验现象 实验结论
1 向烧杯中加入约2mL无水乙醇,点燃,观察现象
2 向试管中加入2mL酸性KMnO4溶液,滴入数滴无水乙醇,震荡,观察现象。
3 向试管中加入约2mL无水乙醇,取一根光洁的铜丝,置于酒精灯外焰加热,伸入无水乙醇中,反复几次,观察铜丝变化并闻一闻液体的气味
(2)乙醇的氧化反应
①燃烧:优质燃料(清洁,可再生,放出热量多)
②与强氧化剂反应
乙醇还可以与酸性高锰酸钾或重铬酸钾溶液反应,被直接氧化成:乙酸
【实验1】
【实验2】
实 验 现 象
将铜丝在火焰上烧热 铜丝由红色变成黑色
将烧热的铜丝插入无水乙醇中 铜丝由黑色变成红色,反复多次后闻到刺激性气味
【实验3】
2Cu + O2 2CuO
CH3CH2OH + CuO CH3CHO +Cu +H2O
红色变为黑色
黑色变为红色
总式:2CH3CH2OH + O2 2CH3CHO + 2H2O
Cu
O2(燃烧) KMnO4溶液 K2Cr2O7溶液 O2(催化氧化)
CH3CH2OH CO2 CH3COOH CH3COOH CH3CHO
氧化剂的氧化性强弱比较
氧化剂
氧化产物
还原剂
四、不同氧化剂与乙醇反应的产物比较
A
1.乙醇与钠反应时在何处断键;乙醇催化氧化是在何处断键( )
A. ①;①③ B.③;①②
C. ④;①③ D.①;①④
谈谈你有哪些收获?
五、学乙醇知识,长生活见识
课下活动
酿酒工艺的反应原理?
感谢聆听!
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
必修第二册第3章
第3节 第一课时
饮食中的有机物
乙醇
“酉”字最早见于商代甲骨文,本义是酒器,后引申为“酒”,而酒中主要成分就是乙醇。
乙醇是无色透明、具有特殊香味的液体;比水轻,20℃时密度为0.789g/cm3;熔点为-117.3℃,沸点为78.5℃,易挥发,与水以任意比互溶,能溶解多种无机物和有机化合物,是优良的有机溶剂。
1.增减的是浓度,不变的是贡献
99.5%的酒精是无水酒精,可做溶剂
95%的酒精用于擦拭相机摄像头
75%的酒精消毒效果最好
40%-50%的酒精用于按摩
25%-50%的酒精可用于物理退热
一、乙醇的功与过
2.酒的主要成分
白酒的度数表示酒中含乙醇的体积百分比。
啤酒的度数是指啤酒生产原料麦芽汁的浓度。
3.作为汽车燃料
我国使用乙醇汽油是用90%的普通汽油与
10%的燃料乙醇调和而成。
4 . 酒驾违法
血液中的酒精含量大于或等于20mg/100mL,小于80mg/100mL。
饮用350mL啤酒或20mL白酒后,血液酒精浓度就可达到20mg/100mL
根据乙醇的分子式C2H6O及原子的价键关系写出乙醇的可能结构并搭出球棍模型。
二、结构决定性质
C—C—O—H
H
H
H
H
H
两者互为同分异构体,究竟哪一个是乙醇分子的结构式?
二、结构决定性质
钠可以与水反应,以上结构类似水,如果这个结构是乙醇的结构,则该物质能与水反应
定量计算:
一定量乙醇与钠完全反应,放出的氢气体积如下:(已换算成标准状况)
乙醇(g) 氢气(L)
46 11.2
C—C—O—H
H
H
H
H
H
H
H
由实验数据分析得到:
(1)1mol乙醇与钠完全反应时,生成( )mol氢气,相当( )mol氢原子。
(2)1mol乙醇分子中存在的活泼氢原子为( )mol.
0.5
1
1
乙醇与钠的反应——
H—C —C—O—H ,
H H
H H
①处O—H键断开
①
☆★含有-OH的物质一般都能与活泼金属反应放出H2 。
(置换反应)
2 mol —OH→→1mol H2。
确定结构:
C—C—O—H
H
H
H
H
H
H
H
醇的官能团--羟基
CH3CH2OH
乙基
烃的衍生物: 烃分子中的氢原子被
其他原子或原子团所取代而生成的一系
列化合物称为烃的衍生物。
醇的官能团--羟基
实验目的:探究乙醇的化学性质
实验用品:无水乙醇,酸性高锰酸钾溶液,金属钠,铜丝;
试管,试管夹,烧杯,量筒,玻璃片,火柴,小刀,滤纸
实验方案实施:
三、活动 探究
实验方案 实验现象 实验结论
1 向烧杯中加入约2mL无水乙醇,点燃,观察现象
2 向试管中加入2mL酸性KMnO4溶液,滴入数滴无水乙醇,震荡,观察现象。
3 向试管中加入约2mL无水乙醇,取一根光洁的铜丝,置于酒精灯外焰加热,伸入无水乙醇中,反复几次,观察铜丝变化并闻一闻液体的气味
(2)乙醇的氧化反应
①燃烧:优质燃料(清洁,可再生,放出热量多)
②与强氧化剂反应
乙醇还可以与酸性高锰酸钾或重铬酸钾溶液反应,被直接氧化成:乙酸
【实验1】
【实验2】
实 验 现 象
将铜丝在火焰上烧热 铜丝由红色变成黑色
将烧热的铜丝插入无水乙醇中 铜丝由黑色变成红色,反复多次后闻到刺激性气味
【实验3】
2Cu + O2 2CuO
CH3CH2OH + CuO CH3CHO +Cu +H2O
红色变为黑色
黑色变为红色
总式:2CH3CH2OH + O2 2CH3CHO + 2H2O
Cu
O2(燃烧) KMnO4溶液 K2Cr2O7溶液 O2(催化氧化)
CH3CH2OH CO2 CH3COOH CH3COOH CH3CHO
氧化剂的氧化性强弱比较
氧化剂
氧化产物
还原剂
四、不同氧化剂与乙醇反应的产物比较
A
1.乙醇与钠反应时在何处断键;乙醇催化氧化是在何处断键( )
A. ①;①③ B.③;①②
C. ④;①③ D.①;①④
谈谈你有哪些收获?
五、学乙醇知识,长生活见识
课下活动
酿酒工艺的反应原理?
感谢聆听!
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
