2022届高三化学三轮复习 第三单元 金属及其化合物 第1节 钠及其化合物 课件
文档属性
| 名称 | 2022届高三化学三轮复习 第三单元 金属及其化合物 第1节 钠及其化合物 课件 |  | |
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-02 14:33:34 | ||
图片预览









文档简介
(共31张PPT)
第三单元 金属及其化合物
第一节 钠及其化合物
宏观辨识与微观探析:掌握钠的主要性质及其应用
宏观辨识与微观探析:掌握钠的重要化合物的主要性质及其应用
宏观辨识与微观探析:了解钠及其重要化合物的制备方法
核心素养
钠的性质及应用
(★★★)
01
考点互动探究
知识梳理
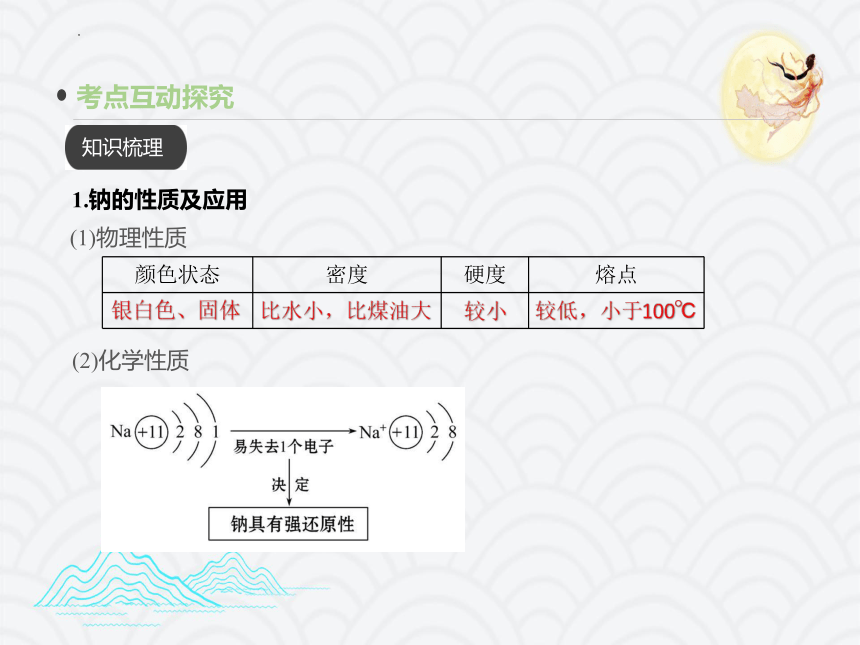
1.钠的性质及应用
(1)物理性质
颜色状态 密度 硬度 熔点
银白色、固体
比水小,比煤油大
较小
较低,小于100℃
(2)化学性质
考点互动探究
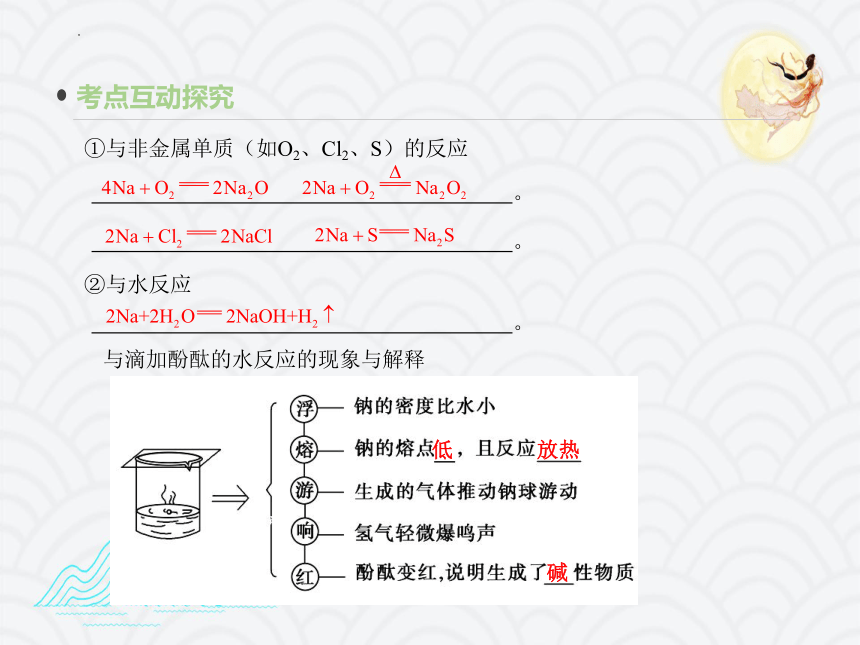
②与水反应
。
①与非金属单质(如O2、Cl2、S)的反应
。
。
与滴加酚酞的水反应的现象与解释
低
放热
碱
考点互动探究
③与酸(如HCl)反应
。
④与盐溶液(如CuSO4溶液)反应
。
(3)工业制备
。
(4)保存
通常保存在 或 中。
拓展:Li是自然界密度最小的金属,化学性质活泼,只能封在石蜡中,若放在煤油中,会浮在表面。
(5)用途
①制取Na2O2等化合物;
②钠、钾合金(液态)可作原子反应堆的导热剂;
③冶炼某些金属,如
④用作电光源,制作高压钠灯。
煤油
石蜡
1.易错易混辨析(正确的画“√”,错误的画“ ”)。
(1)钠着火时,可用泡沫灭火器进行灭火 ( )
(2)钠在空气中与氧气反应,无论生成哪种产物,23 g钠完全反应时转移
电子数肯定为NA ( )
(3)将一小块钠放入乙醇中,产生气泡,可以判断乙醇分子中羟基的活泼
性 ( )
(4)钠与水反应的离子方程式为Na+H2O Na++OH-+H2↑ ( )
(5)电解熔融氯化钠或饱和食盐水都可得到金属钠 ( )
(6)金属钠可保存在煤油中,也可保存在四氯化碳中 ( )
(7)碳或钠与氧气在点燃条件下与不同量的氧气反应时都可生成不同的
产物 ( )
(8)将钠投入FeCl3溶液中,可置换出铁单质 ( )
基础测评
√
基础测评
2.将一小块金属钠分别投入盛有:a.水、b.乙醇、c.稀H2SO4的三个小烧
杯中,反应速率由快到慢的顺序为 (填字母)。解释反应速率不
同的原因: 。
3.金属钠长期露置于空气中,最终得到的白色粉末是什么
c>a>b
钠与水、酸、盐溶液反应的实质都是钠与H+间的反应,H+
浓度的大小决定了反应速率的快慢,由三种物质电离出H+的能力可知H+
浓度的大小顺序为c>a>b,因而反应速率为c>a>b
方法技巧
金属钠与盐或碱溶液反应的思维模板
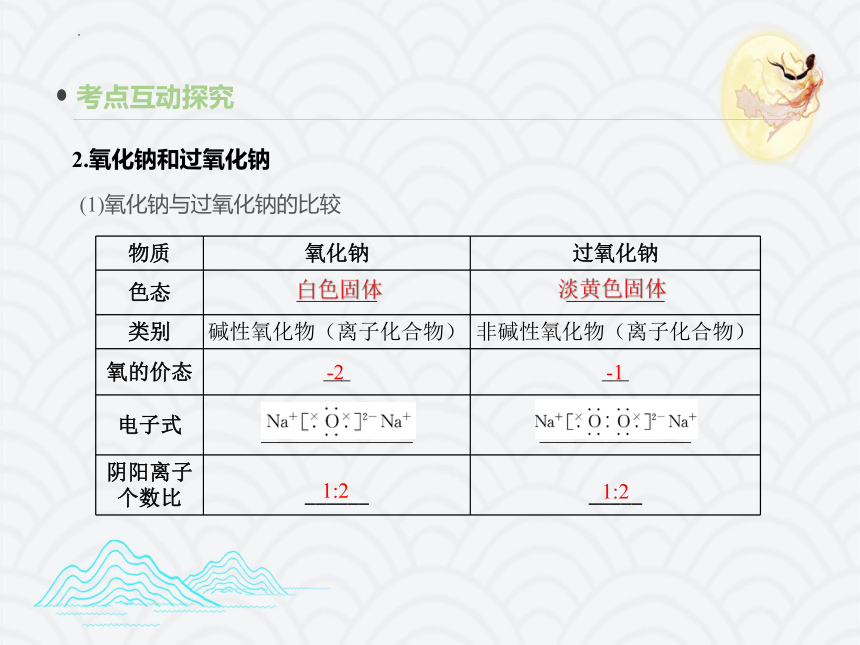
2.氧化钠和过氧化钠
考点互动探究
(1)氧化钠与过氧化钠的比较
物质 氧化钠 过氧化钠
色态 _________ ___________
类别 碱性氧化物(离子化合物) 非碱性氧化物(离子化合物)
氧的价态 ___ ___
电子式 _________________ _________________
阴阳离子个数比 ______ _____
白色固体
淡黄色固体
-2
-1
1:2
1:2
考点互动探究
物质 氧化钠 过氧化钠
与H2O 反应 _________________ ________________________
与CO2 反应 _________________ ________________________
与HCl 反应 _____________________ ____________________________
主要 性质 具有碱性氧化物的通性 具有_________
与品红、石蕊溶液 _____________________ ____________________
用途 —— _____剂、_____剂、消毒剂
Na2O+H2O=2NaOH
2Na2O2+2H2O=4NaOH+O2↑
Na2O+CO2=Na2CO3
2Na2O2+2CO2=2Na2CO3+O2
Na2O+2HCl=2NaCl+H2O
2Na2O2+4HCl=4NaCl+2H2O+O2↑
强氧化性
供氧
漂白
品红不变色,石蕊溶液变蓝
品红因被氧化而褪色;
石蕊溶液先变蓝,后褪色
考点互动探究
(3)Na2O2与CO2、H2O反应的重要关系
考点互动探究
1.易错易混辨析(正确的画“√”,错误的画“ ”)。
(1)氧化钠、过氧化钠都可作供氧剂 ( )
(2)78 g Na2O2中含阴离子的个数是2NA ( )
(3)Na2O2溶于水产生O2的离子方程式为Na2O2+H2O 2Na++2OH-+O2↑
( )
(4)Na2O、Na2O2组成元素相同,与CO2反应产物也相同 ( )
(5)Na2O2与H2O反应时,Na2O2既是还原剂又是氧化剂 ( )
(6)Na2O2在潮湿的空气中放置一段时间,最终产物是NaOH ( )
(7)烧碱和纯碱都属于碱 ( )
(8)Na2O由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气
体和沉淀产生 ( )
基础测评
√
基础测评
2.200 ℃时,11.6 g CO2和H2O的混合气体与足量的Na2O2反应,反应后固
体质量增加了3.6 g,则原混合气体的平均相对分子质量为 ( )
A.5.8 B.11.6 C.23.2 D.46.4
C
基础测评
3.在溶液中加入足量的Na2O2后仍能大量共存的离子组是( )
A.Na+、Fe2+、Cl-、
B.K+、Al 、Cl-、
C.Ca2+、Mg2+、N 、HC
D.Na+、Cl-、C 、S
B
3.碳酸钠 碳酸氢钠
考点互动探究
(1)性质对比
纯碱
小苏打
考点互动探究
2NaCl+H2O+CO2↑
NaCl+H2O+CO2↑
CaCO3↓
CaCO3↓+2NaOH
Na2CO3+H2O
CaCO3↓+Na2CO3+2H2O
考点互动探究
(2)Na2CO3的工业制备——侯氏制碱法
原理:把二氧化碳通入氨的氯化钠饱和溶液中,使溶解度较小的碳酸氢钠从溶液中析出,过滤得到碳酸氢钠晶体,碳酸氢钠受热分解生成碳酸钠。
写出制备过程发生反应的化学方程式:
a._____________________________________;
b. ___________________________。
1.易错易混辨析(正确的画“√”,错误的画“ ”)。
(1)向苏打和小苏打溶液中分别加入盐酸,均冒气泡,说明两者均能与盐
酸反应 ( )
(2)NaHCO3溶液中加入盐酸:C +2H+ CO2↑+H2O ( )
(3)等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成
CO2的体积相同 ( )
(4)侯氏制碱法的工艺流程中应用了物质溶解度的差异 ( )
(5)用酚酞试液不能鉴别饱和食盐水和饱和纯碱溶液 ( )
(6)用加热分解的方法区分碳酸钠和碳酸氢钠两种固体 ( )
(7)Na2CO3溶液中滴入少量盐酸:C +2H+ CO2↑+H2O ( )
(8)将CO2气体通入饱和Na2CO3溶液中无明显现象 ( )
(9)Na2CO3溶液用于洗涤油污原理:C +2H2O H2CO3+2OH-( )
基础测评
√
√
√
2.下列方法不能用于鉴别Na2CO3和NaHCO3固体的是 ( )
A.分别加热两种固体,将放出的气体通入澄清石灰水,观察澄清石灰水
是否变浑浊
B.分别取两种固体溶于水,滴加Ba(OH)2溶液,观察是否生成沉淀
C.分别取两种固体各1 g,滴入几滴水振荡,再加1~2滴酚酚溶液
D.分别取等质量的固体与足量稀盐酸充分反应,加热、蒸干、灼烧称重
基础测评
B
方法技巧
鉴别碳酸钠与碳酸氢钠的方法
4.碱金属元素 焰色反应
考点互动探究
(1)碱金属单质、化合物的相似性与递变性
相似性 递变性(由Li→Cs)
原子 结构 最外层均为1个电子 电子层数逐渐增多
核电荷数逐渐_____
原子半径逐渐_____
元素 性质 都具有较强的金属性,最高正价均为+1价 金属性逐渐_____
单质性质 物理 性质 (除Cs外)都呈银白色,密 度较小,熔、沸点_____ 密度逐渐增大(钾反常),熔、
沸点逐渐_____
化学 性质 都具有较强的还原性 还原性逐渐_____;与O2反应
越来越剧烈,产物越来越复
杂
增大
增大
增强
较低
降低
增强
考点互动探究
(2)焰色反应
①概念:很多金属或他们的化合物在灼烧时会使火焰呈现特殊颜色的现象,属于元素的物理性质。
②操作步骤
③常见元素焰色反应的颜色
钠元素: 色;钾元素: 色(透过蓝色钴玻璃);铜元素: 色
焰色反应的现象只与元素的种类有关,而与元素的状态无关,如Na+、Na的焰色均为黄色。
观察钾的焰色时必须透过蓝色钴玻璃观察,目的是滤去黄光以免产生干扰。
黄
紫
绿
用光洁的铂丝蘸取某无色溶液在无色火焰上灼烧,直接观察到火焰呈黄色,下列各判断正确的是( )
A.只含有Na+
B.一定含有Na+,可能含有K+
C.既含有Na+,又含有K+
D.可能含有Na+,可能还含有K+
基础测评
B
模拟真题演练
1. [2020山西晋中模拟]实验室验证钠能与二氧化碳发生反应的装置如图所示(已知:PdCl2溶液遇CO能产生黑色的Pd),下列说法错误的是( )
A.用装置①还可以制取H2、NH3等气体
B.装置⑤中澄清石灰水变浑浊后,再点燃酒精灯
C.装置②、③中分别盛装饱和Na2CO3溶液、浓H2SO4
D.装置⑥中有黑色沉淀产生,发生的反应是PdCl2+CO+H2O Pd↓+CO2+2HCl
C
模拟真题演练
2. [2019江西上饶中学检测]向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间的关系如图所示。下列判断正确的是( )
A.原NaOH溶液的浓度为0.1 mol/L
B.通入CO2的体积为448 mL(标准状况)
C.所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3
D.所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)= 2∶1
D
模拟真题演练
3.(2020年山东济南模拟,6)利用下列装置模拟“侯氏制碱法”,通过制备的,与饱和食盐水反应先制备NaHCO3。下列说法正确的是( )
A. 实验时装置Ⅰ产生的气体应先通入到装置Ⅳ中
B. 装置Ⅱ中的试剂为浓硫酸
C. 导管口的连接顺序为a e f d c b
D. 实验过程中,装置Ⅳ内会出现浑浊现象
D
模拟真题演练
4.[2020河北衡水第三次模拟]氟化锂(LiF)难溶于水,可用于铝、镁合金的焊剂和钎剂等。以透锂长石(含Li2O、Al2O3、SiO2)为原料制备氟化锂的工艺流程如图所示。
回答下列问题。
(1)滤液1中含有的金属离子为 ,滤渣1的一种用途是 。
Li+、Al3+
制作光导纤维
模拟真题演练
(2)滤渣2是目前应用广泛的无机阻燃剂,写出生成滤渣2的离子方程式:
。常温下,向滤液1中滴加氨水调节pH=5时,溶液中c(Al3+)= mol·L-1,则溶液中Al3+ (填“能”或“不能”)沉淀完全{已知:常温下Ksp[Al(OH)3]=2.0×10-33,且溶液中的离子浓度≤1.0×10-5 mol·L-1时沉淀完全}。
(3)操作Ⅳ包括 、 和干燥。
(4)写出Li2CO3与氢氟酸反应的化学方程式: ,该反应不能在玻璃容器中进行的原因是 (用化学方程式表示)。
(5)Li的焰色是 。
能
Al3++3NH3·H2O Al(OH)3↓+3NH4+
2.0×10-6
过滤
洗涤
Li2CO3+2HF 2LiF↓+CO2↑+H2O
4HF+SiO2 2H2O+SiF4↑
紫红色
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
第三单元 金属及其化合物
第一节 钠及其化合物
宏观辨识与微观探析:掌握钠的主要性质及其应用
宏观辨识与微观探析:掌握钠的重要化合物的主要性质及其应用
宏观辨识与微观探析:了解钠及其重要化合物的制备方法
核心素养
钠的性质及应用
(★★★)
01
考点互动探究
知识梳理
1.钠的性质及应用
(1)物理性质
颜色状态 密度 硬度 熔点
银白色、固体
比水小,比煤油大
较小
较低,小于100℃
(2)化学性质
考点互动探究
②与水反应
。
①与非金属单质(如O2、Cl2、S)的反应
。
。
与滴加酚酞的水反应的现象与解释
低
放热
碱
考点互动探究
③与酸(如HCl)反应
。
④与盐溶液(如CuSO4溶液)反应
。
(3)工业制备
。
(4)保存
通常保存在 或 中。
拓展:Li是自然界密度最小的金属,化学性质活泼,只能封在石蜡中,若放在煤油中,会浮在表面。
(5)用途
①制取Na2O2等化合物;
②钠、钾合金(液态)可作原子反应堆的导热剂;
③冶炼某些金属,如
④用作电光源,制作高压钠灯。
煤油
石蜡
1.易错易混辨析(正确的画“√”,错误的画“ ”)。
(1)钠着火时,可用泡沫灭火器进行灭火 ( )
(2)钠在空气中与氧气反应,无论生成哪种产物,23 g钠完全反应时转移
电子数肯定为NA ( )
(3)将一小块钠放入乙醇中,产生气泡,可以判断乙醇分子中羟基的活泼
性 ( )
(4)钠与水反应的离子方程式为Na+H2O Na++OH-+H2↑ ( )
(5)电解熔融氯化钠或饱和食盐水都可得到金属钠 ( )
(6)金属钠可保存在煤油中,也可保存在四氯化碳中 ( )
(7)碳或钠与氧气在点燃条件下与不同量的氧气反应时都可生成不同的
产物 ( )
(8)将钠投入FeCl3溶液中,可置换出铁单质 ( )
基础测评
√
基础测评
2.将一小块金属钠分别投入盛有:a.水、b.乙醇、c.稀H2SO4的三个小烧
杯中,反应速率由快到慢的顺序为 (填字母)。解释反应速率不
同的原因: 。
3.金属钠长期露置于空气中,最终得到的白色粉末是什么
c>a>b
钠与水、酸、盐溶液反应的实质都是钠与H+间的反应,H+
浓度的大小决定了反应速率的快慢,由三种物质电离出H+的能力可知H+
浓度的大小顺序为c>a>b,因而反应速率为c>a>b
方法技巧
金属钠与盐或碱溶液反应的思维模板
2.氧化钠和过氧化钠
考点互动探究
(1)氧化钠与过氧化钠的比较
物质 氧化钠 过氧化钠
色态 _________ ___________
类别 碱性氧化物(离子化合物) 非碱性氧化物(离子化合物)
氧的价态 ___ ___
电子式 _________________ _________________
阴阳离子个数比 ______ _____
白色固体
淡黄色固体
-2
-1
1:2
1:2
考点互动探究
物质 氧化钠 过氧化钠
与H2O 反应 _________________ ________________________
与CO2 反应 _________________ ________________________
与HCl 反应 _____________________ ____________________________
主要 性质 具有碱性氧化物的通性 具有_________
与品红、石蕊溶液 _____________________ ____________________
用途 —— _____剂、_____剂、消毒剂
Na2O+H2O=2NaOH
2Na2O2+2H2O=4NaOH+O2↑
Na2O+CO2=Na2CO3
2Na2O2+2CO2=2Na2CO3+O2
Na2O+2HCl=2NaCl+H2O
2Na2O2+4HCl=4NaCl+2H2O+O2↑
强氧化性
供氧
漂白
品红不变色,石蕊溶液变蓝
品红因被氧化而褪色;
石蕊溶液先变蓝,后褪色
考点互动探究
(3)Na2O2与CO2、H2O反应的重要关系
考点互动探究
1.易错易混辨析(正确的画“√”,错误的画“ ”)。
(1)氧化钠、过氧化钠都可作供氧剂 ( )
(2)78 g Na2O2中含阴离子的个数是2NA ( )
(3)Na2O2溶于水产生O2的离子方程式为Na2O2+H2O 2Na++2OH-+O2↑
( )
(4)Na2O、Na2O2组成元素相同,与CO2反应产物也相同 ( )
(5)Na2O2与H2O反应时,Na2O2既是还原剂又是氧化剂 ( )
(6)Na2O2在潮湿的空气中放置一段时间,最终产物是NaOH ( )
(7)烧碱和纯碱都属于碱 ( )
(8)Na2O由两种单质直接反应生成,将其加入Ba(HCO3)2溶液中同时有气
体和沉淀产生 ( )
基础测评
√
基础测评
2.200 ℃时,11.6 g CO2和H2O的混合气体与足量的Na2O2反应,反应后固
体质量增加了3.6 g,则原混合气体的平均相对分子质量为 ( )
A.5.8 B.11.6 C.23.2 D.46.4
C
基础测评
3.在溶液中加入足量的Na2O2后仍能大量共存的离子组是( )
A.Na+、Fe2+、Cl-、
B.K+、Al 、Cl-、
C.Ca2+、Mg2+、N 、HC
D.Na+、Cl-、C 、S
B
3.碳酸钠 碳酸氢钠
考点互动探究
(1)性质对比
纯碱
小苏打
考点互动探究
2NaCl+H2O+CO2↑
NaCl+H2O+CO2↑
CaCO3↓
CaCO3↓+2NaOH
Na2CO3+H2O
CaCO3↓+Na2CO3+2H2O
考点互动探究
(2)Na2CO3的工业制备——侯氏制碱法
原理:把二氧化碳通入氨的氯化钠饱和溶液中,使溶解度较小的碳酸氢钠从溶液中析出,过滤得到碳酸氢钠晶体,碳酸氢钠受热分解生成碳酸钠。
写出制备过程发生反应的化学方程式:
a._____________________________________;
b. ___________________________。
1.易错易混辨析(正确的画“√”,错误的画“ ”)。
(1)向苏打和小苏打溶液中分别加入盐酸,均冒气泡,说明两者均能与盐
酸反应 ( )
(2)NaHCO3溶液中加入盐酸:C +2H+ CO2↑+H2O ( )
(3)等质量的NaHCO3和Na2CO3分别与足量盐酸反应,在同温同压下,生成
CO2的体积相同 ( )
(4)侯氏制碱法的工艺流程中应用了物质溶解度的差异 ( )
(5)用酚酞试液不能鉴别饱和食盐水和饱和纯碱溶液 ( )
(6)用加热分解的方法区分碳酸钠和碳酸氢钠两种固体 ( )
(7)Na2CO3溶液中滴入少量盐酸:C +2H+ CO2↑+H2O ( )
(8)将CO2气体通入饱和Na2CO3溶液中无明显现象 ( )
(9)Na2CO3溶液用于洗涤油污原理:C +2H2O H2CO3+2OH-( )
基础测评
√
√
√
2.下列方法不能用于鉴别Na2CO3和NaHCO3固体的是 ( )
A.分别加热两种固体,将放出的气体通入澄清石灰水,观察澄清石灰水
是否变浑浊
B.分别取两种固体溶于水,滴加Ba(OH)2溶液,观察是否生成沉淀
C.分别取两种固体各1 g,滴入几滴水振荡,再加1~2滴酚酚溶液
D.分别取等质量的固体与足量稀盐酸充分反应,加热、蒸干、灼烧称重
基础测评
B
方法技巧
鉴别碳酸钠与碳酸氢钠的方法
4.碱金属元素 焰色反应
考点互动探究
(1)碱金属单质、化合物的相似性与递变性
相似性 递变性(由Li→Cs)
原子 结构 最外层均为1个电子 电子层数逐渐增多
核电荷数逐渐_____
原子半径逐渐_____
元素 性质 都具有较强的金属性,最高正价均为+1价 金属性逐渐_____
单质性质 物理 性质 (除Cs外)都呈银白色,密 度较小,熔、沸点_____ 密度逐渐增大(钾反常),熔、
沸点逐渐_____
化学 性质 都具有较强的还原性 还原性逐渐_____;与O2反应
越来越剧烈,产物越来越复
杂
增大
增大
增强
较低
降低
增强
考点互动探究
(2)焰色反应
①概念:很多金属或他们的化合物在灼烧时会使火焰呈现特殊颜色的现象,属于元素的物理性质。
②操作步骤
③常见元素焰色反应的颜色
钠元素: 色;钾元素: 色(透过蓝色钴玻璃);铜元素: 色
焰色反应的现象只与元素的种类有关,而与元素的状态无关,如Na+、Na的焰色均为黄色。
观察钾的焰色时必须透过蓝色钴玻璃观察,目的是滤去黄光以免产生干扰。
黄
紫
绿
用光洁的铂丝蘸取某无色溶液在无色火焰上灼烧,直接观察到火焰呈黄色,下列各判断正确的是( )
A.只含有Na+
B.一定含有Na+,可能含有K+
C.既含有Na+,又含有K+
D.可能含有Na+,可能还含有K+
基础测评
B
模拟真题演练
1. [2020山西晋中模拟]实验室验证钠能与二氧化碳发生反应的装置如图所示(已知:PdCl2溶液遇CO能产生黑色的Pd),下列说法错误的是( )
A.用装置①还可以制取H2、NH3等气体
B.装置⑤中澄清石灰水变浑浊后,再点燃酒精灯
C.装置②、③中分别盛装饱和Na2CO3溶液、浓H2SO4
D.装置⑥中有黑色沉淀产生,发生的反应是PdCl2+CO+H2O Pd↓+CO2+2HCl
C
模拟真题演练
2. [2019江西上饶中学检测]向100 mL NaOH溶液中通入一定量的CO2气体,充分反应后,再向所得溶液中逐滴加入0.2 mol/L的盐酸,产生CO2的体积与所加盐酸体积之间的关系如图所示。下列判断正确的是( )
A.原NaOH溶液的浓度为0.1 mol/L
B.通入CO2的体积为448 mL(标准状况)
C.所得溶液的溶质成分的物质的量之比为n(NaOH)∶n(Na2CO3)=1∶3
D.所得溶液的溶质成分的物质的量之比为n(NaHCO3)∶n(Na2CO3)= 2∶1
D
模拟真题演练
3.(2020年山东济南模拟,6)利用下列装置模拟“侯氏制碱法”,通过制备的,与饱和食盐水反应先制备NaHCO3。下列说法正确的是( )
A. 实验时装置Ⅰ产生的气体应先通入到装置Ⅳ中
B. 装置Ⅱ中的试剂为浓硫酸
C. 导管口的连接顺序为a e f d c b
D. 实验过程中,装置Ⅳ内会出现浑浊现象
D
模拟真题演练
4.[2020河北衡水第三次模拟]氟化锂(LiF)难溶于水,可用于铝、镁合金的焊剂和钎剂等。以透锂长石(含Li2O、Al2O3、SiO2)为原料制备氟化锂的工艺流程如图所示。
回答下列问题。
(1)滤液1中含有的金属离子为 ,滤渣1的一种用途是 。
Li+、Al3+
制作光导纤维
模拟真题演练
(2)滤渣2是目前应用广泛的无机阻燃剂,写出生成滤渣2的离子方程式:
。常温下,向滤液1中滴加氨水调节pH=5时,溶液中c(Al3+)= mol·L-1,则溶液中Al3+ (填“能”或“不能”)沉淀完全{已知:常温下Ksp[Al(OH)3]=2.0×10-33,且溶液中的离子浓度≤1.0×10-5 mol·L-1时沉淀完全}。
(3)操作Ⅳ包括 、 和干燥。
(4)写出Li2CO3与氢氟酸反应的化学方程式: ,该反应不能在玻璃容器中进行的原因是 (用化学方程式表示)。
(5)Li的焰色是 。
能
Al3++3NH3·H2O Al(OH)3↓+3NH4+
2.0×10-6
过滤
洗涤
Li2CO3+2HF 2LiF↓+CO2↑+H2O
4HF+SiO2 2H2O+SiF4↑
紫红色
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
同课章节目录
