2022高考三轮复习 第三单元 金属及其化合物 第3节 铁及其化合物 课件
文档属性
| 名称 | 2022高考三轮复习 第三单元 金属及其化合物 第3节 铁及其化合物 课件 |  | |
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-02 14:36:25 | ||
图片预览








文档简介
(共33张PPT)
第三单元 金属及其化合物
第三节 铁及其化合物
宏观辨识与微观探析:掌握铁及其重要化合物的主要性质及其应用。
宏观辨识与微观探析:了解铁及其重要化合物的制备方法。
核心素养
铁的性质
(★★★)
01
考点互动探究
知识梳理
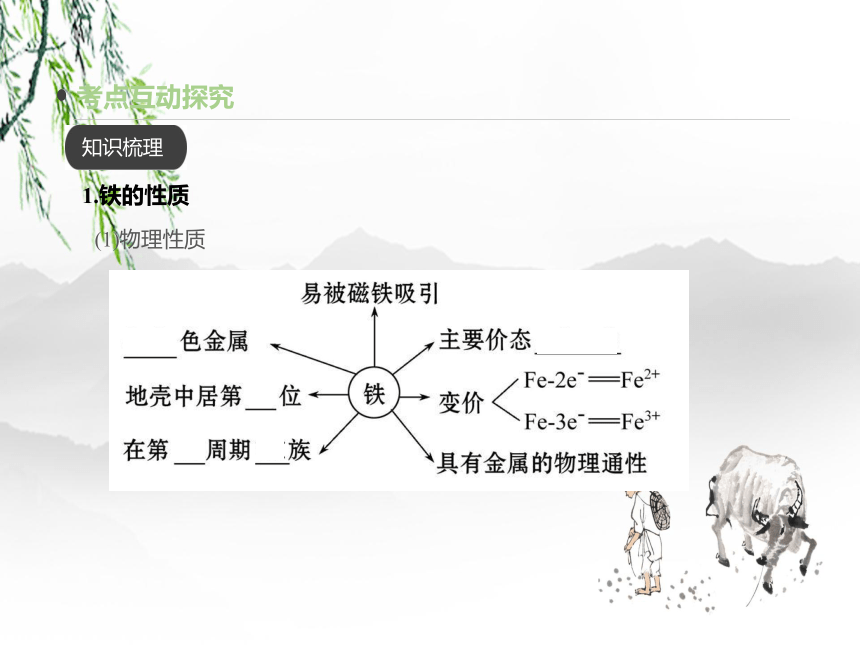
1.铁的性质
(1)物理性质
考点互动探究
知识理
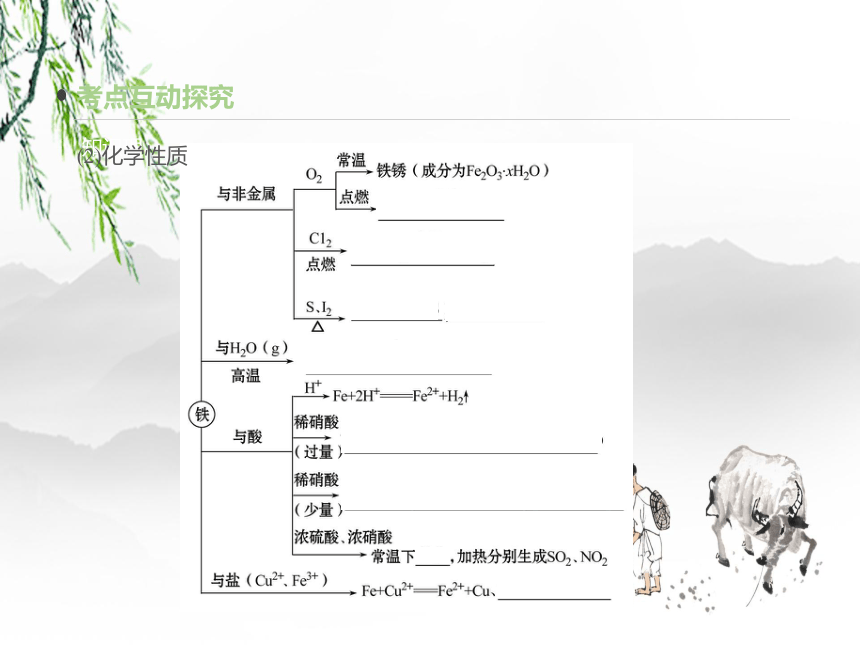
(2)化学性质
考点互动探究
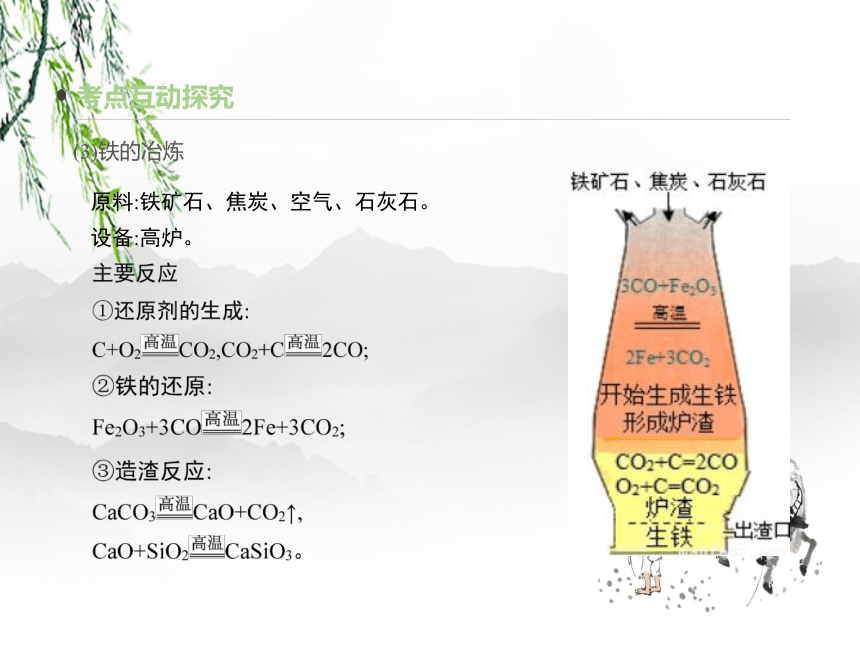
(3)铁的冶炼
原料:铁矿石、焦炭、空气、石灰石。
设备:高炉。
铁的氧化物
(★★)
02
考点互动探究
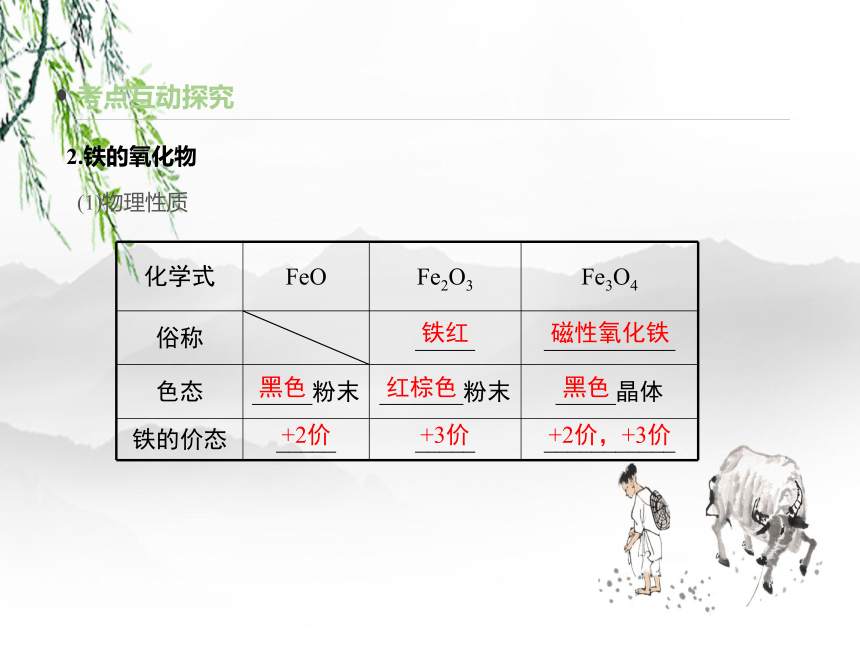
2.铁的氧化物
(1)物理性质
化学式 FeO Fe2O3 Fe3O4
俗称 _____ ___________
色态 _____粉末 _______粉末 _____晶体
铁的价态 _____ _____ ___________
铁红
磁性氧化铁
黑色
红棕色
黑色
+2价
+3价
+2价,+3价
考点互动探究
(2)化学性质
铁的氢氧化物
(★★★)
03
考点互动探究
3.铁的氢氧化物
白色固体
红褐色固体
灰绿
红褐
Fe2O3+3H2O
Fe(OH)3↓
铁盐和亚铁盐
(★★★★)
04
考点互动探究
4.铁盐和亚铁盐的性质
(1)亚铁盐
考点互动探究
(2)铁盐
考点互动探究
(3)Fe2+和Fe3+的检验和相互转化
考点互动探究
考点互动探究
考点互动探究
(4)“铁三角”的转化关系
考点互动探究
应用
①判断离子能否共存
②盐溶液的配制与保存
考点互动探究
③除杂方面
主要物质 少量杂质 除杂方法
Fe2+ Fe3+ 加过量铁屑后过滤
FeCl3 FeCl2 加氯水或H2O2
Fe2+ Cu2+ 加过量铁屑后过滤
Fe Al 加过量强碱溶液后过滤
Fe2O3 Al2O3、SiO2 加过量强碱溶液后过滤
基础测评
1.易错易混辨析(正确的画“√”,错误的画“ ”)。
(1)铁位于元素周期表中第四周期ⅧB族 ( )
(2)氧化铁能与酸反应,所以可用于制作红色染料 ( )
(3)铁的化学性质比较活泼,所以铁在自然界中全部以化合态存在 ( )
(4)用铁制容器可以运输浓硝酸和浓硫酸 ( )
(5)Fe2O3与NaOH溶液反应可制取Fe(OH)3 ( )
(6)铁与过量的碘蒸气共热产物是FeI3 ( )
(7)Fe在足量Cl2中燃烧生成FeCl3,在少量Cl2中燃烧生成FeCl2 ( )
(8)蒸干FeCl3溶液可获得FeCl3晶体 ( )
√
基础测评
(9)向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+ 2Fe(OH)3+3Mg2+
( )
(10)向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液呈血红色,
该溶液中一定含Fe2+ ( )
(11)在氢氧化铁胶体中下列离子能大量共存:H+、K+、 、Br- ( )
(12)因为Fe3+具有氧化性,所以用KSCN溶液可以鉴别Fe3+ ( )
(13)除去MgCl2溶液中的Fe3+,可向混合液中加入MgCO3( )
(14)在pH=7的溶液中Cl-、Na+、Fe3+可大量共存 ( )
(15)16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA ( )
(16)100 mL 1 mol·L-1 FeCl3溶液中所含Fe3+的数目为0.1NA ( )
√
√
√
基础测评
(17)0.1 mol·L-1 Fe2(SO4)3溶液中:Cu2+、NH4+、NO3-、SO42-大量共存 ( )
(18)向FeCl2溶液中滴加NH4SCN溶液,溶液显红色( )
(19)Cu与FeCl3溶液反应可生成CuCl2 ( )
(20)向2 ml 0.1 mol·L-1的FeCl3溶液中加足量铁粉,振荡,黄色逐渐消失,加1滴KSCN溶液,溶液颜色不变,证明还原性:Fe>Fe2+ ( )
(21)Fe FeCl2 Fe(OH)2各步转化都能实现 ( )
(22)FeCl3溶液腐蚀Cu刻制印刷电路板是由于铁比铜的金属性强 ( )
√
√
√
基础测评
2.按要求完成下列离子方程式:
(1)Fe3O4与稀HNO3反应: 。
(2)FeCl3溶液中滴入KSCN溶液: 。
(3)FeCl3溶液腐蚀铜电路板: 。
(4)由FeCl2溶液通过化合反应制FeCl3: 。
(5)足量的铁屑与少量稀硝酸反应: 。
(6)FeO与稀硝酸的反应: 。
(7)Fe(OH)2与稀硝酸的反应: 。
(8)Fe(OH)3与HI溶液的反应(HI是强酸): 。
基础测评
3.下列各图示中能较长时间看到Fe(OH)2白色沉淀的是 ( )
A.①②③④ B.①②③⑤ C.②③④⑤ D.全部
B
基础测评
4.如下图所示,此装置可用来制取和观察Fe(OH)2在空气中被氧化的颜
色变化。实验时必须使用铁屑和6 mol·L-1的硫酸,其他试剂任选。填写
下列空白:
基础测评
(1)B中盛有一定量的NaOH溶液,A中应预先加入的药品是 。A
中反应的离子方程式是 。
(2)实验开始时先将止水夹a (填“打开”或“关闭”)。
(3)简述生成Fe(OH)2的操作过程:
。
(4)实验完毕,打开b处止水夹,放入一部分空气,此时B瓶中发生的反应为
。
铁屑
打开
待A装置反应一段时间后关闭止水夹
a,将FeSO4溶液压入B中进行反应
基础测评
5.混合溶液中Fe3+、Fe2+除去的常用方法
(1)除去Mg2+中混有的Fe3+的方法
向混合溶液中加入 、 、 中之一,与Fe3+水解产生的H+反应,促进Fe3+的水解,将Fe3+转化为Fe(OH)3沉淀除去。
(2)除去Cu2+中混有的Fe3+的方法
向混合溶液中加入 、 、 、 中之一,与Fe3+水解产生的H+反应,促进Fe3+的水解,将Fe3+转化为Fe(OH)3沉淀而除去。
(3)除去Mg2+中混有的Fe2+的方法
先加入氧化剂(如 )将溶液中的Fe2+氧化成Fe3+,然后再按(1)的方法除去溶液中的Fe3+。
(4)除去Cu2+中混有的Fe2+的方法
先加入氧化剂(如 )将溶液中的Fe2+氧化成Fe3+,然后再按(2)的方法除去溶液中的Fe3+。
MgO
MgCO3
Mg(OH)2
CuO
CuCO3
Cu(OH)2
Cu2(OH)2CO3
H2O2
H2O2
真题演练
1.【2021年广东卷,10】部分含铁物质的分类与相应化合价关系如图2所示。下列推断不合理的是( )
A.a可与e反应生成b
B.b既可被氧化,也可被还原
C.可将e加入浓碱液中制得d的胶体
D.可存在b→c→d→e→b的循环转化关系
C
2.【2021年江苏卷,4】下列有关物质的性质与用途不具有对应关系的是( )
A.铁粉能与O2反应,可用作食品保存的吸氧剂
B.纳米Fe3O4能与酸反应,可用作铁磁性材料
C.FeCl3具有氧化性,可用于腐蚀印刷电路板上的Cu
D.聚合硫酸铁能水解并形成胶体,可用于净水
B
真题演练
真题演练
3.【2021年福建卷,4】明代《徐光启手迹》记载了制备硝酸的方法,其主要流程(部分产物已省略)如下:
下列说法错误是( )
A.的分解产物X为FeO B. 本流程涉及复分解反应
C. 的沸点比的低 D. 制备使用的铁锅易损坏
A
真题演练
4.【2021年海南卷,15】无水常作为芳烃氯代反应的催化剂。某研究小组设计了如下流程,以废铁屑(含有少量碳和杂质)为原料制备无水。
已知:氯化亚砜( )熔点-101℃,沸点76℃,易水解。
回答问题:
(1)操作①是过滤,用到的玻璃仪器有烧杯、玻璃棒和________。
漏斗
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
第三单元 金属及其化合物
第三节 铁及其化合物
宏观辨识与微观探析:掌握铁及其重要化合物的主要性质及其应用。
宏观辨识与微观探析:了解铁及其重要化合物的制备方法。
核心素养
铁的性质
(★★★)
01
考点互动探究
知识梳理
1.铁的性质
(1)物理性质
考点互动探究
知识理
(2)化学性质
考点互动探究
(3)铁的冶炼
原料:铁矿石、焦炭、空气、石灰石。
设备:高炉。
铁的氧化物
(★★)
02
考点互动探究
2.铁的氧化物
(1)物理性质
化学式 FeO Fe2O3 Fe3O4
俗称 _____ ___________
色态 _____粉末 _______粉末 _____晶体
铁的价态 _____ _____ ___________
铁红
磁性氧化铁
黑色
红棕色
黑色
+2价
+3价
+2价,+3价
考点互动探究
(2)化学性质
铁的氢氧化物
(★★★)
03
考点互动探究
3.铁的氢氧化物
白色固体
红褐色固体
灰绿
红褐
Fe2O3+3H2O
Fe(OH)3↓
铁盐和亚铁盐
(★★★★)
04
考点互动探究
4.铁盐和亚铁盐的性质
(1)亚铁盐
考点互动探究
(2)铁盐
考点互动探究
(3)Fe2+和Fe3+的检验和相互转化
考点互动探究
考点互动探究
考点互动探究
(4)“铁三角”的转化关系
考点互动探究
应用
①判断离子能否共存
②盐溶液的配制与保存
考点互动探究
③除杂方面
主要物质 少量杂质 除杂方法
Fe2+ Fe3+ 加过量铁屑后过滤
FeCl3 FeCl2 加氯水或H2O2
Fe2+ Cu2+ 加过量铁屑后过滤
Fe Al 加过量强碱溶液后过滤
Fe2O3 Al2O3、SiO2 加过量强碱溶液后过滤
基础测评
1.易错易混辨析(正确的画“√”,错误的画“ ”)。
(1)铁位于元素周期表中第四周期ⅧB族 ( )
(2)氧化铁能与酸反应,所以可用于制作红色染料 ( )
(3)铁的化学性质比较活泼,所以铁在自然界中全部以化合态存在 ( )
(4)用铁制容器可以运输浓硝酸和浓硫酸 ( )
(5)Fe2O3与NaOH溶液反应可制取Fe(OH)3 ( )
(6)铁与过量的碘蒸气共热产物是FeI3 ( )
(7)Fe在足量Cl2中燃烧生成FeCl3,在少量Cl2中燃烧生成FeCl2 ( )
(8)蒸干FeCl3溶液可获得FeCl3晶体 ( )
√
基础测评
(9)向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+ 2Fe(OH)3+3Mg2+
( )
(10)向某溶液中滴加KSCN溶液,溶液不变色,滴加氯水后溶液呈血红色,
该溶液中一定含Fe2+ ( )
(11)在氢氧化铁胶体中下列离子能大量共存:H+、K+、 、Br- ( )
(12)因为Fe3+具有氧化性,所以用KSCN溶液可以鉴别Fe3+ ( )
(13)除去MgCl2溶液中的Fe3+,可向混合液中加入MgCO3( )
(14)在pH=7的溶液中Cl-、Na+、Fe3+可大量共存 ( )
(15)16.25 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.1NA ( )
(16)100 mL 1 mol·L-1 FeCl3溶液中所含Fe3+的数目为0.1NA ( )
√
√
√
基础测评
(17)0.1 mol·L-1 Fe2(SO4)3溶液中:Cu2+、NH4+、NO3-、SO42-大量共存 ( )
(18)向FeCl2溶液中滴加NH4SCN溶液,溶液显红色( )
(19)Cu与FeCl3溶液反应可生成CuCl2 ( )
(20)向2 ml 0.1 mol·L-1的FeCl3溶液中加足量铁粉,振荡,黄色逐渐消失,加1滴KSCN溶液,溶液颜色不变,证明还原性:Fe>Fe2+ ( )
(21)Fe FeCl2 Fe(OH)2各步转化都能实现 ( )
(22)FeCl3溶液腐蚀Cu刻制印刷电路板是由于铁比铜的金属性强 ( )
√
√
√
基础测评
2.按要求完成下列离子方程式:
(1)Fe3O4与稀HNO3反应: 。
(2)FeCl3溶液中滴入KSCN溶液: 。
(3)FeCl3溶液腐蚀铜电路板: 。
(4)由FeCl2溶液通过化合反应制FeCl3: 。
(5)足量的铁屑与少量稀硝酸反应: 。
(6)FeO与稀硝酸的反应: 。
(7)Fe(OH)2与稀硝酸的反应: 。
(8)Fe(OH)3与HI溶液的反应(HI是强酸): 。
基础测评
3.下列各图示中能较长时间看到Fe(OH)2白色沉淀的是 ( )
A.①②③④ B.①②③⑤ C.②③④⑤ D.全部
B
基础测评
4.如下图所示,此装置可用来制取和观察Fe(OH)2在空气中被氧化的颜
色变化。实验时必须使用铁屑和6 mol·L-1的硫酸,其他试剂任选。填写
下列空白:
基础测评
(1)B中盛有一定量的NaOH溶液,A中应预先加入的药品是 。A
中反应的离子方程式是 。
(2)实验开始时先将止水夹a (填“打开”或“关闭”)。
(3)简述生成Fe(OH)2的操作过程:
。
(4)实验完毕,打开b处止水夹,放入一部分空气,此时B瓶中发生的反应为
。
铁屑
打开
待A装置反应一段时间后关闭止水夹
a,将FeSO4溶液压入B中进行反应
基础测评
5.混合溶液中Fe3+、Fe2+除去的常用方法
(1)除去Mg2+中混有的Fe3+的方法
向混合溶液中加入 、 、 中之一,与Fe3+水解产生的H+反应,促进Fe3+的水解,将Fe3+转化为Fe(OH)3沉淀除去。
(2)除去Cu2+中混有的Fe3+的方法
向混合溶液中加入 、 、 、 中之一,与Fe3+水解产生的H+反应,促进Fe3+的水解,将Fe3+转化为Fe(OH)3沉淀而除去。
(3)除去Mg2+中混有的Fe2+的方法
先加入氧化剂(如 )将溶液中的Fe2+氧化成Fe3+,然后再按(1)的方法除去溶液中的Fe3+。
(4)除去Cu2+中混有的Fe2+的方法
先加入氧化剂(如 )将溶液中的Fe2+氧化成Fe3+,然后再按(2)的方法除去溶液中的Fe3+。
MgO
MgCO3
Mg(OH)2
CuO
CuCO3
Cu(OH)2
Cu2(OH)2CO3
H2O2
H2O2
真题演练
1.【2021年广东卷,10】部分含铁物质的分类与相应化合价关系如图2所示。下列推断不合理的是( )
A.a可与e反应生成b
B.b既可被氧化,也可被还原
C.可将e加入浓碱液中制得d的胶体
D.可存在b→c→d→e→b的循环转化关系
C
2.【2021年江苏卷,4】下列有关物质的性质与用途不具有对应关系的是( )
A.铁粉能与O2反应,可用作食品保存的吸氧剂
B.纳米Fe3O4能与酸反应,可用作铁磁性材料
C.FeCl3具有氧化性,可用于腐蚀印刷电路板上的Cu
D.聚合硫酸铁能水解并形成胶体,可用于净水
B
真题演练
真题演练
3.【2021年福建卷,4】明代《徐光启手迹》记载了制备硝酸的方法,其主要流程(部分产物已省略)如下:
下列说法错误是( )
A.的分解产物X为FeO B. 本流程涉及复分解反应
C. 的沸点比的低 D. 制备使用的铁锅易损坏
A
真题演练
4.【2021年海南卷,15】无水常作为芳烃氯代反应的催化剂。某研究小组设计了如下流程,以废铁屑(含有少量碳和杂质)为原料制备无水。
已知:氯化亚砜( )熔点-101℃,沸点76℃,易水解。
回答问题:
(1)操作①是过滤,用到的玻璃仪器有烧杯、玻璃棒和________。
漏斗
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
同课章节目录
