第二章第二节 分子的立体结构1.1
文档属性
| 名称 | 第二章第二节 分子的立体结构1.1 |  | |
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-05-07 18:46:35 | ||
图片预览



文档简介
课件25张PPT。新课标人教版选修三物质结构与性质第二章 分子结构与性质第二节分子的立体结构
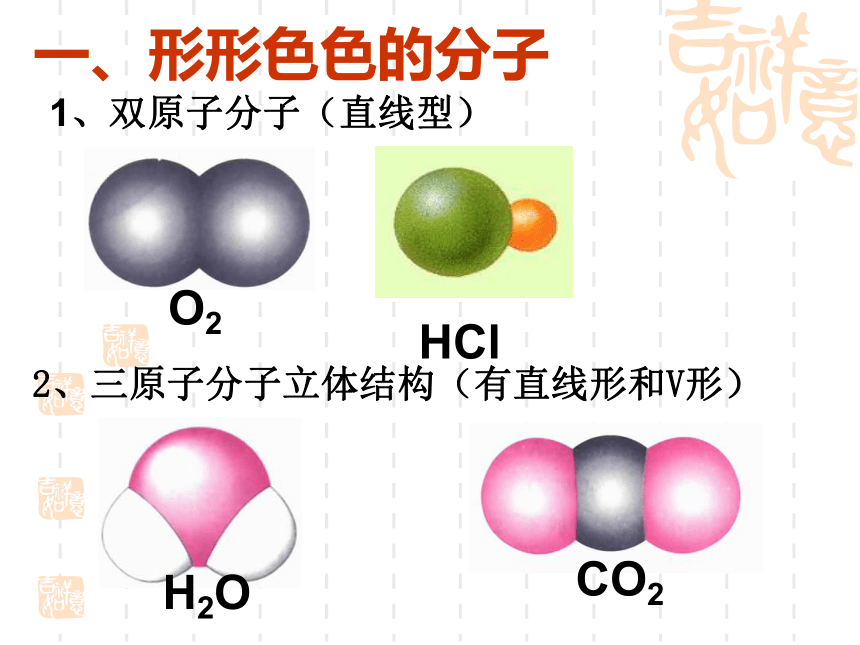
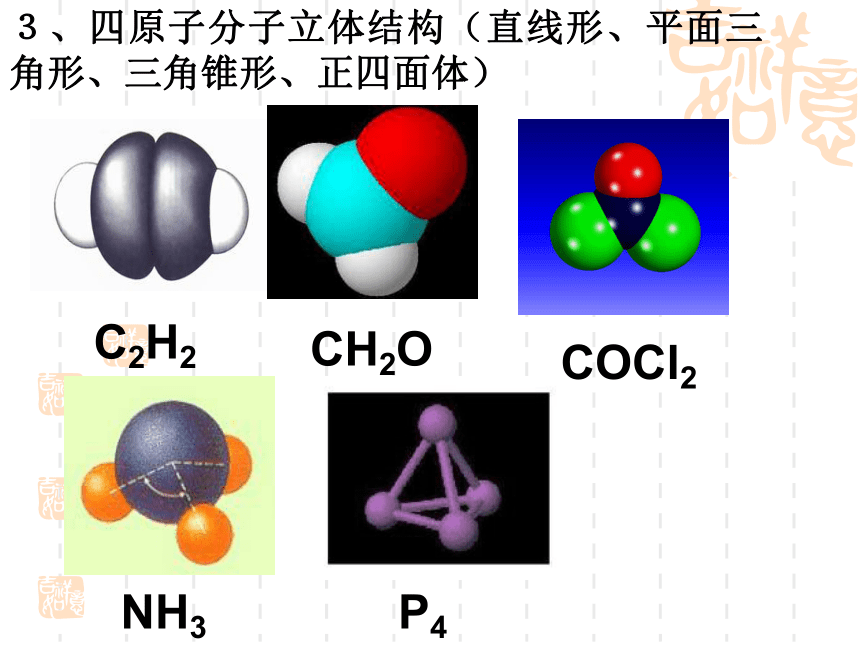
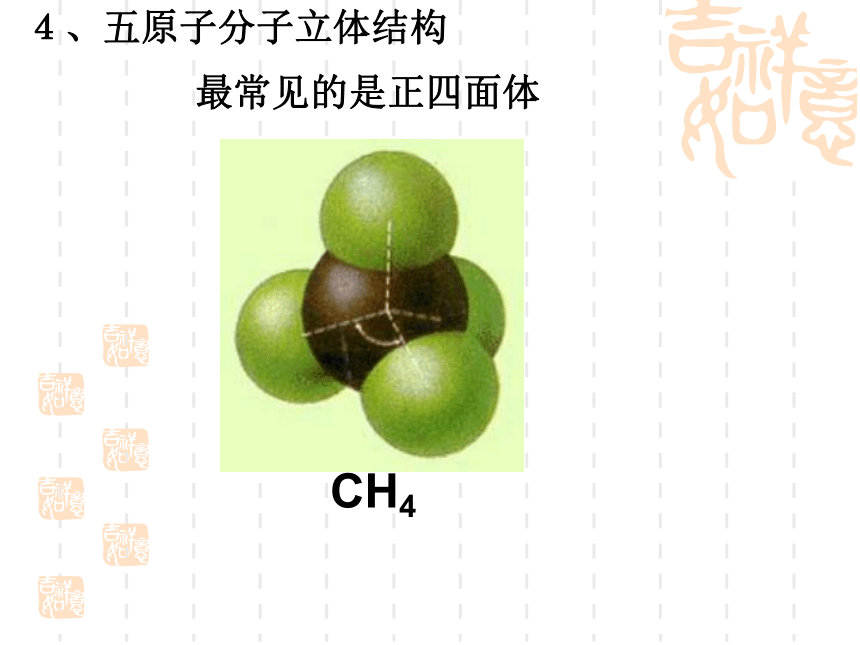
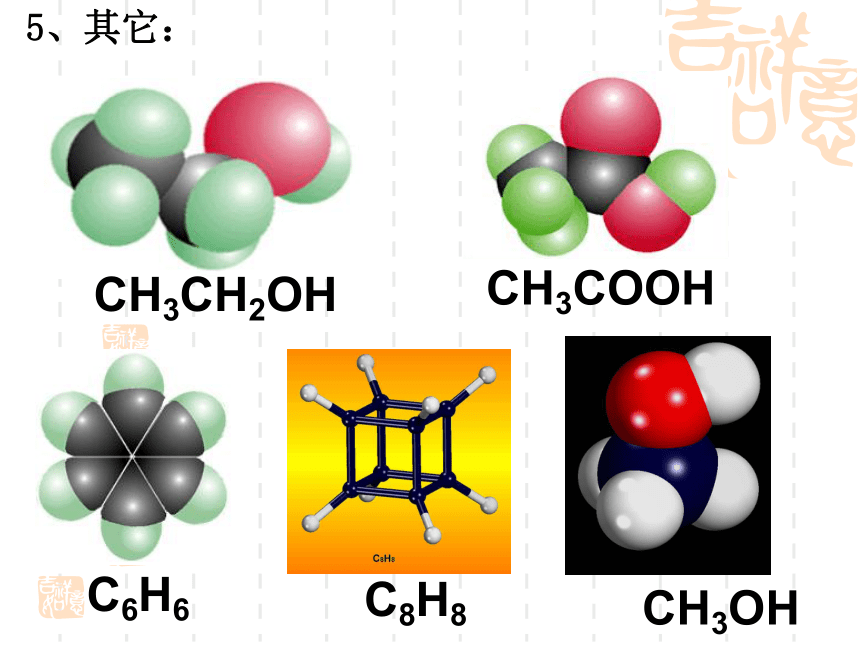
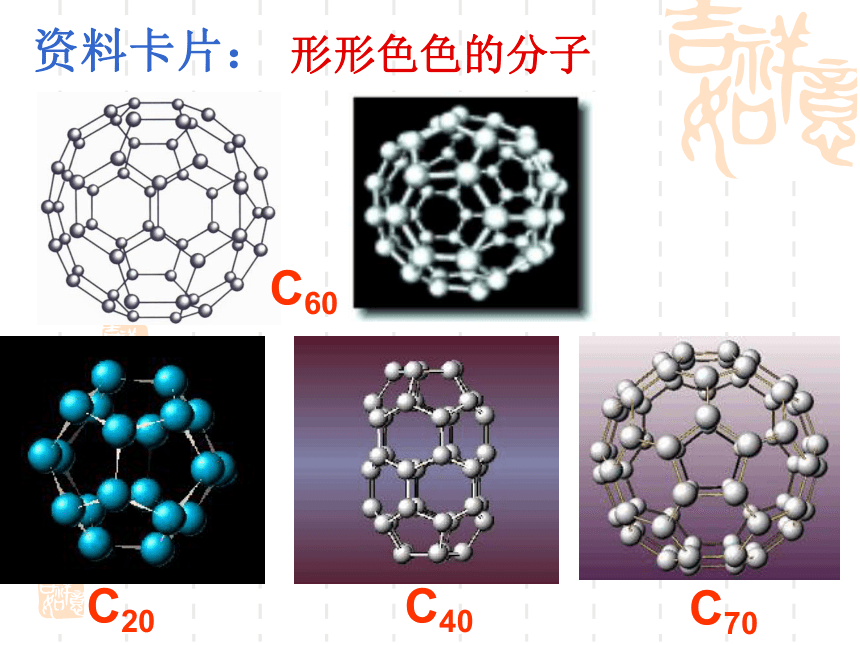
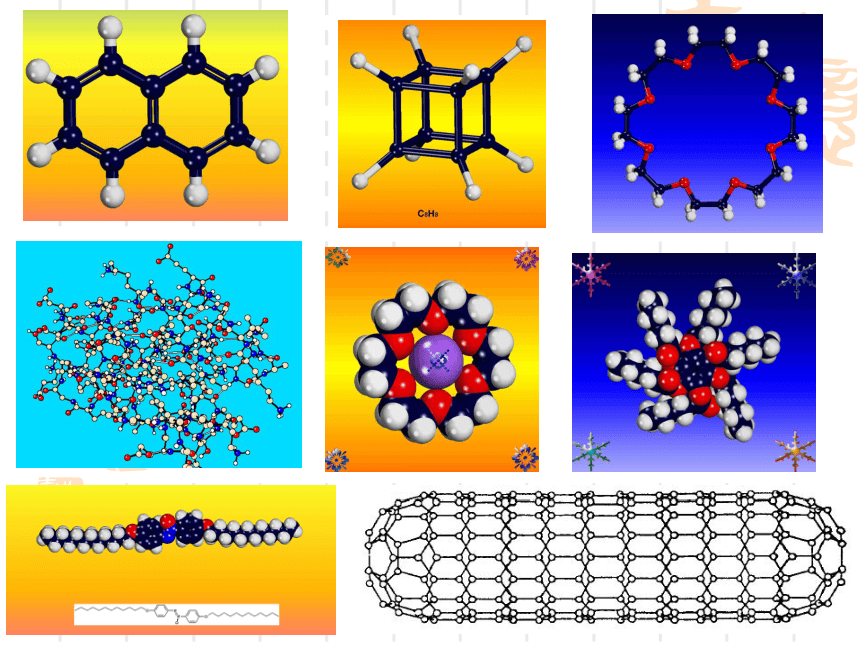
(第一课时)复 习 回 顾共价键σ键π键键参数键能键长键角衡量化学键稳定性描述分子的立体结构的重要因素成键方式 “头碰头”,呈轴对称成键方式 “肩并肩”,呈镜像对称一、形形色色的分子O2HClH2OCO21、双原子分子(直线型)2、三原子分子立体结构(有直线形和V形)3、四原子分子立体结构(直线形、平面三角形、三角锥形、正四面体)(平面三角形,三角锥形)C2H2CH2OCOCl2NH3P44、五原子分子立体结构最常见的是正四面体CH4CH3CH2OHCH3COOHC6H6C8H8CH3OH5、其它:C60C20C40C70资料卡片:形形色色的分子分子世界如此形形色色,异彩纷呈,美不胜收,常使人流连忘返。
那么分子结构又是怎么测定的呢?早年的科学家主要靠对物质的宏观性质进行系统总结得出规律后进行推测,如今,科学家已经创造了许许多多测定分子结构的现代仪器,红外光谱就是其中的一种。
分子中的原子不是固定不动的,而是不断地振动着的。所谓分子立体结构其实只是分子中的原子处于平衡位置时的模型。当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,再记录到图谱上呈现吸收峰。通过计算机模拟,可以得知各吸收峰是由哪一个化学键、哪种振动方式引起的,综合这些信息,可分析出分子的立体结构。
科学视野—分子的立体结构是怎样测定的?
(指导阅读P39)测分子体结构:红外光谱仪→吸收峰→分析。
同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因?思考:直线形V形 同为四原子分子,CH2O与 NH3 分子的的空间结构也不同,什么原因?思考:三角锥形平面三角形(VSEPR models)二、价层电子对互斥模型 1、一类是中心原子上的价电子都用于形成共价键,如CO2、CH2O、CH4等分子中的碳原子,它们的立体结构可用中心原子周围的原子数n来预测,概括如下:
ABn 立体结构 范例
n=2 直线形 CO2、 CS2
n=3 平面三角形 CH2O、BF3
n=4 正四面体形 CH4、 CCl4
n=5 三角双锥形 PCl5
n=6 正八面体形 SCl6
O=C=O无无无直线形 平面
三角形 正
四面体2、另一类是中心原子上有孤对电子(未用于形成共价键的电子对)的分子。 ABn 立体结构 范例
n=2 V形 H2O
n=3 三角锥形 NH3
原因:
中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥。例如,H2O和NH3的中心原子分别有2对和l对孤对电子,跟中心原子周围的σ键加起来都是4,它们相互排斥,形成四面体,因而H2O分子呈V形,NH3分子呈三角锥形。直线形平面三角形正四面体V 形三角锥形小结:价层电子对互斥模型应用反馈:0120100022233444直线形 V 形V形平面三角形三角锥形四面体正四面体正四面体课堂练习1.下列物质中,分子的立体结构与水分子相似的是 ( )
A.CO2 B.H2S C.PCl3 D.SiCl4
2.下列分子的立体结构,其中属于直线型分子的是 ( )
A.H2O B.CO2 C.C2H2 D.P4BBC3.若ABn型分子的中心原子A上没有未用于形成共价键的孤对电子,运用价层电子对互斥模型,下列说法正确的( )
A.若n=2,则分子的立体构型为V形
B.若n=3,则分子的立体构型为三角锥形
C.若n=4,则分子的立体构型为正四面体形
D.以上说法都不正确课堂练习C美国著名化学家鲍林(L.Pauling, 1901—1994)教授具有独特的化学想象力:只要给他物质的分子式,他就能通过“毛估”法,大体上想象出这种物质的分子结构模型。请你根据价层电子对互斥理论,“毛估”出下列分子的空间构型。
PCl5
PCl3
SO3
SiCl4 课堂练习三角双锥形三角锥形平面三角形正四面体谢谢!2019年1月19日星期六
(第一课时)复 习 回 顾共价键σ键π键键参数键能键长键角衡量化学键稳定性描述分子的立体结构的重要因素成键方式 “头碰头”,呈轴对称成键方式 “肩并肩”,呈镜像对称一、形形色色的分子O2HClH2OCO21、双原子分子(直线型)2、三原子分子立体结构(有直线形和V形)3、四原子分子立体结构(直线形、平面三角形、三角锥形、正四面体)(平面三角形,三角锥形)C2H2CH2OCOCl2NH3P44、五原子分子立体结构最常见的是正四面体CH4CH3CH2OHCH3COOHC6H6C8H8CH3OH5、其它:C60C20C40C70资料卡片:形形色色的分子分子世界如此形形色色,异彩纷呈,美不胜收,常使人流连忘返。
那么分子结构又是怎么测定的呢?早年的科学家主要靠对物质的宏观性质进行系统总结得出规律后进行推测,如今,科学家已经创造了许许多多测定分子结构的现代仪器,红外光谱就是其中的一种。
分子中的原子不是固定不动的,而是不断地振动着的。所谓分子立体结构其实只是分子中的原子处于平衡位置时的模型。当一束红外线透过分子时,分子会吸收跟它的某些化学键的振动频率相同的红外线,再记录到图谱上呈现吸收峰。通过计算机模拟,可以得知各吸收峰是由哪一个化学键、哪种振动方式引起的,综合这些信息,可分析出分子的立体结构。
科学视野—分子的立体结构是怎样测定的?
(指导阅读P39)测分子体结构:红外光谱仪→吸收峰→分析。
同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因?思考:直线形V形 同为四原子分子,CH2O与 NH3 分子的的空间结构也不同,什么原因?思考:三角锥形平面三角形(VSEPR models)二、价层电子对互斥模型 1、一类是中心原子上的价电子都用于形成共价键,如CO2、CH2O、CH4等分子中的碳原子,它们的立体结构可用中心原子周围的原子数n来预测,概括如下:
ABn 立体结构 范例
n=2 直线形 CO2、 CS2
n=3 平面三角形 CH2O、BF3
n=4 正四面体形 CH4、 CCl4
n=5 三角双锥形 PCl5
n=6 正八面体形 SCl6
O=C=O无无无直线形 平面
三角形 正
四面体2、另一类是中心原子上有孤对电子(未用于形成共价键的电子对)的分子。 ABn 立体结构 范例
n=2 V形 H2O
n=3 三角锥形 NH3
原因:
中心原子上的孤对电子也要占据中心原子周围的空间,并参与互相排斥。例如,H2O和NH3的中心原子分别有2对和l对孤对电子,跟中心原子周围的σ键加起来都是4,它们相互排斥,形成四面体,因而H2O分子呈V形,NH3分子呈三角锥形。直线形平面三角形正四面体V 形三角锥形小结:价层电子对互斥模型应用反馈:0120100022233444直线形 V 形V形平面三角形三角锥形四面体正四面体正四面体课堂练习1.下列物质中,分子的立体结构与水分子相似的是 ( )
A.CO2 B.H2S C.PCl3 D.SiCl4
2.下列分子的立体结构,其中属于直线型分子的是 ( )
A.H2O B.CO2 C.C2H2 D.P4BBC3.若ABn型分子的中心原子A上没有未用于形成共价键的孤对电子,运用价层电子对互斥模型,下列说法正确的( )
A.若n=2,则分子的立体构型为V形
B.若n=3,则分子的立体构型为三角锥形
C.若n=4,则分子的立体构型为正四面体形
D.以上说法都不正确课堂练习C美国著名化学家鲍林(L.Pauling, 1901—1994)教授具有独特的化学想象力:只要给他物质的分子式,他就能通过“毛估”法,大体上想象出这种物质的分子结构模型。请你根据价层电子对互斥理论,“毛估”出下列分子的空间构型。
PCl5
PCl3
SO3
SiCl4 课堂练习三角双锥形三角锥形平面三角形正四面体谢谢!2019年1月19日星期六
