第二节杂化轨道理论与分子几何构型
文档属性
| 名称 | 第二节杂化轨道理论与分子几何构型 |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-05-07 18:55:58 | ||
图片预览




文档简介
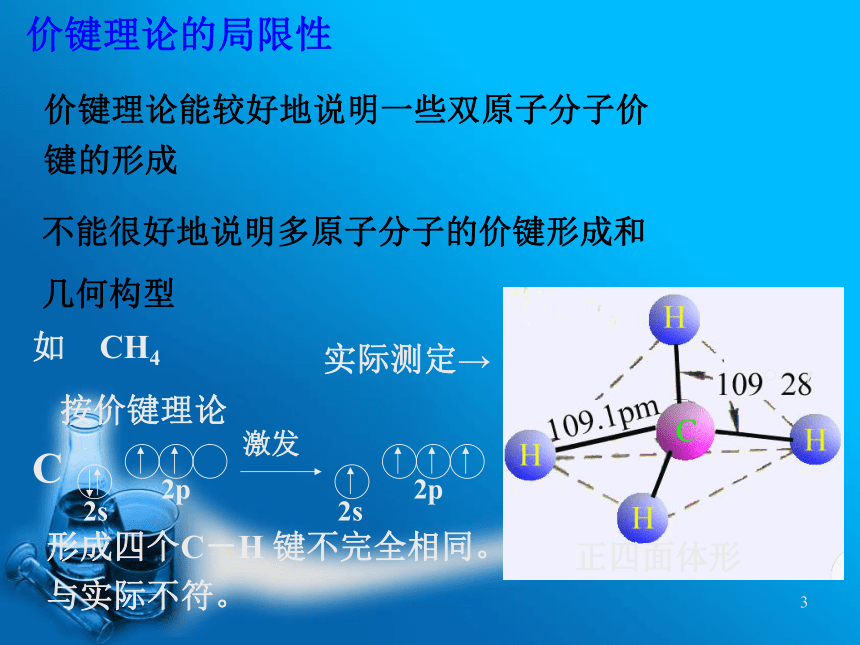
课件15张PPT。第二节杂化轨道理论与分子几何构型教学要求:本节重点:本节难点: 杂化轨道理论的基本要点、特性和类型 杂化轨道理论,杂化轨道 掌握杂化轨道理论的基本要点,熟悉杂化轨道的类型与分子的几何构型。价键理论的局限性价键理论能较好地说明一些双原子分子价
键的形成 不能很好地说明多原子分子的价键形成和
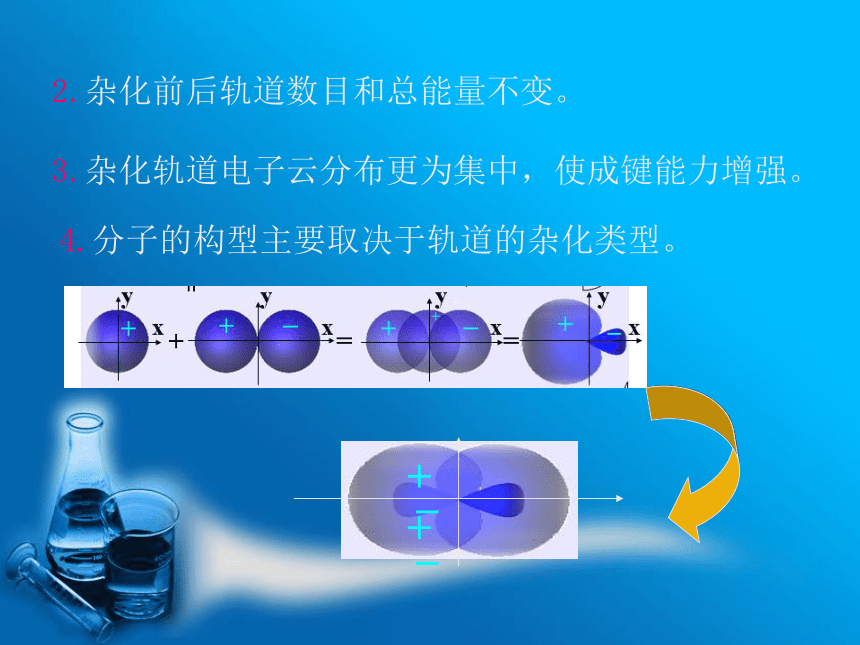
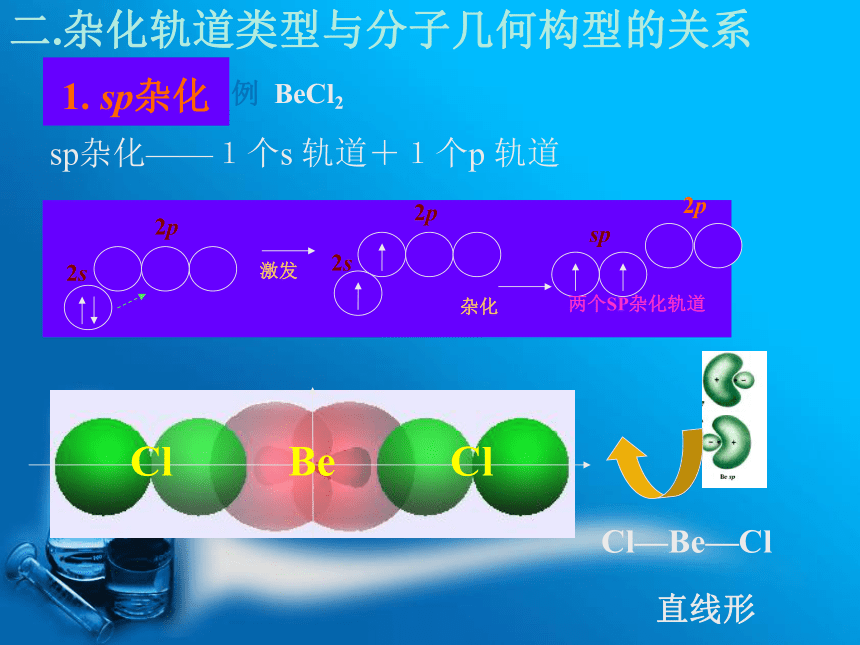
几何构型 如 CH4形成四个C-H 键不完全相同。 与实际不符。 1 1931年鲍林在价键理论的基础上,根据电子的波动性和波的叠加原理提出了杂化轨道力理论。 1.成键时,同一原子能级相近,类型不同的轨道可重新组合形成新的杂化轨道。一、杂化轨道理论的基本要点 杂化:原子成键时, 参与成键的若干个能级相近的原子轨道相互“混杂”, 组成一组新轨道(杂化轨道2.杂化前后轨道数目和总能量不变。3.杂化轨道电子云分布更为集中,使成键能力增强。4.分子的构型主要取决于轨道的杂化类型。1. sp杂化二.杂化轨道类型与分子几何构型的关系例 BeCl2sp杂化——1个s 轨道+1个p 轨道 Zn 、Cd、Hg的某些共价化合物多
采用sp杂化。2.sp2杂化sp2杂化——1个s 轨道+2个p 轨道例 BCl3平面三角形 其它气态BX3,B原子也采取sp2杂化,分子空间构型:平面正三角形。3.sp3杂化sp3杂化——1个s 轨道+3个p 轨道例 CH4正四面体 其它如:CCl4 、CF4 、SiH4 、SiCl4 、GeCl4等分子也采取sp3杂化。 几个能量相近的原子轨道杂化后,所形成的各杂化轨道的成分不完全相等。 NH3: 7N 1s22s22p3杂 化不等性sp3杂化轨道空间构型空间构型:
三角锥形,键角:107.18 o4. 不等性杂化不等性sp3杂化例 H2OO不等性sp3104 45’折线(V)形1小结:1.杂化轨道理论的基本要点
2.杂化轨道理论的特性和类型
键的形成 不能很好地说明多原子分子的价键形成和
几何构型 如 CH4形成四个C-H 键不完全相同。 与实际不符。 1 1931年鲍林在价键理论的基础上,根据电子的波动性和波的叠加原理提出了杂化轨道力理论。 1.成键时,同一原子能级相近,类型不同的轨道可重新组合形成新的杂化轨道。一、杂化轨道理论的基本要点 杂化:原子成键时, 参与成键的若干个能级相近的原子轨道相互“混杂”, 组成一组新轨道(杂化轨道2.杂化前后轨道数目和总能量不变。3.杂化轨道电子云分布更为集中,使成键能力增强。4.分子的构型主要取决于轨道的杂化类型。1. sp杂化二.杂化轨道类型与分子几何构型的关系例 BeCl2sp杂化——1个s 轨道+1个p 轨道 Zn 、Cd、Hg的某些共价化合物多
采用sp杂化。2.sp2杂化sp2杂化——1个s 轨道+2个p 轨道例 BCl3平面三角形 其它气态BX3,B原子也采取sp2杂化,分子空间构型:平面正三角形。3.sp3杂化sp3杂化——1个s 轨道+3个p 轨道例 CH4正四面体 其它如:CCl4 、CF4 、SiH4 、SiCl4 、GeCl4等分子也采取sp3杂化。 几个能量相近的原子轨道杂化后,所形成的各杂化轨道的成分不完全相等。 NH3: 7N 1s22s22p3杂 化不等性sp3杂化轨道空间构型空间构型:
三角锥形,键角:107.18 o4. 不等性杂化不等性sp3杂化例 H2OO不等性sp3104 45’折线(V)形1小结:1.杂化轨道理论的基本要点
2.杂化轨道理论的特性和类型
