原电池教案
图片预览

文档简介
选修四 原电池教案
教学目标:
1、知识目标:掌握盐桥的概念、作用;进一步理解原电池原理及形成条件;巩固判断原电池的正负极的方法。通过对原电池中闭合电路形成过程的分析,复习半电池、盐桥、内电路、外电路等概念。
2、能力目标:通过动手操作锻炼实验能力;通过对实验现象的分析锻炼分析、抽象、概括、判断等思维能力。
3、情感目标:联系生活实际,感受生活中的化学;由现象与本质的关系初步形成辩证唯物主义世界观;通过对电池原理的探索体会科学精神在研究中的作用。
教学重点:掌握盐桥的概念。
教学难点:理解盐桥的作用。
教学方法:实验探究法、对比法、讨论法。
教学过程:
【新课导入】前面我们在必修《二》中学习了电池的工作原理,
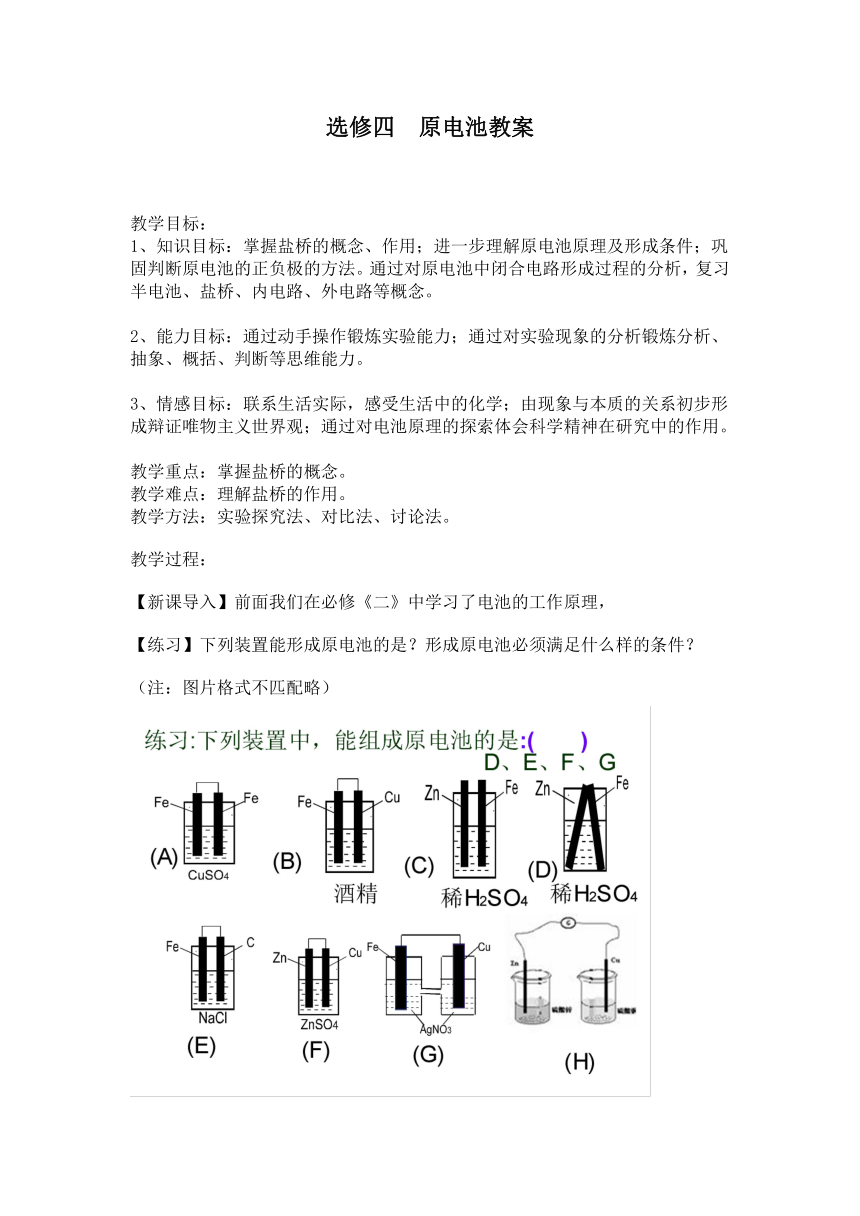
【练习】下列装置能形成原电池的是?形成原电池必须满足什么样的条件?
(注:图片格式不匹配略)
【学生讨论】
(1)图一能够形成原电池,其中锌做负极、铜做正极、硫酸铜溶液作电解质溶液。
(2)图二不能形成原电池,因为该装置不能形成闭合回路。
(3)图三不确定。
【学生归纳】【学生讨论后电脑展示】
条件1:自发的氧化还原反应
条件2:两电极
条件3:电极与电解质溶液接触
条件4:形成闭合回路
【实验探究】有哪些方法能使该装置能形成闭合回路而形成原电池?并利用现有
仪器药品组装成原电池。
【电脑展示】实验探究的步骤
实验 实验步骤: 实验现象:
(一) 如图三连接装置,观察有什么现象发生,取出盐桥,又有什么现象发生?
(二) 如图一连接装置观察有什么现象发生?(Cu导线连接)
【学生汇报实验结果】
(1) 实验一现象:有盐桥:指针偏转,且指针稳定;无盐桥:指针不偏转。
(2) 实验二现象: 指针偏转,指针不稳定 ,偏幅越来越小。
【提出问题】对比实验一思考:什么是盐桥?
【讲述】 盐桥是玻璃管中加入用琼脂固定KCl(饱和溶液)装置。
【提出问题】盐桥的作用是什么?
【引导】
(1)没有盐桥时电流计指针不发生偏转,为什么?
(2)有盐桥时电流计指针发生了偏转又说明了什么?此时盐桥起的作用是什么
(3)有盐桥时形成原电池电子的流向是怎样的?发生得失电子对溶液的电性产生什么样的影响?此时盐桥又起什么样的作用?
【学生讨论得出结论】盐桥的作用:
a、使两个半电池溶液连成一个通路(代替两溶液直接接触)
b、使两溶液保持电中性(平衡电荷)
(3)盐桥中离子移动的方向:Cl-移向ZnSO4溶液K+移向CuSO4溶液
【过渡】上述实验其实是由两个半电池组成的原电池。那么这类电池的工作原理是什么呢?
【动画演示】下面我们通过动画来看一下这种原电池内部的变化。
【师生共同分析】把氧化反应和还原反应分开在不同区域进行,再以适当方式连接,可以获得电流。①在这类电池中,用还原性较强的物质作为负极,负极向外电路提供电子;用氧化性较强的物质作为正极,正极从外电路得到电子。②在原电池的内部,两极浸在电解质溶液中,并通过阴阳离子的定向运动而形成内电路。
【投影小结】外电路:电子由负极流向正极,电流由正极流向负极。
内电路:阴离子流向负极,阳离子流向正极
电极:还原性较强的物质作负极,负极向外电路提供电子;氧化性较强的物质作正极,正极从外电路得到电子。
半极反应:负极: Zn-2e-= Zn2+ (氧化反应)
正极: Cu2++ 2e-= Cu (还原反应)
总反应式: Zn+ Cu2+ = Zn2+ + Cu
【本课小结】本节课我们通过实验又一次认识了原电池,进一步学习了原电池的工作原理,认识了一种新的装置——盐桥以及它在原电池装置中的作用,在原有基础上改进了实验装置,通过盐桥的使用使我们能够得到持续稳定的电流,在原电池中设置盐桥不是一个普通的技术改进,而是对旧的思维模式的一个质的突破。过去认为氧化剂、还原剂只有在直接接触、相互作用才能发生电子转移,而现在,是使氧化剂和还原剂近乎完全隔离,并在不同区域之间通过特定的装置(盐桥)实现了电子的定向转移,为原电池持续、稳定地产生电流创造了必要的条件,也为原电池原理的实用性开发奠定了理论基础。在上新课前我们清楚地认识到了电池给我们生活带来了很大的方便,但是如果我们对报废的电池使用后随便丢弃,又会对我们的地球家园引起严重的污染,我希望大家在对电池逐步的学习认识过程中,树立一种环保意识,珍爱我们环境,爱护我们共同的家园。
作业:课本78页第1、2、3题
板书设计
第四章 第一节原电池
一、什么是盐桥:
1、成分:装有含有琼胶的KCl饱和溶液。
2、盐桥的作用是什么?
a、使两个半电池溶液连成一个通路
b、使两溶液保持电中性
3、离子移动的方向:
Cl-移向ZnSO4溶液K+移向CuSO4溶液
教学目标:
1、知识目标:掌握盐桥的概念、作用;进一步理解原电池原理及形成条件;巩固判断原电池的正负极的方法。通过对原电池中闭合电路形成过程的分析,复习半电池、盐桥、内电路、外电路等概念。
2、能力目标:通过动手操作锻炼实验能力;通过对实验现象的分析锻炼分析、抽象、概括、判断等思维能力。
3、情感目标:联系生活实际,感受生活中的化学;由现象与本质的关系初步形成辩证唯物主义世界观;通过对电池原理的探索体会科学精神在研究中的作用。
教学重点:掌握盐桥的概念。
教学难点:理解盐桥的作用。
教学方法:实验探究法、对比法、讨论法。
教学过程:
【新课导入】前面我们在必修《二》中学习了电池的工作原理,
【练习】下列装置能形成原电池的是?形成原电池必须满足什么样的条件?
(注:图片格式不匹配略)
【学生讨论】
(1)图一能够形成原电池,其中锌做负极、铜做正极、硫酸铜溶液作电解质溶液。
(2)图二不能形成原电池,因为该装置不能形成闭合回路。
(3)图三不确定。
【学生归纳】【学生讨论后电脑展示】
条件1:自发的氧化还原反应
条件2:两电极
条件3:电极与电解质溶液接触
条件4:形成闭合回路
【实验探究】有哪些方法能使该装置能形成闭合回路而形成原电池?并利用现有
仪器药品组装成原电池。
【电脑展示】实验探究的步骤
实验 实验步骤: 实验现象:
(一) 如图三连接装置,观察有什么现象发生,取出盐桥,又有什么现象发生?
(二) 如图一连接装置观察有什么现象发生?(Cu导线连接)
【学生汇报实验结果】
(1) 实验一现象:有盐桥:指针偏转,且指针稳定;无盐桥:指针不偏转。
(2) 实验二现象: 指针偏转,指针不稳定 ,偏幅越来越小。
【提出问题】对比实验一思考:什么是盐桥?
【讲述】 盐桥是玻璃管中加入用琼脂固定KCl(饱和溶液)装置。
【提出问题】盐桥的作用是什么?
【引导】
(1)没有盐桥时电流计指针不发生偏转,为什么?
(2)有盐桥时电流计指针发生了偏转又说明了什么?此时盐桥起的作用是什么
(3)有盐桥时形成原电池电子的流向是怎样的?发生得失电子对溶液的电性产生什么样的影响?此时盐桥又起什么样的作用?
【学生讨论得出结论】盐桥的作用:
a、使两个半电池溶液连成一个通路(代替两溶液直接接触)
b、使两溶液保持电中性(平衡电荷)
(3)盐桥中离子移动的方向:Cl-移向ZnSO4溶液K+移向CuSO4溶液
【过渡】上述实验其实是由两个半电池组成的原电池。那么这类电池的工作原理是什么呢?
【动画演示】下面我们通过动画来看一下这种原电池内部的变化。
【师生共同分析】把氧化反应和还原反应分开在不同区域进行,再以适当方式连接,可以获得电流。①在这类电池中,用还原性较强的物质作为负极,负极向外电路提供电子;用氧化性较强的物质作为正极,正极从外电路得到电子。②在原电池的内部,两极浸在电解质溶液中,并通过阴阳离子的定向运动而形成内电路。
【投影小结】外电路:电子由负极流向正极,电流由正极流向负极。
内电路:阴离子流向负极,阳离子流向正极
电极:还原性较强的物质作负极,负极向外电路提供电子;氧化性较强的物质作正极,正极从外电路得到电子。
半极反应:负极: Zn-2e-= Zn2+ (氧化反应)
正极: Cu2++ 2e-= Cu (还原反应)
总反应式: Zn+ Cu2+ = Zn2+ + Cu
【本课小结】本节课我们通过实验又一次认识了原电池,进一步学习了原电池的工作原理,认识了一种新的装置——盐桥以及它在原电池装置中的作用,在原有基础上改进了实验装置,通过盐桥的使用使我们能够得到持续稳定的电流,在原电池中设置盐桥不是一个普通的技术改进,而是对旧的思维模式的一个质的突破。过去认为氧化剂、还原剂只有在直接接触、相互作用才能发生电子转移,而现在,是使氧化剂和还原剂近乎完全隔离,并在不同区域之间通过特定的装置(盐桥)实现了电子的定向转移,为原电池持续、稳定地产生电流创造了必要的条件,也为原电池原理的实用性开发奠定了理论基础。在上新课前我们清楚地认识到了电池给我们生活带来了很大的方便,但是如果我们对报废的电池使用后随便丢弃,又会对我们的地球家园引起严重的污染,我希望大家在对电池逐步的学习认识过程中,树立一种环保意识,珍爱我们环境,爱护我们共同的家园。
作业:课本78页第1、2、3题
板书设计
第四章 第一节原电池
一、什么是盐桥:
1、成分:装有含有琼胶的KCl饱和溶液。
2、盐桥的作用是什么?
a、使两个半电池溶液连成一个通路
b、使两溶液保持电中性
3、离子移动的方向:
Cl-移向ZnSO4溶液K+移向CuSO4溶液
