原电池
图片预览



文档简介
课件17张PPT。第四章 第一节
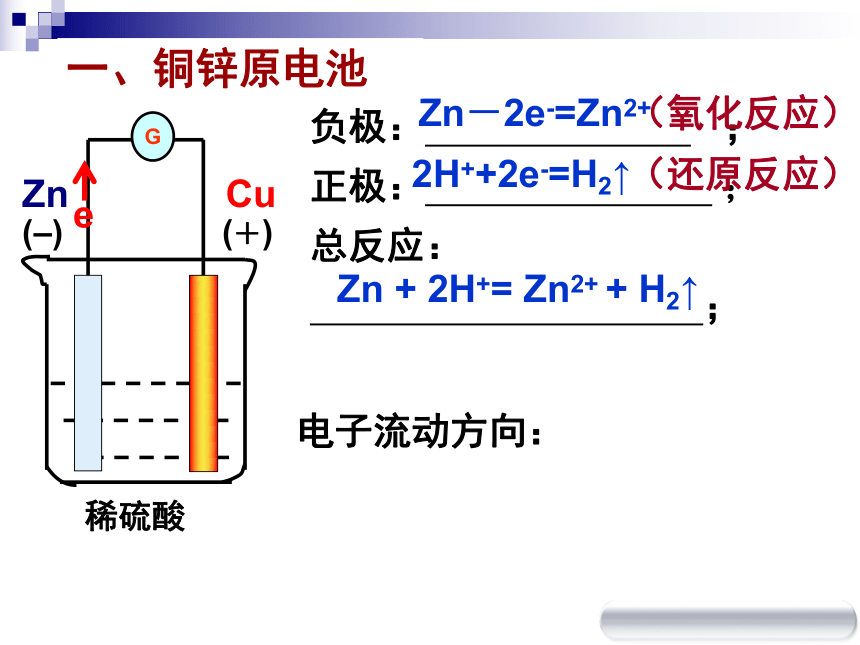
原电池复 习画出铜、锌、稀硫酸组成的原电池装置;
标出正 、负极
写出电极反应和总反应式负极: ;
正极: ;
总反应:
;G电子流动方向:
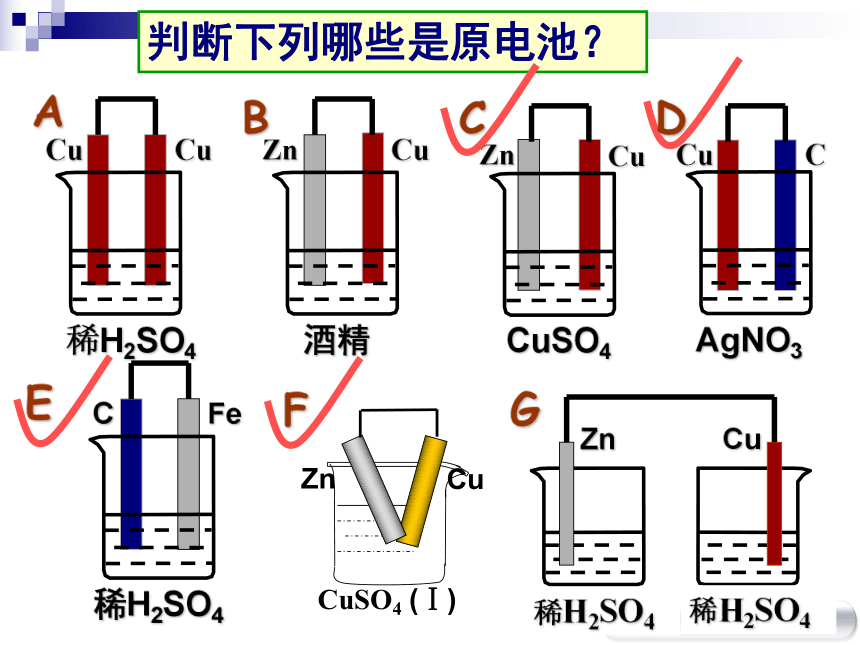
2H++2e-=H2↑Zn-2e-=Zn2+Zn + 2H+= Zn2+ + H2↑(氧化反应)(还原反应)(–)(+)一、铜锌原电池判断下列哪些是原电池?稀H2SO4CuCu酒精ZnCuCuSO4ZnCuAgNO3CuC稀H2SO4CFeABCFGED稀H2SO4稀H2SO4ZnCu Zn CuSO4 (Ⅰ) Cu形成原电池的条件?①电极
②电解质溶液
③闭合回路
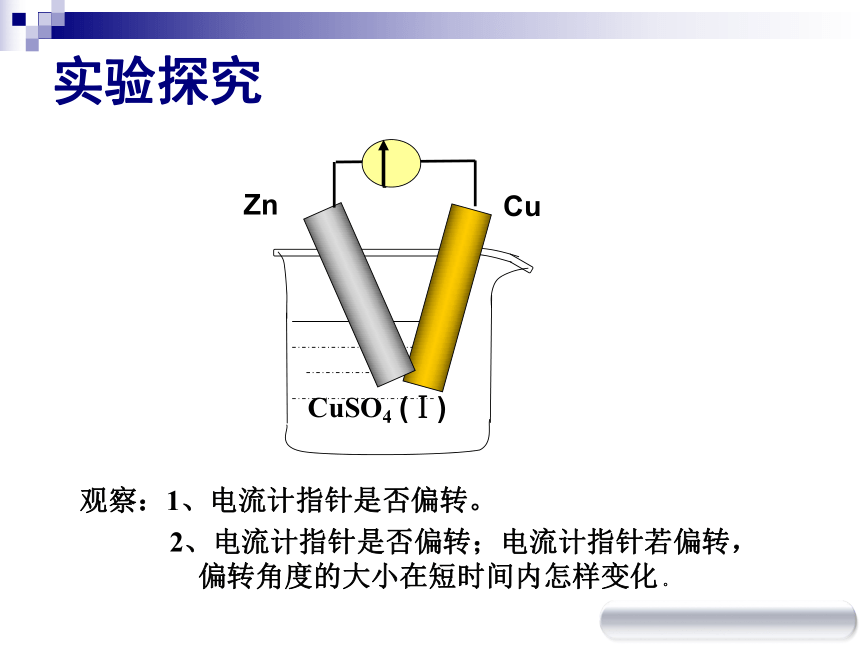
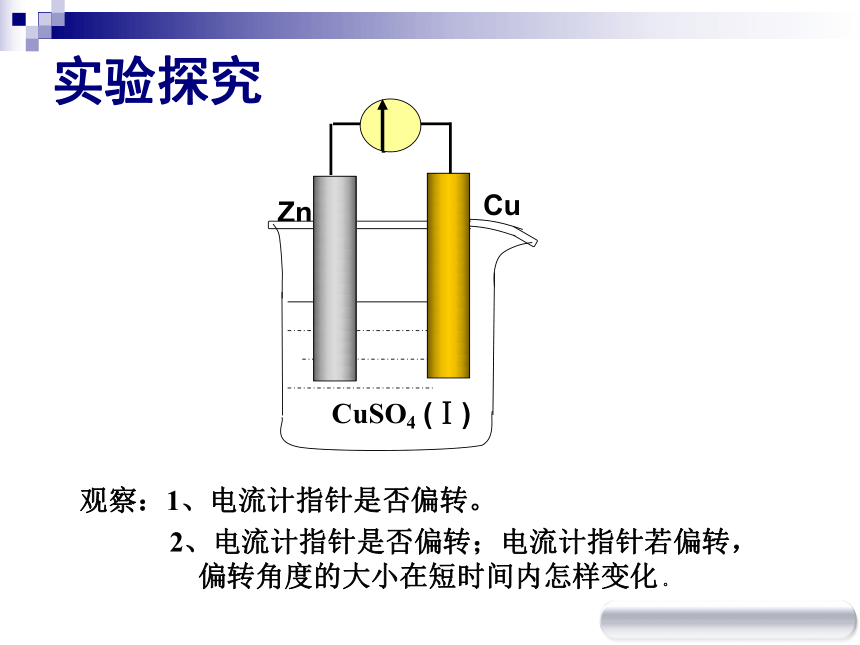
④自发的氧化还原反应实验探究观察:1、电流计指针是否偏转。
2、电流计指针是否偏转;电流计指针若偏转,
偏转角度的大小在短时间内怎样变化 。实验探究观察:1、电流计指针是否偏转。
2、电流计指针是否偏转;电流计指针若偏转,
偏转角度的大小在短时间内怎样变化 。设疑 1、金属片直接相连时,导线中为什么没有电子流过?
2、该简单原电池对外提供的电流是稳定、持久的吗?
3、造成原电池提供电能的能力减弱的原因是什么?铜锌原电池双液电池能量损耗此装置是原电池吗?锌半电池铜半电池电极反应:
负极: ;
正极: ;
总反应:
。Cu2++2e--=CuZn-2e- =Zn2+Zn + Cu2+= Zn2+ + Cu二、铜锌原电池(盐桥)根据下式所表示的氧化还原反应设计一个原电池:Zn(s)+Fe2+(aq)=Zn2+(aq)+Fe(s)
⑴ 装置可采用烧杯和盐桥,画出此原电池的装置简图;
⑵ 注明原电池的正极和负极;
⑶ 注明外电路中电子的流向;
⑷ 写出两个电极上的电极反应。负极:Zn-2e- =Zn2+
正极:Fe2+ + 2e- = Fe(07海南)依据氧化还原反应:
2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)
设计的原电池如图所示。 ⑴电极X的材料是 ;
电解质溶液Y是 ;
⑵银电极为电池的 极,发生的电极反应为 ;
X电极上发生的电极
反应为 ;
⑶外电路中的电子
是从 电极
流向 电极。CuAgNO3正Ag+ + e- = AgCu - 2e- = Cu2+ CuAg练习1: 利用下列氧化还原反应设计原电池,写出电极反应式。并画出装置图(盐桥)Cu+ 2 FeCl3 = CuCl2+ 2FeCl2
化合价降低得2e-Cu+ 2 Fe3+ = Cu2+ + 2Fe2+
化合价升高失2e-
Cu
C
CuCl2
FeCl3
装置图:(Cu+ 2 FeCl3 = CuCl2+ 2FeCl2) SO42-Zn2+e-
e-SO42-H+K+盐桥工作示意图H2ZnK+Cl-K+Cl-K+Cl-K+Cl-K+Cl-Cl-K+K+Cl-K+K+K+Cl-Cl-K+Cl-Cl-Cl-盐桥
离子库
离子导体H2SO4H2SO4
标出正 、负极
写出电极反应和总反应式负极: ;
正极: ;
总反应:
;G电子流动方向:
2H++2e-=H2↑Zn-2e-=Zn2+Zn + 2H+= Zn2+ + H2↑(氧化反应)(还原反应)(–)(+)一、铜锌原电池判断下列哪些是原电池?稀H2SO4CuCu酒精ZnCuCuSO4ZnCuAgNO3CuC稀H2SO4CFeABCFGED稀H2SO4稀H2SO4ZnCu Zn CuSO4 (Ⅰ) Cu形成原电池的条件?①电极
②电解质溶液
③闭合回路
④自发的氧化还原反应实验探究观察:1、电流计指针是否偏转。
2、电流计指针是否偏转;电流计指针若偏转,
偏转角度的大小在短时间内怎样变化 。实验探究观察:1、电流计指针是否偏转。
2、电流计指针是否偏转;电流计指针若偏转,
偏转角度的大小在短时间内怎样变化 。设疑 1、金属片直接相连时,导线中为什么没有电子流过?
2、该简单原电池对外提供的电流是稳定、持久的吗?
3、造成原电池提供电能的能力减弱的原因是什么?铜锌原电池双液电池能量损耗此装置是原电池吗?锌半电池铜半电池电极反应:
负极: ;
正极: ;
总反应:
。Cu2++2e--=CuZn-2e- =Zn2+Zn + Cu2+= Zn2+ + Cu二、铜锌原电池(盐桥)根据下式所表示的氧化还原反应设计一个原电池:Zn(s)+Fe2+(aq)=Zn2+(aq)+Fe(s)
⑴ 装置可采用烧杯和盐桥,画出此原电池的装置简图;
⑵ 注明原电池的正极和负极;
⑶ 注明外电路中电子的流向;
⑷ 写出两个电极上的电极反应。负极:Zn-2e- =Zn2+
正极:Fe2+ + 2e- = Fe(07海南)依据氧化还原反应:
2Ag+(aq)+Cu(s)=Cu2+(aq)+2Ag(s)
设计的原电池如图所示。 ⑴电极X的材料是 ;
电解质溶液Y是 ;
⑵银电极为电池的 极,发生的电极反应为 ;
X电极上发生的电极
反应为 ;
⑶外电路中的电子
是从 电极
流向 电极。CuAgNO3正Ag+ + e- = AgCu - 2e- = Cu2+ CuAg练习1: 利用下列氧化还原反应设计原电池,写出电极反应式。并画出装置图(盐桥)Cu+ 2 FeCl3 = CuCl2+ 2FeCl2
化合价降低得2e-Cu+ 2 Fe3+ = Cu2+ + 2Fe2+
化合价升高失2e-
Cu
C
CuCl2
FeCl3
装置图:(Cu+ 2 FeCl3 = CuCl2+ 2FeCl2) SO42-Zn2+e-
e-SO42-H+K+盐桥工作示意图H2ZnK+Cl-K+Cl-K+Cl-K+Cl-K+Cl-Cl-K+K+Cl-K+K+K+Cl-Cl-K+Cl-Cl-Cl-盐桥
离子库
离子导体H2SO4H2SO4
