8.3环境保护与绿色化学课件2021-2022学年高一下学期化学人教版(2019)必修第二册(20张ppt)
文档属性
| 名称 | 8.3环境保护与绿色化学课件2021-2022学年高一下学期化学人教版(2019)必修第二册(20张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 599.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-11 00:00:00 | ||
图片预览








文档简介
(共20张PPT)
第八单元 化学与可持续发展
第三节 环境保护与绿色化学
[核心素养发展目标]
1.了解环境污染的主要因素、危害及防治的方法,认识化学对环境保护的重要意义,培养保护环境的科学态度和社会责任。
2.了解“绿色化学”“原子经济性反应”的内涵,知道它们在对利用资源、保护环境中的重要意义,加强环境保护意识并培养绿色化学的理念。
一、化学与环境保护
1.环境保护
(1)环境问题:
主要是指由于人类__________地开发和利用________而造成的____________破坏,以及_______________和_______________所造成的环境污染。
不合理
自然资源
生态环境
工农业生产
人类生活
③寻找源头治理环境污染的生产工艺:杜绝污染物的排放,能从根本上解决环境问题。
(2)环境保护的任务
①环境监测:
对污染物的_________、_____等进行_____和____,为控制和消除污染提供可靠的数据。
②治理工业“三废”(__________________)。
存在形态
含量
分析
测定
废气、废水、废渣
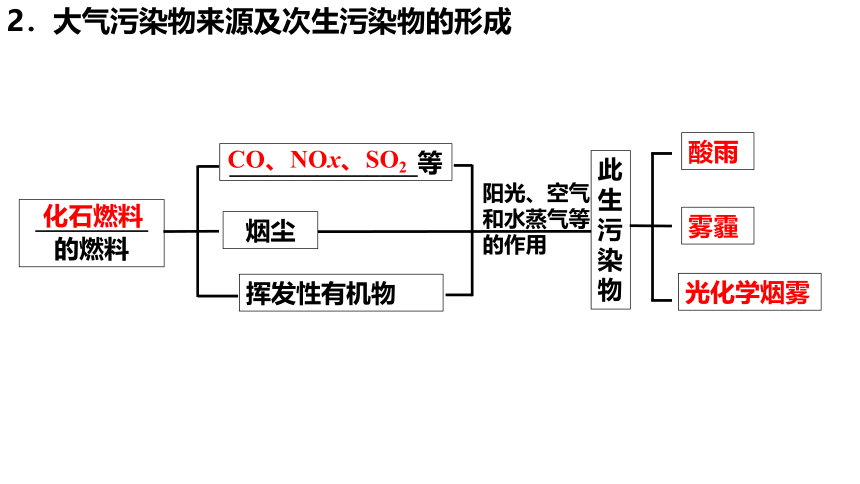
2.大气污染物来源及次生污染物的形成
_________
的燃料
_______________等
烟尘
挥发性有机物
此生污染物
酸雨
雾霾
光化学烟雾
阳光、空气和水蒸气等的作用
化石燃料
CO、NOx、SO2
3.污水的处理
(1)常用的污水处理方法:
(2)污水处理的常用化学方法:
(3)污水处理的流程
①一级处理:
②二级处理:
③三级处理:
物理法、化学法和生物法等。
中和法、氧化还原法、沉淀法等。
通常采用物理方法,即用格栅间、沉淀池等除去污水中不溶解的污染物。经一级处理后的水一般达不到排放标准,一级处理作为预处理。
采用生物方法(又称微生物法)及某些化学方法,除去水中的可降解有机物等污染物。经二级处理后的水一般可以达到国家规定的排放标准。
主要采用化学沉淀法、氧化还原法、离子交换法和反渗透法等,对污水进行深度处理和净化。经三级处理后水可用于绿化和景观用水等。
4.固体废弃物的处理
(1)处理原则:
(2)目的:
无害化、减量化和资源化。
减少环境污染和资源回收利用。
活性炭联合脱硫脱硝技术(AC)是一种比较成熟的脱硫脱硝技术,可以在较低的温度下,将废气中的SO2、NOx通过一系列反应生成铵盐,从而变废为宝,其工作示意图如下所示:
(1)SO2在活性炭表面被氧化最终生成硫酸,方程式为:__________________
___________________________________________。
(2)吸收塔加入NH3后,可脱除废气中的NO、NO2,写出NO和NO2分别和NH3反应的化学方程式:______________________、______________________。
(3)NH3和吸收塔中生成的H2SO4反应,会生成铵盐,写出反应的化学方程式:______________________________________________。
(4)活性炭的造价较高,工业上一般选用活性焦作为吸附剂来脱硫脱硝,活性炭来自煤干馏产品,煤的干馏为________(填“物理”或“化学”)变化,从煤干馏产品中获取苯、二甲苯的操作方法为:______________________________。
2SO2+O2 2SO3
催化剂
SO3+H2O=H2SO4(或2SO2+O2+2H2O=2H2SO4)
4NH3+6NO=5N2+6H2O 8NH3+6NO2=7N2+12H2O
2NH3+H2SO4=(NH4)2SO4(或NH3+H2SO4=NH4HSO4)
化学
蒸馏(或分馏)
(1)化学工作者进行的环境质量监测工作可有可无,有污染治理就行( )
(2)化石燃料燃烧产生的CO、NOx、SO2为次生污染物( )
(3)“燃煤固硫”“汽车尾气催化净化”都能提高空气质量( )
(4)工业废渣和生活垃圾等固体废弃物对环境影响不大,可不必处理( )
(5)污水的一级处理通常采用化学法和生物法将难溶解的污染物除去( )
×
×
√
×
×
二、绿色化学
3.原子经济性反应:
1.绿色化学也称_____________化学。
环境友好
2.核心思想:
改变“先污染后治理”的观念和做法,利用化学原理和技术手段,减少或消除产品在生产和应用中涉及的有害化学物质,实现从__________或_____环境污染。
源头减少
消除
反应物的原子全部转化为期望的最终产物,原子利用率达到100%。
原子利用率= ×100%
期望产物的总质量
生成产物的总质量
4.绿色化学对化学反应的要求
(1)“绿色化学”就是污染后有效治理的化学思想( )
(2)“绿色化学”就是指在化工生产中不排放任何有害物质( )
(3)在汽车排气管上安装“催化转化器”把CO、NO催化生成N2和CO2,符合绿色化学的理念( )
(4)“3R”原则(减量化、再利用和再循环)是开发和利用自然资源的基本原则( )
(5)植物秸秆含大量钾元素,焚烧后作钾肥符合“绿色化学”的思想( )
(6)利用阳光发电,光解水制氢气是解决能源危机,实现可持续发展的有效途径( )
×
√
×
√
×
√
乙烯大量用来生产环氧乙烷,生产工艺主要有两种。
工艺一:CH2==CH2+Cl2+Ca(OH)2 → +CaCl2+H2O
工艺二:2CH2==CH2+O2 2
试回答下列问题:
(1)根据绿色化学原则,理想的生产工艺是原子经济性好的反应,上述工艺一的原子利用率________(填“高”或“低”,下同);工艺二的原子利用率__________,因此,在实际生产中,应采用工艺________更环保、更经济。
Ag
CH2-CH2
O
CH2-CH2
O
二
低
高
(2)下列有机反应中最符合“绿色化学”思想的为________(填序号)。
①CH2==CH2+ ―→ +CH3COOH
②3 + + 2H2O
③nCH2==CH2 [CH2—CH2] n
④CH3CH2OH+CH3COOH CH3COOCH2CH3+H2O
⑤CH3—C≡CH+CO+CH3OH →
CH3 ─ C─O─OH
O
CH2-CH2
O
CH2-CH2
OH
OH
催化剂
CH2─CH2
O
CH2─CH2─O─ CH2─CH2
OH
OH
催化剂
浓H2SO4
△
CH2=C─COOCH3
CH3
③⑤
随堂演练 知识落实
1.(2020·淮安月考)习总书记在十九大报告中提出“我们要建设的现代化是人与自然和谐共生的现代化”,下列说法正确的是( )
A.在田间焚烧秸秆,以增加草木灰肥料从而减少化肥的使用
B.推广使用可降解塑料及布袋购物,以减少“白色污染”
C.用氯气处理水中的Cu2+、Hg2+等重金属离子
D.燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
B
2.(2020·温州期中)下列有关环境保护与绿色化学的叙述不正确的是( )
A.形成酸雨的主要物质是硫的氧化物和氮的氧化物
B.大气污染物主要来自化石燃料燃烧和工业生产过程产生的废气
C.绿色化学的核心就是如何对被污染的环境进行无毒无害的治理
D.燃煤烟气脱硫的石灰石—石膏法,可将烟气中的二氧化硫转化为硫酸钙
C
3.(2020·天津和平区校级期中)“绿色化学“是指从源头上消除或减少对环境的污染。下列实验或实验过程符合化学实验“绿色化学”原则的是( )
A.用过氧化氢溶液代替高锰酸钾制取氧气
B.用纳米铜粉代替铜丝进行铜和浓硝酸反应的实验
C.用溴水代替碘水进行萃取实验
D.为了让学生更清楚地看到实验现象要用较多量的氯气进行性质实验
A
4.(2020·宁波市北仑区校级期中)在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%。下列反应类型能体现“原子经济性”原则的是( )
①置换反应 ②化合反应 ③分解反应 ④取代反应 ⑤加成反应
A.①② B.②⑤ C.②④ D.①③
B
5.(2019·宿迁模拟)中国“十九大”规划纲要提出节能减排(指的是减少能源浪费和降低废气排放),这是贯彻落实科学发展观、构建社会主义和谐社会的重大举措;是建设资源节约型、环境友好型社会的必然选择;是推进经济结构调整,转变增长方式的必由之路;是维护中华民族长远利益的必然要求。请你分析并回答下列问题:
(1)“绿色化学”的最大特点在于它是在始端就采用预防实际污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”,下列化学反应不符合“绿色化学”思想的是________(填字母)。
A.制备环氧乙烷:2CH2= CH2+O2
B.制备硫酸铜:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
C.制备甲醇:2CH4+O2 2CH3OH
D.制备硝酸铜:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
CH2─CH2
O
催化剂
加热
催化剂
加热、加压
BD
乙炔水化法 乙烯氧化法
原料 乙炔、水 乙烯、空气
反应条件 HgSO4、100~125 ℃ PdCl2-CuCl2、100~125 ℃
平衡转化率 乙炔平衡转化率90%左右 乙烯平衡转化率80%左右
日产量 2.5吨(某设备条件下) 3.6吨(相同设备条件下)
原料生产工艺过程
乙炔 CaCO3 CaO CaC2 C2H2
乙烯 来源于石油裂解气
从两表中分析,现代工业上“乙烯氧化法”将逐步取代“乙炔水化法”的可能原因。
①从产率和产量角度分析:_________________________________________________________。
②从环境保护和能耗角度分析:_________________________________________________
_____________________________________________________________________________________。
(2)工业上目前使用两种方法制取乙醛——“乙炔水化法”和“乙烯氧化法”。下面两表提供生产过程中原料反应条件、原料平衡转化率和产量等有关信息
表一:原料、反应条件、平衡转化率、日产量
表二:原料来源生产工艺
②+C、电炉
1 100 ℃
①850~1 100 ℃
③饱和食盐水
虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多
两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,毒性大;乙炔的制取要经过多步反应制得,且消耗大量的热能、电能;乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得
第八单元 化学与可持续发展
第三节 环境保护与绿色化学
[核心素养发展目标]
1.了解环境污染的主要因素、危害及防治的方法,认识化学对环境保护的重要意义,培养保护环境的科学态度和社会责任。
2.了解“绿色化学”“原子经济性反应”的内涵,知道它们在对利用资源、保护环境中的重要意义,加强环境保护意识并培养绿色化学的理念。
一、化学与环境保护
1.环境保护
(1)环境问题:
主要是指由于人类__________地开发和利用________而造成的____________破坏,以及_______________和_______________所造成的环境污染。
不合理
自然资源
生态环境
工农业生产
人类生活
③寻找源头治理环境污染的生产工艺:杜绝污染物的排放,能从根本上解决环境问题。
(2)环境保护的任务
①环境监测:
对污染物的_________、_____等进行_____和____,为控制和消除污染提供可靠的数据。
②治理工业“三废”(__________________)。
存在形态
含量
分析
测定
废气、废水、废渣
2.大气污染物来源及次生污染物的形成
_________
的燃料
_______________等
烟尘
挥发性有机物
此生污染物
酸雨
雾霾
光化学烟雾
阳光、空气和水蒸气等的作用
化石燃料
CO、NOx、SO2
3.污水的处理
(1)常用的污水处理方法:
(2)污水处理的常用化学方法:
(3)污水处理的流程
①一级处理:
②二级处理:
③三级处理:
物理法、化学法和生物法等。
中和法、氧化还原法、沉淀法等。
通常采用物理方法,即用格栅间、沉淀池等除去污水中不溶解的污染物。经一级处理后的水一般达不到排放标准,一级处理作为预处理。
采用生物方法(又称微生物法)及某些化学方法,除去水中的可降解有机物等污染物。经二级处理后的水一般可以达到国家规定的排放标准。
主要采用化学沉淀法、氧化还原法、离子交换法和反渗透法等,对污水进行深度处理和净化。经三级处理后水可用于绿化和景观用水等。
4.固体废弃物的处理
(1)处理原则:
(2)目的:
无害化、减量化和资源化。
减少环境污染和资源回收利用。
活性炭联合脱硫脱硝技术(AC)是一种比较成熟的脱硫脱硝技术,可以在较低的温度下,将废气中的SO2、NOx通过一系列反应生成铵盐,从而变废为宝,其工作示意图如下所示:
(1)SO2在活性炭表面被氧化最终生成硫酸,方程式为:__________________
___________________________________________。
(2)吸收塔加入NH3后,可脱除废气中的NO、NO2,写出NO和NO2分别和NH3反应的化学方程式:______________________、______________________。
(3)NH3和吸收塔中生成的H2SO4反应,会生成铵盐,写出反应的化学方程式:______________________________________________。
(4)活性炭的造价较高,工业上一般选用活性焦作为吸附剂来脱硫脱硝,活性炭来自煤干馏产品,煤的干馏为________(填“物理”或“化学”)变化,从煤干馏产品中获取苯、二甲苯的操作方法为:______________________________。
2SO2+O2 2SO3
催化剂
SO3+H2O=H2SO4(或2SO2+O2+2H2O=2H2SO4)
4NH3+6NO=5N2+6H2O 8NH3+6NO2=7N2+12H2O
2NH3+H2SO4=(NH4)2SO4(或NH3+H2SO4=NH4HSO4)
化学
蒸馏(或分馏)
(1)化学工作者进行的环境质量监测工作可有可无,有污染治理就行( )
(2)化石燃料燃烧产生的CO、NOx、SO2为次生污染物( )
(3)“燃煤固硫”“汽车尾气催化净化”都能提高空气质量( )
(4)工业废渣和生活垃圾等固体废弃物对环境影响不大,可不必处理( )
(5)污水的一级处理通常采用化学法和生物法将难溶解的污染物除去( )
×
×
√
×
×
二、绿色化学
3.原子经济性反应:
1.绿色化学也称_____________化学。
环境友好
2.核心思想:
改变“先污染后治理”的观念和做法,利用化学原理和技术手段,减少或消除产品在生产和应用中涉及的有害化学物质,实现从__________或_____环境污染。
源头减少
消除
反应物的原子全部转化为期望的最终产物,原子利用率达到100%。
原子利用率= ×100%
期望产物的总质量
生成产物的总质量
4.绿色化学对化学反应的要求
(1)“绿色化学”就是污染后有效治理的化学思想( )
(2)“绿色化学”就是指在化工生产中不排放任何有害物质( )
(3)在汽车排气管上安装“催化转化器”把CO、NO催化生成N2和CO2,符合绿色化学的理念( )
(4)“3R”原则(减量化、再利用和再循环)是开发和利用自然资源的基本原则( )
(5)植物秸秆含大量钾元素,焚烧后作钾肥符合“绿色化学”的思想( )
(6)利用阳光发电,光解水制氢气是解决能源危机,实现可持续发展的有效途径( )
×
√
×
√
×
√
乙烯大量用来生产环氧乙烷,生产工艺主要有两种。
工艺一:CH2==CH2+Cl2+Ca(OH)2 → +CaCl2+H2O
工艺二:2CH2==CH2+O2 2
试回答下列问题:
(1)根据绿色化学原则,理想的生产工艺是原子经济性好的反应,上述工艺一的原子利用率________(填“高”或“低”,下同);工艺二的原子利用率__________,因此,在实际生产中,应采用工艺________更环保、更经济。
Ag
CH2-CH2
O
CH2-CH2
O
二
低
高
(2)下列有机反应中最符合“绿色化学”思想的为________(填序号)。
①CH2==CH2+ ―→ +CH3COOH
②3 + + 2H2O
③nCH2==CH2 [CH2—CH2] n
④CH3CH2OH+CH3COOH CH3COOCH2CH3+H2O
⑤CH3—C≡CH+CO+CH3OH →
CH3 ─ C─O─OH
O
CH2-CH2
O
CH2-CH2
OH
OH
催化剂
CH2─CH2
O
CH2─CH2─O─ CH2─CH2
OH
OH
催化剂
浓H2SO4
△
CH2=C─COOCH3
CH3
③⑤
随堂演练 知识落实
1.(2020·淮安月考)习总书记在十九大报告中提出“我们要建设的现代化是人与自然和谐共生的现代化”,下列说法正确的是( )
A.在田间焚烧秸秆,以增加草木灰肥料从而减少化肥的使用
B.推广使用可降解塑料及布袋购物,以减少“白色污染”
C.用氯气处理水中的Cu2+、Hg2+等重金属离子
D.燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
B
2.(2020·温州期中)下列有关环境保护与绿色化学的叙述不正确的是( )
A.形成酸雨的主要物质是硫的氧化物和氮的氧化物
B.大气污染物主要来自化石燃料燃烧和工业生产过程产生的废气
C.绿色化学的核心就是如何对被污染的环境进行无毒无害的治理
D.燃煤烟气脱硫的石灰石—石膏法,可将烟气中的二氧化硫转化为硫酸钙
C
3.(2020·天津和平区校级期中)“绿色化学“是指从源头上消除或减少对环境的污染。下列实验或实验过程符合化学实验“绿色化学”原则的是( )
A.用过氧化氢溶液代替高锰酸钾制取氧气
B.用纳米铜粉代替铜丝进行铜和浓硝酸反应的实验
C.用溴水代替碘水进行萃取实验
D.为了让学生更清楚地看到实验现象要用较多量的氯气进行性质实验
A
4.(2020·宁波市北仑区校级期中)在“绿色化学工艺”中,理想状态是反应物中的原子全部转化为欲制得的产物,即原子利用率为100%。下列反应类型能体现“原子经济性”原则的是( )
①置换反应 ②化合反应 ③分解反应 ④取代反应 ⑤加成反应
A.①② B.②⑤ C.②④ D.①③
B
5.(2019·宿迁模拟)中国“十九大”规划纲要提出节能减排(指的是减少能源浪费和降低废气排放),这是贯彻落实科学发展观、构建社会主义和谐社会的重大举措;是建设资源节约型、环境友好型社会的必然选择;是推进经济结构调整,转变增长方式的必由之路;是维护中华民族长远利益的必然要求。请你分析并回答下列问题:
(1)“绿色化学”的最大特点在于它是在始端就采用预防实际污染的科学手段,因而过程和终端均为零排放和零污染,具有“原子经济性”,下列化学反应不符合“绿色化学”思想的是________(填字母)。
A.制备环氧乙烷:2CH2= CH2+O2
B.制备硫酸铜:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
C.制备甲醇:2CH4+O2 2CH3OH
D.制备硝酸铜:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
CH2─CH2
O
催化剂
加热
催化剂
加热、加压
BD
乙炔水化法 乙烯氧化法
原料 乙炔、水 乙烯、空气
反应条件 HgSO4、100~125 ℃ PdCl2-CuCl2、100~125 ℃
平衡转化率 乙炔平衡转化率90%左右 乙烯平衡转化率80%左右
日产量 2.5吨(某设备条件下) 3.6吨(相同设备条件下)
原料生产工艺过程
乙炔 CaCO3 CaO CaC2 C2H2
乙烯 来源于石油裂解气
从两表中分析,现代工业上“乙烯氧化法”将逐步取代“乙炔水化法”的可能原因。
①从产率和产量角度分析:_________________________________________________________。
②从环境保护和能耗角度分析:_________________________________________________
_____________________________________________________________________________________。
(2)工业上目前使用两种方法制取乙醛——“乙炔水化法”和“乙烯氧化法”。下面两表提供生产过程中原料反应条件、原料平衡转化率和产量等有关信息
表一:原料、反应条件、平衡转化率、日产量
表二:原料来源生产工艺
②+C、电炉
1 100 ℃
①850~1 100 ℃
③饱和食盐水
虽然乙烯氧化法的转化率略小于乙炔水化法,但反应快、日产量比其高得多
两者反应条件温度相当,但乙炔水化法制乙醛使用的是汞盐催化剂,毒性大;乙炔的制取要经过多步反应制得,且消耗大量的热能、电能;乙烯来源于石油裂解气,消耗的总能量比乙炔少,且较容易获得
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
