3.2第2课时物质的量在化学方程式计算中的应用2022-2023学年高一上学期化学人教版(2019)必修第一册(28张ppt)
文档属性
| 名称 | 3.2第2课时物质的量在化学方程式计算中的应用2022-2023学年高一上学期化学人教版(2019)必修第一册(28张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 830.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-13 14:52:38 | ||
图片预览








文档简介
(共28张PPT)
第二节 金属材料
第三章 铁金属材料
第2课时 物质的量在化学方程式计算中的应用
素养目标
1.复习回顾有关物质的量n与微粒数N、物质的质量m、气体体积V、溶液浓度c间的计算公式,巩固以物质的量为中心的各物理量之间的换算方法。提升定量探究的学习能力及证据推理意识。
2.掌握物质的量在化学方程式计算中的一般方法和步骤,能逐步熟练在计算中应用物质的量,掌握计算的技巧和方法。
【知识铺垫】
1.在化学变化前后,原子的种类和个数都保持不变,所以任何化学反应都遵循质量守恒定律。
2.在标准状况下,46 g钠和足量的水反应生成H2的质量为2 g,即2 mol钠和足量的水反应,生成H2的物质的量为1 mol,其体积为22.4 L。
3.物质的量(n)、微粒个数(N)、物质质量(m)、气体体积(V)之间的关系:
素养初探
一、物质的量在化学方程式计算中的应用
物质之间的化学反应,是物质的构成粒子(原子、分子、离子等)按一定的数目关系进行的。以钠和水的反应为例:
2Na + 2H2O === 2NaOH+H2↑
化学计量数 2 2 2 1
扩大到原
来的NA倍 2×NA 2×NA 2×NA 1×NA
物质的量 2 mol 2 mol 2 mol 1 mol
结论:化学方程式中各物质的化学计量数之比=参加反应的物质的微粒个数之比=参加反应的物质的物质的量之比=参加反应的气体体积(相同状况)之比。
【微思考】“化学反应前后质量是守恒的,那么物质的量也肯定守恒”,这种说法对吗 为什么
提示 不对。化学方程式中各物质的物质的量之比=各物质的化学计量数之比,所以,化学反应后物质的量可能增大,可能减小,也可能不变。
二、根据化学方程式进行计算的基本步骤
【情境链接】甲、乙两位同学就物质的量应用于化学方程式的计算,产生了以下讨论:
你同意哪位同学的说法 举例说明。
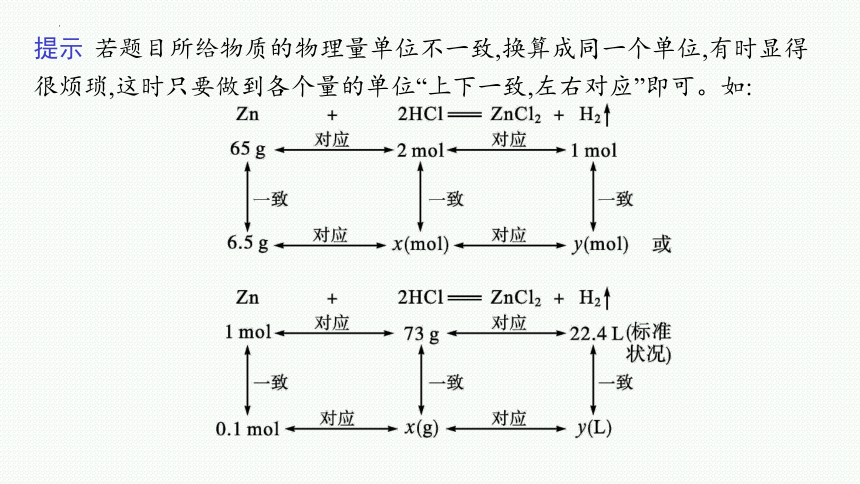
提示 若题目所给物质的物理量单位不一致,换算成同一个单位,有时显得很烦琐,这时只要做到各个量的单位“上下一致,左右对应”即可。如:
【自我小测】
1.判断正误:
(1)铝与NaOH溶液反应中,每转移3 mol e-,就生成1.5 mol H2。( )
(2)化学方程式中各物质的化学计量数之比等于各物质的质量之比。( )
(3)化学反应前后反应物和生成物遵循质量守恒,也遵循物质的量守恒。( )
(4)由钠、镁、铝、锌四种金属单质中的两种组成的合金共12 g,跟足量的盐酸反应产生5.6 L氢气(标准状况),此合金中一定含有金属Zn。( )
(5)1 mol Na和1 mol Al的混合物投入足量水中,产生的气体在标准状况下的体积为44.8 L。( )
答案 (1)√ (2)× (3)× (4)√ (5)√
2.物质在发生化学反应时( )
A.每种物质的质量一定相等
B.每种物质的物质的量一定相等
C.每种物质的质量比等于化学方程式中化学计量数之比
D.每种物质的物质的量比等于化学方程式中化学计量数之比
D
新知 物质的量应用于化学方程式计算的步骤
【问题探究】
1.观察下面化学方程式及各物质对应的物理量,思考并回答相关问题。
2Na + 2H2O === 2NaOH + H2↑
2×23 g 2 mol 2 mol 22.4 L
m(Na) n(H2O) n(NaOH) V(H2)
则有
素养提升
(1)为什么利用化学方程式进行计算时,同一种物质的单位必须统一,而不同的物质则不必统一
提示 同一种物质用不同的物理量表示时,比例是相同的。例如1 mol钠和23 g钠完全相同。
(2)判断上述反应是在常温常压下发生的吗 说明你的判断理由。
提示 不是。因为在计算中1 mol氢气的体积是22.4 L,说明不是在常温常压下进行的。
2.将5.6 g铁放入足量的稀硫酸中充分反应,生成标准状况下氢气的体积是多少
提示 2.24 L。
3.将5.6 g铁放入含有0.05 mol H2SO4的稀硫酸中,充分反应,生成标准状况下氢气的体积是多少
提示 1.12 L(若已知两种或以上反应物的量,计算时首先要判断哪种物质过量,然后以完全反应的物质的量为标准进行计算)。
4.将一定量的铁放入稀硫酸中,完全反应后,溶液质量增加5.4 g,计算参加反应的铁的物质的量。
提示 0.1 mol(本题可以用差量法计算,1 mol铁完全反应生成1 mol H2,溶液质量增加54 g,现在溶液质量增加5.4 g,则反应的铁的物质的量为0.1 mol)。
【深化拓展】
1.有关物质的量的计算中的“三个规范”
(1)书写规范:各种符号的书写要规范,大写字母与小写字母的意义各不相同。如“M”表示摩尔质量,而“m”表示质量;“N”表示微粒数,而“n”表示物质的量。
(2)符号规范
①设未知数直接用各物理量的符号表示,且要注明物质(或粒子)的符号。如设参加反应的HCl溶液的体积为V[HCl(aq)]。
②各物理量及单位、物质的名称、公式等尽量用符号表示。如已知NaOH溶液的体积和物质的量浓度,求NaOH的质量时就写成:m(NaOH)=c(NaOH)·V[NaOH(aq)]·M(NaOH)。
(3)单位规范:把已知量代入计算式中计算时都要带单位且单位要统一。
2.物质的量应用于化学方程式计算时的注意事项
(1)化学方程式中各物质的化学计量数之比等于各物质的物质的量之比,而非质量之比。
(2)计算时,各种物质不一定都用物质的量表示,也可以用质量表示,气态物质还可以用体积(标准状况)表示。但要注意物质的量与其他各物理量之间的换算关系,只要做到计量单位“上下一致,左右相当”即可。
【素能应用】
例 向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应,计算:
(1)Al的物质的量。
(2)参加反应的NaOH的物质的量和NaOH溶液中溶质的物质的量浓度。
(3)生成的H2在标准状况下的体积。
(2)设参加反应的NaOH的物质的量为x。
2Al + 2NaOH+2H2O === 2NaAlO2+3H2↑
2 2
0.4 mol x
(3)设生成的H2在标准状况下的体积为y。
2Al+2NaOH+2H2O === 2NaAlO2+3H2↑
2 mol 3×22.4 L
0.4 mol y
答:(1)Al的物质的量为0.4 mol;
(2)参加反应的NaOH的物质的量为0.4 mol,NaOH溶液中溶质的物质的量浓度为0.8 mol·L-1;
(3)生成的H2在标准状况下的体积为13.44 L。
变式训练1在500 mL NaOH溶液中加入足量铝粉,反应完全后共收集到标准状况下的气体33.6 L,该NaOH溶液中NaOH的物质的量浓度为( )
A.1 mol·L-1 B.2 mol·L-1
C.1.5 mol·L-1 D.3 mol·L-1
B
变式训练2将8 g铁片放入100 mL硫酸铜溶液中,溶液中的铜离子全部被还原时,固体质量变为8.2 g,则原硫酸铜溶液的物质的量浓度为( )
A.0.5 mol·L-1 B.0.25 mol·L-1
C.0.025 mol·L-1 D.0.125 mol·L-1
B
素养脉络
1.对于反应aA+bB === cC+dD(A、B、C、D表示物质的化学式,a、b、c、d为化学方程式中的化学计量数),下列说法不正确的是( )
A.如果质量为m1的A与质量为m2的B恰好完全反应,则生成的C、D的质量之和一定等于(m1+m2)
B.参加反应的A和B中的原子总数一定等于生成的C和D的原子总数
C.(a+b)不一定等于(c+d)
D.A和B中的元素种类,不一定等于C和D中的元素种类
素养巩固
D
2.将质量为100 g的铁棒插入1 L 0.5 mol·L-1 CuSO4溶液中,足够长时间后,铁棒的质量将变为( )
A.102 g B.106 g
C.104 g D.110 g
C
3.(2020辽宁实验中学高一检测)铁粉可在高温下与水蒸气反应,若反应后得到的干燥固体质量比反应前铁粉的质量增加了32 g,则参加反应的铁粉的物质的量是( )
A.0.5 mol B.1 mol
C.1.5 mol D.2 mol
C
4.将19.5 g锌粒投入250 mL 2 mol·L-1的稀硫酸中,试计算:(写出计算过程)
(1)产生的氢气在标准状况下的体积。
(2)忽略溶液体积变化,反应后溶液中氢离子浓度。
(3)要配制250 mL 2 mol·L-1的稀硫酸,需取用质量分数为98%、密度为
1.84 g·cm-3的浓硫酸的体积为多少毫升 (保留三位有效数字)
答案 (1)设反应产生氢气的物质的量为x mol,19.5 g锌粒的物质的量为0.3 mol,250 mL 2 mol·L-1的稀硫酸中溶质的物质的量为0.25 L×2 mol·L-1
=0.5 mol。
Zn + H2SO4 === ZnSO4+H2↑
1 mol 1 mol 1 mol
0.3 mol 0.5 mol x mol
硫酸过量,按锌的量进行计算,得x=0.3,在标准状况下体积为
0.3 mol×22.4 L·mol-1=6.72 L。
再 见
第二节 金属材料
第三章 铁金属材料
第2课时 物质的量在化学方程式计算中的应用
素养目标
1.复习回顾有关物质的量n与微粒数N、物质的质量m、气体体积V、溶液浓度c间的计算公式,巩固以物质的量为中心的各物理量之间的换算方法。提升定量探究的学习能力及证据推理意识。
2.掌握物质的量在化学方程式计算中的一般方法和步骤,能逐步熟练在计算中应用物质的量,掌握计算的技巧和方法。
【知识铺垫】
1.在化学变化前后,原子的种类和个数都保持不变,所以任何化学反应都遵循质量守恒定律。
2.在标准状况下,46 g钠和足量的水反应生成H2的质量为2 g,即2 mol钠和足量的水反应,生成H2的物质的量为1 mol,其体积为22.4 L。
3.物质的量(n)、微粒个数(N)、物质质量(m)、气体体积(V)之间的关系:
素养初探
一、物质的量在化学方程式计算中的应用
物质之间的化学反应,是物质的构成粒子(原子、分子、离子等)按一定的数目关系进行的。以钠和水的反应为例:
2Na + 2H2O === 2NaOH+H2↑
化学计量数 2 2 2 1
扩大到原
来的NA倍 2×NA 2×NA 2×NA 1×NA
物质的量 2 mol 2 mol 2 mol 1 mol
结论:化学方程式中各物质的化学计量数之比=参加反应的物质的微粒个数之比=参加反应的物质的物质的量之比=参加反应的气体体积(相同状况)之比。
【微思考】“化学反应前后质量是守恒的,那么物质的量也肯定守恒”,这种说法对吗 为什么
提示 不对。化学方程式中各物质的物质的量之比=各物质的化学计量数之比,所以,化学反应后物质的量可能增大,可能减小,也可能不变。
二、根据化学方程式进行计算的基本步骤
【情境链接】甲、乙两位同学就物质的量应用于化学方程式的计算,产生了以下讨论:
你同意哪位同学的说法 举例说明。
提示 若题目所给物质的物理量单位不一致,换算成同一个单位,有时显得很烦琐,这时只要做到各个量的单位“上下一致,左右对应”即可。如:
【自我小测】
1.判断正误:
(1)铝与NaOH溶液反应中,每转移3 mol e-,就生成1.5 mol H2。( )
(2)化学方程式中各物质的化学计量数之比等于各物质的质量之比。( )
(3)化学反应前后反应物和生成物遵循质量守恒,也遵循物质的量守恒。( )
(4)由钠、镁、铝、锌四种金属单质中的两种组成的合金共12 g,跟足量的盐酸反应产生5.6 L氢气(标准状况),此合金中一定含有金属Zn。( )
(5)1 mol Na和1 mol Al的混合物投入足量水中,产生的气体在标准状况下的体积为44.8 L。( )
答案 (1)√ (2)× (3)× (4)√ (5)√
2.物质在发生化学反应时( )
A.每种物质的质量一定相等
B.每种物质的物质的量一定相等
C.每种物质的质量比等于化学方程式中化学计量数之比
D.每种物质的物质的量比等于化学方程式中化学计量数之比
D
新知 物质的量应用于化学方程式计算的步骤
【问题探究】
1.观察下面化学方程式及各物质对应的物理量,思考并回答相关问题。
2Na + 2H2O === 2NaOH + H2↑
2×23 g 2 mol 2 mol 22.4 L
m(Na) n(H2O) n(NaOH) V(H2)
则有
素养提升
(1)为什么利用化学方程式进行计算时,同一种物质的单位必须统一,而不同的物质则不必统一
提示 同一种物质用不同的物理量表示时,比例是相同的。例如1 mol钠和23 g钠完全相同。
(2)判断上述反应是在常温常压下发生的吗 说明你的判断理由。
提示 不是。因为在计算中1 mol氢气的体积是22.4 L,说明不是在常温常压下进行的。
2.将5.6 g铁放入足量的稀硫酸中充分反应,生成标准状况下氢气的体积是多少
提示 2.24 L。
3.将5.6 g铁放入含有0.05 mol H2SO4的稀硫酸中,充分反应,生成标准状况下氢气的体积是多少
提示 1.12 L(若已知两种或以上反应物的量,计算时首先要判断哪种物质过量,然后以完全反应的物质的量为标准进行计算)。
4.将一定量的铁放入稀硫酸中,完全反应后,溶液质量增加5.4 g,计算参加反应的铁的物质的量。
提示 0.1 mol(本题可以用差量法计算,1 mol铁完全反应生成1 mol H2,溶液质量增加54 g,现在溶液质量增加5.4 g,则反应的铁的物质的量为0.1 mol)。
【深化拓展】
1.有关物质的量的计算中的“三个规范”
(1)书写规范:各种符号的书写要规范,大写字母与小写字母的意义各不相同。如“M”表示摩尔质量,而“m”表示质量;“N”表示微粒数,而“n”表示物质的量。
(2)符号规范
①设未知数直接用各物理量的符号表示,且要注明物质(或粒子)的符号。如设参加反应的HCl溶液的体积为V[HCl(aq)]。
②各物理量及单位、物质的名称、公式等尽量用符号表示。如已知NaOH溶液的体积和物质的量浓度,求NaOH的质量时就写成:m(NaOH)=c(NaOH)·V[NaOH(aq)]·M(NaOH)。
(3)单位规范:把已知量代入计算式中计算时都要带单位且单位要统一。
2.物质的量应用于化学方程式计算时的注意事项
(1)化学方程式中各物质的化学计量数之比等于各物质的物质的量之比,而非质量之比。
(2)计算时,各种物质不一定都用物质的量表示,也可以用质量表示,气态物质还可以用体积(标准状况)表示。但要注意物质的量与其他各物理量之间的换算关系,只要做到计量单位“上下一致,左右相当”即可。
【素能应用】
例 向500 mL NaOH溶液中投入10.8 g Al,二者恰好完全反应,计算:
(1)Al的物质的量。
(2)参加反应的NaOH的物质的量和NaOH溶液中溶质的物质的量浓度。
(3)生成的H2在标准状况下的体积。
(2)设参加反应的NaOH的物质的量为x。
2Al + 2NaOH+2H2O === 2NaAlO2+3H2↑
2 2
0.4 mol x
(3)设生成的H2在标准状况下的体积为y。
2Al+2NaOH+2H2O === 2NaAlO2+3H2↑
2 mol 3×22.4 L
0.4 mol y
答:(1)Al的物质的量为0.4 mol;
(2)参加反应的NaOH的物质的量为0.4 mol,NaOH溶液中溶质的物质的量浓度为0.8 mol·L-1;
(3)生成的H2在标准状况下的体积为13.44 L。
变式训练1在500 mL NaOH溶液中加入足量铝粉,反应完全后共收集到标准状况下的气体33.6 L,该NaOH溶液中NaOH的物质的量浓度为( )
A.1 mol·L-1 B.2 mol·L-1
C.1.5 mol·L-1 D.3 mol·L-1
B
变式训练2将8 g铁片放入100 mL硫酸铜溶液中,溶液中的铜离子全部被还原时,固体质量变为8.2 g,则原硫酸铜溶液的物质的量浓度为( )
A.0.5 mol·L-1 B.0.25 mol·L-1
C.0.025 mol·L-1 D.0.125 mol·L-1
B
素养脉络
1.对于反应aA+bB === cC+dD(A、B、C、D表示物质的化学式,a、b、c、d为化学方程式中的化学计量数),下列说法不正确的是( )
A.如果质量为m1的A与质量为m2的B恰好完全反应,则生成的C、D的质量之和一定等于(m1+m2)
B.参加反应的A和B中的原子总数一定等于生成的C和D的原子总数
C.(a+b)不一定等于(c+d)
D.A和B中的元素种类,不一定等于C和D中的元素种类
素养巩固
D
2.将质量为100 g的铁棒插入1 L 0.5 mol·L-1 CuSO4溶液中,足够长时间后,铁棒的质量将变为( )
A.102 g B.106 g
C.104 g D.110 g
C
3.(2020辽宁实验中学高一检测)铁粉可在高温下与水蒸气反应,若反应后得到的干燥固体质量比反应前铁粉的质量增加了32 g,则参加反应的铁粉的物质的量是( )
A.0.5 mol B.1 mol
C.1.5 mol D.2 mol
C
4.将19.5 g锌粒投入250 mL 2 mol·L-1的稀硫酸中,试计算:(写出计算过程)
(1)产生的氢气在标准状况下的体积。
(2)忽略溶液体积变化,反应后溶液中氢离子浓度。
(3)要配制250 mL 2 mol·L-1的稀硫酸,需取用质量分数为98%、密度为
1.84 g·cm-3的浓硫酸的体积为多少毫升 (保留三位有效数字)
答案 (1)设反应产生氢气的物质的量为x mol,19.5 g锌粒的物质的量为0.3 mol,250 mL 2 mol·L-1的稀硫酸中溶质的物质的量为0.25 L×2 mol·L-1
=0.5 mol。
Zn + H2SO4 === ZnSO4+H2↑
1 mol 1 mol 1 mol
0.3 mol 0.5 mol x mol
硫酸过量,按锌的量进行计算,得x=0.3,在标准状况下体积为
0.3 mol×22.4 L·mol-1=6.72 L。
再 见
