4.3.2共价键课件2022-2023学年高一上学期化学人教版(2019)必修第一册(18张ppt)
文档属性
| 名称 | 4.3.2共价键课件2022-2023学年高一上学期化学人教版(2019)必修第一册(18张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-16 09:57:53 | ||
图片预览





文档简介
(共18张PPT)
第三节 化学键
第二课时
共价键
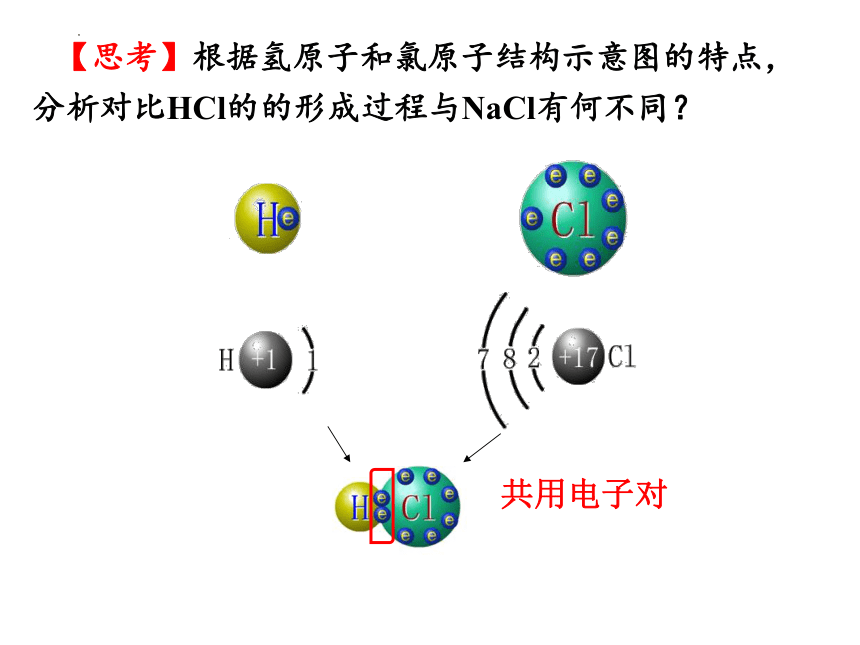
【思考】根据氢原子和氯原子结构示意图的特点,分析对比HCl的的形成过程与NaCl有何不同?
共用电子对
一、共价键
3、成键实质:
4、成键元素:
2、成键微粒:
1、概念:原子间通过 共用电子对 所形成的
相互作用。
原子
共用电子对,没有电子得失
同种或不同种 非金属 元素结合,
如Cl2、HCl;部分不活泼金属元
素与非金属元素结合,如AlCl3
思考1:下列物质中是否存在共价键?你能总结出哪些物质中存在共价键吗?
H2、Cl2、CO2、H2O、HF、NH3、HCl、OH-、SO42-、NH4+
共价键存在于:
多原子单质分子、非金属氧化物、非金属氢化物、带电原子团
思考2:Cl2、HCl中Cl元素的价态是否相同?
是否与共用电子对的偏移有关?共价键分为几种?
共用电子对偏移
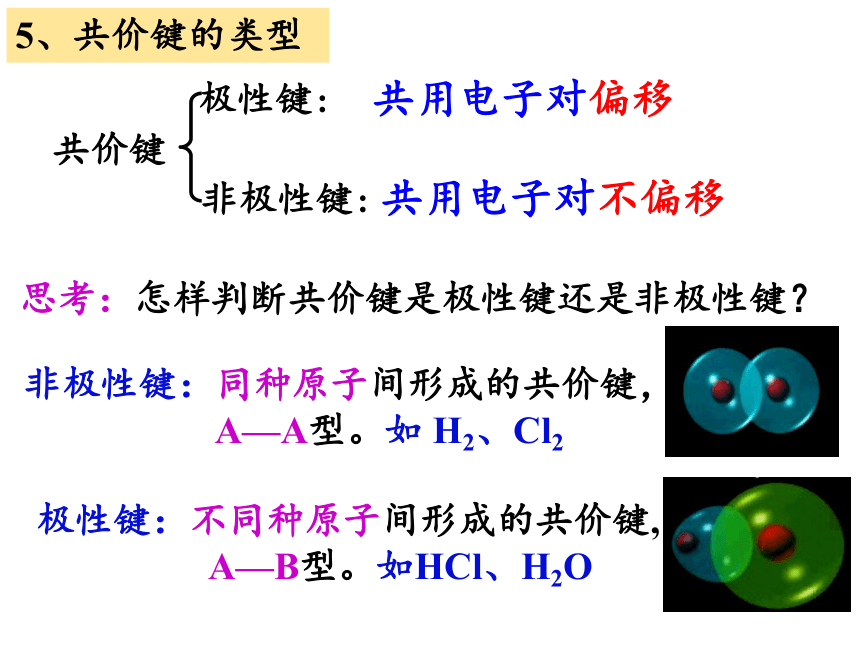
极性键:
共价键
非极性键:
共用电子对不偏移
思考:怎样判断共价键是极性键还是非极性键?
非极性键:同种原子间形成的共价键,
A—A型。如 H2、Cl2
极性键:不同种原子间形成的共价键,
A—B型。如HCl、H2O
5、共价键的类型
共价化合物:以共用电子对形成分子的化合物。
二、共价化合物
思考3:NaOH中是否含有共价键?是共价化合物吗?为什么?
NaOH中含有极性共价键,但它不是共价化合物。因为NaOH是由阴阳离子构成的,不是分子构成的。
换句话说:
只含有共价键的化合物为共价化合物。
以下是常见的共价化合物:CH4、NH3、H2O、HF、HCl、CO2、NO2、SO2、H2CO3、HNO3、H2SO4、HClO、CCl4、C2H5OH、AlCl3
1、总结出常见的共价化合物类型有哪些?
2、共价化合物一定不含离子键吗?
3、含有共价键的化合物一定是共价化合物吗?
4、由非金属元素组成的化合物一定是共价化合物吗?
5、共价化合物一定不含金属元素吗?
【问题探究】
5、共价化合物一定不含金属元素吗?
【合作交流】
1、总结出常见的共价化合物类型有哪些?
非金属氢化物(如HCl、H2O);非金属氧化物(如CO2、SO2);含氧酸(如H2SO4、HNO3);大多数有机化合物(CCl4、C2H5OH);少部分盐(如AlCl3)
2、共价化合物一定不含离子键吗?
一定
3、含有共价键的化合物一定是共价化合物吗?
不一定。含原子团的离子化合物中也含有共价键
如NaOH、Na2SO4
4、由非金属元素组成的化合物一定是共价化合物吗?
不一定。铵盐都是离子化合物。
不一定。如AlCl3
1、用电子式表示下列物质。
(提示:原子最外层缺几个电子达到8电子或2电子稳定结构就形成几对共用电子对,剩余的电子尽可能的成对)
三、用电子式表示共价化合物形成过程
H2O
CO2
HCl
N2
2、结构式
在化学上常用一根短线“ — ”来表示一对共用电子,这样得到的式子叫结构式。
H-Cl
O
··
··
··
O
··
··
C
··
··
··
3、用电子式表示共价化合物的形成过程
→
+
··
· Cl
··
:
H ·
Cl
··
··
H
··
··
注意事项:①不用弯箭头表示电子的偏移;
②右边相同的原子不能合并在一起;
③没有形成离子,不标电荷和中括号 。
例:HCl
原子的电子式
分子的电子式
O
·
·
··
··
H· +
+·H
·
·
O
··
··
·
·
H
H
H2O的形成过程:
1.写出下列物质的电子式并指出共价键类型。
课堂训练
O2 CH4 H2O2
非极性键
极性键
极性键和非极性键
2.用电子式表示H2S的形成过程。
O
··
··
··
··
O
··
··
··
C
H
··
··
H
H
··
H
··
O
··
··
··
··
O
··
··
··
H
H
S
·
·
··
··
H· +
+ ·H
·
·
S
··
··
·
·
H
H
离子键 共价键
概念
成键粒子
成键本质
形成元素
电子式 举例
1、概念:使离子相结合或原子相结合的作用力
化学键
离子键
共价键
非极性键
极性键
四、化学键
··
··
··
··
Na+
[ ]
Cl
-
··
··
··
··
Cl
H
··
··
··
··
Cl
··
··
··
Cl
带相反电荷离子之间的相互作用
原子间通过共用电子对所形成的相互作用
阴、阳离子
原 子
静电作用
形成共用电子对
活泼金属元素与活泼非金属元素
相同或不同的非金属;不活泼金属与非金属元素
离子化合物 共价化合物
概念
构成粒子
粒子间的 作用
物质类别
导电性
熔沸点高低
由离子键构成的化合物叫做离子化合物
以共用电子对形成分子的化合物
阴、阳离子
分子
离子键
共价键
较高
较低
固体不导电,水溶液或熔融状态可导电
水溶液可能导电
强碱、绝大多数盐、活泼金属的氧化物、
活泼金属过氧化物
非金属氧化物、非金属氢化物、含氧酸、大部分有机物
从多角度区别离子化合物和共价化合物
H2和Cl2分子
旧键断裂成原子
新键形成
(HCl分子)
H2和Cl2作用生成HCl的反应过程:
一个化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程。
2、化学反应本质
课堂训练
1.下列这些物质中:①NaCl ② Cl2 ③ KOH
④ HCl ⑤ Na2O2 ⑥H2O2
(1)属于离子化合物有 ,
属于共价化合物的有 。
(2)存在共价键的有 ,
存在离子键的有 。
① ③ ⑤
④ ⑥
② ③ ④⑤ ⑥
① ③ ⑤
课堂小结
1、共价键:原子间通过共用电子对形成的相互作用。
2、共价化合物:以共用电子对形成分子的化合物。
3、会用电子式表示共价化合物的形成过程。
4、能够区分离子化合物和共价化合物,会判断共价键的类型。
5、化学反应的实质就是旧键的断裂和新键的形成。
D
课堂练习
2.下列物质中,既含有非极性共价键又含有极性共价键的是( )
A.NaOH B.CO2 C.N2 D.H2O2
1.下列关于化学键的叙述正确的( )
A.离子化合物只含离子键
B.共价化合物可能含离子键
C.金属原子在化学反应中只能失电子,因而不
能形成共价键
D.离子化合物一定有离子键,也可能有共价键
D
3.所有的物质中都含有化学键。 ( )
4.NaCl固体溶于水形成可以自由移动的Na+和Cl-破坏了什么化学键?HCl气体溶于水形成可以自由移动的H+和Cl-破坏了什么化学键?
离子键;共价键
×
稀有气体单质是单原子分子,不存在化学键。
第三节 化学键
第二课时
共价键
【思考】根据氢原子和氯原子结构示意图的特点,分析对比HCl的的形成过程与NaCl有何不同?
共用电子对
一、共价键
3、成键实质:
4、成键元素:
2、成键微粒:
1、概念:原子间通过 共用电子对 所形成的
相互作用。
原子
共用电子对,没有电子得失
同种或不同种 非金属 元素结合,
如Cl2、HCl;部分不活泼金属元
素与非金属元素结合,如AlCl3
思考1:下列物质中是否存在共价键?你能总结出哪些物质中存在共价键吗?
H2、Cl2、CO2、H2O、HF、NH3、HCl、OH-、SO42-、NH4+
共价键存在于:
多原子单质分子、非金属氧化物、非金属氢化物、带电原子团
思考2:Cl2、HCl中Cl元素的价态是否相同?
是否与共用电子对的偏移有关?共价键分为几种?
共用电子对偏移
极性键:
共价键
非极性键:
共用电子对不偏移
思考:怎样判断共价键是极性键还是非极性键?
非极性键:同种原子间形成的共价键,
A—A型。如 H2、Cl2
极性键:不同种原子间形成的共价键,
A—B型。如HCl、H2O
5、共价键的类型
共价化合物:以共用电子对形成分子的化合物。
二、共价化合物
思考3:NaOH中是否含有共价键?是共价化合物吗?为什么?
NaOH中含有极性共价键,但它不是共价化合物。因为NaOH是由阴阳离子构成的,不是分子构成的。
换句话说:
只含有共价键的化合物为共价化合物。
以下是常见的共价化合物:CH4、NH3、H2O、HF、HCl、CO2、NO2、SO2、H2CO3、HNO3、H2SO4、HClO、CCl4、C2H5OH、AlCl3
1、总结出常见的共价化合物类型有哪些?
2、共价化合物一定不含离子键吗?
3、含有共价键的化合物一定是共价化合物吗?
4、由非金属元素组成的化合物一定是共价化合物吗?
5、共价化合物一定不含金属元素吗?
【问题探究】
5、共价化合物一定不含金属元素吗?
【合作交流】
1、总结出常见的共价化合物类型有哪些?
非金属氢化物(如HCl、H2O);非金属氧化物(如CO2、SO2);含氧酸(如H2SO4、HNO3);大多数有机化合物(CCl4、C2H5OH);少部分盐(如AlCl3)
2、共价化合物一定不含离子键吗?
一定
3、含有共价键的化合物一定是共价化合物吗?
不一定。含原子团的离子化合物中也含有共价键
如NaOH、Na2SO4
4、由非金属元素组成的化合物一定是共价化合物吗?
不一定。铵盐都是离子化合物。
不一定。如AlCl3
1、用电子式表示下列物质。
(提示:原子最外层缺几个电子达到8电子或2电子稳定结构就形成几对共用电子对,剩余的电子尽可能的成对)
三、用电子式表示共价化合物形成过程
H2O
CO2
HCl
N2
2、结构式
在化学上常用一根短线“ — ”来表示一对共用电子,这样得到的式子叫结构式。
H-Cl
O
··
··
··
O
··
··
C
··
··
··
3、用电子式表示共价化合物的形成过程
→
+
··
· Cl
··
:
H ·
Cl
··
··
H
··
··
注意事项:①不用弯箭头表示电子的偏移;
②右边相同的原子不能合并在一起;
③没有形成离子,不标电荷和中括号 。
例:HCl
原子的电子式
分子的电子式
O
·
·
··
··
H· +
+·H
·
·
O
··
··
·
·
H
H
H2O的形成过程:
1.写出下列物质的电子式并指出共价键类型。
课堂训练
O2 CH4 H2O2
非极性键
极性键
极性键和非极性键
2.用电子式表示H2S的形成过程。
O
··
··
··
··
O
··
··
··
C
H
··
··
H
H
··
H
··
O
··
··
··
··
O
··
··
··
H
H
S
·
·
··
··
H· +
+ ·H
·
·
S
··
··
·
·
H
H
离子键 共价键
概念
成键粒子
成键本质
形成元素
电子式 举例
1、概念:使离子相结合或原子相结合的作用力
化学键
离子键
共价键
非极性键
极性键
四、化学键
··
··
··
··
Na+
[ ]
Cl
-
··
··
··
··
Cl
H
··
··
··
··
Cl
··
··
··
Cl
带相反电荷离子之间的相互作用
原子间通过共用电子对所形成的相互作用
阴、阳离子
原 子
静电作用
形成共用电子对
活泼金属元素与活泼非金属元素
相同或不同的非金属;不活泼金属与非金属元素
离子化合物 共价化合物
概念
构成粒子
粒子间的 作用
物质类别
导电性
熔沸点高低
由离子键构成的化合物叫做离子化合物
以共用电子对形成分子的化合物
阴、阳离子
分子
离子键
共价键
较高
较低
固体不导电,水溶液或熔融状态可导电
水溶液可能导电
强碱、绝大多数盐、活泼金属的氧化物、
活泼金属过氧化物
非金属氧化物、非金属氢化物、含氧酸、大部分有机物
从多角度区别离子化合物和共价化合物
H2和Cl2分子
旧键断裂成原子
新键形成
(HCl分子)
H2和Cl2作用生成HCl的反应过程:
一个化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程。
2、化学反应本质
课堂训练
1.下列这些物质中:①NaCl ② Cl2 ③ KOH
④ HCl ⑤ Na2O2 ⑥H2O2
(1)属于离子化合物有 ,
属于共价化合物的有 。
(2)存在共价键的有 ,
存在离子键的有 。
① ③ ⑤
④ ⑥
② ③ ④⑤ ⑥
① ③ ⑤
课堂小结
1、共价键:原子间通过共用电子对形成的相互作用。
2、共价化合物:以共用电子对形成分子的化合物。
3、会用电子式表示共价化合物的形成过程。
4、能够区分离子化合物和共价化合物,会判断共价键的类型。
5、化学反应的实质就是旧键的断裂和新键的形成。
D
课堂练习
2.下列物质中,既含有非极性共价键又含有极性共价键的是( )
A.NaOH B.CO2 C.N2 D.H2O2
1.下列关于化学键的叙述正确的( )
A.离子化合物只含离子键
B.共价化合物可能含离子键
C.金属原子在化学反应中只能失电子,因而不
能形成共价键
D.离子化合物一定有离子键,也可能有共价键
D
3.所有的物质中都含有化学键。 ( )
4.NaCl固体溶于水形成可以自由移动的Na+和Cl-破坏了什么化学键?HCl气体溶于水形成可以自由移动的H+和Cl-破坏了什么化学键?
离子键;共价键
×
稀有气体单质是单原子分子,不存在化学键。
