九年级化学人教版下册实验活动5一定质量分数的氯化钠溶液的配制课件(共26张PPT)
文档属性
| 名称 | 九年级化学人教版下册实验活动5一定质量分数的氯化钠溶液的配制课件(共26张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-16 22:18:39 | ||
图片预览







文档简介
(共26张PPT)
实验活动5
《一定质量分数的氯化钠溶液的配制》
人教版初中九年级化学下册第九单元
《溶液》
新课教学课件
第九单元《溶液》
§实验活动5
一定质量分数的氯化钠溶液的配制
【实验目的】
2、加深对溶质的质量分数概念的理解。
1、练习配制一定质量分数的溶液。
【实验用品】
托盘天平,烧杯,玻璃棒,药品,量筒,胶头滴管,氯化钠,蒸馏水。
【实验步骤】
(1) 计算:配制50g质量分数为6﹪的氯化钠溶液所需氯化钠和水的质量分别为_____g,_______g。
1.配制质量分数为6﹪的氯化钠溶液
解:氯化钠的质量=溶液质量×溶质质量分数
=50 g×6%=3 g
水的质量=溶液质量-溶质质量
=50 g-3 g=47g
水的体积=47 g×1 g/cm3=47 mL
3g
47g
【实验步骤】
1.配制质量分数为6﹪的氯化钠溶液
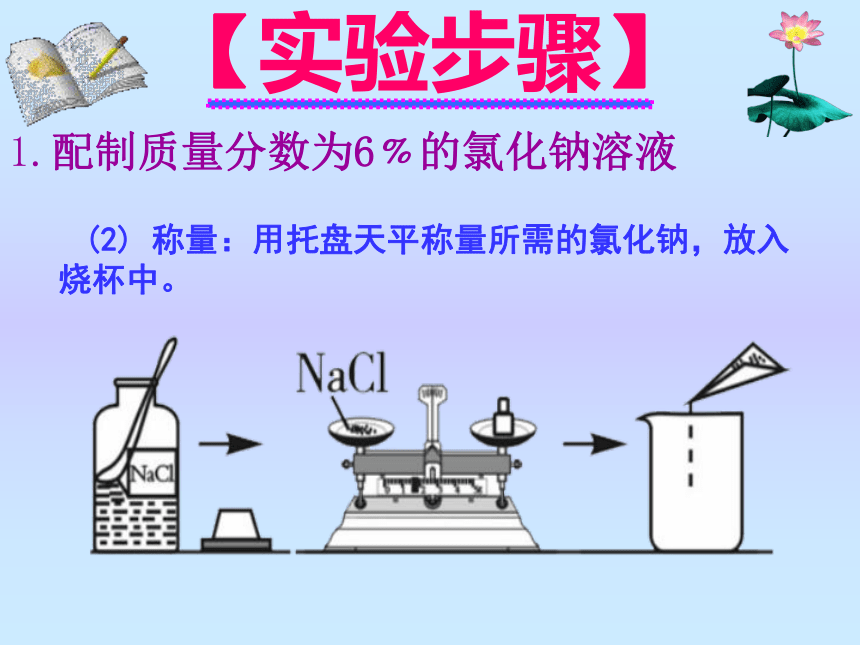
(2) 称量:用托盘天平称量所需的氯化钠,放入烧杯中。
【实验步骤】
1.配制质量分数为6﹪的氯化钠溶液
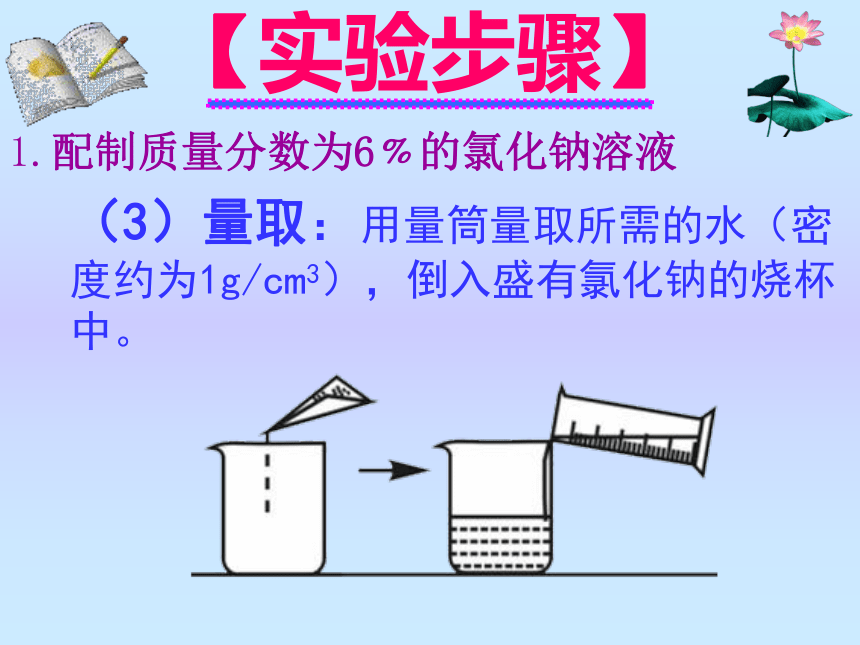
(3)量取:用量筒量取所需的水(密度约为1g/cm3),倒入盛有氯化钠的烧杯中。
【实验步骤】
1.配制质量分数为6﹪的氯化钠溶液
(4)溶解:用玻璃棒搅拌,使氯化钠溶解
【实验步骤】
用已配制好的质量分数为6﹪的氯化钠溶液(密度约为1.04g/cm3),配制50g质量分数为3﹪的氯化钠溶液。
2.配制质量分数为3﹪的氯化钠溶液
(1) 计算:配制50g质量分数为3﹪的氯化钠溶液所需质量分数为6﹪的氯化钠溶液和水的质量分别为_____g(体积______mL),_______g。
解:需要氯化钠溶液xg
6%x=50×3% x=25 g
水=50 g-25 g=25 g
即6%的氯化钠溶液25 g(24 mL),
蒸馏水25 g(25 mL)。
25
24
25
【实验步骤】
用已配制好的质量分数为6﹪的氯化钠溶液(密度约为1.04g/cm3),配制50g质量分数为3﹪的氯化钠溶液。
2.配制质量分数为3﹪的氯化钠溶液
(2) 量取:用量筒量取所需的氯化钠溶液和水,倒入烧杯中。
(3) 混匀:用玻璃棒搅拌,使溶液混合均匀。
3.把配制好的上述两种氯化钠溶液分别装入试剂瓶中,盖好瓶塞并贴上标签(含药品名和溶质的质量分数),放到试剂柜中。
【问题与交流】
问题1:用托盘天平称量氯化钠时,有哪些注意事项?
(1)首先观察天平是否平衡,如果不平衡,需要调节天平的平衡螺母,使天平达到平衡 。
(2)在天平的两盘分别垫一张大小相同的干净的白纸。
(3)用镊子将天平的游码调到3g处
(4)用药匙将固体氯化钠放入天平的左盘,直至天平达到平衡。
【问题与交流】
问题2:用量筒量取液体,读数时应注意什么?
(1)量液时,量筒必须平放,视线要与量筒内液体的凹液面的最低处保持水平,再读取液体的体积 。
(2)俯视或仰视时,读数与实际数值的关系是:俯视读数偏大,仰视读数偏小 。
【问题与交流】
问题3:准确配制一定质量分数的溶液,在实际应用中有什么重要意义?请举例说明。
准确配制一定质量分数的溶液,在工农业生产中有重要的现实意义。例如:在施用农药时,就应该准确地知道一定量的药液中所含农药的量。如果药液过浓,会毒害农作物。如果药液过稀,又不能有效地杀虫灭菌。
1.用氯化钠固体配制一定溶质质量分数的氯化钠溶液需要用到的仪器有( )
①烧杯 ②量筒 ③药匙 ④托盘天平 ⑤玻璃棒
⑥漏斗 ⑦蒸发皿
A.全部 B.①②③④⑤
C.①③④⑤ D.①⑤⑥⑦
2.下列叙述不正确的是( )
A.在水净化的单一操作中,蒸馏是净化程度较高的方法之一
B.常用肥皂水检验硬水和软水
C.用密度约为1.04 g/cm3的6%的氯化钠溶液配制3%的氯化钠溶液一定要使用托盘天平
D.用5%的过氧化氢溶液制氧气,为加快该反应的速率常加少量二氧化锰作催化剂
B
C
3.实验室用密度为1.84 g/cm3、质量分数为98%的浓硫酸和蒸馏水,配制500 g质量分数为20%的稀硫酸。需要用多少毫升的量筒量取多少毫升的浓硫酸( )
A.100 mL 55.5 mL B.100 mL 54.35 mL
C.250 mL 54.35 mL D.250 mL 55.5 mL
4.实验室要配制50 g10%的氯化钠溶液,其中操作方法不正确的是( )
A.计算所需氯化钠的质量为5 g,水的体积为45 mL
B.在托盘天平左盘加5 g砝码,然后在右盘添加氯化钠至天平平衡,再将氯化钠倒入烧杯中
C.用50 mL量筒量取45 mL水,倒入上述烧杯中
D.用玻璃棒搅拌,使氯化钠完全溶解
A
B
5.某同学配制好80 g6%的氯化钠溶液后,将烧杯中的溶液装入试剂瓶时,不慎洒出一部分,则对试剂瓶中溶液的判断正确的是( )
A.溶质的质量不变
B.溶剂的质量不变
C.溶液的质量不变
D.溶质的质量分数不变
D
6.要配制50 g质量分数为20%的硝酸钾溶液,现提供25 g质量分数为40%的硝酸钾溶液、20 g质量分数为15%的硝酸钾溶液及足够多的固体硝酸钾和水,请选用上述药品,设计三套配制方案填入下表。
配制方案(只说明配制时所需各种药品药量)
方案一
方案二
方案三
把10g硝酸钾溶于40g水中
25g40%的硝酸钾溶液和25g水
20g15%的硝酸钾溶液和7g硝酸钾和23g水
7.阿霞要配制80 g质量分数为10%的氯化钠溶液,请你协助她解决以下问题:
(1)写出A仪器的名称____。
(2)氯化钠固体中混有少量泥沙,为除去杂质进行了如下操作:
①将固体倒入烧杯加水溶解;②将烧杯中的溶液进行过滤;③将滤液进行蒸发,当酒精灯加热到 时,停止加热。
漏斗
蒸发皿中出现大量固体
(3)称量提纯后的8 g氯化钠时,C出现了右盘低的现象,接下来的操作应是____(填序号)。
①左边的平衡螺丝向左调 ②右边的平衡螺丝向右调
③右盘中减少砝码 ④左盘中增加氯化钠
(4)D中用玻璃棒搅拌的作用是 。
④
加速溶解
(3)称量提纯后的8 g氯化钠时,C出现了右盘低的现象,接下来的操作应是____(填序号)。
①左边的平衡螺丝向左调 ②右边的平衡螺丝向右调
③右盘中减少砝码 ④左盘中增加氯化钠
(4)D中用玻璃棒搅拌的作用是 。
④
加速溶解
(1)计算需要氢氧化钠的质量为____。
需要水的体积为 mL__。
(2)用上述图示的序号
表示配制溶液的操作顺序: 。
(3)量取所需要的水应选择 (填“10 mL”“50 mL”或“100 mL”)量筒。
(4)①的错误操作导致所配置的溶液的溶质质量分数____ (填“偏大”“偏小”或“不变”),若其他操作均正确,①操作导致最后实际所配置的溶液的溶质质量分数约为
。
(5)③的错误操作导致所配置的溶液的质量分数____(填“偏大”“偏小”或“不变”),
改正: 。
2.5g
47.5
④①③⑤②
50mL
偏小
3.1%
偏小
视线与凹液面的最低处保持水平
8.小明欲配制50 g质量分数为5%的氢氧化钠溶液。如图是实验操作示意图:
9.配制一定溶质质量分数的氯化钠溶液,下列操作错误的是 ( )
B
10.配制100g质量分数为10%的NaOH溶液,用量筒量取水时俯视刻度线,则配制溶液溶质的质量分数时( )
A.等于10%
B.大于10%
C.小于10%
D.无法确定
B
11.小红在实验室欲配制一定质量分数的食盐溶液
(1)B仪器的名称是 ,上面的仪器中除B、E外,她必须选用的仪器还有(填字母编号) ;
(2)E的作用是 。
烧杯
D.G
搅拌,加速溶解
12.配制溶质质量分数一定的氯化钠溶液常按以下操作顺序进行。
请回答下列问题:
(1)农业上需要100g溶质质量分数为16%的氯化钠溶液来选种,
需: 氯化钠 g,水 g。
(2)用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应 ;若发现指针向右偏转,应 。
A.移动游码 B.减少适量氯化钠固体 C.调节平衡螺母 D.增加适量氯化钠固体
B
16
84
D
13、某实验小组利用图1所示仪器进行“配制质量分数一定的氯化钠溶液”的实验:
(1)完成此实验正确的操作顺序是(填序号) ; ①溶解;②把配好的溶液装入试剂瓶;③称量;④计算
(2)按实验要求,图1中还缺少的玻璃仪器是 ;
(3)小红按图2的操作称取氯化钠,小亮发现小红的操作有错误.你认为小红操作中的错误是 ;
他们原计划配制溶液的溶质质量分数是 。
而实际配制溶液的溶质质量分数是 。
④③①②
玻璃棒
砝码和氯化钠放反了
18%
图3
12%
14、100g稀硫酸恰好和13g锌完全反应 。①求该稀硫酸溶质的质量分数,②生成氢气的质量,③反应后溶液的溶质质量分数。
H2SO4 + Zn = ZnSO4 + H2
98 65 161 2
13g
解:设100g稀硫酸中含溶质H2SO4的质量为x,生成氢气质量为y,生成硫酸锌的质量为z。
x=19.6g
x
98
65
13g
x
z
该稀硫酸溶质的质量分数=19.6g÷100g×100%= 19.6%
13g
65
2
y
y=0.4g
生成氢气的质量为0.4g.
y
15、100g稀硫酸恰好和13g锌完全反应 。①求该稀硫酸溶质的质量分数,②生成氢气的质量,③反应后溶液的溶质质量分数。
H2SO4 + Zn = ZnSO4 + H2
98 65 161 2
13g
解:设100g稀硫酸中含溶质H2SO4的质量为x,生成氢气质量为y,生成硫酸锌的质量为z。
x
z
y
13g
65
161
z
z=32.2g
反应后溶液的质量=100g+13g-0.4g=112.6g
反应后溶液的溶质质量分数=32.2g÷112.6g×100%
= 28.6%
实验活动5
《一定质量分数的氯化钠溶液的配制》
人教版初中九年级化学下册第九单元
《溶液》
新课教学课件
第九单元《溶液》
§实验活动5
一定质量分数的氯化钠溶液的配制
【实验目的】
2、加深对溶质的质量分数概念的理解。
1、练习配制一定质量分数的溶液。
【实验用品】
托盘天平,烧杯,玻璃棒,药品,量筒,胶头滴管,氯化钠,蒸馏水。
【实验步骤】
(1) 计算:配制50g质量分数为6﹪的氯化钠溶液所需氯化钠和水的质量分别为_____g,_______g。
1.配制质量分数为6﹪的氯化钠溶液
解:氯化钠的质量=溶液质量×溶质质量分数
=50 g×6%=3 g
水的质量=溶液质量-溶质质量
=50 g-3 g=47g
水的体积=47 g×1 g/cm3=47 mL
3g
47g
【实验步骤】
1.配制质量分数为6﹪的氯化钠溶液
(2) 称量:用托盘天平称量所需的氯化钠,放入烧杯中。
【实验步骤】
1.配制质量分数为6﹪的氯化钠溶液
(3)量取:用量筒量取所需的水(密度约为1g/cm3),倒入盛有氯化钠的烧杯中。
【实验步骤】
1.配制质量分数为6﹪的氯化钠溶液
(4)溶解:用玻璃棒搅拌,使氯化钠溶解
【实验步骤】
用已配制好的质量分数为6﹪的氯化钠溶液(密度约为1.04g/cm3),配制50g质量分数为3﹪的氯化钠溶液。
2.配制质量分数为3﹪的氯化钠溶液
(1) 计算:配制50g质量分数为3﹪的氯化钠溶液所需质量分数为6﹪的氯化钠溶液和水的质量分别为_____g(体积______mL),_______g。
解:需要氯化钠溶液xg
6%x=50×3% x=25 g
水=50 g-25 g=25 g
即6%的氯化钠溶液25 g(24 mL),
蒸馏水25 g(25 mL)。
25
24
25
【实验步骤】
用已配制好的质量分数为6﹪的氯化钠溶液(密度约为1.04g/cm3),配制50g质量分数为3﹪的氯化钠溶液。
2.配制质量分数为3﹪的氯化钠溶液
(2) 量取:用量筒量取所需的氯化钠溶液和水,倒入烧杯中。
(3) 混匀:用玻璃棒搅拌,使溶液混合均匀。
3.把配制好的上述两种氯化钠溶液分别装入试剂瓶中,盖好瓶塞并贴上标签(含药品名和溶质的质量分数),放到试剂柜中。
【问题与交流】
问题1:用托盘天平称量氯化钠时,有哪些注意事项?
(1)首先观察天平是否平衡,如果不平衡,需要调节天平的平衡螺母,使天平达到平衡 。
(2)在天平的两盘分别垫一张大小相同的干净的白纸。
(3)用镊子将天平的游码调到3g处
(4)用药匙将固体氯化钠放入天平的左盘,直至天平达到平衡。
【问题与交流】
问题2:用量筒量取液体,读数时应注意什么?
(1)量液时,量筒必须平放,视线要与量筒内液体的凹液面的最低处保持水平,再读取液体的体积 。
(2)俯视或仰视时,读数与实际数值的关系是:俯视读数偏大,仰视读数偏小 。
【问题与交流】
问题3:准确配制一定质量分数的溶液,在实际应用中有什么重要意义?请举例说明。
准确配制一定质量分数的溶液,在工农业生产中有重要的现实意义。例如:在施用农药时,就应该准确地知道一定量的药液中所含农药的量。如果药液过浓,会毒害农作物。如果药液过稀,又不能有效地杀虫灭菌。
1.用氯化钠固体配制一定溶质质量分数的氯化钠溶液需要用到的仪器有( )
①烧杯 ②量筒 ③药匙 ④托盘天平 ⑤玻璃棒
⑥漏斗 ⑦蒸发皿
A.全部 B.①②③④⑤
C.①③④⑤ D.①⑤⑥⑦
2.下列叙述不正确的是( )
A.在水净化的单一操作中,蒸馏是净化程度较高的方法之一
B.常用肥皂水检验硬水和软水
C.用密度约为1.04 g/cm3的6%的氯化钠溶液配制3%的氯化钠溶液一定要使用托盘天平
D.用5%的过氧化氢溶液制氧气,为加快该反应的速率常加少量二氧化锰作催化剂
B
C
3.实验室用密度为1.84 g/cm3、质量分数为98%的浓硫酸和蒸馏水,配制500 g质量分数为20%的稀硫酸。需要用多少毫升的量筒量取多少毫升的浓硫酸( )
A.100 mL 55.5 mL B.100 mL 54.35 mL
C.250 mL 54.35 mL D.250 mL 55.5 mL
4.实验室要配制50 g10%的氯化钠溶液,其中操作方法不正确的是( )
A.计算所需氯化钠的质量为5 g,水的体积为45 mL
B.在托盘天平左盘加5 g砝码,然后在右盘添加氯化钠至天平平衡,再将氯化钠倒入烧杯中
C.用50 mL量筒量取45 mL水,倒入上述烧杯中
D.用玻璃棒搅拌,使氯化钠完全溶解
A
B
5.某同学配制好80 g6%的氯化钠溶液后,将烧杯中的溶液装入试剂瓶时,不慎洒出一部分,则对试剂瓶中溶液的判断正确的是( )
A.溶质的质量不变
B.溶剂的质量不变
C.溶液的质量不变
D.溶质的质量分数不变
D
6.要配制50 g质量分数为20%的硝酸钾溶液,现提供25 g质量分数为40%的硝酸钾溶液、20 g质量分数为15%的硝酸钾溶液及足够多的固体硝酸钾和水,请选用上述药品,设计三套配制方案填入下表。
配制方案(只说明配制时所需各种药品药量)
方案一
方案二
方案三
把10g硝酸钾溶于40g水中
25g40%的硝酸钾溶液和25g水
20g15%的硝酸钾溶液和7g硝酸钾和23g水
7.阿霞要配制80 g质量分数为10%的氯化钠溶液,请你协助她解决以下问题:
(1)写出A仪器的名称____。
(2)氯化钠固体中混有少量泥沙,为除去杂质进行了如下操作:
①将固体倒入烧杯加水溶解;②将烧杯中的溶液进行过滤;③将滤液进行蒸发,当酒精灯加热到 时,停止加热。
漏斗
蒸发皿中出现大量固体
(3)称量提纯后的8 g氯化钠时,C出现了右盘低的现象,接下来的操作应是____(填序号)。
①左边的平衡螺丝向左调 ②右边的平衡螺丝向右调
③右盘中减少砝码 ④左盘中增加氯化钠
(4)D中用玻璃棒搅拌的作用是 。
④
加速溶解
(3)称量提纯后的8 g氯化钠时,C出现了右盘低的现象,接下来的操作应是____(填序号)。
①左边的平衡螺丝向左调 ②右边的平衡螺丝向右调
③右盘中减少砝码 ④左盘中增加氯化钠
(4)D中用玻璃棒搅拌的作用是 。
④
加速溶解
(1)计算需要氢氧化钠的质量为____。
需要水的体积为 mL__。
(2)用上述图示的序号
表示配制溶液的操作顺序: 。
(3)量取所需要的水应选择 (填“10 mL”“50 mL”或“100 mL”)量筒。
(4)①的错误操作导致所配置的溶液的溶质质量分数____ (填“偏大”“偏小”或“不变”),若其他操作均正确,①操作导致最后实际所配置的溶液的溶质质量分数约为
。
(5)③的错误操作导致所配置的溶液的质量分数____(填“偏大”“偏小”或“不变”),
改正: 。
2.5g
47.5
④①③⑤②
50mL
偏小
3.1%
偏小
视线与凹液面的最低处保持水平
8.小明欲配制50 g质量分数为5%的氢氧化钠溶液。如图是实验操作示意图:
9.配制一定溶质质量分数的氯化钠溶液,下列操作错误的是 ( )
B
10.配制100g质量分数为10%的NaOH溶液,用量筒量取水时俯视刻度线,则配制溶液溶质的质量分数时( )
A.等于10%
B.大于10%
C.小于10%
D.无法确定
B
11.小红在实验室欲配制一定质量分数的食盐溶液
(1)B仪器的名称是 ,上面的仪器中除B、E外,她必须选用的仪器还有(填字母编号) ;
(2)E的作用是 。
烧杯
D.G
搅拌,加速溶解
12.配制溶质质量分数一定的氯化钠溶液常按以下操作顺序进行。
请回答下列问题:
(1)农业上需要100g溶质质量分数为16%的氯化钠溶液来选种,
需: 氯化钠 g,水 g。
(2)用托盘天平称量所需的氯化钠时,发现托盘天平的指针偏向左盘,应 ;若发现指针向右偏转,应 。
A.移动游码 B.减少适量氯化钠固体 C.调节平衡螺母 D.增加适量氯化钠固体
B
16
84
D
13、某实验小组利用图1所示仪器进行“配制质量分数一定的氯化钠溶液”的实验:
(1)完成此实验正确的操作顺序是(填序号) ; ①溶解;②把配好的溶液装入试剂瓶;③称量;④计算
(2)按实验要求,图1中还缺少的玻璃仪器是 ;
(3)小红按图2的操作称取氯化钠,小亮发现小红的操作有错误.你认为小红操作中的错误是 ;
他们原计划配制溶液的溶质质量分数是 。
而实际配制溶液的溶质质量分数是 。
④③①②
玻璃棒
砝码和氯化钠放反了
18%
图3
12%
14、100g稀硫酸恰好和13g锌完全反应 。①求该稀硫酸溶质的质量分数,②生成氢气的质量,③反应后溶液的溶质质量分数。
H2SO4 + Zn = ZnSO4 + H2
98 65 161 2
13g
解:设100g稀硫酸中含溶质H2SO4的质量为x,生成氢气质量为y,生成硫酸锌的质量为z。
x=19.6g
x
98
65
13g
x
z
该稀硫酸溶质的质量分数=19.6g÷100g×100%= 19.6%
13g
65
2
y
y=0.4g
生成氢气的质量为0.4g.
y
15、100g稀硫酸恰好和13g锌完全反应 。①求该稀硫酸溶质的质量分数,②生成氢气的质量,③反应后溶液的溶质质量分数。
H2SO4 + Zn = ZnSO4 + H2
98 65 161 2
13g
解:设100g稀硫酸中含溶质H2SO4的质量为x,生成氢气质量为y,生成硫酸锌的质量为z。
x
z
y
13g
65
161
z
z=32.2g
反应后溶液的质量=100g+13g-0.4g=112.6g
反应后溶液的溶质质量分数=32.2g÷112.6g×100%
= 28.6%
同课章节目录
