粤教版九年级化学下册6.3 金属矿物与冶炼课件(共35张PPT)
文档属性
| 名称 | 粤教版九年级化学下册6.3 金属矿物与冶炼课件(共35张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 4.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-17 09:11:20 | ||
图片预览











文档简介
(共35张PPT)
6.3 金属矿物与冶炼
第六章 金属
5
典型例题
4
课堂小结
3
新课讲授
2
课堂导入
1
知识回顾
1
知识回顾
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
H
Cu
Hg
Ag
Pt
Au
K
金属活动性由强到弱
一、金属活动性顺序
根据金属活动性顺序我们可以知道:
1.在金属活动性顺序里:金属的位置越______ ,它的活动性就越强。
靠前
2. 在金属活动性顺序里:位于____前面的金属能置换出盐酸、稀硫酸中的_____。
氢
氢
3. 在金属活动性顺序里:位于_____的金属能把位
于____的金属从它们的化合物的_____里置换出来。(K、Ca、Na除外!)
前面
后面
溶液
二、金属活动性顺序的应用
1.判断金属能否跟酸反应及反应的快慢;
2.判断金属能否与盐溶液反应;
3.判断金属与混合盐溶液的反应先后顺序。
2
课堂导入
大家知道沙里淘金是怎么回事吗?
由于黄金的化学性质稳定,一般不与其他物质反应,所以它以游离态存在于沙石中,在自然的风化作用下,岩石破碎,最后形成沙子和土,而颗粒状的金沙就埋藏在其中,在流水的冲刷、搬运下,泥沙、金子的颗粒和水一起移动。
采金
根据沙和金的密度不同,人们把含有金屑的沙粒在水中荡洗,使沙随水流去而金沉在底部,这就是常说的淘金。经过淘洗大量的沙子后,可以得到很少很少的金粒。
想一想,社会上常用的金属是从哪里来的?
淘洗后的金粒
3
新课讲授
为人类社会作出许多贡献的金属来自地壳中天然存在的矿物。
金属的存在主要有两种形态:
(1)单质形态:少数化学性质__________的金属,以单质形态存在,如________、________、________。
(2)化合物形态:绝大多数金属都是以__________形态存在于矿物之中,如赤铁矿、钛铁矿等。
很不活泼
金
银
铂
化合物
01
几种金属矿物
自然界以单质形式存在的金
自然界以单质形式存在的银
赤铁矿
主要成分Fe2O3
磁铁矿
主要成分Fe3O4
黄铁矿
主要成分FeS2
铁矿物
孔雀石
主要成分Cu2(OH)2CO3
赤铜矿
主要成分Cu2O
铝土矿
主要成分Al2O3
铜矿物
铝矿物
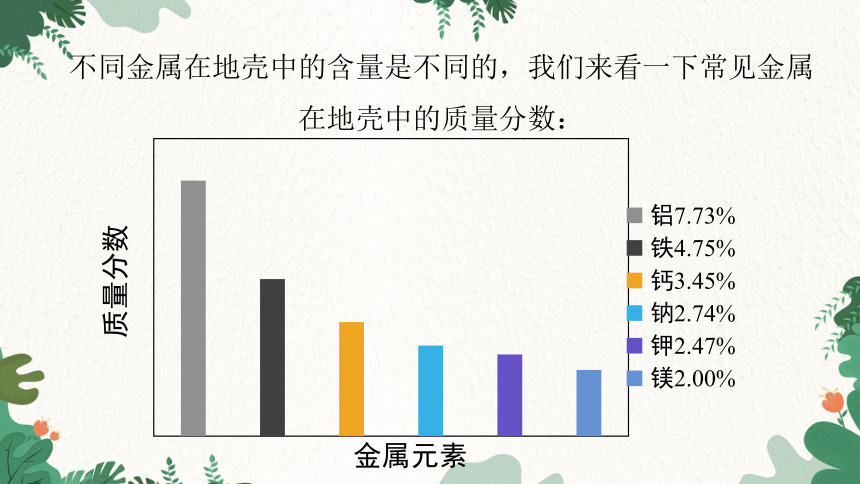
不同金属在地壳中的含量是不同的,我们来看一下常见金属在地壳中的质量分数:
由图表可知:地壳中含量最高的金属是铝,其次是铁;
铝、铁加上钙、钠、钾、镁这6种金属元素,占了地壳总含量的23.14%,其余金属的含量是非常少的。
想一想:自然界中的金属矿物是如何变成人们使用的金属产品的呢?
02
钢铁是怎样炼成的?
我们以产量最大、应用最广的铁为例,学习金属冶炼的基本原理。
观察活动
知道炼铁的原理
【实验6-5】利用如图所示的装置,进行一氧化碳与氧化铁反应生成铁的实验。
(1)验纯,检查装置的气密性
(2)先通一氧化碳气体,点燃最后的酒精灯,最后再点燃酒精喷灯。
(3)当红棕色粉末已转变成黑色后,停止加热,再通一会CO,直至玻璃管冷却。
Fe2O3 +3CO === 2Fe +3CO2
高温
1.药品:赤铁矿(Fe2O3),一氧化碳(CO)
2.原理:
3.实验步骤:
现象:①红色粉末(氧化铁)逐渐变成黑色,②澄清的石灰水逐渐变浑浊,③尾气燃烧产生蓝色火焰。
相关化学方程式:
Fe2O3 +3CO === 2Fe+3CO2;
高温
Ca(OH)2 +CO2 === H2O+CaCO3
2CO+O2 === 2CO2
点燃
①
②
③
【思考】
1.为什么通入一氧化碳,等片刻后点燃尖嘴管处酒精灯?
排尽装置内的空气,防止加热发生爆炸。
2.当红棕色粉末已转变成黑色后,停止加热,再通一会CO,直至玻璃管冷却,为什么?
防止生成的铁重新被氧化;或石灰水倒流,炸裂玻璃管。
炼铁的反应原理解读:
Fe2O3 + 3CO === 2Fe + 3CO2
高温
氧化反应:得到氧的反应
还原反应:失去氧的反应
Fe2O3:能提供氧,具有氧化性;(氧化剂)
CO:能夺氧,具有还原性。(还原剂)
CO、H2 、C
具有还原性的物质:
3C+2Fe2O3 === 4Fe+3CO2↑
高温
练习:请写出H2和C还原Fe2O3的化学方程式
高温
3H2+Fe2O3 === 2Fe+3H2O
钢铁厂炼铁就是根据上述化学反应原理进行的,采用的主要设备是高炉(如右图)。
将铁矿石(主要是赤铁矿)、焦炭和石灰石按一定的比例加入高炉,从炉下部通进热风,使焦炭转变成一氧化碳,并利用它将铁矿石中的铁还原出来。
原料
进气口
思考:石灰石的作用是什么?
使有矿石中的脉石(如二氧化硅)转变成炉渣而除去。
实际上,高炉炼得的铁里含有2%-4.3%的碳,以及少量磷和硫,因而是铁的合金—生铁。它硬而脆,不利于加工。
所以,人们还要把生铁放在炼钢炉里,吹进氧气治炼,使其含碳量降至0.03%-2%,并除去磷、硫等杂质,所得产品称为钢。它硬而韧,有弹性,可锻。
生铁
钢
①吹氧冶炼
②除磷、硫
类别 含碳量/% 含杂质 (硫、磷等) 机械性能 机械加工
生铁
钢
2-4.3
0.03-2
多
少
硬而脆
硬而韧,有弹性
可铸不可锻
可铸可锻
早在春秋战国时期,我国就开始生产和使用铁器。
中国古代冶铁图
03
我国冶铁行业的发展简史
1949年,我国钢的年产量仅15.8万吨,人均不足0.25kg。新中国成立之后,特别是改革开放以来,钢铁工业飞快发展,近年来年产量都居世界首位,钢材的品种也大大增加。
为纪念1996年中国钢产量突破1亿吨而发行的邮票
有关杂质问题的计算:
例题:用1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少吨?
分析:带入化学方程式计算的数据应是纯净物的质量:
方法1:根据化学式:
1000t×80%×70%÷96%=583.3t
方法2:根据化学方程式
赤铁矿石 氧化铁 铁 生铁
解:设理论上可以炼出含铁96%的生铁的质量为x
160 2×56
1000t×80% x·96%
x =
2×56×1000t×80%
160×96%
= 583.3 t
答:理论上可以炼出含铁96%的生铁的质量为583.3 t 。
Fe2O3+3CO === 2Fe+3CO2
高温
知识视窗
金属冶炼的常用方法
越活泼的金属,越容易与其他物质形成化合物,也就越难从化合物中还原出金属单质。
越不活泼的金属, 越不容易与其他物质形成化合物,也就越容易从化合物中还原出金属单质。
根据金属活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au
金 属 活 动 性 由 强 渐 弱
1.活泼金属(如K Ca Na Mg AI):
电解法: 2Al2O3 === 4Al+3O2
通电
2.一般金属(如Zn Fe Sn Pb Cu)
热还原法: Fe2O3+3CO === 2Fe+3CO2
高温
3.较稳定金属(如Hg Ag)
直接加热法:2HgO === 2Hg+O2
加热
4.稳定金属(如Pt Au) : 直接以单质形式存在
金属矿物与冶炼
CO
还原Fe2O3
铁的冶炼
金属矿物
化合物
单质
工业炼铁
原理
含杂质物质的计算
铜矿物
铁矿物
铝矿物
金
铂
银
原理
原料
设备
0
4
课堂小结
5
典型例题
1.自然界中以单质形式存在的金属是( )
A.金
B.铁
C.铝
D.铜
A
2.金属化合物在自然界中大多以矿物形式存在,下列选项中不属于矿物的是( )
A.黄铁矿
B.孔雀石
C.赤铜矿
D.碳素钢
D
3.某同学用如图装置进行CO与Fe2O3的反应。下列说法错误的是( )
A.加热前应先通入一段时间的CO以排尽装置内的空气
B.溶液X是NaOH溶液,可吸收尾气
C.溶液X是Ca(OH)2溶液以检验产生的CO2气体
D.反应后的固体可能是Fe和Fe2O3的混合物,无法通过加入盐酸并过滤的方法分离得到Fe
B
4.用CO还原氧化铁的实验中,下列操作错误的是( )
A.先通CO对氧化铁加热
B.可用石灰水来验证产生的气体
C.暗红色固体全变成黑色后,先停止通CO后停止加热
D.可用酒精灯的火焰烧掉反应剩余的CO
C
5.下列关于实验室模拟工业炼铁的过程说法错误的是( )
A.实验前要检查装置气密性
B.实验开始要先通一段时间一氧化碳再加热
C.实验结束后要先停止一氧化碳再停止加热
D.实验过程要注意尾气处理
C
6.在炼铁的过程中,下列叙述错误的是( )
A.石灰石的主要作用是除去SiO2
B.用CO将铁从铁矿石中还原出来
C.焦炭燃烧放出大量的热,提高炉温并产生CO
D.炼铁的尾气可以随意的排放
D
6.3 金属矿物与冶炼
第六章 金属
5
典型例题
4
课堂小结
3
新课讲授
2
课堂导入
1
知识回顾
1
知识回顾
Ca
Na
Mg
Al
Zn
Fe
Sn
Pb
H
Cu
Hg
Ag
Pt
Au
K
金属活动性由强到弱
一、金属活动性顺序
根据金属活动性顺序我们可以知道:
1.在金属活动性顺序里:金属的位置越______ ,它的活动性就越强。
靠前
2. 在金属活动性顺序里:位于____前面的金属能置换出盐酸、稀硫酸中的_____。
氢
氢
3. 在金属活动性顺序里:位于_____的金属能把位
于____的金属从它们的化合物的_____里置换出来。(K、Ca、Na除外!)
前面
后面
溶液
二、金属活动性顺序的应用
1.判断金属能否跟酸反应及反应的快慢;
2.判断金属能否与盐溶液反应;
3.判断金属与混合盐溶液的反应先后顺序。
2
课堂导入
大家知道沙里淘金是怎么回事吗?
由于黄金的化学性质稳定,一般不与其他物质反应,所以它以游离态存在于沙石中,在自然的风化作用下,岩石破碎,最后形成沙子和土,而颗粒状的金沙就埋藏在其中,在流水的冲刷、搬运下,泥沙、金子的颗粒和水一起移动。
采金
根据沙和金的密度不同,人们把含有金屑的沙粒在水中荡洗,使沙随水流去而金沉在底部,这就是常说的淘金。经过淘洗大量的沙子后,可以得到很少很少的金粒。
想一想,社会上常用的金属是从哪里来的?
淘洗后的金粒
3
新课讲授
为人类社会作出许多贡献的金属来自地壳中天然存在的矿物。
金属的存在主要有两种形态:
(1)单质形态:少数化学性质__________的金属,以单质形态存在,如________、________、________。
(2)化合物形态:绝大多数金属都是以__________形态存在于矿物之中,如赤铁矿、钛铁矿等。
很不活泼
金
银
铂
化合物
01
几种金属矿物
自然界以单质形式存在的金
自然界以单质形式存在的银
赤铁矿
主要成分Fe2O3
磁铁矿
主要成分Fe3O4
黄铁矿
主要成分FeS2
铁矿物
孔雀石
主要成分Cu2(OH)2CO3
赤铜矿
主要成分Cu2O
铝土矿
主要成分Al2O3
铜矿物
铝矿物
不同金属在地壳中的含量是不同的,我们来看一下常见金属在地壳中的质量分数:
由图表可知:地壳中含量最高的金属是铝,其次是铁;
铝、铁加上钙、钠、钾、镁这6种金属元素,占了地壳总含量的23.14%,其余金属的含量是非常少的。
想一想:自然界中的金属矿物是如何变成人们使用的金属产品的呢?
02
钢铁是怎样炼成的?
我们以产量最大、应用最广的铁为例,学习金属冶炼的基本原理。
观察活动
知道炼铁的原理
【实验6-5】利用如图所示的装置,进行一氧化碳与氧化铁反应生成铁的实验。
(1)验纯,检查装置的气密性
(2)先通一氧化碳气体,点燃最后的酒精灯,最后再点燃酒精喷灯。
(3)当红棕色粉末已转变成黑色后,停止加热,再通一会CO,直至玻璃管冷却。
Fe2O3 +3CO === 2Fe +3CO2
高温
1.药品:赤铁矿(Fe2O3),一氧化碳(CO)
2.原理:
3.实验步骤:
现象:①红色粉末(氧化铁)逐渐变成黑色,②澄清的石灰水逐渐变浑浊,③尾气燃烧产生蓝色火焰。
相关化学方程式:
Fe2O3 +3CO === 2Fe+3CO2;
高温
Ca(OH)2 +CO2 === H2O+CaCO3
2CO+O2 === 2CO2
点燃
①
②
③
【思考】
1.为什么通入一氧化碳,等片刻后点燃尖嘴管处酒精灯?
排尽装置内的空气,防止加热发生爆炸。
2.当红棕色粉末已转变成黑色后,停止加热,再通一会CO,直至玻璃管冷却,为什么?
防止生成的铁重新被氧化;或石灰水倒流,炸裂玻璃管。
炼铁的反应原理解读:
Fe2O3 + 3CO === 2Fe + 3CO2
高温
氧化反应:得到氧的反应
还原反应:失去氧的反应
Fe2O3:能提供氧,具有氧化性;(氧化剂)
CO:能夺氧,具有还原性。(还原剂)
CO、H2 、C
具有还原性的物质:
3C+2Fe2O3 === 4Fe+3CO2↑
高温
练习:请写出H2和C还原Fe2O3的化学方程式
高温
3H2+Fe2O3 === 2Fe+3H2O
钢铁厂炼铁就是根据上述化学反应原理进行的,采用的主要设备是高炉(如右图)。
将铁矿石(主要是赤铁矿)、焦炭和石灰石按一定的比例加入高炉,从炉下部通进热风,使焦炭转变成一氧化碳,并利用它将铁矿石中的铁还原出来。
原料
进气口
思考:石灰石的作用是什么?
使有矿石中的脉石(如二氧化硅)转变成炉渣而除去。
实际上,高炉炼得的铁里含有2%-4.3%的碳,以及少量磷和硫,因而是铁的合金—生铁。它硬而脆,不利于加工。
所以,人们还要把生铁放在炼钢炉里,吹进氧气治炼,使其含碳量降至0.03%-2%,并除去磷、硫等杂质,所得产品称为钢。它硬而韧,有弹性,可锻。
生铁
钢
①吹氧冶炼
②除磷、硫
类别 含碳量/% 含杂质 (硫、磷等) 机械性能 机械加工
生铁
钢
2-4.3
0.03-2
多
少
硬而脆
硬而韧,有弹性
可铸不可锻
可铸可锻
早在春秋战国时期,我国就开始生产和使用铁器。
中国古代冶铁图
03
我国冶铁行业的发展简史
1949年,我国钢的年产量仅15.8万吨,人均不足0.25kg。新中国成立之后,特别是改革开放以来,钢铁工业飞快发展,近年来年产量都居世界首位,钢材的品种也大大增加。
为纪念1996年中国钢产量突破1亿吨而发行的邮票
有关杂质问题的计算:
例题:用1000t含氧化铁80%的赤铁矿石,理论上可以炼出含铁96%的生铁的质量是多少吨?
分析:带入化学方程式计算的数据应是纯净物的质量:
方法1:根据化学式:
1000t×80%×70%÷96%=583.3t
方法2:根据化学方程式
赤铁矿石 氧化铁 铁 生铁
解:设理论上可以炼出含铁96%的生铁的质量为x
160 2×56
1000t×80% x·96%
x =
2×56×1000t×80%
160×96%
= 583.3 t
答:理论上可以炼出含铁96%的生铁的质量为583.3 t 。
Fe2O3+3CO === 2Fe+3CO2
高温
知识视窗
金属冶炼的常用方法
越活泼的金属,越容易与其他物质形成化合物,也就越难从化合物中还原出金属单质。
越不活泼的金属, 越不容易与其他物质形成化合物,也就越容易从化合物中还原出金属单质。
根据金属活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au
金 属 活 动 性 由 强 渐 弱
1.活泼金属(如K Ca Na Mg AI):
电解法: 2Al2O3 === 4Al+3O2
通电
2.一般金属(如Zn Fe Sn Pb Cu)
热还原法: Fe2O3+3CO === 2Fe+3CO2
高温
3.较稳定金属(如Hg Ag)
直接加热法:2HgO === 2Hg+O2
加热
4.稳定金属(如Pt Au) : 直接以单质形式存在
金属矿物与冶炼
CO
还原Fe2O3
铁的冶炼
金属矿物
化合物
单质
工业炼铁
原理
含杂质物质的计算
铜矿物
铁矿物
铝矿物
金
铂
银
原理
原料
设备
0
4
课堂小结
5
典型例题
1.自然界中以单质形式存在的金属是( )
A.金
B.铁
C.铝
D.铜
A
2.金属化合物在自然界中大多以矿物形式存在,下列选项中不属于矿物的是( )
A.黄铁矿
B.孔雀石
C.赤铜矿
D.碳素钢
D
3.某同学用如图装置进行CO与Fe2O3的反应。下列说法错误的是( )
A.加热前应先通入一段时间的CO以排尽装置内的空气
B.溶液X是NaOH溶液,可吸收尾气
C.溶液X是Ca(OH)2溶液以检验产生的CO2气体
D.反应后的固体可能是Fe和Fe2O3的混合物,无法通过加入盐酸并过滤的方法分离得到Fe
B
4.用CO还原氧化铁的实验中,下列操作错误的是( )
A.先通CO对氧化铁加热
B.可用石灰水来验证产生的气体
C.暗红色固体全变成黑色后,先停止通CO后停止加热
D.可用酒精灯的火焰烧掉反应剩余的CO
C
5.下列关于实验室模拟工业炼铁的过程说法错误的是( )
A.实验前要检查装置气密性
B.实验开始要先通一段时间一氧化碳再加热
C.实验结束后要先停止一氧化碳再停止加热
D.实验过程要注意尾气处理
C
6.在炼铁的过程中,下列叙述错误的是( )
A.石灰石的主要作用是除去SiO2
B.用CO将铁从铁矿石中还原出来
C.焦炭燃烧放出大量的热,提高炉温并产生CO
D.炼铁的尾气可以随意的排放
D
